Агонисты рецептора окситоцина для лечения заболеваний центральной нервной системы
Иллюстрации
Показать всеГруппа изобретений включает новые производные бензолсульфонамида, фармацевтические композиции заявленных соединений и применение соединения формулы (I) в качестве агониста рецептора окситоцина и их применение для производства лекарственного средства с активностью агониста рецептора окситоцина. Технический результат: соединения формулы (I) обладают хорошим сродством к рецептору окситоцина. Группа изобретений может найти применение в лечении аутизма, стресса, включая посттравматическое стрессовое расстройство, тревожности, включая тревожные расстройства и депрессию, шизофрении, психических расстройств и потери памяти, алкогольной абстиненции, наркозависимости и для лечения синдрома Прадера-Вилли. 6 н. и 2 з.п. ф-лы, 3 табл., 26 пр.
Реферат
Настоящее изобретение относится к применению соединения формулы I
в которой
А1 представляет собой фенил или пяти- или шестичленную гетероарильную группу, содержащую 1, 2 или 3 гетероатома, выбранных из N или S;
R1 представляет собой водород, низший алкил, галоген, низший алкил, замещенный галогеном или циклоалкилом;
А2 представляет собой фенил;
R2 представляет собой галоген, низший алкил, низший алкил, замещенный галогеном, низшую алкоксигруппу, замещенную галогеном, цианогруппу, S-низший алкил, замещенный галогеном, S(O)2-низший алкил, замещенный галогеном;
n равно 1 или 2;
или к его фармацевтически приемлемой соли присоединения кислоты, к рацемической смеси или его соответствующему энантиомеру и/или его оптическим изомерам для лечения аутизма, стресса, включая посттравматическое стрессовое расстройство, тревожности, включая тревожные расстройства и депрессию, шизофрении, психических расстройств и потери памяти, алкогольной абстиненции, наркозависимости, и для лечения синдрома Прадера-Вилли.
Замещенные бензол-сульфонамиды, содержащие пиразольную группу, описаны в литературе, например в: WO 2010118063, ВЕ 655242, US 3014038, GB 893755, DE 1115739, DE 1115261 и GB 865341, как желчегонные средства и для применения в лечении рака и гипогликемии, для применения в целях нормализации острых и хронических нарушений печени и для активации функции печени при печеночной недостаточности.
Обнаружили, что соединения по настоящему изобретению представляют собой агонисты рецептора окситоцина, и являются аналогами окситоцина, которые сохраняют биологическую активность окситоцина. Молекулы таких аналогов способны оказывать действие, аналогичное эндогенному окситоцину, включая связывание с рецептором окситоцина. Аналоги окситоцина имеют совершенно новую молекулярную структуру.
Окситоцин представляет собой девятиаминокислотный циклический пептидный гормон с двумя цистеиновыми остатками, которые образуют дисудьфидный мостик между положениями 1 и 6. Человеческий окситоцин включает последовательность Cys-Tyr-lle-Gln-Asn-Cys-Pro-Leu-Gly.
Окситоцин представляет собой мощный утеротонический агент для контроля атонии матки и избыточного кровотечения, клинически применяется для индукции родовой деятельности, и было показано, что он способствует наступлению и поддержанию лактации (Gimpl et al., Physiol. Rev., 81, (2001), 629 -683, Ruis et al., BMJ, 283, (1981), 340-342). Карбетоцин (1-деамино-1-карба-2-тирозин(О-метил)-окситоцин) также представляет собой мощный утеротонический агент, клинически применяемый для контроля атонии матки и избыточного кровотечения.
Агонисты окситоцина можно применять для лечения синдрома Прадера-Вилли, который представляет собой редкое генетическое расстройство, поражающее одного ребенка из 25000.
Дальнейшие исследования показали, что агонисты окситоцина полезны для лечения воспаления и боли, включая абдоминальную и позвоночную боль (Yang, Spine, 19, 1994, 867-71), сексуальные расстройства у обоих полов (Lidberg et al., Pharmakopsychiat., 10, 1977, 21-25) и у женщин (Anderson-Hunt, et al., BMJ, 309, 1994, 929), синдрома раздраженного кишечника (IBS, Louvel et al., Gut, 39, 1996, 741-47), запоров и обструкции желудочно-кишечного тракта (Ohlsson et al., Neurogastroenterol. Motil., 17, 2005, 697-704), аутизма (Hollander et al., Neuropsychopharm., 28, 2008, 193-98), стресса, включая посттравматическое стрессовое расстройство (ПТСР) (Pitman et al., Psychiatry Research, 48, 107-117), тревожности, включая тревожные расстройства и депрессию (Kirsch et al., J. Neurosci., 25, 49, 11489-93, Waldherr et al., PNAS, 104, 2007, 16681-84), потери крови при хирургических операциях или контроля послеродового кровотечения (Fujimoto et al., Acta Obstet. Gynecol., 85, 2006, 1310-14), индукции и поддержания родовой деятельности (Flamm et al., Obstet. Gynecol., 70, 1987, 70-12), лечения ран и инфекции, мастита и для облегчения рождения плаценты, а также для лечения остеопороза. Кроме того, агонисты окситоцина могут быть полезны для диагностики как рака, так и плацентарной недостаточности.
Кроме того, в статьях "Intranasal Oxytocin blocks alcohol withdrawal in human subjects" (Alcohol Clin Exp Res, Vol, No. 2012) и "Breaking the loop: Oxytocin as a potential treatment for drug addiction" (Hormones and Behavior, 61, 2012, 331-339) предложено лечение алкогольной абстиненции и наркозависимости агонистами окситоцина.
Окситоцин и его рецепторы расположены в участках мозга, задействованных при симптомах шизофрении, таких как прилежащее ядро и гиппокамп. Агонисты рецептора окситоцина можно применять для лечения аутизма, стресса, включая посттравматическое стрессовое расстройство, тревожности, включая тревожные расстройства и депрессию, шизофрении, болезни Альцгеймера, психических расстройств, потери памяти и метаболических расстройств (WO 2012/016229).
Проведены также функциональные исследования соединений формулы I на линиях клеток, экспрессирующих человеческий рецептор вазопрессина 1а и человеческий рецептор вазопрессина 2, для определения потенциальной агонистической активности, и было обнаружено, что эти соединения селективны к рецептору окситоцина человека.
Целями настоящего изобретения является применение соединений формулы I и новых конкретных соединений, охваченных объемом формулы I, и их фармацевтически приемлемых солей для лечения заболеваний центральной нервной системы (ЦНС), связанных с рецептором окситоцина, представляющих собой аутизм, стресс, включая посттравматическое стрессовое расстройство, тревожность, включая тревожные расстройства и депрессию, шизофрению, психические расстройства и потерю памяти, алкогольную абстиненцию, наркозависимость, и для лечения синдрома Прадера-Вилли.
Еще одной целью является получение новых соединений формулы I и изготовление лекарственных средств, содержащих такие соединения, для лечения указанных выше заболеваний.
Настоящее изобретение может предложить селективные, эффективные соединения, обеспечивающие альтернативы и/или улучшения в лечении некоторых заболеваний ЦНС, включая аутизм, стресс, включая посттравматическое стрессовое расстройство, тревожность, включая тревожные расстройства и депрессию, шизофрению, психические расстройства и потерю памяти, алкогольную абстиненцию, наркозависимость, и в лечении) синдрома Прадера-Вилли.
В настоящем описании термин "низший алкил" обозначает насыщенную линейную или разветвленную группу, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и т.п.
В настоящем описании термин "пяти- или шестичленная гетероарильная группа, содержащая 1, 2 или 3 гетероатома, выбранных из N или S", обозначает ароматическое кольцо, выбранное из пиридина, тиазола, пиримидина или 1,2,4-тиадиазола.
Термин "галоген" охватывает хлор, фтор, иод и бромид.
Термин "низший алкил, замещенный галогеном" обозначает низшую алкильную группу, раскрытую выше, в которой по меньшей мере один атом водорода замещен атомом галогена, например CF3, CHF2 или CHFCH3.
Термин "низшая алкоксигруппа, замещенная галогеном", обозначает группу O-"низший алкил, замещенный галогеном" в которой "низший алкил, замещенный галогеном" раскрыт выше.
Термин "фармацевтически приемлемые соли присоединения кислоты" включает соли с неорганическими и органическими кислотами, такими как хлороводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п.
Одним воплощением настоящего изобретения является применение соединений формулы I для лечения аутизма, стресса, включая посттравматическое стрессовое расстройство, тревожности, включая тревожные расстройства и депрессию, шизофрении, психических расстройств и потери памяти, алкогольной абстиненции, наркозависимости и для лечения синдрома Прадера-Вилли.
Еще одним воплощением настоящего изобретения является применение соединений формулы I для изготовления лекарственного средства для лечения аутизма, стресса, включая посттравматическое стрессовой расстройство, тревожности, включая тревожные расстройства и депрессию, шизофрении, психических расстройств и потери памяти, алкогольной абстиненции, наркозависимости, и для лечения синдрома Прадера-Вилли.
Еще одним воплощением настоящего изобретения является способ лечения аутизма, стресса, включая посттравматическое стрессовое расстройство, тревожности, включая тревожные расстройства и депрессию, шизофрении, психических расстройств и потери памяти, алкогольной абстиненции, наркозависимости, и для лечения синдрома Прадера-Вилли, включающий введение эффективного количества соединения формулы I.
Еще одним воплощением настоящего изобретения является фармацевтическая композиция, включающая новое соединение формулы I, выбранное из группы, состоящей из следующих соединений:
4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
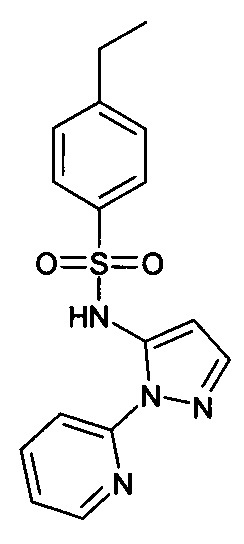
4-этил-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
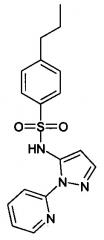
4-пропил-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
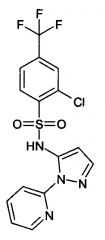
2-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
4-дифторметокси-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
4-хлор-N-[2-(4-фторфенил)-2Н-пиразол-3-ил]-бензолсульфонамид
4-циано-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
N-[2-(4-метил-тиазол-2-ил)-2Н-пиразол-3-ил]-4-трифторметилбензолсульфонамид
4-хлор-N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
4-этил-N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
N-(2-пиримидин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
2,4-дихлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
4-хлор-2-фтор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
4-(1-фторэтил)-N-(2-пиридин-2-ил-2H-пиразол-3-ил)-бензолсульфонамид
N-[2-(4-метилпиридин-2-ил)-2Н-пиразол-3-ил]-4-трифторметилбензолсульфонамид
4-хлор-N-[2-(4-метилпиридин-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
4-этил-N-[2-(4-метилпиридин-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
4-циано-N-[2-(4-метилпиридин-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилсульфанилбензолсульфонамид
4-трифторметил-N-(2-трифторметилпиримидин-4-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
2-фтор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметансульфонилбензолсульфонамид
3-фтор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
N-[2-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-2Н-пиразол-3-ил]-4-этилбензолсульфонамид и
4-хлор-2-фтор-N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид, и терапевтически инертный носитель.
Одним воплощением настоящего изобретения являются новые соединения формулы I, представляющие собой:
4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
4-этил-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
4-пропил-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
2-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
4-дифторметокси-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
4-хлор-N-[2-(4-фторфенил)-2Н-пиразол-3-ил]-бензолсульфонамид
4-циано-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-4-трифторметилбензолсульфонамид
4-хлор-N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
4-этил-N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
N-(2-пиримидин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
2,4-дихлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
4-хлор-2-фтор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
4-(1-фторэтил)-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
N-[2-(4-метилпиридин-2-ил)-2Н-пиразол-3-ил]-4-трифторметилбензолсульфонамид
4-хлор-N-[2-(4-метилпиридин-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
4-этил-N-[2-(4-метилпиридин-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
4-циано-N-[2-(4-метилпиридин-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилсульфанилбензолсульфонамид
4-трифторметил-N-(2-(2-трифторметилпиримидин-4-ил)-2H-пиразол-3-ил]-бензолсульфонамид
2-фтор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметансульфонилбензолсульфонамид
3-фтор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
N-[2-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-2Н-пиразол-3-ил]-4-этилбензолсульфонамид и
4-хлор-2-фтор-N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид.
Еще одно воплощение настоящего изобретения представляет собой соединение формулы IA,
в которой
А1 представляет собой тиазолил, пиримидинил или 1,2,4-тиадиазолил;
R1 представляет собой водород, низший алкил, галоген, низший алкил, замещенный галогеном или циклоалкилом;
А2 представляет собой фенил;
R2 представляет собой галоген, низший алкил, низший алкил, замещенный галогеном, низшую алкоксигруппу, замещенную галогеном, цианогруппу, S-низший алкил, замещенный галогеном, S(O)2-низший алкил, замещенный галогеном;
n равно 1 или 2;
или его фармацевтически приемлемые соли присоединения кислоты, рацемическую смесь или соответствующий энантиомер и/или его оптические изомеры, например следующие соединения:
N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-4-трифторметилбензолсульфонамид
4-хлор-N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
4-этил-N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
N-(2-пиримидин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
4-трифторметил-N-[2-(2-трифторметилпиримидин-4-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
N-[2-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-2Н-пиразол-3-ил]-4-этилбензолсульфонамид или
4-хлор-2-фтор-N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид.
Получение соединений формулы I по настоящему изобретению можно проводить параллельными или сходящимися путями синтеза. Синтез соединений по настоящему изобретению представлен на нижеследующей схеме. Навыки, требуемые для проведения реакций и очистки получаемых продуктов, доступны специалистам в данной области техники. Заместители и индексы, используемые в ниже следующем описании способов, имеют значение, раскрытое ранее в данном тексте, если не указано противоположное. Более конкретно, соединения формулы I можно получать способами, раскрытыми ниже, способами, представленными в примерах, или аналогичными способами. Подходящие условия реакций для конкретных стадий синтеза известны специалисту в данной области техники. Кроме того, в литературе описаны условия проведения реакций, влияющие на раскрытые реакции (см., например: Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Edition, Richard C. Larock. John Wiley & Sons, New York, NY. 1999). Авторы изобретения считают удобным проводить данные реакции в присутствии или в отсутствие растворителя. В отношении природы используемого растворителя не накладывается какого-либо особого ограничения, при условии, что растворитель не оказывает нежелательного воздействия на течение реакции или на используемые реагенты, и что он способен растворять реагенты, по меньшей мере, в некоторой степени. Описанные реакции могут протекать в широком диапазоне температур, и точная температура реакции не имеет большого значения в свете настоящего изобретения. Описанные реакции удобно проводить в интервале температур между -78°C и температурой флегмы. Время, необходимое для протекания реакции, также может меняться в широком диапазоне, в зависимости от многих факторов, в частности от температуры реакции и природы реагентов. Как правило, для получения желаемых промежуточных продуктов и конечных соединений достаточно интервала от 0,5 часов до нескольких суток. Последовательность реакций не ограничена представленной на схемах, а напротив, в зависимости от исходных веществ и их относительной реакционной способности, последовательность реакционных стадий можно легко изменять. Исходные вещества либо имеются в продаже, либо их можно получить способами, аналогичными способам, представленным ниже, способами, описанными в цитируемых источниках в описании или примерах, или способами, известными в данной области техники.
Соединения по настоящему изобретению формулы I и их фармацевтически приемлемые соли можно получить способами, известными в данной области техники, например, способом, описанным ниже, включающим:
а) введение в реакцию соединения формулы
с соединением формулы
с получением соединения формулы
и, при желании, переведение полученного соединения в фармацевтически приемлемые соли присоединения кислоты.
Схема 1
а) Амино-пиразолы II либо коммерчески доступны, либо их можно синтезировать различными путями, способами, известными специалистам в данной области техники. Однако авторы изобретения считают удобным проводить реакцию соединения II с сульфонилхлоридами III (либо коммерчески доступны, либо их можно синтезировать различными путями, способами, известными специалистам в данной области техники) в основных условиях с получением конечных производных пиразола I.
Выделение и очистка соединений
Выделение и очистка соединений и промежуточных продуктов, раскрытых в настоящем описании, можно осуществлять, по желанию, любым подходящим способом разделения или очистки, такими как, например, фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, толстослойная хроматография, препаративная жидкостная хроматография низкого или высокого давления или комбинация указанных способов. Конкретные примеры подходящих способов разделения и выделения можно привести со ссылкой на примеры и способы получения, описанные ниже. Тем не менее, разумеется, можно использовать и другие подобные способы разделения или выделения. Рацемические смеси хиральных соединений формулы I можно разделять с помощью хиральной ВЗЖХ (высокоэффективной жидкостной хроматографии).
Соли соединений формулы I
Соединения формулы I могут представлять собой основания, и их можно переводить в соответствующие соли присоединения кислоты. Такое превращение осуществляют обработкой по меньшей мере стехиометрическим количеством надлежащей кислоты, такой как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п. Как правило, свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в таком же растворителе. Температуру выдерживают в интервале от 0°C до 50°C. Получаемая соль спонтанно осаждается или ее можно извлечь из раствора менее полярным растворителем.
Соли присоединения кислоты основных соединений формулы I можно переводить в соответствующие свободные основания путем обработки по меньшей мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и т.п.
Соединения формулы I могут быть также кислотными.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пример 1
4-Хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
Смесь 16,2 мг (0,1 ммоль) 2-пиридин-2-ил-2Н-пиразол-3-иламина (коммерчески доступного) и 26,4 мг (0,125 ммоль) 4-хлорбензол-1-сульфонил хлорида в 1 мл пиридина вводили в реакцию при комнатной температуре в течение ночи и выпаривали. Остаток разводили в метаноле и муравьиной кислоте и проводили очистку препаративной ВЭЖХ на обращенной фазе, элюировали градиентом смеси ацетонитрил/вода/муравьиная кислота. Фракции, содержащие продукт, выпаривали с получением 20,7 мг (58%) указанного в заголовке соединения в виде вязкого желтого масла. MS(m/e): 335,3 (МН+).
Пример 2
N-(2-Пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1) указанное в заголовке соединение получали из 2-пиридин-2-ил-2Н-пиразол-3-иламина (коммерчески доступного) и 4-(трифторметил)бензол-1-сульфонилхлорида (коммерчески доступного) и выделяли в виде грязно-белого твердого вещества. MS(m/e): 369,1 (МН+).
Пример 3
4-Этил-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-пиридин-2-ил-2Н-пиразол-3-иламина (коммерчески доступного) и 4-этилбензол-1-сульфонилхлорида (коммерчески доступного) и выделяли в виде желтого вязкого масла. MS(m/e): 329,4 (МН+).
Пример 4
4-Пропил-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-пиридин-2-ил-2Н-пиразол-3-иламина (коммерчески доступного) и 4-пропилбензол-1-сульфонилхлорида (коммерчески доступного) и выделяли в виде желтого вязкого масла. MS(m/e): 343,4 (МН+).
Пример 5
2-Хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-пиридин-2-ил-2Н-пиразол-3-иламина (коммерчески доступного) и 2-хлор-4-(трифторметил)бензол-1-сульфонилхлорида (коммерчески доступного) и выделяли в виде светло-желтого твердого вещества. MS(m/e): 403,4 (МН+).
Пример 6
4-Дифторметокси-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-пиридин-2-ил-2Н-пиразол-3-иламина (коммерчески доступного) и 4-(дифторметокси)бензол-1-сульфонилхлорида (коммерчески доступного) и выделяли в виде желтого вязкого масла. MS(m/e): 367,4 (МН+).
Пример 7
4-Хлор-N-[2-(4-фторфенил)-2Н-пиразол-3-ил]-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 1-(4-фторфенил)-1Н-пиразол-5-амина (коммерчески доступного) и 4-хлорбензол-1-сульфонилхлорида (коммерчески доступного). MS(m/e): 352,4 (МН+).
Пример 8
4-Циано-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-пиридин-2-ил-2Н-пиразол-3-иламина (коммерчески доступного) и 4-цианобензол-1-сульфонилхлорида (коммерчески доступного) и выделяли в виде грязно-белого твердого вещества. MS(m/e): 326,4 (МН+).
Пример 9
N-[2-(4-Метилтиазол-2-ил)-2Н-пиразол-3-ил]-4-трифторметилбензолсульфонамид
а) 2-(4-Метилтиазол-2-ил)-2Н-пиразол-3-иламин
Смесь 2-гидразинил-4-метилтиазолгидрохлорида (5 г; 30,2 ммоль) и DIPEA (7,8 г; 10,5 мл, 60,4 ммоль) в N,N-диметилацетамиде (150 мл) обрабатывали 3-(диметиламино)акрилонитрилом (2,9 г; 3,05 мл; 30,2 ммоль) и нагревали до 145°C в течение 4 ч. Этот раствор охлаждали до комнатной температуры и концентрировали в высоком вакууме. Остаток растворяли в DCM (50 мл), абсорбировали на Isolute HM-N (30 г) и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, элюировали градиентом смеси гептан/этилацетат, с получением после выпаривания фракций, содержащих продукт, 530 мг (9,5%) указанного в заголовке соединения в виде светло-коричневого твердого вещества. MS(m/e): 181,2 (МН+).
b) N-[2-(4-Метилтиазол-2-ил)-2Н-пиразол-3-ил]-4-трифторметилбензол-сульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-(4-метилтиазол-2-ил)-2Н-пиразол-3-иламина и 4-(трифторметил)бензол-1-сульфонилхлорида (коммерчески доступного) и выделяли в виде светло-желтого твердого вещества. MS(m/e): 389,5 (МН+).
Пример 10
4-Хлор-N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-(4-метилтиазол-2-ил)-2Н-пиразол-3-иламина и 4-хлорбензол-1-сульфонилхлорида (коммерчески доступного) и выделяли в виде оранжевого твердого вещества. MS(m/e): 355,4 (МН+).
Пример 11
4-Этил-N-[2-(4-метилтиазол-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-(4-метилтиазол-2-ил)-2Н-пиразол-3-иламина и 4-этилбензол-1-сульфонилхлорида (коммерчески доступного) и выделяли в виде оранжевого твердого вещества. MS(m/e): 349,5 (МН+).
Пример 12
N-(2-Пиримидин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 1-(пиримидин-2-ил)-1Н-пиразол-5-амина (коммерчески доступного) и 4-(трифторметил)бензол-1-сульфонилхлорида (коммерчески доступного). MS(m/e): 370,5 (МН+).
Пример 13
2,4-Дихлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-пиридин-2-ил-2Н-пиразол-3-иламина (коммерчески доступного) и 2,4-дихлорбензол-1-сульфонилхлорида (коммерчески доступного). MS(m/e): 367,4 (МН+).
Пример 14
4-Хлор-2-фтор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-пиридин-2-ил-2Н-пиразол-3-иламина (коммерчески доступного) и 4-хлор-2-фторбензол-1-сульфонилхлорида (коммерчески доступного). MS(m/e): 351,4 (МН+).
Пример 15
4-(1-Фторэтил)-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
a) 4-Ацетил-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-пиридин-2-ил-2Н-пиразол-3-иламина (коммерчески доступного) и 4-ацетилбензол-1-сульфонилхлорида (коммерчески доступного) и выделяли в виде светло-коричневого твердого вещества. MS(m/e): 343,5 (МН+).
b) 4-(1-Гидроксиэтил)-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
Смесь 4-ацетил-N-(1-(пиридин-2-ил)-1Н-пиразол-5-ил)бензолсульфонамида (200 мг, 0,584 ммоль) и NaBH4 (22,1 мг, 0,584 ммоль) в THF (20 мл)/МеОН (5 мл) перемешивали в течение ночи при комнатной температуре. Добавляли раствор Na2CO3 (10%, водн.) и перемешивали в течение 30 мин. Значение рН доводили рН 6-7 и эту смесь экстрагировали этилацетатом (2×30 мл). Органические слои промывали солевым раствором (1×50 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения (193 мг, 0,56 ммоль, 96%) в виде грязно-белого воскообразного твердого вещества. MS(m/e): 345,5 (МН+).
с) 4-(1-Фторэтил)-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамид
Смесь 4-(1-гидроксиэтил)-N-(1-(пиридин-2-ил)-1Н-пиразол-5-ил)бензолсульфонамида (100 мг, 0,290 ммоль) и DAST (51,5 мг; 42,2 мкл; 0,319 ммоль) в DCM (11 мл) при 0-5°C перемешивали в течение 1 ч. Добавляли раствор NaHCO3 (5%, водн., 5 мл) и доводили рН до 6-7. Органический слой отделяли и водный слой экстрагировали с помощью DCM (2×5 мл). Объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Остаток растворяли в метаноле (4 мл) и очищали с помощью препаративной ВЭЖХ на обращенной фазе с получением после выпаривания фракций, содержащих продукт, 57 мг (55%) указанного в заголовке соединения в виде бесцветного вязкого масла. MS(m/e): 347.6 (МН+).
Пример 16
N-[2-(4-Метилпиридин-2-ил)-2Н-пиразол-3-ил]-4-трифторметилбензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 1-(4-метилпиридин-2-ил)-1Н-пиразол-5-амина (коммерчески доступного) и 4-(трифторметил)бензол-1-сульфонилхлорида (коммерчески доступного). MS(m/e): 383,5 (МН+).
Пример 17
4-Хлор-N-[2-(4-метилпиридин-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 1-(4-метилпиридин-2-ил)-1Н-пиразол-5-амина (коммерчески доступного) и 4-хлорбензол-1-сульфонилхлорида (коммерчески доступного). MS(m/e): 349,5 (МН+).
Пример 18
4-Этил-N-[2-(4-метилпиридин-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 1-(4-метилпиридин-2-ил)-1Н-пиразол-5-амина (коммерчески доступного) и 4-этилбензол-1-сульфонилхлорида (коммерчески доступного). MS(m/e): 343.6 (МН+).
Пример 19
4-Циано-N-[2-(4-метилпиридин-2-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 1-(4-метилпиридин-2-ил)-1Н-пиразол-5-амина (коммерчески доступного) и 4-цианобензол-1-сульфонилхлорида (коммерчески доступного). MS(m/e): 340,5 (МН+).
Пример 20
N-(2-Пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилсульфанилбензол-сульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 2-пиридин-2-ил-2Н-пиразол-3-иламина (коммерчески доступного) и 4-(трифторметилтио)бензол-1 -сульфонилхлорида (коммерчески доступного) и выделяли в виде грязно-белого твердого вещества. MS(m/e): 401,5 (МН+).
Пример 21
4-Трифторметил-N-[2-(2-трифторметилпиримидин-4-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
а) 2-(2-Трифторметилпиримидин-4-ил)-2Н-пиразол-3-иламин
Смесь 4-гидразинил-2-(трифторметил)пиримидина (533 мг; 2,99 ммоль) и (Е)-3-(диметиламино)акрилонитрила (288 мг; 2,99 ммоль) нагревали до 145°C в течение 90 мин. Эту смесь охлаждали до комнатной температуры, растворяли в DCM (5 мл) и абсорбировали на Isolute HM-N. Смесь концентрировали в вакууме и очищали хроматографией на силикагеле, элюировали градиентом смеси гептан/этилацетат, с получением после выпаривания фракций, содержащих продукт, 500 мг (73%) указанного в заголовке соединения в виде желтого твердого вещества. MS(m/e): 230,2 (МН+).
b) 4-Тифторметил-N-[2-(2-трифторметилпиримидин-4-ил)-2Н-пиразол-3-ил]-бензолсульфонамид
По аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), указанное в заголовке соединение получали из 1-(2-(трифторметил)пиримидин-4-ил)-1Н-пиразол-5-амина и 4-(трифторметил)бензол-1-сульфонилхлорида (коммерчески доступного). MS(m/e): 436.6 (МН+).
Пример 22
2-Фтор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
2-Фтор-4-трифторметилбензолсульфонилхлорид синтезировали по аналогии с производственным способом, описанным в литературе ("Preparation of arylsulfonyl chlorides by chlorsulfonylation of in situ generated diazonium salts using a continuous flow reactor", Malet-Sanz L, Madrzak J., Ley S.V., Baxendale I.R., Org Biomol Chem 2010, 8, 5324-5332) из 2-фтор-4-(трифторметил)анилина (коммерчески доступного), и после этого проводили реакцию по аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), с 1-(пиридин-2-ил)-1Н-пиразол-5-амином (коммерчески доступным) и выделяли продукт в виде коричневого твердого вещества. MS(m/e): 387,4 (МН+).
Пример 23
N-(2-Пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметансульфонилбензолсульфонамид
4-Трифторметансульфонилбензолсульфонилхлорид синтезировали по аналогии с производственным способом, описанным в литературе "Preparation of arylsulfonyl chlorides by chlorsulfonylation of in situ generated diazonium salts using a continuous flow reactor", Malet-Sanz L, Madrzak J., Ley S.V., Baxendale I.R., Org Biomol Chem 2010, 8, 5324-5332), из 4-(трифторметилсульфонил)анилина (коммерчески доступного) и далее проводили реакцию по аналогии со способом, описанным для синтеза 4-хлор-г>1-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), с 1-(пиридин-2-ил)-1Н-пиразол-5-амином (коммерчески доступным) и выделяли продукт в виде светло-коричневого твердого вещества. MS(m/e): 433,5 (МН+).
Пример 24
3-Фтор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-4-трифторметилбензолсульфонамид
3-Фтор-4-трифторметилбензолсульфонилхлорид синтезировали по аналогии с производственным способом, описанным в литературе ("Preparation of arylsulfonyl chlorides by chlorsulfonylation of in situ generated diazonium salts using a continuous flow reactor", Malet-Sanz L., Madrzak J., Ley S.V., Baxendale I.R., Org Biomol Chem 2010, 8, 5324-5332) из 3-фтор-4-(трифторметил)анилина (коммерчески доступного) и далее проводили реакцию по аналогии со способом, описанным для синтеза 4-хлор-N-(2-пиридин-2-ил-2Н-пиразол-3-ил)-бензолсульфонамида (пример 1), с 1-(пиридин-2-ил)-1Н-пиразол-5-амином (коммерчески доступным) и выделяли продукт в виде светло-коричневого твердого вещества. MS(m/e): 387,5 (МН+).
Пример 25
N-[2-(3-Циклопропил-[1,2,4]тиадиазол-5-ил)-2Н-пиразол-3-ил]-4-этилбензолсульфонамид
a) 2-(3-Циклопропил-[1,2,4]тиадиазол-5-ил)-2Н-пиразол-3-иламин
Смесь 5-хлор-3-циклопропил-1,2,4-тиадиазола (1,22 г; 7.6 ммоль) и гидразина моногидрата (1,9 г; 1,85 мл; 38,0 ммоль) в этаноле (50 мл) нагревали в течение 1 ч при температуре флегмы. Эту смесь охлаждали до комнатной температуры, концентрировали в вакууме и высушивали в высоком вакууме при 60°C. Остаток объединяли с 3-(диметиламино)акрилонитрилом (1,83 г; 1,92 мл; 19,0 ммоль) и N,N-диметилацетамидом (30 мл) и нагревали в течение 2 ч до 145°C. Через 1 ч добавляли еще одну порцию 3-(диметиламино)акрилонитрила (1,1 г; 1,15 мл; 11,4 ммоль). Этот раствор охлаждали до комнатной температуры и концентрировали в высоком вакууме. Остаток растворяли в DCM (15 мл), абсорбировали на Isolute НМ, концентрировали в вакууме и очищали хроматографией на силикагеле, элюировали градиентом смеси гептан/этилацетат, с получением после выпаривания фракций, содержащих п