Пероральная фармацевтическая композиция замедленного высвобождения, содержащая гидрохлорид гидроморфона
Иллюстрации
Показать всеГруппа изобретений относится к области фармации, в частности к пероральной фармацевтической композиции замедленного высвобождения и к способам ее получения. Фармацевтическая композиция с замедленным высвобождением содержит (А) гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона, (B) ацетат сукцинат гидроксипропилметилцеллюлозы, имеющий средний размер (D50) 40 мкм или меньше, (C) гидроксипропилцеллюлозу и (D) сахарид, где относительное содержание компонента (C) и компонента (B) по массе в композиции, (С)/(В), составляет от 10/4 до 8/6. Способы ее получения заключаются в смешивании компонентов (A), (B), (C) и (D) и вспомогательного вещества с последующим формованием для получения фармацевтической композиции с замедленным высвобождением в виде таблетки. Группа изобретений обеспечивает возможность избежать преждевременного и увеличенного высвобождения действующего вещества в присутствии спирта и при нахождении композиции в кислой среде, такой как среда верхнего отдела желудочно-кишечного тракта. 4 н. и 19 з.п. ф-лы, 6 ил., 11 табл., 4 пр.
Реферат
Область техники
Настоящее изобретение относится к пероральной фармацевтической композиции замедленного высвобождения, содержащей гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона, которая надежно проявляет свой основной фармакологический эффект при пероральном введении один или два раза в день.
Уровень техники
Препараты с замедленным высвобождением для регулирования концентраций лекарственных средств в крови являются весьма полезными с точки зрения соотношения между основным фармакологическим эффектом и неблагоприятной реакцией, улучшения соответствия стандартам (например, количество доз снижается при повышении пролонгированной эффективности), медицинской экономики и т.д. При этом сообщалось о некоторых способах получения препаратов с замедленным высвобождением. Между тем, поскольку соединения, обладающие основным фармакологическим действием, имеют различные химические свойства, сообщалось о некоторых, хотя по-прежнему неудовлетворительных, способах получения препаратов с замедленным высвобождением, направленных на адаптацию к разнообразию этих соединений (смотри, например, патентные документы 1 и 2).
Наркотический анальгетик гидроморфон (смотри, например, непатентный документ 1) обладает сильным обезболивающим эффектом и демонстрирует в 3,5 раза более сильное обезболивающее действие, чем оксикодон, и в 5 раз более сильное действие, чем морфин при пероральном введении, и в 8 раз более сильное действие, чем морфин при введении в виде инъекций. Кроме того, этот препарат можно вводить пациентам, испытывающим трудности в приеме повышенных доз существующих лекарственных препаратов. По этим причинам препарат широко применяют во всем мире, а также применяют в течение длительного срока. Гидроморфон и другой наркотический анальгетик оксикодон, как известно, исключительно хорошо переносится по сравнению с морфином, с точки зрения нежелательных реакций, свойственных опиоидам (констипация, тошнота или рвота, зуд, сонливость, угнетение дыхания и т.д.). Оксикодон, как известно, подвергается метаболизму посредством цитохрома CYP450 (CYP3A4 или CYP2D6) и, соответственно, необходимо с осторожностью его использовать совместно с препаратами, ингибирующими CYP3A4 или CYP2D6. С другой стороны, гидроморфон ингибирует цитохром CYP450 (CYP3A4 или CYP2D6) в меньшей степени, чем оксикодон, фентанил и морфин, и, предпочтительно, маловероятно взаимодействует с препаратами, которые метаболизируются с помощью CYP. Кроме того, его метаболиты не обладают анальгезирующим эффектом. Поэтому гидроморфон обладает следующими преимуществами: например, для пациентов с плохой функцией почек, которые служат в качестве выводящих путей, препарат может быть использован более безопасно, чем морфин; препарат не демонстрирует эффект высвобождения гистамина; и препарат вызывает меньшую нежелательную реакцию (зуд), чем морфин.
При лечении рака устранение боли является очень важным для улучшения качества жизни пациентов, а также является частью лечения. Гидроморфон или оксикодон является типичным препаратом, который используется за рубежом в ротации опиоидов при раковой боли и, вероятно, вносит значительный вклад в качестве стандартного препарата для подавления боли у пациентов.
Обычно проблемой разработки пероральных препаратов с замедленным высвобождением является преждевременное и увеличенное высвобождение действующего вещества из препарата в случае, когда препарат с замедленным высвобождением распадается вследствие механического напряжения, возникающего в связи с присутствием пищи в верхних отделах желудочно-кишечного тракта, моторики желудочно-кишечного тракта и так далее (см. патентный документ 3). Гидроморфон или оксикодон является основным соединением и высоко растворимым в воде препаратом и, следовательно, легко растворим в нейтральном водном растворе, таком как нейтральный буфер. Однако в некоторых случаях при преждевременном и увеличенном высвобождении наркотического анальгетика существует вероятность возникновения нежелательной летальной реакции. Решение проблемы преждевременного и увеличенного высвобождения действующего вещества является важным вопросом для препаратов с замедленным высвобождением наркотического анальгетика. По результатам исследований было обнаружено, что Palladone(R), ранее известный препарат с замедленным высвобождением наркотического анальгетика гидроморфона, вызывает преждевременное и увеличенное высвобождение действующего вещества в результате повреждения препарата с замедленным высвобождением при совместном приеме со спиртом (см., например, непатентная литература 2). В связи с этим Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) обратилось с требованием об изъятии с рынка капсул с замедленным высвобождением Palladone(R) (см пресс-релиз FDA от 13 июля 2005). FDA также предупредило пациентов, что они могут подвергаться опасности возникновения смертельных последствий от совместного употребления Palladone(R) с алкогольными напитками. С учетом сказанного наблюдается потребность в спирто-резистентном препарате с замедленным высвобождением (фармацевтическая композиция с замедленным высвобождением), содержащем наркотический анальгетик, такой как гидроморфон или оксикодон, в качестве основного фармацевтически активного ингредиента без возможного преждевременного и увеличенного высвобождения действующего вещества.
Перечень ссылок
Непатентная литература
Непатентная литература 1: Expert Opin. Pharmacother., 2010, 11 (7), 1207-1214
Непатентная литература 2: Drug Development and Industrial Pharmacy, 33: 1101-1111, 2007
Патентная литература
Патентная литература 1: Публикация японской патентной заявки № 2006/507216
Патентная литература 2: Публикация японской патентной заявки № 2004/518676
Патентная литература 3: Международная публикация № WO 2011-102504
Сущность изобретения
Техническая задача
Задачей настоящего изобретения является получение фармацевтической композиции с замедленным высвобождением для перорального введения, содержащей гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона в качестве основного фармацевтически активного ингредиента, позволяющей избежать преждевременное и увеличенное высвобождение действующего вещества из лекарственного препарата, вызванного механическим напряжением и присутствием алкоголя, надежно проявляющей свой основной фармакологический эффект при пероральном введении один или два раза в день и обладающей превосходной стабильностью.
Решение технической задачи
Авторы настоящего изобретения провели кропотливые исследования пероральных фармацевтических композиций с замедленным высвобождением, содержащих в качестве основного фармацевтически активного ингредиента гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона. В результате авторы настоящего изобретения обнаружили, что фармацевтическая композиция с замедленным высвобождением, содержащая (A) гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона, (B) ацетат сукцинат гидроксипропилметилцеллюлозы (далее сокращенно упоминаемый также как HPMCAS) со средним размером (D50) 40 мкм или меньше, (С) производное целлюлозы и (D) сахарид, может устранить преждевременное и увеличенное высвобождение действующего вещества лекарственного препарата в присутствии спирта и удовлетворяет свойствам пролонгированного растворения. Авторы настоящего изобретения нашли способ получения лекарственного препарата, позволяющего избежать образование сопутствующего вещества, получаемого в результате зависящего от времени разложения гидрохлорида гидроморфона в фармацевтической композиции с замедленным высвобождением при хранении фармацевтической композиции с замедленным высвобождением. На основании этих данных было осуществлено настоящее изобретение.
В частности, настоящее изобретение относится к следующим пунктам (1)-(24):
(1) Фармацевтическая композиция с замедленным высвобождением, содержащая (A) гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона, (B) ацетат сукцинат гидроксипропилметилцеллюлозы со средним размером (D50) 40 мкм или меньше, (C) гидроксипропилцеллюлозу и (D) сахарид, где
относительное содержание компонента (C) и компонента (B) по массе в композиции, (С)/(В), составляет от 11/3 до 3/11.
(2) Фармацевтическая композиция с замедленным высвобождением в соответствии с пунктом (1), где компонент (B) имеет средний размер (D50), равный 20 мкм или меньше.
(3) Фармацевтическая композиция с замедленным высвобождением в соответствии с пунктом (1), где компонент (B) имеет средний размер (D50), равный 10 мкм или меньше, и (D90), равный 20 мкм или меньше.
(4) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(3), где содержание компонента (B) в композиции составляет от 5 до 75% по массе.
(5) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(3), где содержание компонента (B) в композиции составляет от 10 до 60% по массе.
(6) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(5), где содержание компонента (A) в композиции составляет от 0,3 до 30% по массе в отношении свободной формы гидрохлорида гидроморфона или в отношении безводной формы гидрата гидрохлорида оксикодона.
(7) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(6), где содержание компонента (C) в композиции составляет от 5 до 75% по массе.
(8) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(6), где содержание компонента (C) в композиции составляет от 10 до 60% по массе.
(9) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(8), где относительное содержание компонента (C) и компонента (B) в композиции, (C)/(B), составляет от 10/4 до 7/7.
(10) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(9), где гидроксипропилцеллюлоза представляет собой гидроксипропилцеллюлозу, имеющую вязкость, равную от 150 до 400 мПа⋅с или от 1000 до 4000 мПа⋅с.
(11) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(10), где компонент (D) в композиции является лактозой или сахарным спиртом.
(12) Фармацевтическая композиция с замедленным высвобождением в соответствии с пунктом (11), где сахарный спирт представляет собой маннит, ксилит или эритрит.
(13) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(12), где композиция представлена в виде таблетки.
(14) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(12), которая является фармацевтической композицией с замедленным высвобождением, содержащей (A) гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона, (B) ацетат сукцинат гидроксипропилметилцеллюлозы, имеющий средний размер (D50) 40 мкм или меньше, (C) гидроксипропилцеллюлозу и (D) сахарид, где
относительное содержание компонента (C) и компонента (B) по массе в композиции, (С)/(В), составляет от 11/3 до 3/11,
фармацевтическую композицию с замедленным высвобождением получают путем осуществления следующей стадии:
(стадия): смешивание компонентов (A), (B), (C) и (D) и вспомогательного вещества с последующим формованием для получения фармацевтической композиции с замедленным высвобождением в виде таблетки.
(15) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(12), которая является фармацевтической композицией с замедленным высвобождением, содержащей (A) гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона, (B) ацетат сукцинат гидроксипропилметилцеллюлозы, имеющий средний размер (D50) 40 мкм или меньше, (C) гидроксипропилцеллюлозу и (D) сахарид, где
относительное содержание компонента (C) и компонента (B) по массе в композиции, (С)/(В), составляет от 11/3 до 3/11,
фармацевтическую композицию с замедленным высвобождением получают путем осуществления следующих двух стадий:
(стадия 1): смешивание компонентов (A), (B), (C) и (D) и вспомогательного вещества с последующим сухим гранулированием для получения гранул (гранулированный продукт), и
(стадия 2): смешивание гранул, полученных на (стадии 1), и вспомогательного вещества с последующим формованием для получения фармацевтической композиции с замедленным высвобождением в виде таблетки.
(16) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (1)-(12), которая является фармацевтической композицией с замедленным высвобождением, содержащей (A) гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона, (B) ацетат сукцинат гидроксипропилметилцеллюлозы, имеющий средний размер (D50) 40 мкм или меньше, (C) гидроксипропилцеллюлозу и (D) сахарид, где
относительное содержание компонента (C) и компонента (B) по массе в композиции, (С)/(В), составляет от 11/3 до 3/11,
фармацевтическую композицию с замедленным высвобождением получают путем осуществления следующих двух стадий:
(стадия 1): смешивание компонентов (B), (C) и (D) для получения гранул (гранулированный продукт), и
(стадия 2): смешивание гранул (гранулированный продукт), полученных на (стадии 1), компонентов (A) и (D) и вспомогательного вещества с последующим формованием для получения фармацевтической композиции с замедленным высвобождением в виде таблетки.
(17) Фармацевтическая композиция с замедленным высвобождением в соответствии с любым из пунктов (14)-(16), где вспомогательным веществом является смазывающее вещество.
(18) Фармацевтическая композиция с замедленным высвобождением в соответствии с пунктом (17), где смазывающее вещество представляет собой стеарилфумарат натрия или стеарат магния.
(19) Способ получения фармацевтической композиции с замедленным высвобождением в соответствии с любым из пунктов (1)-(12), которая является фармацевтической композицией с замедленным высвобождением, содержащей (A) гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона, (B) ацетат сукцинат гидроксипропилметилцеллюлозы, имеющий средний размер (D50) 40 мкм или меньше, (C) гидроксипропилцеллюлозу и (D) сахарид, где
относительное содержание компонента (C) и компонента (B) по массе в композиции, (С)/(В), составляет от 11/3 до 3/11,
способ получения, включающий следующую стадию:
(стадия): смешивание компонентов (A), (B), (C) и (D) и вспомогательного вещества с последующим формованием для получения фармацевтической композиции с замедленным высвобождением в виде таблетки.
(20) Способ получения фармацевтической композиции с замедленным высвобождением в соответствии с любым из пунктов (1)-(12), которая является фармацевтической композицией с замедленным высвобождением, содержащей (A) гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона, (B) ацетат сукцинат гидроксипропилметилцеллюлозы, имеющий средний размер (D50) 40 мкм или меньше, (C) гидроксипропилцеллюлозу и (D) сахарид, где
относительное содержание компонента (C) и компонента (B) по массе в композиции, (С)/(В), составляет от 11/3 до 3/11,
способ получения, включающий следующие две стадии:
(стадия 1): смешивание компонентов (A), (B), (C) и (D) и вспомогательного вещества с последующим сухим гранулированием для получения гранул (гранулированный продукт), и
(стадия 2): смешивание гранул, полученных на (стадии 1), и вспомогательного вещества с последующим формованием для получения фармацевтической композиции с замедленным высвобождением в виде таблетки.
(21) Способ получения фармацевтической композиции с замедленным высвобождением в соответствии с любым из пунктов (1)-(12), которая является фармацевтической композицией с замедленным высвобождением, содержащей (A) гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона, (B) ацетат сукцинат гидроксипропилметилцеллюлозы, имеющий средний размер (D50) 40 мкм или меньше, (C) гидроксипропилцеллюлозу и (D) сахарид, где
относительное содержание компонента (C) и компонента (B) по массе в композиции, (С)/(В), составляет от 11/3 до 3/11,
способ получения, включающий следующие две стадии:
(стадия 1): смешивание компонентов (B), (C) и (D) для получения гранул (гранулированный продукт), и
(стадия 2): смешивание гранул (гранулированный продукт), полученных на (стадии 1), компонентов (A) и (D) и вспомогательного вещества с последующим формованием для получения фармацевтической композиции с замедленным высвобождением в виде таблетки.
(22) Способ получения в соответствии с любым из (19)-(21), где вспомогательным веществом является смазывающее вещество.
(23) Способ получения в соответствии с (22), где смазывающее вещество представляет собой стеарилфумарат натрия или стеарат магния.
(24) Способ получения в соответствии с любым из (19)-(23), где способ представляет собой способ предотвращения увеличения количества сопутствующего вещества.
Положительные эффекты изобретения
Настоящее изобретение может предоставить пероральную фармацевтическую композицию с замедленным высвобождением, содержащую гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона в качестве основного фармацевтически активного ингредиента. Фармацевтическая композиция с замедленным высвобождением по настоящему изобретению обладает подходящей силой действия таблетки, которая предотвращает преждевременное и увеличенное высвобождение действующего вещества, возникающее в кислотном растворе при механической нагрузке и в присутствии спирта, и обладает подходящими свойствами растворения в нейтральном растворе. Таким образом, фармацевтическая композиция с замедленным высвобождением по настоящему изобретению является эффективной для поддержания пролонгированного растворения (высвобождения) содержащегося в ней гидрохлорида гидроморфона или гидрата гидрохлорида оксикодона, начиная от двенадцатиперстной кишки, далее через тонкую кишку до нижнего отдела желудочно-кишечного тракта. Кроме того, использование способа получения по настоящему изобретению может предотвратить увеличение сопутствующего вещества и может обеспечить содержащую гидроморфон или оксикодон фармацевтическую композицию с замедленным высвобождением, обладающую превосходной стабильностью.
Краткое описание рисунков
[Фигура 1] На фигуре 1 представлена диаграмма, показывающая зависящее от времени растворение лекарственного вещества (A) из каждого твердого препарата композиций 4 и 5, полученных в примере 2, в каждой аналитической среде.
[Фигура 2] На фигуре 2 представлена диаграмма, показывающая зависящее от времени растворение лекарственного вещества (A) из каждого твердого препарата (таблеток) композиций 6 и 7, полученных в примере 3, в аналитической среде с добавлением и без добавления спирта.
[Фигура 3] На фигуре 3 представлена диаграмма, показывающая зависящее от времени растворение лекарственного вещества (A) из каждого твердого препарата (таблетки) композиций 8, 9 и 10, полученных в примере 4, в аналитической среде (pH 6,8, 900 мл, 37°C, скорость вращения лопастной мешалки 50 об/мин).
[Фигура 4] На фигуре 4 представлена диаграмма, показывающая зависящее от времени растворение лекарственного вещества (A) из твердого препарата композиции 11, полученной в примере 5, в каждой аналитической среде.
[Фигура 5] На фигуре 5 представлена диаграмма, показывающая зависящее от времени растворение лекарственного вещества (A) из твердого препарата (таблетка) композиции 12, полученной в примере 6, в аналитической среде с добавлением и без добавления спирта.
[Фигура 6] На фигуре 6 представлена диаграмма, показывающая зависящее от времени растворение лекарственного вещества (A) из каждой таблетки композиций 11 (плоская таблетка) и 13 (покрытая оболочкой таблетка), полученных в примере 7, в каждой аналитической среде.
Описание вариантов осуществления
Далее настоящее изобретение описано более подробно.
В настоящем изобретении "кислотный раствор" означает кислотную испытательную среду растворения, используемую для оценки свойств растворения в верхнем отделе желудочно-кишечного тракта, таком как желудок. Неограничивающие примеры кислотных сред для испытания на растворимость могут включать: 1-ю испытательную среду растворения JP, описанную в Японской Фармакопее; и 0,1 н. соляную кислоту USP, то есть, 0,01 н. соляную кислоту и жидкость, имитирующую желудочный сок без ферментов, описанную в Фармакопее Соединенных Штатов.
В настоящем изобретении "нейтральный раствор" означает нейтральную среду для испытания на растворимость, используемую для оценки свойств растворения лекарственного вещества в тонком кишечнике, толстом кишечнике или тому подобное. Неограничивающие примеры нейтральной среды для исследования растворения могут включать испытательную среду растворения (рН 6,8), такую как 2-ю испытательную среду растворения JP и фосфатный буфер (рН 6,8), описанные в Японской фармакопее; фосфатный буфер USP (рН 6,8) и жидкость, имитирующая желудочный сок без ферментов, описанную в фармакопее Соединенных Штатов; и раствор фосфатного буфера (рН 6,8), описанный в Европейской фармакопее.
Вышеуказанную испытательную среду растворения получали с помощью методов, описанных в соответствующей фармакопее или подобное каждой страны. В случае, когда используемой испытательной средой растворения является буферный раствор, изменение рН среды для испытаний предпочтительно находится в пределах ±0,05 показателя рН, определенного для каждой среды растворения.
Примеры способа с использованием лопастной мешалки с применением кислотной среды растворения для оценки свойств растворения фармацевтической композиции с замедленным высвобождением по настоящему изобретению в верхнем отделе желудочно-кишечного тракта может включать способ, в котором исследование на растворение проводят с помощью лопастной мешалки со скоростью вращения 50 об/мин и 200 об/мин при 37±0,5°C в течение 2 часов в 0,1 н. соляной кислоте (900 мл). Как описано выше, гидроморфон или оксикодон в препарате имеют проблему преждевременного и увеличенного высвобождения лекарственного вещества, в случае, когда препарат разрушается при механическом напряжении в результате нахождения пищи в верхнем отделе желудочно-кишечного тракта, двигательной активности желудочно-кишечного тракта и так далее. Соотношение средних выраженных в процентах растворения (значение при скорости вращения 200 об/мин в способе с использованием лопастной мешалки/значение при скорости вращения 50 об/мин в способе с использованием лопастной мешалки) гидроморфона составляет предпочтительно 2,0 или меньше, более предпочтительно, 1 или меньше 5, после 2-часового исследования растворения в кислотной среде.
Примеры способа с использованием лопастной мешалки с применением нейтральной среды растворения для оценки свойств растворения в нейтральном зоне фармацевтической композиции с замедленным высвобождением по настоящему изобретению могут включать способ, в котором исследование растворения проводят способом с использованием лопастной мешалки при скорости вращения 50 об/мин при 37±0,5°C в фосфатном буфере (рН 6,8; 900 мл). Средняя выраженная в процентах степень растворения гидроморфона или оксикодона в испытательной среде растворения соответствует, предпочтительно, степени растворения, превышающей 85% в течение 24 часов после начала испытания на растворение. Кроме того, фармацевтическая композиция с замедленным высвобождением более предпочтительно демонстрирует среднюю выраженную в процентах степень растворения гидроморфона или оксикодона равную 50% или меньше в течение 2 часов после начала испытания на растворимость, и более чем 85% в течение 24 часов после начала испытание на растворение.
Исследование растворения фармацевтической композиции с замедленным высвобождением по настоящему изобретению в присутствии спирта выполняли в соответствии со способом с использованием лопастной мешалки с использованием кислотной среды растворения, содержащий 40% этанол. Что касается растворения гидроморфона или оксикодона в кислотной среде растворения, содержащей 40% этанол, то разница от средней выраженной в процентах степени растворения гидроморфона или оксикодона в соответствующей кислотной среде растворения, свободной от этанола, может составлять 25% или меньше, и составляет, предпочтительно, 20% или меньше, более предпочтительно, 15% или меньше. Кроме того, соотношение средних выраженных в процентах степеней растворения (кислотная среда растворения, содержащая 40% этанол/кислотная среда растворения) гидроморфона или оксикодона равно, предпочтительно, 2,0 или менее, более предпочтительно 1,5 или менее, в среде для исследования растворения через 2 ч.
Концентрация лекарственного вещества в растворе может быть измерена с применением условий (среда для испытаний, скорость встряхивания и время измерения), показанных в описанных ниже примерах. В испытании на растворение концентрация гидроморфона или оксикодона в среде для исследования растворения может быть рассчитана с использованием метода ВЭЖХ или тому подобное, для вычисления средней выраженной в процентах степени растворения и времени растворения гидроморфона или оксикодона из твердого препарата.
Используемый в настоящем документе термин «средняя выраженная в процентах степень растворения» относится к средней величине выраженных в процентах значений степени растворения, полученных для, по меньшей мере, 2, предпочтительно, 6, более предпочтительно, 12 образцов твердых препаратов для каждого типа твердого препарата.
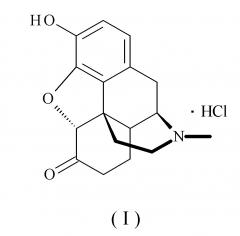
Гидрохлорид гидроморфона, который используется в качестве "компонента (А)", в соответствии с настоящим изобретением, представляет собой соединение, представленное следующей формулой (I):
[формула 1]
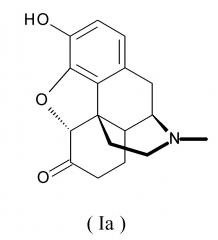
Его свободная форма (свободное основание) является гидроморфоном (INN), представленным следующей формулой (Ia):
[формула 2]
который также называют дигидроморфиноном. Систематическое название по IUPAC: 17-метил-3-гидрокси-4,5α-эпоксиморфинан-6-он. Гидроморфон является производным морфина, и это соединение классифицируется как наркотический анальгетик для невропатической боли, действующий на опиоидные рецепторы μ.
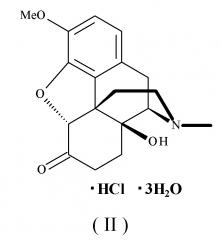
Гидрат гидрохлорида оксикодона, который используется в качестве "компонента (А)" в соответствии с настоящим изобретением, представляет собой гидрохлорид оксикодона (INN) или гидрат гидрохлорида оксикодона (Jan; Японская фармакопея), и он представлен следующей формулой (II):
[формула 3]
Его химическое название представляет собой (5R)-4,5-эпокси-14-гидрокси-3-метокси-17-метилморфинан-6-он моногидрохлорид тригидрат. Это соединение, как и в случае морфина, классифицируется как наркотический анальгетик для лечения невропатической боли, действующий на опиоидные рецепторы μ.
Его безводная форма представлена следующей формулой (IIa):
[формула 4]
"Ацетат сукцинат гидроксипропилметилцеллюлозы (HPMCAS) (В)" в соответствии с настоящим изобретением известен в качестве полимерной основы, проявляющей свойства рН-зависимого растворения, используемого в области фармацевтики. рН-зависимые полимерные основы могут быть классифицированы как основы энтеросолюбильного покрытия и основы, растворимые в желудке. В настоящем изобретении основа энтеросолюбильного покрытия предпочтительна для функционирования в препарате с замедленным высвобождением, поскольку основа энтеросолюбильного покрытия плохо растворима в среде с показателем рН, таким как в желудке, и постепенно растворяется в среде с нейтральным показателем рН, таким как, например, в тонком или толстом кишечнике.
"HPMCAS (В)" в соответствии с настоящим изобретением, можно приобрести, например, у компании Shin-Etsu Chemical Co., Ltd., в виде AQOAT (торговое наименование). В зависимости от свойств рН растворения или размера частиц, доступными являются типы HPMCAS (B), такие как: LF, MF, HF, LG, MG и HG. HPMCAS типа LF является предпочтительным (pH ≥5,5; в соответствии со сборником стандартов Вспомогательные вещества в фармакопее Японии).
Размер частиц HPMCAS (B) по настоящему изобретению D50 равен 40 мкм или меньше, предпочтительно, D50 равен 20 мкм или меньше, более предпочтительно, D50 равен 10 мкм или меньше, исходя из его среднего размера частиц (средний размер). Кроме того, 90% совокупный размер частиц D90, при котором совокупная фракция составляет 90%, равен предпочтительно 20 мкм или меньше. При использовании HPMCAS количество добавляемой HPMCAS предпочтительно составляет от 5 до 75% по массе, более предпочтительно от 10 до 60% по массе композиции.
"Гидроксипропилцеллюлоза (HPC) (С)", которая может быть использована в настоящем изобретении, является коммерчески доступной. Согласно, например, каталогу Nippon Soda Co., Ltd., можно приобрести два типа частиц, отличающихся по размеру: общий продукт (сетчатый фильтр с размером ячейки 40-меш с выходом продукта 99%, 400 мкм или меньше) и мелкий порошок (сетчатый фильтр с размером ячейки 100 меш с выходом продукта 99%, 150 микрон или меньше). Общий продукт соответствует влажному гранулированию, в то время как тонкий порошок подходит для прямого прессования или сухого гранулирования. Доступные типы вязкости HPC [значения вязкости (мПа⋅с) при концентрации HPC 2% и 20°C] для каждого размера частиц соответствуют SSL (от 2,0 до 2,9), SL (от 3,0 до 5,9), L (от 6,0 до 10), M (от 150 до 400) и H (от 1000 до 4000) в порядке возрастания вязкости.
"Гидроксипропилцеллюлоза (далее также сокращенно HPC) (С)", предпочтительно, имеет размер частиц, соответствующий мелкому порошку (сетчатый фильтр с размером ячейки 100-меш с выходом продукта 99%, 150 мкм или меньше) и вязкость, соответствующую типу М (от 150 до 400 мПа⋅с) или H (от 1000 до 4000 мПа⋅с). Кроме того, по настоящему изобретению HPC может быть использована в качестве связующего для фармацевтической композиции с замедленным высвобождением. При использовании HPC в качестве связующего эта HPC, как правило, растворяется в воде или органическом растворителе, таком как спирт, и используется в качестве раствора. В этом случае размер частиц, соответствующий общему продукту, является приемлемым для гидроксипропилцеллюлозы, и ее вязкость, предпочтительно, равна вязкости, соответствующей типу L (от 6,0 до 10,0), SL (от 3,0 до 5,9) и SSL (от 2,0 до 2,9), более предпочтительно, типу SL (от 3,0 до 5,9).
"Сахарид (D)" в соответствии с настоящим изобретением представляет собой, предпочтительно, лактозу или сахарный спирт.
Лактоза по настоящему изобретению включает все гидраты лактозы и ангидриды лактозы. Гидрат лактозы является предпочтительным. Сахарным спиртом является, предпочтительно, маннит, ксилит и эритрит, особенно предпочтительно, маннит.
Фармацевтическая композиция с замедленным высвобождением по настоящему изобретению представляет собой фармацевтическую композицию с замедленным высвобождением, содержащую (A) гидрохлорид гидроморфона или гидрат гидрохлорида оксикодона, (B) HPMCAS, имеющий средний размер (D50) 40 мкм или меньше, (C) гидроксипропилцеллюлозу (HPC), и (D) сахарид, где относительное содержание компонента (C) и компонента (B) по массе в композиции, (С)/(В), составляет от 11/3 до 3/11. Фармацевтическая композиция с замедленным высвобождением по настоящему изобретению может дополнительно содержать наполнитель, разрыхлитель, связующее вещество, ожижающее вещество, смазывающее вещество, краситель, полирующее (глянцующее) средство и т.д., при условии, что эффекты настоящего изобретения не ослабляются.
Примеры наполнителя в соответствии с настоящим изобретением включают: производные сахара, такие как лактоза, сахароза, глюкоза, маннит и сорбит; производные крахмала, такие как кукурузный крахмал, картофельный крахмал, желатинизированный крахмал, декстрин, карбоксиметилкрахмал и натрий карбоксиметилкрахмал; прежелатинизированный крахмал; производные целлюлозы, такие как кристаллическая целлюлоза, метилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилцеллюлоза с низкой степенью замещения, гидроксипропилметилцеллюлоза, кармеллоза, кальций кармеллоза, кроскармеллоза и натрий кроскармелоза; гуммиарабик; декстран; пуллулан; кремниевые производные, такие как легкая безводная кремниевая кислота, силикат кальция, гидрат кремниевой кислоты, синтетический силикат алюминия и алюминометасиликат магния; фосфатные производные, такие как дикальций фосфат; хлоридные производные, такие как хлорид натрия; карбонатные производные, такие как карбонат кальция; сульфатные производные, такие как сульфат кальция; и их смеси.
Примеры разрыхляющего вещества в соответствии с настоящим изобретением включают адипиновую кислоту, альгиновую кислоту, желатинизированный крахмал, натрий карбоксиметилкрахмал, водный диоксид кремния, цитрат кальция, легкую безводную кремниевую кислоту, синтетический силикат алюминия, пшеничный крахмал, рисовый крахмал, стеарат кальция, кукурузный крахмал, порошкообразный трагакант, картофельный крахмал, гидроксипропилкрахмал, прежелатинизированный крахмал, фумарат мононатрия, безводную лимонную кислоту и дигидрогенфосфат кальция.
Примеры связующего вещество в соответствии с настоящим изобретением включают порошкообразный мальтозный сироп, гуммиарабик, порошкообразную аравийскую камедь, альгинат натрия, альгинатный эфир пропиленгликоля, порошкообразный гидролизованный желатин, гидролизованный крахмал-легкая безводная кремниевая кислота, фруктозу, водный диоксид кремния, порошкообразный агар, легкую безводную кремниевую кислоту, синтетический силикат алюминия, пшеничную муку, пшеничный крахмал, рисовую муку, рисовый крахмал, поливинилацетатную смолу, фталат ацетата целлюлозы, диоктил натрий сульфосукцинат, аминоацетат дигидроксиалюминия, тартрат калия-натрия, воду, сложный эфир сахарозы и жирной кислоты, очищенный желатин, желатин, D-сорбит, декстрин, крахмал, кукурузный крахмал, трагакант, порошкообразный трагакант, концентрированный глицерин, картофельный крахмал, гидроксипропил крахмал, сополимеры винилпирролидона и винилацетата, пиперонилбутоксид, глюкозу, прежелатинизированный крахмал, пуллулан, поливиниловый спирт (полностью омыленный продукт), поливиниловый спирт (частично омыленный продукт), полифосфат натрия, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу.
Примеры ожижающего вещества в соответствии с настоящим изобретением могут включать в себя водный диоксид кремния, легкую безводную кремниевую кислоту, синтетический силикат алюминия, оксид титана, стеариновую кислоту, стеарат кальция, стеарат магния, третичный фосфат кальция, тальк, кукурузный крахмал и алюминометасиликат магния.
Примеры смазывающего вещества в соответствии с настоящим изобретением включают какао-масло, карнаубский воск, водный диоксид кремния, сухой гель гидрокиси алюминия, эфир глицерина и жирной кислоты, силикат магния, легкую безводную кремниевую кислоту, гидрогенизированное масло, синтетический силикат алюминия, белый пчелиный воск, оксид магния, тартрат натрия-калия, сложный эфир сахарозы и жирной кислоты, стеариновую кислоту, стеарат кальция, стеарат магния, стеариловый спирт, полиоксил 40 стеарат, цетанол, соевое гидрогенизированное масло, желатин, тальк, карбонат магния, осажденный карбонат кальция, кукурузный крахмал, картофельный крахмал, стеарил фумарат натрия, пчелиный воск, метасиликат алюминат магния, лаурат натрия и сульфат магния.
Примеры основ покрытия в соответствии с настоящим изобретением включают основы для сахарного покрытия, основы для водорастворимого пленочного покрытия, основы для растворимого в кишечнике пленочного покрытия, основы для пленочного покрытия замедленного высвобождения. Сахарозу используют в качестве основы для сахарного покрытия. Альтернативно, одна или две, или более основ для сахарного покрытия, выбранные из талька, осажденного карбоната кальция, фосфата кальция, сульфата кальция, желатина, гуммиарабика, поливинилпирролидона, пуллулана и т.д., могут быть использованы по отдельности или в сочетании. Примеры основ пленочного водорастворимого покрытия включают: производные целлю