Моноклональное антитело к pd-l1
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложены антитело и его антигенсвязывающий фрагмент, способные к специфичному связыванию с PD-L1. Также рассмотрены фармацевтическая композиция, нуклеиновая кислота, кодирующая антитело или его антигенсвязывающий фрагмент, экспрессионный вектор, клетка-хозяин и способ ее получения. Кроме того, описан способ получения антитела или его антигенсвязывающего фрагмента, способ ингибирования биологической активности PD-L1, а также применение антитела или его антигенсвязывающего фрагмента или фармацевтической композиции. Данное изобретение может найти дальнейшее применение в терапии заболевания или нарушения, опосредованного PD-L1, в частности различных видов рака. 10 н. и 19 з.п. ф-лы, 19 ил., 3 табл., 18 пр.
Реферат
Область техники
Настоящее изобретение относится к области биотехнологии, а именно к антителам или их антигенсвязывающим фрагментам, а также их применению. Более конкретно, настоящее изобретение относится к моноклональному антителу, которое специфически связывается с PD-L1 (CD274, B7-H1, лиганд 1 рецептора программируемой гибели клеток). Изобретение также относится к нуклеиновой кислоте, кодирующей данное антитело или его антигенсвязывающий фрагмент, вектору экспрессии, способу получения антитела и применению антитела для усиления функции Т-клеток для повышающей регуляции клеточно-опосредованных иммунных реакций и для лечения связанных с дисфункцией Т-клеток нарушений, например, иммунитета опухоли и для лечения рака.
Уровень техники
Развитие и активация лимфоцитов
Двумя основными типами лимфоцитов у человека являются Т-тип (тимоциты) и В-тип (костномозговые). Эти клетки образуются из гемопоэтических стволовых клеток в костном мозге и эмбриональной печени, которые запрограммированы на лимфоидный путь развития. Потомство этих стволовых клеток различными путями созревает до В- или Т-лимфоцитов. Развитие В-лимфоцитов человека происходит исключительно в костном мозге. Т-клетки, с другой стороны, развиваются из незрелых предшественников, которые покидают костный мозг и перемещаются через кровоток в тимус, где они размножаются и дифференцируются в зрелые Т-лимфоциты.
Зрелые лимфоциты, источником которых является тимус или костный мозг, пребывают в неактивном или "покоящемся" состоянии, т. е., они являются митотически неактивными. Когда они рассредоточиваются в кровотоке, эти "необученные" или "наивные" лимфоциты перемещаются в различные вторичные или периферические лимфоидные органы, такие, как селезенка, лимфатические узлы или миндалины. Для большинства наивных лимфоцитов характерна короткая продолжительность жизни, и они погибают за несколько дней после того, как покидают костный мозг или тимус. Однако если такая клетка получает сигналы, указывающие на присутствие антигена, она может активироваться и претерпевать последовательные циклы деления клеток. Некоторые клетки из полученного в результате потомства затем возвращаются в покоящееся состояние и становятся лимфоцитами памяти - В- и Т-клетками, которые по сути обучены для следующей встречи со стимулирующим аллергеном. Другим потомством активированных наивных лимфоцитов являются эффекторные клетки, живущие лишь несколько дней, но выполняющие определенные виды защитной активности.
Активация лимфоцитов представляет собой упорядоченную последовательность событий, которую проходит покоящийся лимфоцит после стимуляции к делению и производству потомства, из которого некоторые клетки становятся эффекторными клетками. Полный ответ включает как индукцию пролиферации клеток (митогенез), так и проявление иммунологических функций. Лимфоциты активируются, когда специфические лиганды связываются с рецепторами на их поверхностях. Лиганды отличаются от Т-клеток и В-клеток, однако конечные внутриклеточные физиологические механизмы сходны.
Сами же некоторые инородные антигены могут вызывать активацию лимфоцитов, в частности, большие полимерные антигены, сшивающие поверхностные иммуноглобулины на В-клетках или другие гликопротеины на Т-клетках. Однако большинство антигенов не являются полимерными, и даже прямое связывание с В- клетками в больших количествах не обеспечивает активации. Эти более распространенные антигены активируют В-клетки, когда они стимулируются совместно с активированными поблизости хелперными Т-лимфоцитами. Такая стимуляция может происходить от лимфокинов, секретируемых Т-клеткой, однако наиболее эффективно она передается путем прямого контакта В-клетки с поверхностными белками Т-клеток, взаимодействующими с определенными поверхностными рецепторами В-клеток для создания вторичного сигнала.
Т-клетки
Т-лимфоциты не экспрессируют иммуноглобулины, однако обнаруживают присутствие инородных веществ при помощи поверхностных белков, называемых рецепторами Т-клеток (TCR). Эти рецепторы распознают антигены либо через прямой контакт, либо воздействуя на активность других иммунных клеток. Вместе с макрофагами Т-клетки являются основным типом клеток, вовлеченных в клеточно-опосредованный иммунитет.
В отличие от В-клеток, Т-клетки могут обнаруживать инородные вещества только в конкретных условиях. В частности, Т-лимфоциты распознают инородный белок, только если он расщепляется на малые пептиды, которые затем выявляются на поверхности второй клетки-хозяина, называемой антигенпрезентирующей клеткой (АРС). Многие типы клеток-хозяев могут представлять антигены в некоторых условиях, однако определенные типы более специфично адаптированы для этой и являются особенно важными для регулирования активности Т-клеток, включая макрофаги и другие В-клетки. Представление антигена частично зависит от определенных белков, называемых белками главного комплекса гистосовместимости (МНС), на поверхности представляющих клеток. Таким образом, для стимуляции клеточно-опосредованного иммунитета инородные пептиды должны быть представлены Т-клеткам в комбинации с пептидами МНС, и эта комбинация должна распознаваться рецептором Т-клеток.
Существует две значительных субпопуляции Т-клеток: цитотоксичные Т- лимфоциты (Тц-клетки или CTL) и хелперные Т-клетки (Тх), которые ориентировочно идентифицируются по экспрессии на клеточной поверхности маркера CD8 и CD4. Тц-клетки важны для защиты от вирусов и способны уничтожать вирусы непосредственно путем распознавания некоторых экспрессируемых на поверхности клеток вирусных пептидов. Тх-клетки способствуют пролиферации, созреванию и иммунологической функции других типов клеток, например, секреции лимфокинов для регулирования активности В-клеток, макрофагов и цитотоксичных Т-клеток. И наивные Т-лимфоциты, и Т-лимфоциты памяти обычно остаются в покоящемся состоянии, и в этом состоянии они не демонстрируют значительной хелперной или цитотоксичной активности. В активированном состоянии эти клетки претерпевают несколько циклов митотического деления для образования дочерних клеток. Некоторые из этих дочерних клеток возвращаются в покоящееся состояние как клетки памяти, а другие становятся эффекторными клетками, активно проявляющими хелперную или цитотоксичную активность. Эти дочерние клетки подобны их родительским клеткам: CD4+ клетки могут образовывать только CD4+ потомство, a CD8+ клетки дают только CD8+ потомство. Эффекторные Т-клетки экспрессируют маркеры поверхности клеток, которые не экспрессируются на покоящихся Т-клетках, таких, как CD25, CD28, CD29, CD40L, рецепторы трансферрина и белки МНС II класса. При устранении активирующих стимулов цитотоксичная или хелперная активность постепенно снижается в течение нескольких дней, поскольку эффекторные клетки либо отмирают, либо возвращаются в покоящееся состояние.
Подобно активации В-клеток, реакция Т-лимфоцитов на большинство антигенов также требует двух типов одновременных стимулов. Первым является антиген, который, будучи соответствующим образом экспонированным белками МНС на антигенпрезентирующей клетке, может распознаваться и связываться рецепторами Т- клеток. Поскольку этот комплекс антиген-МНС не посылает сигнал внутрь клетки, он обычно бывает недостаточным для того, чтобы привести к активации Т-клетки. Полная активация, такая, как та, что происходит с хелперными Т-клетками, требует костимуляции другими специфическими лигандами, называемыми костимуляторами, которые экспрессируются на поверхности антигенпрезентирующей клетки. С другой стороны, активация цитотоксичной Т-клетки обычно требует IL-2 - цитокина, секретируемого активированными хелперными Т-клетками.
Путь PD-1
Важные отрицательный костимулирующий сигнал, регулирующий активацию Т-клеток, обеспечивается рецептором запрограммированной гибели-1 (PD-1, CD279) и его партнерами по связыванию с лигандом PD-L1 (В7-Н1, CD274) и PD-L2 (B7-DC, CD273). Отрицательная регулирующая роль PD-1 была обнаружена при помощи нокаутов PD-1 (Pdcd1 -/-), которые склонны к аутоиммунности. (Nishimura et al., Immunity JJ: 141 - 51 (1999); Nishimura et al., Science 291: 319 - 22 (2001)). PD-1 связан с CD28 и CTLA-4, но в нем отсутствует ближний к мембране цистеин, обеспечивающий возможность гомодимеризации. Цитоплазматический домен PD-1 содержит иммунорецепторный тирозинсвязывающий ингибирующий мотив (ITIM, V/IxYxxL/V). PD-1 связывается только с PD-L1 и PD-L2 (Freeman et al., J. Exp. Med. 192: 1 - 9 (2000); Dong et al., Nature Med. 5: 1365 - 1369 (1999); Latchman et al., Nature Immunol 2: 261 - 268 (2001); Tseng et al., J. Exp. Med. 193: 839 - 846 (2001)).
PD-1 может экспрессироваться на Т-клетках, В-клетках, природных киллерных Т-клетках, активированных моноцитах и дендритных клетках (DC). PD-1 экспрессируется активированными, не нестимулированными человеческими Т- клетками CD4+ и CD8+, В-клетками и миелоидными клетками. В этом состоит отличие от более ограниченной экспрессии CD28 и CTLA-4 (Nishimura et al., Int. Immunol. 8: 773 - 80 (1996); Boettler et al., J. Virol. 80: 3532 - 40 (2006)). Существует как минимум 4 варианта PD-1, которые были клонированы из активированных человеческих Т-клеток, включая транскрипты, в которых отсутствуют (i) экзон 2, (ii) экзон 3, (iii) экзоны 2 и 3 или (iv) экзоны с 2 по 4 (Nielsen et al., Cell. Immunol. 235: 109 - 16 (2005)). За исключением PD-1Δex3, все варианты экспрессируются в такой же мере, как и PD-1 полной длины в покоящихся мононуклеарных клетках периферической крови (РВМС). Экспрессия всех вариантов в значительной мере индуцируется после активации человеческих Т-клеток антителами против CD3 и против CD28. В вариантах PD-lΔex3 отсутствует трансмембранный домен, и они подобны растворимому CTLA-4, играющему важную роль в аутоиммунности (Ueda et al., Nature 423: 506 - 11 (2003)). Этим вариантом богата синовиальная жидкость и сыворотка пациентов с ревматоидным артритом (Wan et al., J. Immunol. 177: 8844 - 50 (2006)). Два лиганда PD-1 отличаются по характеру экспрессии. PD-L1 конститутивно экспрессируется на мышиных Т- и В-клетках, CD, макрофагах, мезенхимальных стволовых клетках и мастоцитах костного мозга (Yamazaki et al., J. Immunol. 169: 5538 - 45 (2002)). PD-L1 экспрессируется на многих различных негемопоэтических клетках (например, клетках роговицы, легких, сосудистого эпителия, непаренхиматозных клетках печени, мезенхимальных стволовых клетках, панкреатических островках, плацентарных синцитиотрофобластах, кератиноцитах и т. п.) [Keir et al., Annu. Rev. Immunol. 26: 677 - 704 (2008)] и подвергается повышенной регуляции на многих типах клеток после активации. Интерфероны IFN как типа I, так и типа II вызывают повышение PD-L1 (Eppihimer et al., Microcirculation 9: 133 - 45 (2002)); Schreiner et al., J. Neuroimmunol 155: 172 - 82 (2004). Экспрессия PD-L1 в линиях клеток снижается при ингибировании MyD88, TRAF6 и МЕК (Liu et al., Blood НО: 296 - 304 (2007)). JAK2 также участвует в 30 индукции PD-L1 (Lee et al., FEBS Lett, 580: 755 - 62 (2006); Liu et al., Blood HO: 296 - 304 (2007)). Потеря или ингибирование гомолога фосфатазы и тензина (PTEN), клеточной фосфатазы, которая модифицирует фосфатидилинозитол-3-киназу (PI3K) и сигнал Akt, повышала посттранскрипционную экспрессию PD-L1 при раке (Parsa et al., Nat. Med. 13: 84 - 88 (2007)).
Экспрессия PD-L2 более ограничена по сравнению с PD-L1. PD-L2 индуцибельно экспрессируется на DC, макрофагах и мастоцитах костного мозга. PD-L2 также экспрессируется приблизительно на половине, а то и двух третях покоящихся брюшинных В1-клетках, но не на традиционных В2 В-клетках (Zhong et al., Eur. J. Immunol. 37: 2405 - 10 (2007)). PD-L2+ B1 клетки связывают фосфатидилхолин и могут быть важны для природного иммунного ответа на бактериальные антигены. Индукция PD-L2 со стороны IFN-γ частично зависит от NF -КВ (Liang et al., Eur. J. Immunol. 33_: 2706 - 16 (2003)). PD-L2 также может индуцироваться на моноцитах и макрофагах GM-CF, IL-4 и IFN-γ (Yamazaki et al., J. Immunol. 169: 5538 - 45 (2002); Loke et al., PNAS 100: 5336-41 (2003)).
Сигнал PD-1, как правило, больше влияет на выработку цитокина, чем на пролиферацию клеток, со значительным влиянием на выработку IFN-γ, TNF-a и IL-2. Опосредованный PD-1 ингибиторный сигнал также зависит от силы сигнала TCR, причем большее ингибирование обеспечивается при более низких уровнях стимуляции TCR. Это снижение может быть преодолено путем костимуляции через CD28 [Freeman et al., J. Exp. Med. 192: 1027 - 34 (2000)] или присутствие IL-2 [Carter et al., Eur. J. Immunol. 32: 634 - 43 (2002)].
Появляется все больше свидетельств того, что сигнал через PD-L1 и PD-L2 может быть двунаправленным. То есть, помимо модификации сигнала TCR или BCR, сигнал также может доставляться обратно к клеткам, экспрессирующим PD-L1 и PD-L2. Хотя обработка дендритных клеток природным человеческим антителом против PD-L2, выделенным из организма пациента с макроглобулинемией Вальденстрема, не обнаружила повышающей регуляции МНС II или костимулирующих молекул В7, такие клетки вырабатывали большее количество провоспалительных цитокинов, в частности, TNF-a и IL-6, и стимулировали пролиферацию Т-клеток (Nguyen et al., J. Exp. Med. 196: 1393 - 98 (2002)). Лечение мышей этим антителом также (1) повышало сопротивление пересаженной меланоме b16 и быстро индуцировало опухолеспецифические CTL (Radhakrishnan et al., J. Immunol. 170: 1830 - 38 (2003); Radhakrishnan et al., Cancer Res. 64: 4965 - 72 (2004); Heckman et al., Eur. J. Immunol. 37: 1827 - 35 (2007)); (2) блокировало развитие воспалительной болезни дыхательных путей в мышиной модели аллергической астмы (Radhakrishnan et al., J. Immunol. 173: 1360 - 65 (2004); Radhakrishnan et al., J. Allergy Clin. Immunol. UJy. 668 - 74 (2005)).
Еще одно свидетельство обратного сигнала в дендритные клетки ("DC") было получено по результатам исследований костномозговых DC, культивированных с растворимым PD-1 (домен PD-1 ЕС, слитый с константной областью Ig - "s-PD-1") (Kuipers et al., Eur. J. Immunol. 36: 2472 - 82 (2006)). Этот sPD-1 ингибировал активацию DC и повышал выработку IL-10 обратимым способом благодаря введению антитела против PD-1. Кроме того, некоторые исследования выявили рецептор для PD-L1 или PD-L2, независимый от PD-1. В7.1 уже был определен как партнер по связыванию для PD-L1 (Butte et al., Immunity 27: 111 - 22 (2007)). Исследования химического сшивания показывают, что PD-L1 и В7.1 могут взаимодействовать через их IgV-подобные домены. Взаимодействие В7.1 :PD-L1 может вызывать ингибиторный сигнал в Т- клетки. Сшивание PD-L1 на CD4+ Т-клетках при помощи В7.1 или сшивание В7.1 на CD4+ Т-клетках при помощи PD-L1 обеспечивает ингибиторный сигнал. Т-клетки с отсутствующими CD28 и CTLA-4 демонстрируют сниженную пролиферацию и выработку цитокинов при стимулировании шариками, покрытыми антителом против CD3 плюс В7.1. В Т-клетках с отсутствием всех рецепторов для В7.1 (т. е., CD28, CTLA-4 и PD-L1) ингибирование пролиферации Т-клеток и выработки цитокинов шариками, покрытыми антителом против CD3 плюс В7.1, прекращалось. Это указывает на то, что В7.1 специфично действует через PD-L1 на Т-клетку в отсутствие CD28 и CTLA-4. Подобным образом Т-клетки с отсутствующим PD-1 демонстрировали сниженную пролиферацию и выработку цитокинов при стимулировании в присутствии шариков, покрытых антителом против CD3 плюс PD-L1, демонстрируя ингибирующее воздействие сшивания PD-L1 на В7.1 на Т-клетки. При отсутствии в Т-клетках всех известных рецепторов для PD-L1 (т. е., при отсутствии PD-1 и В7.1) ослабление пролиферации Т-клеток шариками, покрытыми антителом против CD3 плюс PD-L1, прекращается. Таким образом, PD-L1 может оказывать ингибиторное воздействие на Т- клетки через В7.1 или PD-1.
Прямое взаимодействие между В7.1 и PD-L1 указывает на то, что нынешнее понимание костимуляции является неполным и подчеркивает значение для экспрессии этих молекул на Т-клетках. Исследования PD-L1 -/- Т-клеток показывают, что PD-L1 на Т-клетках может снижать выработку цитокинов Т-клеткой. (Latchman et al., Ргос. Natl. Acad. Sci. USA 101: 10691 - 96 (2004)). Поскольку и PD-L1, и B7.1 экспрессируются на Т-клетках, В-клетках, DC и макрофагах, существует потенциал для направленного взаимодействия между В7.1 и PD-L1 на этих типах клеток. Кроме того, PD-L1 на негемопоэтических клетках может взаимодействовать с В7.1, а также PD-1 на Т- клетках, что вызывает вопрос: участвует ли PD-L1 в их регуляции. Одним из возможных объяснений ингибиторного влияния взаимодействия В7.1:PD-L1 является то, что PD-L1 Т-клеток может улавливать или изолировать АРС В7.1 от взаимодействия с CD28.
В результате антагонизм сигнала через PD-L1, включающий блокирование взаимодействия PD-L1 с PD-1, В7.1, или и с тем, и с другим, таким образом, не давая PD-L1 отправить отрицательный костимулирующий сигнал на Т-клетки и другие антиген-представляющие клетки, возможно, повышает иммунитет в ответ на инфекцию (например, острую или хроническую) и иммунитет опухоли. Кроме того, антитела против PD-L1 согласно настоящему изобретению могут комбинироваться с антагонистами других компонентов сигнала PD-1: PD-L1, например, антагониста антител против PD-1 и против PD-L2.
В частности, ингибирование сигнала PD-L1 было предложено в качестве средства повышения иммунитета Т-клетки для лечения рака (например, иммунитета опухоли) и к инфекциям, включая как острые, так и хронические (например, устойчивые) инфекции.
Ингибиторы, блокирующие взаимодействие PD-L1 : PD-1, известны, помимо прочих источников, из документов W0 2001014557, W0 2002086083, W0 2007005874, W0 2010036959, W0 2010077634 и WO 2011066389.
В настоящее время на ранних стадиях клинических исследований находятся более 10 моно- и биспецифических препаратов с анти-PD-L1 компонентом.
Одно моноспецифическое анти-PD-L1 антитело, MPDL3280A (atezolizumab, Roche), успешно прошло клинические испытания (КИ) и применяется в клинической практике. Атезолизумаб одобрен FDA к применению у пациентов с метастатическим уротелиальным раком, продолжаются КИ III фазы у пациентов с немелкоклеточный рак легких (НМРЛ), почечно-клеточным раком, колоректальный рак (КРР), раком молочной железы (РМЖ). Препарат представляет собой Ig1 антитело с модифицированным Fc-регионом (с целью элиминации ADCC - эффекта). Атезолизумаб описан в документе WO 2010077634.
Другими анти-PD-L1 препаратами, находящимися на заключительной фазе КИ, являются препараты avelumab (Pfizer) и durvalumab (AZ). Дурвалумабом (Durvalumab, MEDI-4736) описан в документе WO2011066389. Авелумаб (Avelumab) описан в документе WO2013079174. Основным отличием препарата авелумаб является наличие у антитела ADCC-эффекта, более того, его можно усиливать с помощью IFNg или IL12 (NCT01772004). При этом профиль безопасности препарата авелумаб соответствует таковому других анти-PD-1/PD-L1 препаратов (Cancer Immunol Res; 3(10) October 2015; Antibody-Dependent Cellular Cytotoxicity Activity of a Novel Anti-PD-L1 Antibody Avelumab on Human Tumor Cells; Benjamin Boyerinas).
Таким образом, существует необходимость в создание эффективного ингибитора PD-L1 (лиганда 1 рецептора программируемой гибели клеток)
В связи с вышесказанным, актуальным является создание новых антител, которые эффективно связываются с PD-L1.
Антитело BCD-135 селективно связывается с PD-L1 и является эффективным ингибитором лиганда 1 рецептора программируемой гибели клеток.
Краткое описание изобретения
Настоящее изобретение относится к связывающим молекулам, в частности антителам, направленным для связывания с PD-L1. Такие антитела могут быть использованы для лечения заболевания или нарушения, опосредуемого PD-L1.
В одном из аспектов настоящее изобретение относится к моноклональному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с PD-L1, включающее вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность по меньшей мере на 90% гомологичную последовательности SEQ ID NO: 3 и вариабельный домен легкой цепи, содержащий аминокислотную последовательность по меньшей мере на 90% гомологичную последовательности SEQ ID NO: 7.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 3.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 7.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи, который содержит аминокислотные последовательности по меньшей мере на 90% гомологичные последовательностям SEQ ID NO: 1-3.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи, который содержит аминокислотные последовательности, представленные последовательностями SEQ ID NO: 1-3.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен легкой цепи, который содержит аминокислотные последовательности по меньшей мере на 90% гомологичные последовательностям SEQ ID NO: 5-7.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен легкой цепи, который содержит аминокислотные последовательности, представленные последовательностями SEQ ID NO: 5-7.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи, который содержит аминокислотные последовательности по меньшей мере на 90% гомологичные последовательностям SEQ ID NO: 1-3, и вариабельный домен легкой цепи, который содержит аминокислотные последовательности по меньшей мере на 90% гомологичные последовательностям SEQ ID NO: 5-7.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи, который содержит аминокислотные последовательности SEQ ID NO: 1-3, и вариабельный домен легкой цепи, который содержит аминокислотные последовательности SEQ ID NO: 5-7.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность по меньшей мере на 90% гомологичную аминокислотной последовательности SEQ ID NO: 4.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 4.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен легкой цепи, который содержит аминокислотную последовательность по меньшей мере на 90% гомологичную аминокислотной последовательности SEQ ID NO: 8.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 8.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность по меньшей мере на 90% гомологичную аминокислотной последовательности SEQ ID NO: 4, и вариабельный домен легкой цепи, который содержит аминокислотную последовательность по меньшей мере на 90% гомологичную аминокислотной последовательности SEQ ID NO: 8.
В некоторых вариантах моноклональное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 4, и вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 8.
В некоторых вариантах моноклональное антитело содержит тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере на 90% гомологичную последовательности SEQ ID NO: 9, и легкую цепь, содержащую аминокислотную последовательность по меньшей мере на 90% гомологичную последовательности SEQ ID NO: 10.
В некоторых вариантах моноклональное антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 9, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах моноклональное антитело, специфичное к PD-L1, представляет собой полноразмерное антитело IgG.
В некоторых вариантах полноразмерное антитело IgG относится к изотипу IgG1, IgG2, IgG3, IgG4 человека.
В некоторых вариантах моноклональное антитело относится к изотипу IgG1 человека.
В одном из аспектов настоящее изобретение относится к нуклеиновой кислоты, которая кодирует любое вышеуказанное антитело или его антигенсвязывающий фрагмент.
В некоторых вариантах нуклеиновая кислота представляет собой ДНК.
В одном из аспектов настоящее изобретение относится к экспрессионному вектору содержащему любую вышеуказанную нуклеиновую кислоту.
В одном из аспектов настоящее изобретение относится к способу получения клетки-хозяина для получения любого вышеуказанного антитела или его антигенсвязывающего фрагмента, который включает трансформирование клетки вышеуказанным вектором.
В одном из аспектов настоящее изобретение относится к клетке-хозяину для получения любого вышеуказанного антитела или его антигенсвязывающего фрагмента, которая содержит любую вышеуказанную нуклеиновую кислоту.
В одном из аспектов настоящее изобретение относится к способу получения любого вышеуказанного антитела или его антигенсвязывающего фрагмента, который заключается в культивировании вышеуказанной клетки-хозяина в культуральной среде в условиях, достаточных для получения указанного антитела, при необходимости, с последующим выделением и очисткой полученного антитела.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для профилактики или лечения заболевания или нарушения, опосредуемого PD-L1, которая содержит любое вышеуказанное антитело или его антигенсвязывающий фрагмент в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
В некоторых вариантах фармацевтическая композиция предназначена для профилактики или лечения заболевания или нарушения, опосредуемого PD-L1, выбранного из группы: ПРГШ, рак шейки матки, рак без выявленного первоисточника, глиобластома, рак пищевода, рак мочевого пузыря, ТНРМЖ, КРР, гепатоцеллюлярная карцинома, меланома, НМРЛ , рак почки, рак яичника, лимфома Ходжкина, MSI КРР .
В одном из аспектов настоящее изобретение относится к фармацевтической комбинации для профилактики или лечения заболевания или нарушения, опосредуемого PD-L1, которая содержит любое вышеуказанное антитело или его антигенсвязывающий фрагмент и по меньшей мере одно терапевтически активное противоопухолевое соединение.
В некоторых вариантах фармацевтическая комбинация предназначена для профилактики или лечения заболевания или нарушения, опосредуемого PD-L1, выбранного из группы: ПРГШ, рак шейки матки, рак без выявленного первоисточника, глиобластома, рак пищевода, рак мочевого пузыря, ТНРМЖ, КРР, гепатоцеллюлярная карцинома, меланома, НМРЛ, рак почки, рак яичника, лимфома Ходжкина, MSI КРР.
В некоторых вариантах фармацевтическая комбинация содержит терапевтически активное противоопухолевое соединение, которое выбирают из химиотерапевтического средства, антитела или противогормонального средства.
В одном из аспектов настоящее изобретение относится к способу ингибирования биологической активности PD-L1 у субъекта, нуждающемуся в таком ингибировании, который включает введение субъекту эффективного количества любого вышеуказанного антитела или его антигенсвязывающего фрагмента.
В одном из аспектов настоящее изобретение относится к применению любого вышеуказанного антитела или его антигенсвязывающего фрагмента или вышеуказанной фармацевтической композиции для лечения у субъекта, нуждающегося в таком лечении, заболевания или нарушения, опосредуемого PD-L1.
В некоторых вариантах изобретение относится к применению любого вышеуказанного антитела или его антигенсвязывающего фрагмента или вышеуказанной фармацевтической композиции для лечения заболевания или нарушения, выбранного из группы: ПРГШ, рак шейки матки, рак без выявленного первоисточника, глиобластома, рак пищевода, рак мочевого пузыря, ТНРМЖ, КРР, гепатоцеллюлярная карцинома, меланома, НМРЛ, рак почки, рак яичника, лимфома Ходжкина, MSI КРР.
Краткое описание чертежей
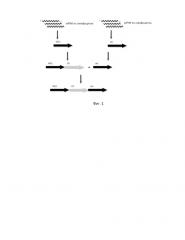
Фиг. 1. Схема синтеза комбинаторной наивной библиотеки человека.
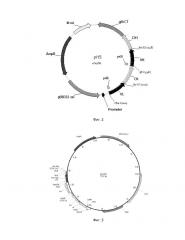
Фиг. 2. Карта фагмиды для клонирования Fab фаговых дисплейных библиотек.
Фиг. 3. Карта экспрессионной плазмиды для наработки Fab.
Фиг. 4. Электрофореграмма BCD-135 в восстанавливающих условиях (4А, 12% SDS-PAGE), в невосстанавливающих условиях (4B, 8% SDS-PAGE).
Фиг. 5. Иммуноферментный анализ взаимодействия BCD-135 с PD-L1 и другими антигенами.
Фиг. 6. Реактивация NFAT-сигналинга анти-PD-L1 антителами в репортерной клеточной линии Jurkat-NFAT-PD-1.
Фиг. 7. Анализ взаимодействий BCD-135 с FcRn и Fcγ-рецепторами на приборе Octet RED 96.
Фиг. 8. Иммуноферментный анализ взаимодействий BCD-135 с PD-L1 разных видов организмов.
Фиг. 9. Анализ взаимодействий BCD-135 с PD-L1 человека и обезьяны циномолгуса на приборе Octet RED 96.
Фиг. 10. Анализ конформационной стабильности BCD-135.
Фиг. 11. Анализ коллоидной стабильности BCD-135.
Фиг. 12. Анализ термической стабильности BCD-135 в фосфатном (A), ацетатном (Б) и гистидиновом (В) буферах. По оси Х - время, по оси Y - поглощение.
Фиг. 13. Анализ стабильности BCD-135 в сыворотке крови человека. А- калибровочная кривая отражающую зависимость оптической плотности от концентрации добавленного в лунку BCD-135. Б - Результирующая таблица показывающая зависимость концентрации BCD-135 при инкубации в сыворотке человека от времени инкубации.
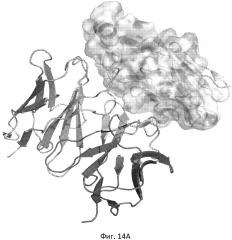
Фиг. 14. 3D пространственная модель комплекса BCD-135 и N-terminus Ig домена PD-L1 антигена. A - общий вид 3D модели Б - Детализированная модель в районе прямых контактов антиген антитело (см. таб в примере 18).
Описание изобретения
Определения и общие методы
Если иное не определено в настоящем документе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понятны специалистам в данной области. Примерные способы и материалы описаны ниже, хотя на практике или при тестировании настоящего изобретения могут также использоваться способы и материалы, подобные или эквивалентные тем, что описаны в настоящем документе. Все публикации и другие ссылочные материалы, упомянутые в настоящем документе, включены во всей их полноте путем отсылки. В случае противоречий настоящее описание, включая определения, будет превалировать. Хотя в настоящем документе цитируется ряд документов, такое цитирование не является признанием того, что любой из этих документов образует часть общеизвестных знаний в данной области.
Кроме того, если по контексту не требуется иное, термины в единственном числе включают в себя термины во множественном числе, и термины во множественном числе включают в себя термины в единственном числе. Как правило, используемая классификация и методы клеточной и тканевой культуры, молекулярной биологии, иммунологии, микробиологии, генетики, аналитической химии, химии органического синтеза, медицинской и фармацевтической химии, а также гибридизации и химии белка и нуклеиновых кислот, описанные в настоящем документе, хорошо известны специалистам и широко применяются в данной области. Ферментные реакции и способы очистки осуществляют в соответствии с инструкциями производителя, как это обычно осуществляется в данной области, или как описано в настоящем документе.
В этом описании и вариантах осуществления изобретения слова «иметь» и «содержать» или их вариации, такие как «имеет», «имеющий», «содержит» или «содержащий», следует понимать как включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Определения, связанные с антителом
PD-L1 (лиганд 1 рецептора программируемой гибели клеток), также известный как кластер дифференцировки 274 (CD274) или гомолог 1 B7 (B7-H1), является трансмембранным белком 1 типа, массой 40кДа. Состоит из 3 доменов: внеклеточного, представленного Ig V и C-подобными доменами (220), трансмембранного (21) и внутриклеточного (31). Он играет важную роль в супрессии иммунной системы в период беременности, при пересадке чужеродной ткани, некоторых заболеваниях, например, при гепатите. В нормальных условиях, в ответ на собственные антигены, в лимфатических узлах и селезенке аккумулируется некоторое количество антиген-специфичных CD8+ Т-эффекторных клеток, с целью предотвращения аутоиммунного процесса, формируются PD-1/PD-L1 или B7-1/PD-L1 комплексы, это приводит к передаче ингибиторного сигнала, снижающего пролиферацию данных CD8+ T - клеток в лимфоузлах. Таким образом PD-1/PD-L-взаимодействие является одним из ключевых в развитии иммунной толерантности.
"Дисфункция" в контексте иммунной дисфункции означает состояние снижения иммунной реакции на антигенную стимуляцию. Термин включает общие элементы истощения и/или анергии, при которых может происходить распознавание антигена, однако вызываемая иммунная реакция неэффективна для контроля над инфекцией или ростом опухоли.
"Усиление функции Т-клеток" означает индукцию, вызывание или стимулирование устойчивой или усиленной биологической функции Т-клетки или восстановление или реактивацию истощенных или неактивных Т-клеток. Примерами усиления функции Т-клеток являются: повышенная секреция γ-интерферона из CD8+ Т- клеток, повышенная пролиферация, повышенная реакция на антиген (например, элиминация вируса или патогена) относительно показателей до вмешательства. В одном варианте воплощения уровень усиления составляет как минимум 50%, в альтернативном варианте - 60%, 70%, 80%, 90%, 100%, 120%, 150%, 200%. Способ измерения этого усиления известен специалистам в данной области.
"Связанное с дисфункцией Т-клеток нарушение" представляет собой нарушение или состояние Т-клеток, характеризующееся сниженной реакцией на антигенную стимуляцию. В конкретном варианте воплощения связанным с Т-клетками дисфункциональным нарушением является нарушение, конкретно связанное с неприемлемо повышенным сигналом через PD-1. В другом варианте воплощения связанным с дисфункцией Т-клеток нарушением является нарушение, при котором Т- клетки являются энергическими или обладают сниженной способностью к секретированию цитокинов, пролиферации или цитолитической активности. В конкретном аспекте снижение реакции приводит к неэффективности контроля над патогеном или опухолью, экспрессирующей иммуноген. Примерами связанных с дисфункцией Т-клеток нарушений, характеризующихся дисфункцией Т-клеток, могут быть неразрешенная острая инфекция, хроническая инфекция и иммунитет опухоли.
"Иммунитет опухоли" означает процесс, при котором опухоли уклоняются от иммунного распознавания и элиминации. Таким образом, как терапевтическое понятие, иммунитет опухоли поддается "лечению", когда такое уклонение ослабляется, и опухоли распознаются и атакуются иммунной системой. Примерами распознавания опухолей являются связывание опухоли, уменьшение размеров опухоли и элиминация опухоли.
Термин "вакцина" в контексте данного описания включает любой непатогенный иммуноген, который, будучи инокулированным в организм-хозяин, вызывает защитный иммунитет против конкретного патогена. Вакцины могут приобретать различные формы. Вакцины могут быть целыми организмами, имеющими общие антигены с патогеном, но сами не являются патогенными (например, коровья оспа). Вакцины также могут быть приготовлены из убитых (например, вакцина против полиомиелита Salk) или ослабленных (с потерей способности к вызыванию болезни - например, вакцина против полиомиелита Sabin). Вакцины также могут приготавливаться из очищенных макромолекул, выделенных из патогенного организма. Например, токсоидные вакцины (например, столбняка и дифтерии), содержащие неактивную форму растворимого бактериального токсина и обеспечивающие в результате выработку антител против токсина, но не иммунитет к интактной бактерии. Субъединичные вакцины (например, гепатит В) содержат только один иммуногенный белок, выделенный из нужного патогена. Гаптеновые конъюгатные вакцины присоединяют некоторые углеводные или полипептидные эпитопы, выделенные из нужного патогена, к иммуногенным носителям, таким, как столбнячный токсоид. Эти методики предусматривают главным образом применение эпитопов, таких, как гаптены, для индукции выработки антитела, которые затем распознают один эпитоп в природном патогене. Однако для максимальной эффективности такие вакцины должны включать В- и Т-клеточные эпитопы, и должны выбираться Т-клеточные для гарантии возможности их распознавания, презентации и реакции на них со стороны иммунных систем организмов-хозяев. В ДНК-вакцинах используется способность клеток-хозяев к захвату и экспрессии ДНК, кодирующей патогенные белки, которую вводят внутримышечно. Реакция хозяина на иммуногены может усиливаться при введении в форме смеси с адъювантами. Иммунные адъюванты функционируют одним или несколькими из следующих способов: (1) продления удерживания иммуногена, (2) увеличения эффективного размер