Содержащие антитела составы
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к составу, содержащему антитело к IL13, поверхностно-активное вещество и буфер на основе ацетата гистидина, для лечения аллергического, аутоиммунного или воспалительного заболевания или нарушения. Также раскрыт набор для лечения пациента, содержащий указанный состав. Изобретение позволяет эффективно лечить аллергическое, аутоиммунное или воспалительное заболевание или нарушение. 7 н. и 53 з.п. ф-лы, 20 ил., 3 табл., 1 пр.
Реферат
Ссылка на родственные заявки
Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №61/553916, поданной 31 октября 2011 г., полное содержание которой включено в настоящий документ посредством ссылки.
Область техники
Описаны составы, содержащие антитело к IL-13, включая в себя фармацевтические составы и способы применения таких составов.
Список последовательностей
Настоящая заявка содержит список последовательностей, который был подан в формате ASCII через EFS-Web и полностью включен в настоящий документ посредством ссылки. Указанная копия ASCII, созданная 4 октября 2012 г., имеет название P4786R1W.txt, и размер ее составляет 22776 байт.
Уровень техники
Интерлейкин (IL)-13 представляет собой плейотропный цитокин Т-хелперных клеток 2 подкласса (Th2). Предположили, что IL13 может играть намного более значительную роль, чем другие цитокины Th2 в эффекторных функциях, связанных с симптомами бронхиальной астмы (Corry, Curr. Opin. Immunol., 11: 610 (1999)). Были описаны гуманизированные антитела к IL-13. Смотрите, например, международную патентную публикацию №2005/062967, Одно конкретное антитело к IL13, лебрикизумаб, клинически исследовали для лечения пациентов с плохо поддающейся контролю бронхиальной астмой. Определенные результаты этих исследований были описаны в Corren et al., N Engi J Med 365(12): 1088-98 (2011).
Поскольку белки, включающие в себя антитела, больше по размеру и намного сложнее традиционных органических и неорганических лекарственных средств (например, они обладают множественными функциональными группами в дополнение к сложным трехмерным структурам), то получение составов таких белков связано с определенными проблемами. Чтобы белок оставался биологически активным, состав должен сохранить интактной конформационную целостность по меньшей мере сердцевинной последовательности аминокислот белка, в то же время защищая множественные функциональные группы белка от деградации. Пути деградации белков могут включать в себя химическую нестабильность (например, любой процесс, который предусматривает модификацию белка путем образования или расщепления связей, приводящих к новому химическому соединению) или физическую нестабильность (например, изменения в структуре белка более высокого порядка). Химическая нестабильность может представлять собой результат деамидирования, рацемизации, гидролиза, окисления, бета-отщепления или дисульфидного обмена. Физическая нестабильность может являться результатом, например, денатурации, агрегации, осаждения или адсорбции. Три наиболее распространенных пути деградации белка представляют собой агрегацию, деамидирование и окисление белка. Cleland et al Critical Reviews in Therapeutic Drug Carrier Systems 10(4): 307-377 (1993).
Высококонцентрированные (например, >100 мг/мл) жидкие составы антител необходимы, например, для таких путей терапевтического введения или терапевтических применений, при которых целесообразны небольшие объемы лекарственного продукта, например, для подкожной инъекции. Тем не менее, высококонцентрированные составы антител связаны с многочисленными сложностями и проблемами. Такой проблемой является нестабильность вследствие образования твердых частиц. В случае восстановленных жидких составов указанная проблема была решена посредством применения поверхностно-активных веществ (например, полисорбата), но поверхностно-активные вещества в некоторых случаях считаются неподходящими для жидких составов, поскольку они осложняют последующую обработку. Более того, поверхностно-активные вещества дополнительно не снижают повышенную вязкость, являющуюся результатом многочисленных межмолекулярных взаимодействий, обусловленных макромолекулярной природой антител.
Хотя было показано, что поверхностно-активные вещества существенно снижают степень образования твердых частиц белков, они не решают проблему повышенной вязкости, которая затрудняет обращение с концентрированными составами антител и их введение. Антитела склонны к образованию вязких растворов при высокой концентрации вследствие своей макромолекулярной природы и способности к межмолекулярным взаимодействиям. Более того, в качестве стабилизаторов зачастую используются фармацевтически приемлемые сахара. Такие сахара могут усиливать межмолекулярные взаимодействия, тем самым увеличивая вязкость состава. Составы с высокой вязкостью трудно произвести, набрать в шприц и ввести подкожно. Приложение усилия в обращении с вязкими составами приводит к избыточному вспениванию, которое может привести к денатурации и инактивации активных биологических средств.
Были описаны определенные составы для высококонцентрированных антител. Смотрите, например, международные патентные публикации №№2006/065746 и 2002/30463. Указанные публикации конкретно не описывают высококонцентрированные антитела к IL13.
Крайне предпочтительно было бы получить составы, содержащие антитело к IL-13, характеризующиеся увеличенной стабильностью и низкой вязкостью при высоких концентрациях антитела. Составы высококонцентрированных антител, характеризующиеся такими свойствами, были бы чрезвычайно предпочтительными для определенных путей введения, например, для подкожного введения. Предусмотренные в настоящем документе составы направлены на решение указанных потребностей и предоставляют другие применимые преимущества.
Все цитируемые в настоящем документе ссылки, включающие в себя патентные заявки и публикации, полностью включены с любой целью посредством ссылки в настоящий документ.
Сущность изобретения
Композиции согласно настоящему изобретению основаны, по меньшей мере частично, на открытии того, что описанное в настоящем документе антитело к IL13 антитело, лебрикизумаб, может быть введено в состав в высокой концентрации (>100 мг/мл) в гистидиновом буфере, содержащем полиол и поверхностно-активное вещество, и что такой состав высококонцентрированных антител характеризуется низкой вязкостью, увеличенной физической и химической стабильностью и сохраняет активность. Композиции или составы согласно настоящему изобретению применимы, например, для лечения бронхиальной астмы и других легочных нарушений, таких как идиопатический фиброз легких и определенные аллергические, аутоиммунные и другие воспалительные нарушения. Кроме того, такой состав может быть упакован в описанные в настоящем документе устройства для подкожного введения с поддержанием, например, стабильности продукта и других требуемых признаков.
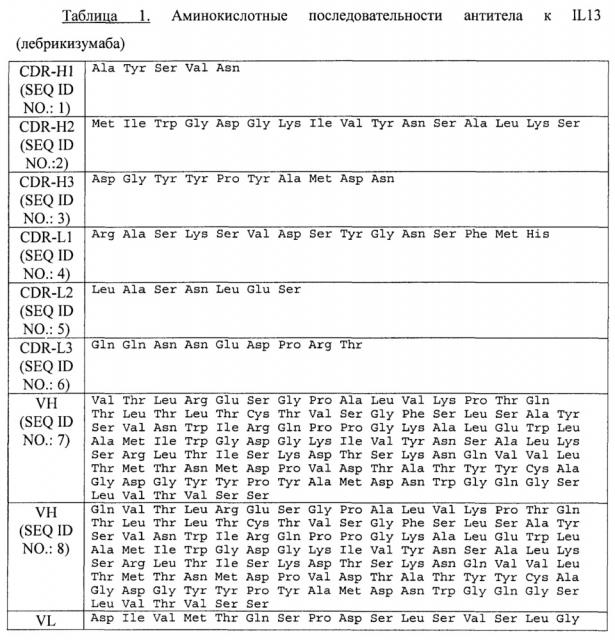
Соответственно, согласно одному аспекту предусматривается состав, содержащий антитело к IL13. Согласно определенным вариантам осуществления концентрация антитела в составе составляет по меньшей мере 100 мг/мл, и вязкость состава составляет меньше 15 сантипуаз (сП) при 25°С. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10. Согласно одному варианту осуществления антитело к IL13 содержит легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14. Согласно одному варианту осуществления концентрация антитела составляет 125 мг/мл. Согласно одному варианту осуществления концентрация антитела составляет 150 мг/мл.
Согласно другому аспекту состав содержит буфер на основе ацетата гистидина, рН 5,4-6,0, и концентрация ацетата гистидина в буфере составляет 5 мМ - 40 мМ. Согласно определенным вариантам осуществления состав содержит полиол и поверхностно-активное вещество, и концентрация полиола в составе составляет 100 мМ - 200 мМ, а концентрация поверхностно-активного вещества в составе составляет 0,01% и 0,1%. Согласно определенным вариантам осуществления полиол представляет собой сахарозу, и поверхностно-активное вещество представляет собой полисорбат 20. Согласно определенным вариантам осуществления буфер на основе ацетата гистидина характеризуется рН 5,7, и концентрация ацетата гистидина в буфере составляет 20 мМ, и концентрация сахарозы в составе составляет 175 мМ, и концентрация полисорбата 20 составляет 0,03%. Согласно одному варианту осуществления концентрация антитела составляет 125 мг/мл или 150 мг/мл. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6.
Согласно другому аспекту состав содержит антитело к IL13 в буфере на основе ацетата гистидина, рН 5,4-6,0, и концентрация ацетата гистидина в буфере составляет 5 мМ - 40 мМ, и концентрация антитела в составе составляет по меньшей мере 100 мг/мл. Согласно определенным вариантам осуществления состав дополнительно содержит полиол и поверхностно-активное вещество, и концентрация полиола в составе составляет 100 мМ - 200 мМ, и концентрация поверхностно-активного вещества в составе составляет 0,01% - 0,1%. Согласно одному варианту осуществления полиол представляет собой сахарозу, и поверхностно-активное вещество представляет собой полисорбат 20. Согласно одному варианту осуществления буфер на основе ацетата гистидина характеризуется рН 5,7, и концентрация ацетата гистидина в буфере составляет 20 мМ, и при этом концентрация сахарозы в составе составляет 175 мМ, и концентрация полисорбата 20 составляет 0,03%. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10. Согласно одному варианту осуществления антитело к IL13 содержит легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14. Согласно одному варианту осуществления состав характеризуется вязкостью, составляющей меньше 15 сантипуаз (сП) при 25°С. Согласно одному варианту осуществления концентрация антитела составляет 125 мг/мл. Согласно одному варианту осуществления концентрация антитела составляет 150 мг/мл.
Согласно другому аспекту предусматривается состав, содержащий антитело к IL-13, характеризующееся увеличенной стабильностью. Согласно определенным вариантам осуществления концентрация антитела составляет по меньшей мере 100 мг/мл, и вязкость составляет меньше 15 сантипуаз (сП) при 25°С. Согласно одному варианту осуществления антитело к IL-13 является стабильным по меньшей мере в течение одного года при 5°С. Согласно одному варианту осуществления антитело к IL13 является стабильным по меньшей мере в течение двух лет при 5°С. Согласно одному варианту осуществления антитело к IL13 является стабильным в течение трех лет при 5°С. Согласно одному варианту осуществления антитело к IL13 является стабильным в течение по меньшей мере четырех недель при 25°С, или по меньшей мере 8 недель при 25°С, или по меньшей мере 12 недель при 25°С, или в течение 26 недель при 4°С. Согласно одному варианту осуществления состав содержит буфер на основе ацетата гистидина, рН 5,4-6,0, и концентрация ацетата гистидина в буфере составляет 5 мМ - 40 мМ. Согласно одному варианту осуществления состав дополнительно содержит полиол и поверхностно-активное вещество, и концентрация полиола в составе составляет 100 мМ - 200 мМ и концентрация поверхностно-активного вещества в составе составляет 0,01% - 0,1%. Согласно одному варианту осуществления полиол представляет собой сахарозу, и поверхностно-активное вещество представляет собой полисорбат 20. Согласно одному варианту осуществления буфер на основе ацетата гистидина характеризуется рН 5,7, и концентрация ацетата гистидина в буфере составляет 20 мМ, и концентрация сахарозы в составе составляет 175 мМ, и концентрация полисорбата 20 составляет 0,03%. Согласно одному варианту осуществления концентрация антитела составляет 125 мг/мл или 150 мг/мл. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6.
Согласно другому аспекту предусматривается состав, содержащий антитело к IL13, характеризующееся увеличенной стабильностью в буфере на основе 20 мМ ацетата гистидина, рН 5,7, 175 мМ сахарозы, 0,03% полисорбата 20. Согласно одному варианту осуществления концентрация антитела в составе составляет 125 мг/мл, и вязкость состава составляет меньше 15 сантипуаз (сП) при 25°С. Согласно одному варианту осуществления концентрация антитела в составе составляет 150 мг/мл, и вязкость состава составляет меньше 15 сантипуаз (сП) при 25°С. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14.
Согласно дополнительному аспекту предусматривается изделие, содержащее устройство для подкожного введения. Согласно определенным вариантам осуществления устройство для подкожного введения доставляет пациенту постоянную дозу антитела к IL13. Согласно одному варианту осуществления постоянная доза составляет 37,5 мг антитела к IL13. Согласно одному варианту осуществления постоянная доза составляет 75 мг антитела к IL13. Согласно одному варианту осуществления постоянная доза составляет 125 мг антитела к IL13. Согласно одному варианту осуществления постоянная доза составляет 150 мг антитела к IL13. Согласно определенным вариантам осуществления антитело к IL13 представляет собой лебрикизумаб. Антитело к IL13 в устройстве для подкожного введения вводят в состав в буфере и других описанных выше вспомогательных веществах так, чтобы оно было предоставлено в стабильном фармацевтическом составе. Согласно определенным вариантам осуществления устройство для подкожного введения представляет собой предварительно наполненный шприц, содержащий стеклянный цилиндр, шток поршня, содержащий ограничитель хода поршня, и иглу. Согласно определенным вариантам осуществления устройство для подкожного введения дополнительно содержит защитный колпачок для иглы и необязательно защитное устройство для иглы. Согласно определенным вариантам осуществления объема состава, содержащегося в предварительно наполненном шприце, составляет 0,3 мл, 1 мл, 1,5 мл или 2,0 мл. Согласно определенным вариантам осуществления игла представляет собой несъемную иглу с типом заточки острия 3В или 5В. Согласно определенным вариантам осуществления игла характеризуется калибром (G) от 25G до 30G и составляет от 1/2 дюйма в длину до 5/8 дюйма в длину. Согласно одному варианту осуществления устройство для подкожного введения содержит предварительно наполненный шприц объемом 1,0 мл из боросиликатного стекла с низким содержанием вольфрама (тип I) и тонкостенную несъемную иглу из нержавеющей стали, калибра 27G, длиной 1/2 дюйма, с типом заточки острия 5В. Согласно определенным вариантам осуществления устройство для подкожного введения содержит твердый защитный колпачок для иглы. Согласно определенным вариантам осуществления твердый защитный колпачок для иглы содержит состав на основе резины с низким содержанием цинка. Согласно одному варианту осуществления защитный колпачок для иглы является твердым и содержит эластомерный компонент, FM27/0, и твердый полипропиленовый защитный колпачок. Согласно определенным вариантам осуществления шток поршня содержит резиновый ограничитель хода поршня. Согласно определенным вариантам осуществления резиновый ограничитель хода поршня содержит в своем составе резину 4023/50 и этилентетрафторэтиленовое (ETFE) покрытие FluroTec®. Согласно определенным вариантам осуществления устройство для подкожного введения содержит защитное устройство для иглы. Иллюстративные защитные устройства для иглы включают в себя без ограничения Ultrasafe Passive® Needle Guard X100L (Safety Syringes, Inc.) и Rexam Safe n SoundTM (Rexam).
Согласно другому аспекту предусматривается способ лечения бронхиальной астмы у пациента. Согласно определенным вариантам осуществления способ предусматривает введение пациенту эффективного количества любого из описанных выше составов. Согласно определенным вариантам осуществления эффективное количество составляет 0,3 мл, 0,5 мл, 1 мл или 2 мл или приблизительно 0,3 мл, приблизительно 0,5 мл, приблизительно 1 мл или приблизительно 2 мл. Согласно другому аспекту предусматривается способ лечения идиопатического фиброза легких у пациента. Согласно определенным вариантам осуществления способ предусматривает введение пациенту эффективного количества любого из описанных выше составов. Согласно определенным вариантам осуществления эффективное количество составляет 0,5 мл, 1 мл или 2 мл, или приблизительно 0,5 мл, приблизительно 1 мл или приблизительно 2 мл.
Согласно другому аспекту предусматриваются способы подкожного введения состава, содержащего антитело к IL13. Такие способы предусматривают подкожное введение любого из описанных выше составов антитела к IL13. Согласно определенным вариантам осуществления способы предусматривают устройство для подкожного введения согласно любому из описанных выше устройств.
Краткое описание чертежей
На фигуре 1 показана скорость деградации мономера антитела к IL13 в неделю в зависимости от рН, как описано в примере 1.
На фигуре 2 показаны показатели увеличения мутности раствора при 350 нм растворов антитела к IL13 в зависимости от рН в ходе хранения при 30°С, как описано в примере 1.
На фигуре 3 показаны изменения низкомолекулярных (LMW) растворимых фрагментов и высокомолекулярных (HMW) агрегатов, измеренные с помощью CE-SDS (капиллярного электрофореза в присутствии додецилсульфата натрия) в невосстанавливающих условиях в ходе хранения при 30°С в зависимости от рН, как описано в примере 1.
На фигуре 4 показаны скорости образования кислотных вариантов (AV) и основного варианта (пик 1) (BV) при 30°С в зависимости от рН, как описано в примере 1. Скорость образования отличающихся зарядом вариантов выражают как отношение %/неделя, показанное на вертикальной оси.
На фигуре 5 показаны скорости образования основного варианта (пик 2) (BV2) и потери главного пика (МР) при 30°С в зависимости от рН, как описано в примере 1. Скорость образования отличающихся зарядом вариантов выражают как отношение %/неделя, показанное на вертикальной оси.
На фигуре 6 показаны реологические характеристики антитела к IL13 в зависимости от концентрации антитела и рН раствора, как описано в примере 1. Вязкость раствора выражают в единицах сантипуаз (сП) при 25°С, показанных на вертикальной оси.
На фигуре 7 показаны реологические характеристики различных моноклональных антител в широком диапазоне концентраций, как описано в примере 1. Вязкость раствора выражают в единицах сантипуаз (сП) при 25°С, показанных на вертикальной оси.
На фигуре 8 показано количественное определение характеристик внешнего вида растворов антитела к IL13 и антитела к CD20 в зависимости от концентрации с использованием нефелометрии под углом 90°, как описано в примере 1.
На фигуре 9 показаны измерения мутности (А350) для растворов антител к IL13 и к CD20 в зависимости от концентрации моноклональных антител (mAb), как описано в примере 1.
На фигуре 10 показана мутность раствора антитела к IL13 в зависимости от концентрации и рН, как описано в примере 1.
На фигуре 11 показано количество невидимых невооруженным глазом твердых частиц в растворах антитела к IL13 и антитела к CD20 в зависимости от концентрации mAb, как описано в примере 1.
На фигуре 12 показаны измерения нефелометрического, турбидиметрического и статического светорассеяния 125 мг/мл раствора антитела к IL13, как описано в примере 1.
На фигуре 13 обобщенно представлена температурная зависимость опалесценции раствора при различных условиях рН для антитела к IL13 в концентрации 125 мг/мл и 204 мг/мл, как описано в примере 1.
На фигуре 14 обобщенно представлены пики температурного перехода плавления, наблюдаемые для двух частично разделенных пиков в капиллярной ДСК (дифференциальной сканирующей калориметрии) в зависимости от композиции состава антитела к IL13 и рН раствора, как описано в примере 1.
На фигуре 15 обобщенно представлены измеренные осмотические вторые вириальные коэффициенты (Вз) для антитела к IL13 в зависимости от рН раствора с образцами в простых буферах, как указано и измерено в диапазоне 0,1-1,0 мг/мл, как описано в примере 1.
На фигуре 16 показаны измеренные осмотические вторые вириальные коэффициенты для антитела к IL13 в зависимости от композиции состава и рН в диапазоне 1,0-10 мг/мл, как описано в примере 1.
На фигуре 17 показана зависимость измеренной интенсивности статического светорассеяния от концентрации для каждого из антитела к IL13 и антитела к CD20 по сравнению с моделью твердой сферы (HS), как описано в примере 1.
На фигуре 18 показаны данные статического светорассеяния для антитела к IL13 в зависимости от рН состава, представленные в виде средних молекулярных масс, наблюдаемых при концентрациях до 200 мг/мл, как описано в примере 1.
На фигуре 19 показаны средние молекулярные массы антител к IL13 и к CD20 в растворе при высоких концентрациях до 200 мг/мл, как описано в примере 1.
На фигуре 20 показана сдвиговая вязкость, измеренная для антитела к IL13 и антитела к CD20 при соответствующих условиях получения состава при 25°С, как описано в примере 1.
Подробное описание изобретения
Если не указано иное, использованные в настоящем документе технические или научные термины имеют такие же значения, которые являются в большинстве случаев понятными для специалиста в настоящей области техники, к которой принадлежит настоящее изобретение. Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (New York, N.Y. 1994), and March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 4th ed., John Wiley & Sons (New York, N.Y. 1992) представляет специалисту в настоящей области техники общее руководство в отношении многих используемых в настоящей заявке терминов.
Некоторые определения
В целях интерпретации настоящего описания будут применяться следующие определения, и используемые в форме единственного числа термины по возможности также будут включать в себя форму множественного числа и наоборот. В том случае, если какое-либо из представленных ниже определений противоречит какому-либо включенному в настоящий документ посредством ссылки документу, представленное ниже определение должно иметь преимущественное значение.
Используемые в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают в себя ссылки на формы множественного числа, если иное не продиктовано контекстом. Таким образом, например, ссылка на "белок" или "антитело" включает в себя многочисленные белки или антитела, соответственно; ссылка на "клетку" включает в себя смеси клеток и подобное.
Термин "фармацевтические состав" относится к препарату, находящемуся в такой форме, которая обеспечивает эффективное проявление биологической активности активного ингредиента, и которая не содержит дополнительных компонентов, являющихся неприемлемо токсическими для субъекта, которому будет введен состав. Такие составы являются стерильными. "Фармацевтически приемлемые" вспомогательные вещества (инертные носители, добавки) представляют собой те, которые могут быть целесообразно введены млекопитающему-субъекту для обеспечения эффективной дозы используемого активного ингредиента.
"Стерильный" состав является асептическим или свободным или по существу свободным от каких-либо живых микроорганизмов и их спор.
"Замороженный" состав представляет собой состав при температуре ниже 0°С. Как правило, замороженный состав не является ни высушенным заморозкой, ни составом, подвергшимся предварительной или последующей лиофилизации. Согласно определенным вариантам осуществления замороженный состав содержит замороженное лекарственное вещество для хранения (в контейнере из нержавеющей стали) или замороженный лекарственный продукт (в конечной форме флакона).
"Стабильный" состав представляет собой состав, в котором белок по существу сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность при хранении. Согласно определенным вариантам осуществления состав по существу сохраняет свою физическую и химическую стабильность, а также свою биологическую активность при хранении. Период хранения, как правило, выбирают на основании предусмотренного срока годности состава.
Используемый в настоящем документе термин состав с "увеличенной стабильностью" означает состав, в котором белок по существу сохраняет свою физическую стабильность, химическую стабильность и биологическую активность при хранении при 5°С в течение одного года или больше. Согласно определенным вариантам осуществления хранение происходит при 5°С в течение двух лет или больше. Согласно определенным вариантам осуществления хранение происходит при 5°С в течение до трех лет.
Белок "сохраняет свою физическая стабильность" в фармацевтическом составе, если он не демонстрирует никаких признаков агрегации, осаждения и/или денатурации или очень незначительную агрегацию, осаждение и/или денатурацию при визуальном исследовании цвета и/или прозрачности, или что измеряют с помощью УФ светорассеяния или эксклюзионной хроматографии.
Белок "сохраняет свою химическую стабильность" в фармацевтическом составе, если химическая стабильность в указанный момент времени является такой, чтобы белок рассматривался как все еще сохраняющий свою биологическую активность, определенную ниже. Химическую стабильность можно оценить путем обнаружения и количественного определения химически измененных форм белка. Химическое изменение может включать в себя модификацию размера (например, усечение), которую можно оценить с использованием, например, эксклюзионной хроматографии, SDS-PAGE (электрофореза в полиакриламидном геле с использованием додецилсульфата натрия) и/или ионизации лазерной десорбцией с использованием матрицы/времяпролетной масс-спектрометрии (MALDI/TOF MS). Другие типы химического изменения включают в себя изменение заряда (например, возникающее в результате деамидирования), которое можно оценить, например, с помощью ионообменной хроматографии или капиллярного изоэлектрического фокусирования (icIEF).
Антитело "сохраняет свою биологическую активность" в фармацевтическом составе, если биологическая активность антитела в указанный момент времени находится в пределах приблизительно 10% (в пределах ошибок при анализе) от биологической активности, проявляемой в момент времени, когда был получен фармацевтический состав, что определяют, например, в анализе связывания антигена или анализе эффективности.
В настоящем документе термин "биологическая активность" моноклонального антитела относится к способности антитела связываться с антигеном. Термин может дополнительно включать в себя связывание антитела с антигеном и являющийся результатом этого измеряемый биологический ответ, который может быть измерен in vitro или in vivo. Такая активность может являться антагонистической или агонистической.
"Деамидированное" моноклональное антитело представляет собой моноклональное антитело, в котором один или несколько аспарагиновых остатков были дериватизированы, например, до аспарагиновой кислоты или изоаспарагиновой кислоты.
Антитело, которое является "подверженным деамидированию", представляет собой антитело, содержащее один или несколько остатков, которые, как было обнаружено, предрасположены к деамидированию.
Антитело, которое является "подверженным агрегации", представляет собой антитело, которое, как было показано, агрегирует с другой(ими) молекулой(ами) антитела, особенно при замораживании и/или перемешивании.
Антитело, которое является "подверженным фрагментации", представляет собой антитело, которое, как было показано, расщепляется на два или больше фрагментов, например, в его шарнирной области.
Под "снижением деамидирования, агрегации или фрагментации" подразумевается предотвращение или снижение уровня деамидирования, агрегации или фрагментации относительно моноклонального антитела, введенного в состав при другом значении рН или в другом буфере.
Антитело, которое вводят в состав, является по существу чистым и желательно по существу гомогенным (например, не содержащим белки-примеси и т.д.). "По существу чистое" антитело означает композицию, содержащую по меньшей мере приблизительно 90% по весу антитела, из расчета общего веса композиции, или по меньшей мере приблизительно 95% по весу. "По существу гомогенное" антитело означает композицию, содержащие по меньшей мере приблизительно 99% по весу антитела, из расчета общего веса композиции.
Под термином "изотонический" подразумевают, что представляющий интерес состав характеризуется по существу таким же осмотическим давлением, как и кровь человека. Изотонические составы, как правило, будут характеризоваться осмотическим давлением приблизительно 250-350 мОсм. Изотоничность можно измерить, например, с использованием парового или криоскопического осмометра.
Используемый в настоящем документе термин "буфер" относится к забуференному раствору, который препятствует изменениям в рН за счет действия своих компонентов кислотно-основных конъюгатов.
"Гистидиновый буфер" представляет собой буфер, содержащий ионы гистидина. Примеры гистидиновых буферов включают в себя хлорид гистидина, ацетат гистидина, фосфат гистидина, сульфат гистидина, сукцинат гистидина и т.д. Согласно одному варианту осуществления гистидиновый буфер представляет собой ацетат гистидина. Согласно одному варианту осуществления буфер на основе ацетата гистидина получают путем титрования L-гистидина (свободным основанием, твердым веществом) с уксусной кислотой (жидкостью). Согласно определенным вариантам осуществления гистидиновый буфер или буфер на основе ацетата гистидина характеризуется рН 4,5-6,5. Согласно определенным вариантам осуществления гистидиновый буфер или буфер на основе ацетата гистидина характеризуется рН 5,4-6,0. Согласно одному варианту осуществления буфер характеризуется рН 5,6. Согласно одному варианту осуществления буфер характеризуется рН 5,7. Согласно одному варианту осуществления буфер характеризуется рН 5,8.
В настоящем документе "поверхностно-активное вещество" относится к поверхностно-активному средству, как правило, неионному поверхностно-активному веществу. Примеры поверхностно-активных веществ в настоящем документе включают в себя полисорбат (например, полисорбат 20 и полисорбат 80); полоксамер (например, полоксамер 188); тритон; додецилсульфат натрия (SDS); лаурилсульфат натрия; октилгликозид натрия; лаурил-, миристил-, линолеил- или стеарил-сульфобетаин; лаурил-, миристил-, линолеил- или стеарил-саркозин; линолеил-, миристил- или цетил-бетаин; лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальмидопропил- или изостеарамидопропил-бетаин (например, лауроамидопропил); миристамидопропил-, пальмидопропил- или изостеарамидопропил-диметиламин; натрийметилкокоил- или динатрийметилолеил-таурат; и серия MONAQUAT™ (Mona Industries, Inc., Paterson, N.J.); полиэтилгликоль, полипропилгликоль и сополимеры этиленгликоля и пропиленгликоля (например, плюроники, PF68 и т.д.); и т.д. Согласно одному варианту осуществления поверхностно-активное вещество представляет собой полисорбат 20.
"Консервант" представляет собой соединение, которое может быть необязательно включено в состав для существенного снижения деятельности в нем бактерий, таким образом, облегчая получение, например, состава для многократного использования. Примеры возможных консервантов включают в себя октадецилдиметилбензиламмонийхлорид, гексаметонийхлорид, бензалконийхлорид (смесь алкилбензилдиметиламмонийхлоридов, в которых алкильные группы представляют собой соединения с длинной цепью) и бензетонийхлорид. Другие типы консервантов включают в себя такие ароматические спирты, как фенольный, бутиловый и бензиловый спирт, такие алкилпарабены, как метил- или пропилпарабен, катехол, резорцинол, циклогексанол, 3-пентанол и m-крезол. Согласно одному варианту осуществления консервант в настоящем документе представляет собой бензиловый спирт.
"Полиол" представляет собой вещество с многочисленными гидроксильными группами и включает в себя сахара (восстанавливающие и невосстанавливающие сахара), сахарные спирты и сахарные кислоты. Полиол может быть необязательно включен в состав. Согласно определенным вариантам осуществления полиолы в настоящем документе характеризуются молекулярной массой, составляющей меньше чем приблизительно 600 кДа (например, в диапазоне от приблизительно 120 до приблизительно 400 кДа). "Восстанавливающий сахар" представляет собой сахар, который содержит гемиацетальную группу, которая может восстанавливать ионы металла или ковалентно реагировать с лизином и другими аминогруппами в белках, а "невосстанавливающий сахар" представляет собой сахар, у которого нет описанных свойств восстанавливающего сахара. Примеры восстанавливающих Сахаров представляют собой фруктозу, маннозу, мальтозу, лактозу, арабинозу, ксилозу, рибозу, рамнозу, галактозу и глюкозу. Невосстанавливающие сахара включают в себя сахарозу, трегалозу, сорбозу, мелезитозу и раффинозу. Маннит, ксилит, эритрит, треит,