Селективность в отношении мутантных форм и комбинации соединения, представляющего собой ингибитор фосфоинозитид-3-киназы, и химиотерапевтических агентов для лечения рака
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована для лечения рака. Способы, фармацевтические композиции, применения, изделие, продукт и терапевтическая комбинация по изобретению касаются лечения рака введением ингибитора фосфоинозитид-3-киназы (PI3K), GDC-0032 и химиотерапевтического агента, выбранного из фулвестранта и летрозола. Использование изобретений позволяет усилить противоопухолевую активность за счет синергетического эффекта комбинации. 13 н. и 26 з.п. ф-лы, 5 табл., 44 ил., 4 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В целом данное изобретение относится к лечению гиперпролиферативных расстройств, таких как рак, соединениями, которые ингибируют активность PI3-киназы. Изобретение также относится к способам применения соединений для диагностики или обработки in vitro, in situ и in vivo клеток млекопитающих или лечения ассоциированных патологических состояний.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Применение комбинаций противораковых фармацевтических терапевтических средств, вводимых в режиме одновременного или последовательного дозирования, в настоящее время является общепризнанным подходом в лечении рака. Успешная комбинированная терапия обеспечивает получение улучшенного и даже синергетического эффекта по сравнению с монотерапией, т.е. фармацевтическим лечением, ограниченным одним лекарственным средством (Ouchi et al. (2006) Cancer Chemother. Pharmacol. 57:693-702; Higgins et al. (2004) Anti-Cancer Drugs 15: 503-512). Доклиническое изучение составляет основу для предсказания синергизма комбинаций противораковых фармацевтических терапевтических средств, таких как капецитабин и таксаны, на клинической стадии в отношении лечения рака молочной железы (Sawada et al. (1998) Clin. Cancer Res., 4: 1013-1019). Некоторые дозы и режимы проведения комбинированной терапии могут повысить безопасность без ухудшения эффективности (O'Shaughnessy et al. (2006) Clin. Breast Cancer, Apr 7(1): 42-50). Синергетические эффекты in vitro коррелировали с синергизмом на клинической стадии (Steinbach et al. (2003) Clin. Inf. Dis. Oct 1; 37 Suppl. 3: S188-224).
Активация сигнального пути фосфоинозитид-3-киназа/протеинкиназа В (phosphoinositide-3 kinase (PI3K)/Akt) является общим признаком большинства раковых заболеваний (Yuan and Cantley (2008) Oncogene, 27: 5497-510). Генетические отклонения, касающиеся данного пути, были обнаружены во многих случаях рака у человека (Osaka et al. (2004) Apoptosis, 9: 667-76), и их влияние преимущественно связано со стимулированием пролиферации, миграции и выживаемости клеток. Активация данного пути происходит вследствие активирующих точечных мутаций или амплификации гена PI3KCA, кодирующего изоформы р110а PI3K (Hennessy et al. (2005) Nat. Rev. Drug Discov., 4: 988-1004). Генетическая делеция или приводящие к потере функциональности мутации в гене онкосупрессора PTEN (phosphatase and tensin homolog deleted on chromosome 10 - фосфатаза и гомолог тензина с делецией по 10-й хромосоме), фосфатазы с функцией, противоположной PI3K, также усиливает PI3K-опосредованный путь передачи сигнала (Zhang and Yu (2010) Clin. Cancer Res., 16: 4325-30). Эти нарушения приводят к усилению последующих звеньев передачи сигнала с участием таких киназ, как Akt и mTOR mammalian target of rapamycin - мишень рапамицина у млекопитающих), и высказано предположение, что повышение активности PI3K-пути является признаком резистентности к лечению рака (Opel et al. (2007) Cancer Res., 67: 735-45; Razis et al. (2011) Breast Cancer Res. Treat., 128: 447-56).
Фосфатидилинозитол-3-киназа (phosphatidylinositol 3-kinase; PI3K) является основным узлом пути передачи сигнала для ключевых сигналов, связанных с выживаемостью и ростом в случае лимфом, и она обладает активностью, противоположной активности фосфатазы PTEN. PI3K-путь нарушен при агрессивных формах лимфомы (Abubaker (2007) Leukemia, 21: 2368-2370). В восьми процентах случаев диффузной В-клеточной крупноклеточной лимфомы (diffuse large B-cell lymphoma; DLBCL) имеются миссенс-мутации в гене PI3KCA (каталитической альфа-субъединицы фосфатидилинозитол-3-киназы), а 37% случаев по данным иммуногистохимического тестирования являются PTEN-отрицательными.
Фосфатидилинозит является одним из ряда фосфолипидов, обнаруженных в клеточных мембранах и принимающих участие во внутриклеточной передаче сигнала. Передача сигнала клетками, опосредованная 3'-фосфорилированными фосфоинозитидами, вовлечена в целый ряд клеточных процессов, например, малигнизацию, передачу сигнала с участием ростовых факторов, воспаление и иммунитет (Rameh et al. (1999) J. Biol. Chem. 274: 8347-8350). Фермент, ответственный за образование таких фосфорилированных продуктов сигнального пути, фосфатидилинозитол-3-киназу (также обозначаемую как PI3-киназа или PI3K), изначально идентифицировали по активности, ассоциированной с вирусными онкобелками и тирозинкиназами - рецепторами ростовых факторов, которые фосфорилируют фосфатидилинозит (phosphatidylinositol; PI) и его фосфорилированные производные по 3'-гидроксилу кольца инозита (Panayotou et al. (1992) Trends Cell Biol. 2: 358-60). Фосфоинозитид-3-киназы (PI3K) представляют собой липидкиназы, которые фосфорилируют липиды по 3'-гидроксильному остатку кольца инозита (Whitman et al. (1988) Nature, 332: 664). 3'-Фосфорилированные фосфолипиды (3-phosphorylated phospholipids; PIP3), образованные с помощью Р13-киназ, действуют в качестве вторичных мессенджеров, вовлекающих киназы с липид-связывающими доменами (включая плекстрин-гомологичные (РН; plekstrin homology) участки), такие как Akt и фосфоинозитид-зависимая киназа-1 (PDK1; phosphoinositide-dependent kinase-1) (Vivanco et al. (2002) Nature Rev. Cancer 2: 489; Phillips et al. (1998) Cancer 83: 41).
Семейство Р13-киназ содержит по меньшей мере 15 разных ферментов, систематизированных по структурной гомологии и разделенных на 3 класса на основе гомологии последовательностей и продукта, образующегося в результате ферментативного катализа. Р13-киназы I класса состоят из 2 субъединиц: каталитической субъединицы с молекулярной массой (ММ) 110 кДа и регуляторной субъединицы с ММ 85 кДа. Регуляторные субъединицы содержат 8Н2-домены (src-гомологичные домены 2) и связываются с остатками тирозина, фосфорилированными под действием рецепторов ростовых факторов, обладающих тирозинкиназной активностью, или продуктов онкогенов, индуцируя тем самым PI3K-активность каталитической субъединицы р110, которая фосфорилирует свой липидный субстрат. Р13-киназы I класса вовлечены в важные события передачи сигнала вниз по пути цитокинов, интегринов, ростовых факторов и иммунорецепторов, что предполагает, что регулирование этого пути может приводить к получению важных терапевтических эффектов, таких как модулирование клеточной пролиферации и канцерогенеза. PI3K I класса могут фосфорилировать фосфатидилинозит (PI), фосфатидилинозит-4-фосфат и фосфатидилинозит-4,5-бифосфат (PIP2) с получением фосфатидилинозит-3-фосфата (PIP), фосфатидилинозит-3,4-бифосфата и фосфатидилинозит-3,4,5 трифосфата, соответственно. PI3K II класса фосфорилируют PI и фосфатидилинозит-4-фосфат. PI3K III класса могут фосфорилировать только PI. Ключевой изоформой Р13-киназ при раке является PI3-киназа I класса, содержащая р110а, на что указывают неоднократно повторяющиеся онкогенные мутации в р110а (Samuels et al. (2004) Science 304: 554; US 5824492; US 5846824; US 6274327). Другие изоформы могут играть важную роль при раке и также вовлечены в сердечно-сосудистые и иммуновоспалительные заболевания (Workman Р (2004) Biochem. Soc. Trans., 32: 393-396; Patel et al. (2004) Proc. Am. Assoc. of Cancer Res. (Abstract LB-247) 95th Annual Meeting, March 27-31, Orlando, Florida, USA; Ahmadi К and Waterfield MD (2004) "Phosphoinositide 3-Kinase: Function and Mechanisms" Encyclopedia of Biological Chemistry (Lennarz WJ, Lane MD eds) Elsevier/Academic Press). Онкогенные мутации р110-альфа со значительной частотой были обнаружены в солидных опухолях толстой кишки, молочной железы, головного мозга, печени, яичников, желудка, легкого и головы и шеи. Примерно 35-40% случаев раковых опухолей молочной железы, положительных в отношении рецепторов гормонов (hormone receptor positive; HR+), содержат мутацию PIK3CA. Нарушения в PTEN обнаруживаются при глиобластоме, меланоме, раке предстательной железы, эндометрия, яичников, молочной железы, легкого, головы и шеи, гепатоклеточном раке и раке щитовидной железы.
PI3-Киназа представляет собой гетеродимер, состоящий из субъединиц р85 и р110 (Otsu et al. (1991) Cell, 65: 91-104; Hiles et al. (1992) Cell, 70: 419-29). Были идентифицированы четыре разных PI3K I класса, обозначенных как PI3K-α (альфа), -β (бета), -δ (дельта) и -γ (гамма), каждая из которых содержит индивидуальную каталитическую субъединицу (110 кДа) и регуляторную субъединицу. Каждая из трех каталитических субъединиц, т.е. р110-альфа, р110-бета и р110-дельта, взаимодействует с одной и той же регуляторной субъединицей, р85; тогда как р110-гамма взаимодействует с другой регуляторной субъединицей, р101. Картины экспрессии для каждой из этих PI3K в клетках и тканях человека различаются. В случае каждого из подтипов PI3K, альфа, бета и дельта, субъединица р85 действует таким образом, чтобы локализовать PI3-киназу в плазматической мембране посредством взаимодействия ее 5Н2-домена с фосфорилированными остатками тирозина (имеющимися в соответствующем окружении последовательностей) в белках-мишенях (Rameh et al. (1995) Cell, 83: 821-30; Volinia et al. (1992) Oncogene, 7: 789-93).
Измерение уровней экспрессии биомаркеров (например, белков, секретируемых в плазму) может быть эффективным средством выявления пациентов и групп пациентов, которые будут отвечать на конкретные терапии, включая, например, лечение химиотерапевтическими агентами. Существует потребность в более эффективных средствах определения того, какие пациенты с гиперпролиферативными расстройствами, такими как рак, будут отвечать на лечение какими химиотерапевтическими агентами, и потребность во включении результатов таких определений в более эффективные схемы лечения пациентов независимо от того, используются ли данные химиотерапевтические агенты в виде отдельных агентов или в комбинации с другими агентами.
Путь PI3-киназа/Akt/PTEN представляет собой привлекательную мишень для разработки противораковых лекарственных средств, поскольку ожидается, что такие агенты будут ингибировать клеточную пролиферацию, подавлять сигналы от стромальных клеток, обеспечивающих раковым клеткам выживаемость и химиорезистентность, реверсировать подавление апоптоза и преодолевать внутреннюю резистентность раковых клеток к цитотоксическим агентам. Данные об ингибиторах PI3-киназ опубликованы (Yaguchi et al. (2006) Jour, of the Nat. Cancer Inst., 98(8): 545-556; US 7173029; US 7037915; US 6608056; US 6608053; US 6838457; US 6770641; US 6653320; US 6403588; US 7750002; WO 2006/046035; US 7872003; WO 2007/042806; WO 2007/042810; WO 2004/017950; US 2004/092561; WO 2004/007491; WO 2004/006916; WO 2003/037886; US 2003/149074; WO 2003/035618; WO 2003/034997; US 2003/158212; EP 1417976; US 2004/053946; JP 2001247477; JP 08175990; JP 08176070).
Некоторые соединения тиенопиримидинов обладают активностью в отношении связывания с р110-альфа и ингибирования PI3-киназы и подавляют рост раковых клеток (Wallin et al. (2011) Mol. Can. Then, 10(12): 2426-2436; Sutherlin et al. (2011) Jour. Med. Chem., 54: 7579-7587; US 2008/0207611; US 7846929; US 7781433; US 2008/0076758; US 7888352; US 2008/0269210). GDC-0941 (регистрационный № в Химической реферативной службе (Chemical abstracts service; CAS) 957054-30-7, Genentech Inc.) представляет собой селективный, биодоступный при пероральном введении ингибитор PI3K с многообещающими фармакокинетическими и фармацевтическими свойствами (Folkes et al. (2008) Jour, of Med. Chem., 51(18): 5522-5532; US 7781433; Belvin et al., American Association for Cancer Research Annual Meeting, 2008, 99th: April 15, Abstract 4004; Folkes et al., American Association for Cancer Research Annual Meeting, 2008, 99th: April 14, Abstract LB-146; Friedman et al., American Association for Cancer Research Annual Meeting, 2008, 99th: April 14, Abstract LB-110) и демонстрирует синергетическую активность in vitro и in vivo в комбинации с некоторыми химиотерапевтическими агентами в отношении клеточных линий солидных опухолей (US 2009/0098135).
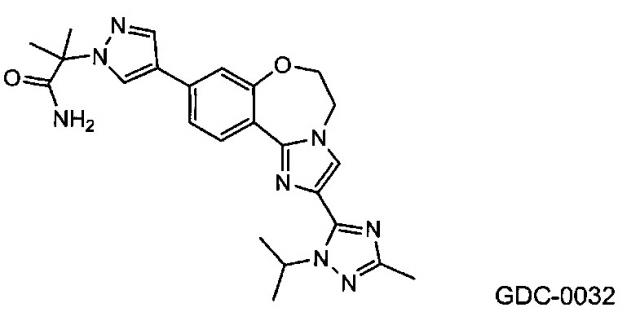
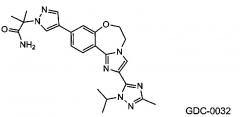
GDC-0032 (Roche RG7604, регистрационный № в CAS 1282512-48-4) с названием 2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо-[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамид обладает сильной активностью в отношении PI3K (WO 2011/036280; US 8242104; US 8343955), и в настоящее время проходят его исследования на пациентах с локально распространенными или метастатическими солидными опухолями.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Эта заявка также включает любую комбинацию перечисленных ниже аспектов изобретения.
Было установлено, что аддитивные или синергетические эффекты ингибирования роста раковых клеток in vitro и in vivo могут быть достигнуты путем введения соединения GDC-0032 или его фармацевтически приемлемой соли в комбинации с некоторыми другими определенными химиотерапевтическими агентами. Комбинации и способы могут быть использованы в лечении гиперпролиферативных расстройств, таких как рак.
В одном из аспектов изобретение относится к способу лечения гиперпролиферативного расстройства, включающему введение терапевтической комбинации в виде объединенной композиции или путем чередования млекопитающему, где терапевтическая комбинация содержит терапевтически эффективное количество GDC-0032, имеющего структуру:
и терапевтически эффективное количество химиотерапевтического агента, выбранного из 5-FU (5-фторурацил), доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола.
В одном из аспектов согласно изобретению предложен способ лечения гиперпролиферативного расстройства, где введение GDC-0032 и одного или более химиотерапевтических агентов, выбранных из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, обеспечивает синергетический эффект при лечении гиперпролиферативного расстройства. В следующем аспекте синергетический эффект имеет значение показателя для комбинации (combination index) менее чем примерно 0,8.
В одном из аспектов изобретения предложена терапевтическая комбинация, дополнительно содержащая карбоплатин.
В одном из аспектов изобретение включает терапевтическую комбинацию, дополнительно содержащую антитело к сосудистому эндотелиальному фактору роста (vascular endothelial growth factor; VEGF).
В одном из аспектов изобретения антителом к VEGF является бевацизумаб.
В одном из аспектов изобретение включает фармацевтически приемлемую соль GDC-0032, выбранную из соли, образованной с использованием соляной кислоты, бромистоводородной кислоты, йодистоводородной кислоты, серной кислоты, азотной кислоты, фосфорной кислоты, метансульфоновой кислоты, бензолсульфоновой кислоты, муравьиной кислоты, уксусной кислоты, трифторуксусной кислоты, пропионовой кислоты, щавелевой кислоты, малоновой кислоты, янтарной кислоты, фумаровой кислоты, малеиновой кислоты, молочной кислоты, яблочной кислоты, винной кислоты, лимонной кислоты, этансульфоновой кислоты, аспарагиновой кислоты и глутаминовой кислоты.
В одном из аспектов изобретение относится к способу лечения гиперпролиферативного расстройства у пациента, включающему введение пациенту терапевтически эффективного количества GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, при этом биологический образец, полученный от пациента до введения комбинации пациенту, протестирован на статус биомаркера, и при этом статус биомаркера указывает на отвечаемость пациентом на терапию GDC-0032 или комбинацией GDC-0032 и химиотерапевтического агента. В одном из воплощений биологический образец протестирован посредством измерения уровня функционального биомаркерного белка, при этом повышенный уровень функционального биомаркера указывает на то, что пациент будет резистентным к GDC-0032 или указанной комбинации. В другом воплощении биологический образец протестирован посредством измерения уровня функционального биомаркера, при этом повышенный или пониженный уровень функционального биомаркера указывает на то, что пациент будет резистентным к GDC-0032 или указанной комбинации.
В одном из аспектов изобретение включает фармацевтическую композицию, содержащую GDC-0032 и химиотерапевтический агент, выбранный из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола.
В одном из аспектов изобретение включает применение терапевтической комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, в изготовлении лекарственного средства для лечения гиперпролиферативного расстройства.
В одном из аспектов изобретение включает применение терапевтической комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, в изготовлении лекарственного средства для лечения рака, выбранного из рака молочной железы, шейки матки, толстой кишки, эндометрия, глиомы, рака легкого, меланомы, рака яичников, поджелудочной и предстательной железы.
В одном из аспектов изобретение включает терапевтическую комбинацию GDC-0032, имеющего структуру:
и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, для применения при лечении гиперпролиферативного расстройства.
В одном из аспектов изобретение включает терапевтическую комбинацию GDC-0032, имеющего структуру:
и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, для применения в лечении рака, выбранного из рака молочной железы, шейки матки, толстой кишки, эндометрия, глиомы, рака легкого, меланомы, рака яичников, поджелудочной и предстательной железы.
В одном из аспектов изобретение включает применение терапевтической комбинации GDC-0032, имеющего структуру:
и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, для применения при лечении гиперпролиферативного расстройства.
В одном из аспектов изобретение включает применение терапевтической комбинации GDC-0032, имеющего структуру:
и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, в лечении рака, выбранного из рака молочной железы, шейки матки, толстой кишки, эндометрия, глиомы, рака легкого, меланомы, рака яичников, поджелудочной и предстательной железы. В одном из аспектов изобретение включает изобретение, как оно изложено в данном описании ранее.
В одном из аспектов изобретение включает изделие производства для лечения гиперпролиферативного расстройства, содержащее:
a) терапевтическую комбинацию GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола; и
b) инструкции по применению.
В одном из аспектов изобретение включает продукт, содержащий GDC-0032 и химиотерапевтический агент, выбранный из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, в виде объединенной композиции для раздельного, одновременного или последовательного применения при лечении гиперпролиферативного расстройства.
В одном из аспектов изобретение включает способ, где терапевтически эффективное количество GDC-0032 и терапевтически эффективное количество химиотерапевтического агента вводят в виде объединенной композиции.
В одном из аспектов изобретение включает способ, где терапевтически эффективное количество GDC-0032 и терапевтически эффективное количество химиотерапевтического агента вводят млекопитающему путем чередования.
В одном из аспектов изобретение включает способ, где млекопитающему вводят химиотерапевтический агент и после этого вводят GDC-0032.
В одном из аспектов изобретение включает способ, где терапевтическую комбинацию вводят в режиме введения, когда терапевтически эффективное количество GDC-0032 вводят в диапазоне от двух раз в сутки до одного раза каждые три недели и терапевтически эффективное количество химиотерапевтического агента вводят в диапазоне от двух раз в сутки до одного раза каждые три недели.
В одном из аспектов изобретение включает способ, где данный режим введения повторяют один или более раз.
В одном из аспектов изобретение включает способ, где введение терапевтической комбинации приводит к синергетическому эффекту.
В одном из аспектов изобретение включает способ, где введение терапевтической комбинации приводит к получению значения показателя для комбинации и менее чем примерно 0,7.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой рак, выбранный из рака молочной железы, шейки матки, толстой кишки, эндометрия, желудка, глиомы, рака легкого, меланомы, рака яичников, поджелудочной и предстательной железы.
В одном из аспектов изобретение включает способ, где раковая опухоль экспрессирует мутантную форму PIK3CA с мутацией, выбранной из Е542К, Е545К, Q546R, H1047L и H1047R.
В одном из аспектов изобретение включает способ, где раковая опухоль экспрессирует мутантную форму PTEN.
В одном из аспектов изобретение включает способ, где рак является HER2(рецептор эпидермального фактора роста человека 2 типа)-положительным.
В одном из аспектов изобретение включает способ, где млекопитающее представляет собой пациента с раком молочной железы, при этом данный пациент является HER2-отрицательным, ER(рецептор эстрогенов)-отрицательным и PR(рецептор прогестерона)-отрицательным.
В одном из аспектов изобретение включает способ, где рак молочной железы является раком базального или люминального подтипа.
В одном из аспектов изобретение включает способ, где пациенту вводят GDC-0032 и эрибулин.
В одном из аспектов изобретение включает способ, где GDC-0032 и химиотерапевтический агент каждый вводят в количестве от примерно 1 мг до примерно 1000 мг на стандартную лекарственную форму.
В одном из аспектов изобретение включает способ, где GDC-0032 и химиотерапевтический агент вводят в соотношении от примерно 1:50 до примерно 50:1 по массе.
В одном из аспектов изобретение включает фармацевтическую композицию, содержащую GDC-0032 и химиотерапевтический агент, выбранный из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола.
В одном из аспектов изобретение включает фармацевтическую композицию, дополнительно содержащую фармацевтически приемлемый глидант, выбранный из диоксида кремния, порошкообразной целлюлозы, микрокристаллической целлюлозы, стеаратов металлов, алюмосиликата натрия, бензоата натрия, карбоната кальция, силиката кальция, кукурузного крахмала, карбоната магния, талька без примеси асбеста, стеаровета (stearowet) С, крахмала, крахмала 1500, лаурилсульфата магния, оксида магния и их комбинаций.
В одном из аспектов изобретение включает фармацевтическую композицию, в которой содержание каждого из GDC-0032 и химиотерапевтического агента составляет от примерно 1 мг до примерно 1000 мг на стандартную лекарственную форму.
В одном из аспектов изобретение включает фармацевтическую композицию для применения в способе лечения рака.
В одном из аспектов изобретение включает способ определения соединений, предназначенных для применения в комбинации для лечения рака, включающий:
a) обработку in vitro опухолевой клеточной линии с мутацией K-ras терапевтической комбинацией GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, и
b) измерение синергетического или несинергетического эффекта; посредством чего определяют синергетическую терапевтическую комбинацию для лечения рака.
В одном из аспектов изобретение включает способ выбора соединений, предназначенных для использования в комбинации для лечения рака, включающий:
a) введение в опухолевые клетки терапевтической комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола;
b) измерение изменения уровня фосфорилированной киназы Akt (pAkt); и
c) выбор синергетической терапевтической комбинации, которая демонстрирует увеличение уровней pAkt.
В одном из аспектов изобретение относится к способу лечения гиперпролиферативного расстройства у пациента, включающему введение пациенту терапевтически эффективного количества GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, при этом биологический образец, полученный от пациента до введения комбинации пациенту, протестирован на статус мутации PIK3CA или PTEN, и при этом статус мутации PIK3CA или PTEN указывает на отвечаемость пациентом на терапию данной комбинацией. Пациенту вводят терапевтически эффективное количество GDC-0032 в виде отдельного агента или комбинации GDC-0032 и химиотерапевтического агента. Биологический образец может быть протестирован посредством измерения уровня функционального белка PI3K после введения GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, при этом изменение уровня функционального белка PI3K указывает на то, что пациент будет резистентным к GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента либо будет отвечать на GDC-0032 или комбинацию GDC-0032 и химиотерапевтического агента.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение включает способ, где биологический образец протестирован посредством измерения уровня функционального белка PI3K после введения GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, при этом изменение уровня функционального белка PI3K указывает на то, что пациент будет резистентным к GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента либо будет отвечать на GDC-0032 или комбинацию GDC-0032 и химиотерапевтического агента.
В одном из аспектов изобретение относится к способу мониторинга того, будет ли пациент с гиперпролиферативным расстройством отвечать на лечение с применением GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, включающему:
(а) детекцию мутации PIK3CA или PTEN в биологическом образце, полученном от пациента после введения по меньшей мере одной дозы GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола; и
(b) сравнение статуса мутации PIK3CA или PTEN в биологическом образце, полученном от пациента до введения данному пациенту GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента,
при этом изменение или модулирование статуса мутации PIK3CA или PTEN в образце, полученном после введения GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, позволяет идентифицировать пациента, который будет отвечать на лечение с применением GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение относится к способу оптимизации терапевтической эффективности GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, включающему:
(a) детекцию мутации PIK3CA или PTEN в биологическом образце, полученном от пациента после введения по меньшей мере одной дозы GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола; и
(b) сравнение статуса мутации PIK3CA или PTEN в биологическом образце, полученном от пациента до введения пациенту GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента,
при этом изменение или модулирование PIK3CA или PTEN в образце, полученном после введения GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, позволяет идентифицировать пациента, который имеет более высокую вероятность получения пользы от лечения с применением GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение относится к способу идентификации биомаркера для мониторинга отвечаемости на GDC-0032 или комбинацию GDC-0032 и химиотерапевтического агента, включающему:
(a) детекцию экспрессии, модулирования или активности биомаркера, выбранного из мутантной формы PIK3CA или PTEN, в биологическом образце, полученном от пациента, получившего по меньшей мере одну дозу GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола; и
(b) сравнение экспрессии, модулирования или активности биомаркера со статусом биомаркера в образце сравнения, представляющем собой биологический образец, полученный от пациента до введения данному пациенту GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента;
при этом модулирование изменений биомаркера по меньшей мере в 2 раза в меньшую или большую сторону по сравнению с образцом сравнения позволяет идентифицировать биомаркер как биомаркер, полезный для мониторинга отвечаемости на GDC-0032 или комбинацию GDC-0032 и химиотерапевтического агента. В одном из воплощений биомаркер представляет собой pAkt.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение относится к способу лечения гиперпролиферативного расстройства у пациента, включающему введение пациенту терапевтически эффективного количества GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола, при этом лечение основывается на данных об образце, полученном от пациента, имеющего мутацию PIK3CA или PTEN. Такой мутацией биомаркера может быть мутация H1047R, H1047L, Е545К или Е542К в PIK3CA.
В одном из аспектов изобретение включает способ, где мутация в биомаркере представляет собой мутацию H1047R или H1047L в PIK3CA.
В одном из аспектов изобретение включает способ, где мутация в биомаркере представляет собой мутацию Е542К, Е545К или Q546R в PIK3CA.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение включает способ, где гиперпролиферативное расстройство представляет собой положительный в отношении рецепторов эстрогенов (ER+) рак молочной железы.
В одном из аспектов изобретение относится к применению GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента при лечении гиперпролиферативного расстройства у пациента, включающем введение пациенту терапевтически эффективного количества GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, выбранного из 5-FU, доцетаксела, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитаксела, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтанзина, трастузумаба и летрозола,
при этом биологический образец, полученный от пациента до введения пациенту GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента, протестирован на статус мутации PIK3CA или PTEN, и при этом статус мутации PIK3CA или PTEN указывает на отвечаемость пациентом на терапию с применением GDC-0032 или комбинации GDC-0032 и химиотерапевтического агента.
В одном из аспектов изобретение включает применение, где гиперпролиферативное расстройство представляет собой HER2-экспрессирующий рак молочной железы.
В одном из аспектов изобретение включает применение, где гиперпролиферативное расстройство представляет собой положительный в отношении рецепторов эстрогенов (ER+) рак молочной железы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 приведены два графика, демонстрирующие эффективность (EC50, микромолярная концентрация) GDC-0032 и GDC-0941 (4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[3,2-d]пиримидин-4-ил)морфолина) в анализе клеточной пролиферации (Cell-Titer Glo®, Promega), выполненном в отношении клеточных линий с PIK3CA дикого типа (wild type; WT) и PIK3CA-мутантных клеточных линий. Каждая точка относится к отдельной раковой клеточной линии.
На Фиг. 2 приведены два графика, демонстрирующие эффективность (EC50, микромолярная концентрация) GDC-0032 и GDC-0941 в анализах клеточной пролиферации, выполненных в отношении клеточных линий с PIK3CA дикого типа (WT), PIK3CA-мутантных, HER2-экспрессирующих и PI3K-мутантных/HER2-экспрессирующих клеточных линий. Каждая точка относится к отдельной клеточной линии.
На Фиг. 3 приведены три графика, демонстрирующие эффективность (EC50, микромолярная концентрация) GDC-0032 в отношении: (3а, верх) клеточных линий с мутацией по спиральному и киназному домену PIK3CA; (3b, середина) клеточных линий с PIK3CA дикого типа, PIK3CA-мутантных клеточных линий, клеточных линий с нулевыми мутациями PTEN (PTEN null) и PTEN/PIKSCA-мутантных клеточных линий; и (3с, низ) клеточных линий с PIK3CA дикого типа, PIK3CA-мутантных, Ras-мутантных и Ras/PIK3CA-мутантных клеточных линий в анализах жизнеспособности Cell-Titer Glo® на 4-е сутки. Каждая точка относится к отдельной клеточной линии.
Фиг. 4а демонстрирует эффективность GDC-0032 в отношении набора изогенных клеточных линий SW48. Родительские клетки SW48 и субклоны мутантов с направленными вставками (knock-in mutant subclones), несущие обычные мутации PIK3CA в горячих точках, Е545К или H1047R, получали от Horizon Discovery. Значения EC50, характеризующие жизнеспособность клеток при обработке GDC-0032, определяли в этих линиях с использованием анализа CellTiter-Glo® на 4-е сутки.
На Фиг. 4b приведены проявленные авторадиографией вестерн-блоты после гель-электрофореза клеточных лизатов, полученных после воздействия GDC-0032 в диапазоне концентраций в течение 18 часов на изогенные клетки SW48: родительские и PIK3CA-мутанты с направленными вставками, Е545К и H1047R.
На Фиг. 5а показано влияние GDC-0032, паклитаксела (paclitaxel; РТХ) и комбинации GDC-0032 и паклитаксела на клеточную линию рака молочной железы MFM223 с мутациями H1047R и D350N в PIK3CA. В анализе in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки (relative light units (RLU) - относительные световые единицы) при варьировании концентраций ингибиторов, используя титрование дозы путем 2-кратных разведений GDC-0032, паклитаксела (РТХ) и комбинации GDC-0032 и паклитаксела.
На Фиг. 5b приведены показатели для комбинации (combination indices; CI) для GDC-0032+паклитаксел и GDC-0941+паклитаксел в отношении клеточных линий с PIK3CA дикого типа и мутантных клеточных линий рака молочной железы как базального, так и люминального типов. Мутации PIK3CA включают Е545К и H1047R. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к раковой клеточной линии.
На Фиг. 6а показано влияние GDC-0032, эрибулина и комбинации GDC-0032 и эрибулина на клеточную линию рака молочной железы Cal51 базального типа с мутацией Е542К в PIK3CA и потерей PTEN. В анализе выживаемости и пролиферации клеток in vitro (Cell-Titer Glo®, Promega) измеряли жизнеспособные клетки (RLU - относительные световые единицы) при варьировании концентраций ингибиторов, используя титрование дозы путем 2-кратных разведений GDC-0032, эрибулина и комбинации GDC-0032 и эрибулина.
На Фиг. 6b приведены показатели для комбинации (CI) для GDC-0032+эрибулин, GDC-0032+доцетаксел, GDC-0941+эрибулин и GDC-0941+доцетаксел в отношении клеточных линий рака молочной железы как базального, так и люминального типов. Значение CI ниже примерно 0,7 указывает на синергизм. Каждая точка относится к клето