Четвертичная аммониевая соль, обладающая антимикотической и антибактериальной активностью
Иллюстрации
Показать всеИзобретение относится к химии органических гетероциклических соединений, а именно - к новой четвертичной аммониевой соли, содержащей фрагмент производного витамина В6, формулы I. Технический результат – получено новое соединение, которое может найти применение в медицине и ветеринарии в качестве антимикотического и антибактериального средства. 1 з.п. ф-лы, 7 ил., 6 пр.
Реферат
Изобретение относится к химии органических гетероциклических соединений, а именно - к новой четвертичной аммониевой соли, содержащей фрагмент производного витамина В6 формулы I, проявляющей антимикотические и антибактериальные свойства. Соединение может найти применение в медицине и ветеринарии.
Инфекционные заболевания, вызванные патогенными грибами и грамположительными бактериями, занимают одно из ведущих мест по распространенности [G.D. Brown, D.W. Denning, N.A. Gow., S.M. Levitz, M.G. Netea, Т.е. White. Hidden killers: human fungal infections // Sci.Trans 1. Med. - 2012. - V. 19, №4. - P. 165rv13.]. Участившиеся в последние годы случаи появления резистентных штаммов грибов и грамположительных бактерий обуславливают необходимость создания принципиально новых эффективных и селективных противомикробных средств для терапии внутри- и внебольничных инфекций._
Четвертичные аммониевые соли (ЧАС) являются одним из важнейших классов антисептических средств и имеют широкую область применения, в частности, в терапии местных гнойно-воспалительных процессов, в дезинфекции неповрежденной кожи перед операциями, консервировании глазных капель, инъекционных растворов, зубных паст, косметических средств, дезинфекции и очистке поверхностей. Современные ЧАС характеризуются широким спектром антимикробной активности по отношению к грамположительным и грамотрицательным микроорганизмам, а также грибам. Механизм антибактериального действия ЧАС заключается в их адсорбции и проникновении через клеточную стенку бактерий с последующим взаимодействием с фосфолипидами цитоплазматической мембраны, что приводит к полной структурной дезорганизации и последующей гибели бактериальной клетки [McDonnell G, Russell AD. Antiseptics and Disinfectants: Activity, Action, and Resistance. Clinical Microbiology Reviews. - 1999 - V. 12(1). - P. 147-179].
Недостатками используемых ЧАС являются неэффективность в отношении спор грибов [Шандала М.Г. Перспективы и проблемы современной дезинфектологии. Журн. Дезинфекционное дело. - 2002, №4. - С 13-19] и простых вирусов [Райнбабен, Фридрих фон. Основы противовирусной дезинфекции: перевод с немецкого языка Москва: Самарово: Летний сад. - 2014. - С. 525], а также недостаточная активность по отношению к грамотрицательным бактериям, микобактериям и собственно грибам.
Анализ известных на дату подачи настоящей заявки лекарственных препаратов, содержащих фрагменты четвертичных аммониевых солей наиболее близких по эффективности и действию на аналогичный спектр патогенных организмов позволяет выделить следующую наиболее известную и широко применяемую в мире группу препаратов:
Мирамистин ((бензилдиметил[3-(миристоиламино)пропил]-аммонийхлорид моногидрат) - разработанный в СССР антисептик, обладающий широким спектром бактерицидного действия в отношении грамположительных (Staphylococcus spp., Streptococcus spp., Streptococcus pneumoniae и др.), грамотрицательных (Pseudomonas aeruginosa, Escherichia coli, Klebsiella spp.и др.), аэробных и анаэробных бактерий, патогенных грибов и вирусов, включая клинические штаммы с полирезистентностью к антибиотикам [Регистр лекарственных средств России РЛС Энциклопедия лекарств. - 20-й вып. Гл.ред. Г.Л. Вышковский. - М.: ЛИБРОФАРМ, 2011. - С. 1368]. Препарат применяется в профилактике нагноений и лечении гнойных ран, лечении и профилактике кандидозов кожи и слизистых оболочек, комплексном лечении острых и хронических отитов, лечении и профилактике инфекционно-воспалительных заболеваний полости рта (стоматитов, гингивитов, пародонтитов, периодонтитов),
индивидуальной профилактике заболеваний, передаваемых половым путем (сифилиса, гонореи, хламидиоза, генитального герпеса и др.) [Блатун Л.А. Мирамистин в комплексной программе борьбы с госпитальной инфекцией в хирургическом стационаре // В сб.: Мирамистин: применение в хирургии, травматологии и комбустиологии. М. - 2006. - С. 27-33.; Макеева И.М. Е.В. Боровский, М.В. Матавкина, Е.А. Бровенко. Применение препарата Мирамистин в комплексном лечении заболеваний слизистой оболочки рта. Фарматека. - 2013. - №3 - С. 1].
Флуомизин (хлорид деквалиния) - антисептик широкого спектра действия, активен в отношении большинства грамположительных бактерий Streptococcus spp., Staphylococcus aureus, Listeria spp.; анаэробов Peptostreptococcus (группы D), грибов рода Candida (Candida tropicalis, Candida aMXicans, Candida glabrata), грамотрицательных бактерий Gardnerella vaginalis, Escherichia coli, Serratia spp., Klebsiella spp., Pseudomonas spp., Proteus spp., и простейших (Trichomonas vaginalis). Используется при бактериальном вагинозе, кандидозе кожи, ногтевых валиков, слизистой оболочки полости рта, воспалительных процессах в полости рта и глотки (тонзиллит, стоматит, в т.ч. афтозный, глоссит, фарингит) [Справочник Видаль «Лекарственные препараты в России», https://www.vidal.ru/drugs/fluomisin_22520].
Бензалкония хлорид (алкилдиметил(фенилметил)аммония хлорид) антисептическое средство активное в отношении грамположительных (Staphylococcus spp., Streptococcus spp., Streptococcus pneumoniae и др.), грамотрицательных (Pseudomonas aeruginosa, Escherichia coli, Klebsiella spp. и др.) и анаэробных бактерий, грибов и плесеней. Применяется при первичной и первично-отсроченной обработке ран, профилактике вторичного инфицирования ран госпитальными штаммами микроорганизмов, бактериальном вагинозе, дренировании костных полостей после операции при остеомиелите [Справочник Видаль «Лекарственные препараты в России». https://www.vidal.ru/drugs/dettol_benzalkonium_chloride_30527].
В изобретении по патенту РФ №2641309 от 17.01.2018 «Антисептическое лекарственное средство» заявлена четвертичная аммониевая соль, содержащая фрагмент производного витамина В6, проявляющая антибактериальные, антимикотические, противовирусные и антипротозойные свойства. При этом данное соединение обладает недостаточной активностью в отношении грамотрицательных бактерий, а также грибов.
При этом следует отметить, что описанные выше лекарственные препараты, по мнению заявителя, не могут рассматриваться в качестве аналогов к заявленному изобретению вследствие того, что они не совпадают с заявленным соединением по химической структуре, хотя и обладают сходной в целом антимикотической и антибактериальной активностью (совпадают по назначению), сопоставимой с заявленным изобретением в большей или меньшей степени.
Задачей заявленного технического решения является новое соединение, обладающее высокой антимикотической и антибактериальной активностью, сопоставимой с существующими антимикотическими и антибактериальными препаратами, но при этом существенно менее токсичное.
Техническим результатом заявленного технического решения является новое соединение формулы I, содержащее в своем составе как фрагмент природного соединения (витамина В6), так и четвертичный аммониевый фрагмент, обладающее высокой антимикотической и антибактериальной активностью, а также низкой токсичностью.
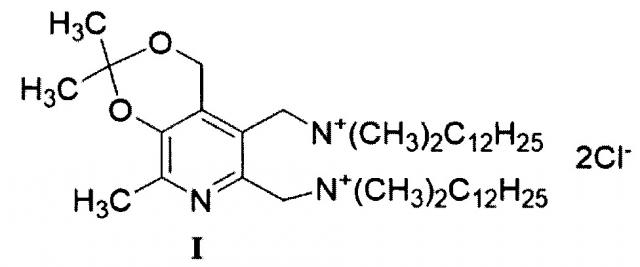
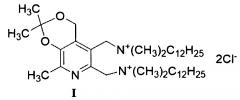
Задача решается, и указанный технический результат достигается посредством синтеза нового производного витамина В6 формулы I:
Заявленное техническое решение иллюстрируется Фиг. 1 - Фиг. 7.
На Фиг. 1 приведена Таблица 1, в которой представлены средние значения минимальной подавляющей концентрации (МПК) (в мкг/мл) для соединения I, а также препаратов сравнения в отношении грамположительных и грамотрицательных микроорганизмов, при концентрации инокулюма 107 КОЕ/мл.
На Фиг. 2 приведена Таблица 2, в которой представлены средние значения МПК (в мкг/мл) для соединения I, а также препаратов сравнения в отношении дрожжевых и мицелиальных грибов.
На Фиг. 3 приведен график, на котором представлены кривые определения количественного роста биопленок С.albicans при культивировании с тербинафином (р<0.05), где К1 - начальная пленка сформированная в течение 24 часов, К2 - рост биопленки в отсутствие препарата. Номера рядов соответствует порядковому номеру штаммов.
На Фиг. 4 приведен график, на котором представлены кривые определения количественного роста биопленок С.albicans при культивировании с флуконазолом (р<0.05), где К1 - начальная пленка сформированная в течение 24 часов, К2 - рост биопленки в отсутствие препарата. Номера рядов соответствует порядковому номеру штаммов.
На Фиг. 5 приведен график, на котором представлены кривые определения количественного роста биопленок С.albicans при культивировании с соединением I (р<0.05), где К1 - начальная пленка сформированная в течение 2 4 часов, К2 - рост биопленки в отсутствие препарата. Номера рядов соответствует порядковому номеру штаммов.
На Фиг. 6 приведена Таблица 3, на которой представлены результаты исследования острой токсичности соединения I на крысах при внутрижелудочном введении, где ЛД10, ЛД16, ЛД50 и ЛД84 - средние дозы вещества, вызывающие гибель 10, 16, 50 и 84% животных, соответственно.
На Фиг. 7 приведена Таблица 4, на которой представлены результаты исследования острой токсичности соединения I на крысах при нанесении на кожу, где ЛД10, ЛД16, ЛД50 и ЛД84 - средние дозы вещества, вызывающие гибель 10, 16, 50 и 84% животных, соответственно.
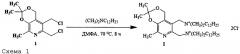
Заявленное соединение I получают по нижеприведенной Схеме 1:
Характеристики нового соединения, а также описание его синтеза, приведены далее в примерах конкретного практического осуществления.
Структура полученного соединения подтверждена методами масс-спектрометрии, 1Н и 13С ЯМР-спектроскопии. Спектры ЯМР регистрировали на приборе Bruker AVANCE-400. Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированных растворителей (1Н и 13С). Температуры плавления определялись с помощью прибора Stanford Research Systems МРА-100 OptiMelt. Контроль за ходом реакций и чистотой соединений проводили методом ТСХ на пластинах Sorbfil Plates. HRMS-эксперимент был проведен с использованием масс-спектрометра TripleTOF 5600, АВ Sciex (Германия) из раствора в метаноле методом ионизации - турбоионный спрей (TIS) -при энергии столкновения с молекулами азота 10 еВ.
Примеры конкретного практического осуществления заявленного технического решения.
Пример 1. Получение N,N'-((2,2,8-Триметил-4Н-[1,3]диоксино[4,5-с]пиридин-5,6-диил)бис(метилен))бис(N,N-диметилдодекан-1-аминий) дихлорида (I).
К раствору 0.20 г (0.7 ммоль) соединения 1 [Shtyrlin N.V., Pavelyev R.S., Pugachev M.V., Sysoeva L.P., Musin R.Z., Shtyrlin Yu.G. Synthesis of novel 6-substituted sulfur-containing derivatives of pyridoxine// Tetrahedron Letters - 2012. - V. 53, Iss. 31. - P. 3967-3970] в 30 мл ДМФА добавляют 0.39 мл (1.4 ммоль) N, N-диметилдодециламина, после чего реакционную смесь перемешивают в течение 8 часов при температуре 70°С. Далее растворитель отгоняют в вакууме. Полученный остаток перекристализовывают из смеси ацетон: диэтиловый эфир (10:1). Выход 0.30 г (67%), белое кристаллическое вещество, т.пл. 138°С (разл).
Спектр ЯМР 1Н (400 МГц, CDCl3) δ, м.д.: 0.84 т (6Н, 3Jнн=7.2 Гц, СН3С11Н22), 1.17-1.32 м (36Н, 18СН2), 1.52 с (3Н, СН3), 1.56 с (3Н, СН3), 1.70-2.02 м (4Н, 2СН2), 2.40 С (3Н, СН3), 3.19 С (3Н, 2CH3N+), 3.21 с (3Н, CH3N+), 3.37 с (3Н, CH3N+), 3.54 с (3Н, CH3N+), 3.42-3.45 м (2Н, CH2N+), 3.78-3.96 м (2Н, CH2N+), 4.83, 5.70 (АВ-система, 2Н, 2Jнн=-13.4 Гц, СН2), 5.04, 5.82 (АВ-система, 2Н, 2Jнн=-14.2 Гц, СН2), 5.06, 5.47 (АВ-система, 2Н, 2Jнн=- 16.8 Гц, СН2).
Спектр ЯМР 13С {1H} (100 МГц, CDCl3) δ, м.д.: 14.19 с (СН3), 18.53 с (СН3), 19.14 с (СН2), 22.75 с (СН2), 23.03 с (СН2), 23.11 с (СН3), 23.64 с (СН2), 26.36 с (СН2), 26.53 с (СН2), 26.73 (с, СН2), 29.40 с (СН2), 29.45 с (СН2), 29.51 С (СН2), 29.57 с (СН2), 29.67 с (СН2), 31.97 с (СН2), 48.09 с (CH3N+), 49.30 с (CH3N+), 51.17 с (CH3N+), 51.93 с (CH3N+), 60.41 с (СН2), с 61.12 (СН2), 62.39 С (СН2), 64.06 с (CH2N+), 64.83 С (CH2N+), 101.25 с (С(СН3)2), 120.70 С (Спир), 130.95 с (Спир), 141.37 с (Спир), 147.44 с (Спир), 150.44 с (Спир).
Масс-спектр (HRMS-ESI): Найдено [М-2Сl]2+ 315.8003. C40H77N3O2Cl2. Вычислено [М-2Сl]2+ 315.8006.
Пример 2. Исследование антибактериальной активности четвертичной аммониевой соли I in vitro.
Сравнительную оценку спектра антибактериального действия соединения I проводили на музейных и клинических штаммах грамположительных и грамотрицательных микроорганизмов в соответствии с [Определение чувствительности микроорганизмов к антибактериальным препаратам (Методические указания МУК 4.2.1890-04). Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 04.03.2004 г.]. В качестве препаратов сравнения использовали мирамистин и хлорид бензалкония.
Значение минимальной подавляющей концентрации (МПК) определяли методом серийных разведений на среде Мюллера-Хинтона с использованием 96 - луночных стерильных планшетов. Готовили двукратные разведения исследуемых веществ в питательной среде. Конечные концентрации составляли 1-128 мкг/мл.
Оценку роста культур проводили визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест-соединений с ростом культуры без них.
Наличие роста микроорганизма в бульоне (помутнение бульона) свидетельствует о том, что данная концентрация исследуемого препарата недостаточна, чтобы подавить его жизнеспособность. Первую наименьшую концентрацию исследуемого вещества (из серии последовательных разведений), где визуально не определяется бактериальный рост, считают минимальной подавляющей концентрацией.
МПК определяли методом серийных разведений в бульоне с шагом 2, поэтому различия соседних разведений не считаются существенными. В каждом опыте присутствует положительный (бульон с растущей культурой) и отрицательный (бульон без растущей культуры) контроли.
Для определения МПК брали 10 мкл культуральной среды из тех лунок, в которых не наблюдался рост, и проводили посев на плотную среду Мюллера-Хинтона.
Для приготовления инокулюма использовали чистую, суточную культуру грамположительных и грамотрицательных микроорганизмов, выросших на плотной питательной среде. Питательная среда - бульон Мюллера-Хинтона, который готовили из сухих сред (Mueller Hinton broth, Acumedia, Baltimore).
Культивирование осуществляли на агаризованной среде Мюллера-Хинтона, включающей дополнительно 2% агара. Среды стерилизовали автоклавированием при 121°С в течение 15 минут. В стерильном изотоническом растворе хлорида натрия готовили взвесь микроорганизмов, доводя плотность инокулюма до 0.5 по стандарту МакФарланда (1.5×108 КОЕ/мл). Затем полученный инокулят разводили до концентрации 107 КОЕ/мл средой Мюллера-Хинтона. Инокулюм использовали в течение 15 минут после приготовления; чистоту бактериальных штаммов контролировали перед каждым экспериментом.
В лунки каждого планшета вносили по 100 мкл бульона Мюллера-Хинтона; в первую лунку вносили испытуемое вещество в концентрации 128 мкг/мл в объеме 100 мкл и последовательным двукратным разведением доводили его концентрацию до 0.5 мкг/мл. Затем в каждую лунку вносили приготовленный инокулюм (100 мкл), разводя тем самым вдвое концентрацию изучаемых соединений.
В качестве контроля включали лунки, не содержащие тестируемых веществ (контроль роста культуры). Кроме того, ставили контроль чистоты питательных сред и растворителей. Планшеты инкубировали в термостате при 37°С в течение 24 часов. Оценку роста культур проводили визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест - соединений с ростом культуры без них.
За МПК принимали минимальную концентрацию исследуемых соединений, обеспечивающую полное подавление видимого роста исследуемых штаммов микроорганизмов. В качестве МПК соединения принимали его максимальное значение, полученное в трех независимых экспериментах. Полученные результаты представлены в Таблице 1 на Фиг. 1.
Как видно из представленных в Таблице 1 данных, соединение I на штаммах грамположительных и грамотрицательных бактерий существенно превосходит мирамистин и сопоставимо по своей активности с хлоридом бензалкония. Необходимо отметить, что к соединению I были чувствительны все 55 бактериальных штаммов (МПК100<64 мкг/мл), в то время как у мирамистина МПК91<64 мкг/мл, а у бензалкония хлорида МПК98<64 мкг/мл.
Пример 3. Исследование антимикотической активности четвертичной аммониевой соли I in vitro.
При исследовании антимикотической (противогрибковой) активности четвертичной аммониевой соли I использовались следующие штаммы грибов:
- Candida albicans К-1020 (клинический изолят, резистентный к флуконазолу, выделенный от больной с клинически подтвержденным диагнозом (системный кандидоз кожи и слизистой) в Казанском НИИ эпидемиологии и микробиологии Роспотребнадзора, лаборатория микологии, г. Казань.
- Rhizopus nigricans 600 Всероссийская коллекция микроорганизмов (ВКМ) (эталонный штамм).
- Aspergillus fumigatus 1320-13 (клинический изолят, выделен из полости носа, грибковое образование, решетчатая кость) в Казанском НИИ эпидемиологии и микробиологии Роспотребнадзора, лаборатория микологии, г. Казань.
- Trichophyton rubrum К-1 (клинический изолят, выделен с кожных покровов человека) из Казанского НИИ эпидемиологии и микробиологии Роспотребнадзора, лаборатория микологии, г. Казань.
Для приготовления инокулюма использовали чистые, 2-5 суточные культуры дрожжевых и мицелиальных грибов соответственно, выросших на плотной питательной среде Сабуро.
Инокулят для засева готовили по-разному в зависимости от вида грибов. Так, дрожжевые культуры (Candida albicans, Candida tropicalis) готовили путем смыва культуры с агарового косяка. Культуры мицелиальных грибов (Rhizopus nigricans, Aspergillus fumigatus) предварительно растирались в ступке. В стерильном изотоническом растворе хлорида натрия готовили взвесь микроорганизмов, доводя плотность инокулюма до 2 млрд. по стандарту МакФарланда (2⋅108 КОЕ/мл), учитывая, что величина грибковых
элементов примерно в 10 раз превышает величину бактерий. Конечная концентрация клеток в опыте составляет 1-5×103 для дрожжевых грибов и 0.4-5104 для мицелиальных. Инокулюм использовали в течение 15 минут после приготовления; чистота грибковых штаммов контролировалась перед каждым экспериментом
Изучение противогрибковой активности веществ in vitro проводилось в жидкой питательной среде (глюкозный бульон Сабуро) в биологических пробирках методом 2-х кратных серийных разведений. В пробирках готовили два параллельных ряда разведений исследуемого вещества следующим способом.
Жидкую среду Сабуро разливали стерильно по 3 мл в каждую пробирку; в первую пробирку ряда наливали 4.5 мл. Всего в ряду использовались 14 пробирок; из них последняя контрольная. В качестве стандартной навески брали 40 мг испытуемого вещества и растворяли в 1 мл ДМСО, а затем добавляли дистиллированную воду, доводя объем до 10 мл. Таким образом, исходное разведение содержало испытуемое вещество в концентрации 4000 мкг/мл. Затем 0.5 мл этого разведения вносили в первую пробирку ряда (с 4.5 мл среды), разводя тем самым концентрацию вещества еще в 10 раз. Следовательно, первая пробирка ряда содержала 400 мкг/мл испытуемого вещества. Затем из первой пробирки брали по 3 мл раствора и переносили его во вторую пробирку, тщательно продув. Затем снова брали 3 мл раствора уже из второй пробирки и переносили в третью пробирку и т.д.; из предпоследней пробирки 3 мл выливали. В последнюю пробирку, как в контрольную, вещество не вносили.
Таким образом, получили следующие разведения в мкг/мл: 4 00, 200, 100, 50, 25, 12.5, 6.25, 3.12, 1.5, 0.75, 0.38, 0.19, 0.09.
В пробирки с двумя параллельными рядами разведений исследуемого вещества (как описано выше) и в контрольные пробирки в отсутствии испытуемых веществ оттитрованной пипеткой, содержащей 25 капель в 1 мл, вносили по одной капле взвеси инокулюма. После засева штатив энергично встряхивали и помещали в термостат с температурой 27°С на 2-4 суток для дрожжевых грибов и на 7-14 суток для мицелиальных грибов соответственно. За МПК принимали минимальную концентрацию исследуемых соединений, обеспечивающую полное подавление видимого роста исследуемых штаммов микроорганизмов. В качестве препаратов сравнения использовали антимикотики флуконазол и тербинафин, а также антисептики бензалкония хлорид и мирамистин.
Как видно из данных, представленных в Таблице 2 на Фиг. 2, соединение I по своей антимикотической активности сопоставимо с препаратом сравнения тербинафином и существенно превосходит флуконазол, а также антисептики мирамистин и хлорид бензалкония.
Пример 4. Исследование влияния соединения I на рост грибов Candida albicans в составе биопленок.
При исследовании влияния соединения I на грибы в составе биопленок использовались следующие штаммы:
- Candida albicans К-4546 (клинический изолят, выделенный со слизистой зева) Казанский НИИ эпидемиологии и микробиологии Роспотребнадзора, лаборатория микологии, г. Казань;
- Candida albicans (С.albicans) K-203 (клинический изолят, выделенный с кожных покровов);
- Candida albicans K-230 (клинический изолят, выделенный со слизистой зева);
- Candida albicans K-249 (клинический изолят, выделенный с ногтевых пластин);
- Candida albicans K-256 (клинический изолят, выделенный с кожных покровов).
Формирование биопленок грибов С.albicans проводили по методу [G. Ramage, K. VandeWalle, B.L. Wickes, J.L. Lopez-Ribot.
Characteristics of biofilm formation by Candida albicans // Rev. Iberoam. Micol. - 2001. - V. 18. - P. 163-170]. Культуру грибов засевали в жидкую среду Сабуро и инкубировали в орбитальном шейкере (180 об/мин) при 30°С в течение 24 часов. Затем культуру промывали два раза стерильным фосфатным буфером и ресуспендировали в жидкой среде Сабуро с конечной плотностью 1.0×106 клеток/мл. Суспензию клеток в количестве 100 мкл вносили в 96-луночные плоскодонные полистироловые микропанели и инкубировали в течение 2 4 часов при 37°С (контроль К1). После образования биопленки планшеты промывали три раза стерильным фосфатным буфером. Затем вносили тестируемые соединения методом серийных разведений в различных концентрациях в количестве 12 5 мкл и инкубировали в течение 48 часов.
Оценивали степень или количество сформированных биопленок колориметрическим способом. В лунки со сформированными биопленками добавляли 125 мкл водного раствора 1% кристаллического фиолетового и инкубировали 20 мин при 37°С. После удаления избытка красителя и промывки лунок добавляли 95% этанол в количестве 125 мкл, оптическую плотность регистрировали на ридере с вертикальным лучом света с использованием светофильтра 620 нм.
Как видно из представленных на Фиг. 3-5 графиков, количественный рост штаммов С.albicans в составе биопленок в отсутствии препаратов увеличивался в 2 раза. Минимальные значения МПК для флуконазола на штаммы С.albicans в составе биопленок составили >400 мкг/мл, максимальные значения >1600 мкг/мл. МПК для тербинафина на штаммах С.albicans в составе биопленок составили >1600 мкг/мл. МПК для тестируемого соединения I на штаммах С.albicans в составе биопленок составили >200 мкг/мл. Препараты сравнения (флуконазол, тербинафин) проявляли различную активность в отношении группы штаммов. Так, флуконазол был менее активен в отношении штаммов, выделенных с кожных покровов. Тербинафин не оказывал противогрибковую активность в отношении штамма, выделенного с ногтевых пластин.
Тестируемое соединение I проявляло стабильную активность в отношении всех групп штаммов, существенно большую, чем тербинафин и флуконазол. Кроме того, ингибирование количественного роста биопленок наступает уже в концентрации 6.2 мкг/мл, что является его несомненным преимуществом.
Пример 5. Исследование острой токсичности соединения I на крысах при внутрижелудочном введении.
Исследование острой токсичности соединения I проводили на SPF крысах линии Sprague Dawley при внутрижелудочном введении в соответствии с Руководством по проведению доклинических исследований лекарственных средств [Руководство по проведению доклинических исследований лекарственных средств. Часть первая [Текст] / Под ред. А.Н. Миронова. - М.: Гриф и К, 2012. - 944 с.]. Использовали внутрижелудочное (пероральное) введение раствора соединения I в объеме не более 0.5 мл/300 г живой массы тела крысы с применением желудочного зонда. Крысам вводили дозу 2000 мг/кг. Расчет токсических доз ЛД10, ЛД16, ЛД50 и ЛД84 (средние дозы вещества, вызывающие гибель 10, 16, 50 и 84% животных, соответственно) производился с использованием пробит-анализа в программном обеспечении IBM SPSS Statistics.
Через 14 дней после введения препарата были проведены эвтаназия и патоморфологическое вскрытие контрольной и опытных групп животных. При вскрытии крыс никаких изменений внутренних органов не наблюдалось.
В результате эксперимента величина ЛД50 для соединения I выявлена не была (Таблица 3 на Фиг. 6), поскольку при введении дозы 2000 мг/кг падеж крыс не фиксировался.
По результатам исследования острой токсичности при пероральном введении (Таблица 3 на Фиг. 6) в соответствии с ГОСТ 32644-2014 соединение I можно отнести к 4-му классу токсичности по
Согласованной на глобальном уровне системе классификации опасности и маркировки химической продукции, а в соответствии с ГОСТ 12.1.007-76 - к 3-му классу умеренно опасных вредных веществ. Широко применяемые в настоящее время антисептики мирамистин (ЛД50=1200 мг/кг) [Лекарственный препарат Патент РФ №2161961 от 17.03.2000], бензалкония хлорид (ЛД50=240 мг/кг) [http://www.sciencelab.com/msds.php?msdsId=9923038], хлоргексидин (ЛД50=2000 мг/кг) [http://www.pfizer.com/files/products/material_safety_data/PZ00711.pdf] и антимикотик флуконазол (ЛД50=1325 мг/кг) [https://www.pfizer.com/sites/default/files/products/material_safety__data/diflucan(fluconazole)tablets_31-may-2016.pdf], при внутрижелудочном введении на крысах существенно более токсичны.
Пример 6. Исследование острой токсичности соединения I на крысах при нанесении на кожу.
Исследования острой токсичности соединения I на крысах линии Wistar при нанесении на кожу проводились в соответствии с Руководством по проведению доклинических исследований лекарственных средств [Руководство по проведению доклинических исследований лекарственных средств. Часть первая [Текст] / Под ред. А.Н. Миронова. - М.: Гриф и К, 2012. - 944 с.].
Использовали накожное нанесение раствора соединения I в объеме не более 0.5 мл/250 г живой массы тела крысы. При накожной аппликации навеску соединения I равномерно наносили на марлю, увлажняли дистиллированной водой для обеспечения лучшего контакта с кожей, фиксировали при помощи лейкопластыря и оставляли на 24 часа.
Через 14 дней после введения соединения была проведена эвтаназия животных и проведено патоморфологическое вскрытие. При вскрытии крыс никаких изменений внутренних органов не наблюдалось.
В результате эксперимента величина ЛД50 для соединения I выявлена не была, поскольку при нанесении на кожу дозы 2000 мг/кг падеж крыс не фиксировался (Таблица 4 на Фиг. 7). По результатам исследования острой токсичности при накожном нанесении в соответствии с ГОСТ 32644-2014 соединение I можно отнести к 4-му классу токсичности по Согласованной на глобальном уровне системе классификации опасности и маркировки химической продукции, а в соответствии с ГОСТ 12.1.007-76 - к 3-му классу умеренно опасных вредных веществ. Широко применяемые в настоящее время антисептик бензалкония хлорид (ЛД50=1420 мг/кг) [https://www.sigmaaldrich.com/MSDS/MSDS/DisplayMSDSPage.do?country=RU&language=en&productNumber=12060&brand=SIAL&PageToGoToURL=https%3A%2F%2Fwww.sigmaaldrich.com%2Fcatalog%2Fsearch%3Fterm%3D63449-41-2%26interface%3DCAS%2520No.%26N%3D0%26mode%3Dpartialmax%26lang%3Den% 26region%3DRU%26focus%3Dproduct] и хлоргексидин (ЛД50=2000 мг/кг) [http://www.pfizer.com/files/products/material_safety_data/PZ00711.p df] при накожном нанесении на крысах существенно более токсичны.
Таким образом, заявленное техническое решение - новое соединение формулы I, содержащее в своем составе как фрагмент природного соединения (витамина Вб), так и четвертичный аммониевый фрагмент, позволяет создать новое высокоэффективное и малотоксичное лекарственное средство, обладающее как антимикотической, так и антибактериальной активностью, которое потенциально позволит существенно повысить качество и продолжительность жизни пациентов.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, обладающие заявленной совокупностью отличительных признаков, обеспечивающих достижение заявленных результатов.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, так как не является очевидным для специалиста в данной области науки и техники.
Заявленное техническое решение соответствует критерию «промышленная применимость», т.к. может быть реализовано на любом специализированном предприятии с использованием стандартного оборудования, известных отечественных материалов и технологий
1. Четвертичная аммониевая соль формулы I:
.
2. Четвертичная аммониевая соль по п.1, обладающая антимикотической и антибактериальной активностью.