Способы диагностики и композиции для лечения рака
Иллюстрации
Показать всеПредложенная группа изобретений относится к области медицины. Предложены способы определения и выбора терапии для пациента и набор для определения, может ли пациент получать пользу от лечения с помощью антагониста VEGF. Осуществляют обнаружение экспрессии Cox2 в биологическом образце пациента до введения антагониста VEGF, сравнивают уровень экспрессии Cox2 с эталонным уровнем, где по увеличению экспрессии Cox2 в образце пациента относительно эталонного уровня экспрессии идентифицируют пациента, который с большой вероятностью будет реагировать на лечение антагонистом VEGF. Предложенная группа изобретений обеспечивает эффективные средства и методы определения того, может ли пациент получать пользу от лечения с помощью антагониста VEGF посредством обнаружения экспрессии Cox2 в биологическом образце пациента. 6 н. и 45 з.п. ф-лы, 8 ил., 4 табл., 4 пр.
Реферат
Область изобретения
[0001] Настоящее изобретение относится к способам идентификации пациентов, для которых будет эффективно лечение антагонистом VEGF, например, антителом против VEGF.
Уровень техники, предшествующий изобретению
[0002] Измерение уровней экспрессии биомаркеров (например, секретируемых белков в плазме) может являться эффективным способом идентификации пациентов и популяций пациентов, которые будут реагировать на конкретные виды терапии, включая, например, лечение антагонистами VEGF, такими как антитела против VEGF.
[0003] Существует необходимость в эффективных способах определения того, какие пациенты будут реагировать на какое лечение и введения таких определений в эффективные схемы лечения для пациентов с видами терапии антагонистами VEGF, независимо от того используется ли они в качестве единственных средств или в комбинации с другими средствами.
Сущность изобретения
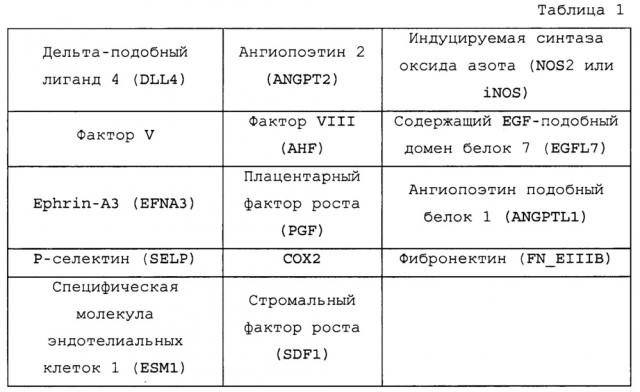
[0004] Настоящее изобретение относится к способам идентификации пациентов, для которых будет эффективно лечение антагонистом VEGF, таким как антитело против VEGF. Таких пациентов идентифицируют в зависимости от уровней экспрессии следующих генов: DLL4, ангиопоэтина 2 (Angpt2), NOS2, фактора V, фактора VIII (AHF), EGFL7, EFNA3, PGF, ANGPTL1, SELP, Cox2, фибронектина (FN_EIIIB), ESM1 и стромального фактора роста (SDF1).
[0005] Изобретение относится к способам определения, с какой вероятностью пациент будет реагировать на лечение антагонистом VEGF, где способы включают: (a) определение экспрессии по меньшей мере одного из следующих генов: DLL4, ангиопоэтина 2 (Angpt2), NOS2, фактора V, фактора VIII (AHF), EGFL7, EFNA3, PGF, ANGPTL1, SELP, Cox2, фибронектина (FN_EIIIB), ESM1 и стромального фактора роста (SDF1) в биологическом образце, получаемом у пациента до какого-либо введения антагониста VEGF пациенту; (b) сравнение уровня экспрессии по меньшей мере одного гена с эталонным уровнем экспрессии по меньшей мере одного гена, где по изменению уровня экспрессии по меньшей мере одного гена в образце пациента относительно эталонного уровня идентифицируют пациента, который с большей вероятностью будет реагировать на лечение антагонистом VEGF, и необязательно (c) информирование пациента, что для него существует повышенная вероятность того, что он является восприимчивым к лечению антагонистом VEGF. В некоторых вариантах осуществления способы могут наоборот необязательно включать (с) информирование пациента, что для него не существует повышенная вероятность того, что он является восприимчивым к лечению антагонистом VEGF, например, если в образце пациента не детектируют изменение уровня экспрессии по меньшей мере одного гена относительно эталонного уровня.
[0006] Изобретение также относится к способам оптимизации терапевтической эффективности терапии против рака для пациента, где способы включают: (a) обнаружение экспрессии по меньшей мере одного из следующих генов: DLL4, ангиопоэтина 2 (Angpt2), NOS2, фактора V, фактора VIII (AHF), EGFL7, EFNA3, PGF, ANGPTL1, SELP, Cox2, фибронектина (FN_EIIIB), ESM1 и стромального фактора роста (SDF1) в биологическом образце, получаемом у пациента до какого-либо введения антагониста VEGF пациенту; (b) сравнение уровня экспрессии по меньшей мере одного гена с эталонным уровнем экспрессии по меньшей мере одного гена, где по изменению уровня экспрессии по меньшей мере одного гена в образце пациента относительно эталонного уровня идентифицируют пациента, который с большей вероятностью будет реагировать на лечение антагонистом VEGF, и необязательно (c) предоставление рекомендации пациенту, что терапия против рака предусматривает введение антагониста VEGF. В некоторых вариантах осуществления способы могут наоборот необязательно включать (c) предоставление рекомендации пациенту, что терапия против рака не представляет собой антагонист VEGF, например, если в образце пациента не детектируют изменение уровня экспрессии по меньшей мере одного гена относительно эталонного уровня.
[0007] В этих способах пациент может входить в популяцию пациентов, подлежащих тестированию на восприимчивость к антагонисту VEGF, и эталонный уровень может представлять собой средний уровень экспрессии по меньшей мере одного гена в популяции пациентов.
[0008] Изобретение также относится к способам мониторинга, будет ли пациент, который получил по меньшей мере одну дозу антагониста VEGF, реагировать на лечение антагонистом VEGF, где способы включают: (a) обнаружение экспрессии по меньшей мере одного из следующих генов: DLL4, ангиопоэтина 2 (Angpt2), NOS2, фактора V, фактора VIII (AHF), EGFL7, EFNA3, PGF, ANGPTL1, SELP, Cox2, фибронектина (FN_EIIIB), ESM1 и стромального фактора роста (SDF1) в биологическом образце, получаемом у пациента после введения по меньшей мере одной дозы антагониста VEGF; (b) сравнение уровня экспрессии по меньшей мере одного гена с эталонным уровнем, который может представлять собой уровень экспрессии по меньшей мере одного гена в биологическом образце, получаемом у пациента до введения антагониста VEGF пациенту, где по изменению уровня экспрессии по меньшей мере одного гена в образце, получаемом после введения антагониста VEGF, относительно эталонного уровня идентифицируют пациента, который будет реагировать на лечение антагонистом VEGF, и необязательно (c) информирование пациента, что для него существует повышенная вероятность того, что он является восприимчивым к лечению антагонистом VEGF. В некоторых вариантах осуществления способы могут включать наоборот (c) информирование пациента, что он может является не восприимчивым к лечению антагонистом VEGF, например, если в образце, получаемом после введения антагониста VEGF, не детектируют изменение уровня экспрессии по меньшей мере одного гена относительно эталонного уровня.
[0009] В описанных выше способах изменение уровня экспрессии по меньшей мере одного гена в образце пациента может представлять собой повышение или понижение относительно эталонного уровня.
[0010] Экспрессию по меньшей мере одного гена в биологическом образце, получаемом у пациента, можно детектировать измерением, например, уровней мРНК и/или белка в плазме.
[0011] Биологический образец может представлять собой, например, опухолевую ткань, такую как образец биопсии опухоли или плазмы крови.
[0012] Способы по изобретению могут дополнительно включать обнаружение экспрессии по меньшей мере второго, третьего, четвертого или последующих генов в биологическом образце у пациента.
[0013] Антагонист VEGF может представлять собой антитело против VEGF, такое как бевацизумаб.
[0014] Пациент может страдать ангиогенным нарушением. Например, пациент может страдать раком, выбранной из группы, состоящей из: колоректального рака, рака молочной железы, рака легких, глиобластомы и их сочетаний.
[0015] Описанные выше способы могут дополнительно включать стадию введения антагониста VEGF (например, антитела против VEGF, такого как, например, бевацизумаб) пациенту.
[0016] Изобретение также включает способы выбора терапии для конкретного пациента в популяции пациентов, для которых предполагают проведение терапии, где способы включают: (a) обнаружение экспрессии по меньшей мере одного из следующих генов: DLL4, ангиопоэтина 2 (Angpt2), NOS2, фактора V, фактора VIII (AHF), EGFL7, EFNA3, PGF, ANGPTL1, SELP, Cox2, фибронектина (FN_EIIIB), ESM1 и стромального фактора роста (SDF1) в биологическом образце, получаемом у пациента до какого-либо введения антагониста VEGF пациенту; (b) сравнение уровня экспрессии по меньшей мере одного гена с эталонным уровнем экспрессии по меньшей мере одного гена, где по изменению уровня экспрессии по меньшей мере одного гена в образце пациента относительно эталонного уровня идентифицируют пациента, который с большей вероятностью будет реагировать на лечение антагонистом VEGF, и (c) выбор терапии, предусматривающей введение антагониста VEGF, если идентифицируют, что пациент с большой вероятностью реагирует на лечение антагонистом VEGF, и необязательно рекомендацию пациенту выбранной терапии, предусматривающей введение антагониста VEGF, или (d) выбор терапии, которая не предусматривает введение антагониста VEGF, если не идентифицируют, что пациент с большой вероятностью реагирует на лечение антагонистом VEGF, и необязательно рекомендацию пациенту выбранной терапии, которая не предусматривает введение антагониста VEGF.
[0017] В этих способах пациент может входить в популяцию пациентов, подлежащих тестированию на восприимчивость к антагонисту VEGF, и эталонный уровень может представлять собой средний уровень экспрессии по меньшей мере одного гена в популяции пациентов.
[0018] Изобретение также относится к способам выбора терапии для пациента, который получал по меньшей мере одну дозу антагониста VEGF, где способы включают: (a) обнаружение экспрессии по меньшей мере одного из следующих генов: DLL4, ангиопоэтина 2 (Angpt2), NOS2, фактора V, фактора VIII (AHF), EGFL7, EFNA3, PGF, ANGPTL1, SELP, Cox2, фибронектина (FN_EIIIB), ESM1 и стромального фактора роста (SDF1), в биологическом образце, получаемом у пациента после введения антагониста VEGF; (b) сравнение уровня экспрессии по меньшей мере одного гена с эталонным уровнем, который представляет собой уровень экспрессии по меньшей мере одного гена в биологическом образце, получаемом у пациента до введения антагониста VEGF пациенту; где по изменению уровня экспрессии по меньшей мере одного гена в образце пациента относительно эталонного уровня идентифицируют пациента, который с большой вероятностью реагирует на лечение антагонистом VEGF, и (c) выбор терапии, предусматривающей введение антагониста VEGF, если в образце, получаемом после введения антагониста VEGF, детектируют изменение уровня экспрессии по меньшей мере одного гена, и необязательно рекомендацию пациенту выбранной терапии, предусматривающей введение антагониста VEGF, или (d) выбор терапии, которая не предусматривает введение антагониста VEGF, если в образце, получаемом после введения антагониста VEGF, не детектируют изменение уровня экспрессии по меньшей мере одного гена, и необязательно рекомендацию пациенту выбранной терапии, которая не предусматривает введение антагониста VEGF.
[0019] В двух способах, описанных выше, изменение уровня экспрессии по меньшей мере одного гена в образце пациента может представлять собой повышение или понижение относительно эталонного уровня.
[0020] Способы могут дополнительно включать обнаружение экспрессии по меньшей мере второго, третьего, четвертого или последующих генов в биологическом образце у пациента.
[0021] Кроме того, терапия (d) может представлять собой средство, выбранное из группы, состоящей из противоопухолевого средства, химиотерапевтического средства, ингибирующего рост средства, цитотоксического средства и их сочетаний.
[0022] Способы могут дополнительно включать: (e) введение эффективного количества антагониста VEGF пациенту, если идентифицируют, что пациент с большой вероятностью реагирует на лечение антагонистом VEGF. Антагонист VEGF может представлять собой антитело против VEGF, такое как бевацизумаб.
[0023] Кроме того, способы могут дополнительно включать введение эффективного количества по меньшей мере второго средства. Например, второе средство можно выбирать из группы, состоящей из противоопухолевого средства, химиотерапевтического средства, ингибирующего рост средства, цитотоксического средства и их сочетаний.
[0024] Изобретение также относится к способам диагностики ангиогенного нарушения у пациента, где способы включают стадии: (a) обнаружение уровня экспрессии по меньшей мере одного из следующих генов: DLL4, ангиопоэтина 2 (Angpt2), NOS2, фактора V, фактора VIII (AHF), EGFL7, EFNA3, PGF, ANGPTL1, SELP, Cox2, фибронектина (FN_EIIIB), ESM1 и стромального фактора роста (SDF1) в образце, получаемом у пациента до какого-либо введения антагониста VEGF пациенту; (b) сравнения уровня экспрессии по меньшей мере одного гена или биомаркер с эталонным уровнем по меньшей мере одного гена; где по изменению уровня экспрессии по меньшей мере одного гена в образце пациента относительно эталонного уровня идентифицируют пациента, страдающего ангиогенным нарушением, и необязательно (c) информирования пациента, что он страдает ангиогенным нарушением. В некоторых вариантах осуществления способы могут наоборот включать (c) информирование пациента, что он не страдает ангиогенным нарушением, например, если в образце пациента не детектируют изменение уровня экспрессии по меньшей мере одного гена относительно эталонного уровня.
[0025] Эти способы диагностики также могут включать стадию введения антагониста VEGF пациенту, если идентифицируют, что он страдает ангиогенным нарушением. Антагонист VEGF может представлять собой, например, антитело против VEGF, такое как, например, бевацизумаб.
[0026] Изобретение также относится к наборам для определения, может ли являться эффективным лечение антагонист VEGF для пациент, где набор содержит (a) соединения (например, полипептиды или полинуклеотиды (например, праймеры или зонды для ПЦР)), способные определять уровень экспрессии по меньшей мере одного из следующих генов: DLL4, ангиопоэтин 2 (Angpt2), NOS2, фактор V, фактор VIII (AHF), EGFL7, EFNA3, PGF, ANGPTL1, SELP, Cox2, фибронектин (FN_EIIIB), ESM1 и стромальный фактор роста (SDF1), и необязательно (b) инструкции по применению полипептидов или полинуклеотидов для определения уровня экспрессии по меньшей мере одного из DLL4, ангиопоэтина 2 (Angpt2), NOS2, фактора V, фактора VIII (AHF), EGFL7, EFNA3, PGF, ANGPTL1, SELP, Cox2, фибронектина (FN_EIIIB), ESM1 и стромального фактора роста (SDF1), где изменение уровня экспрессии по меньшей мере одного гена относительно эталонного уровня свидетельствует о том, что лечение антагонист VEGF может являться эффективным для пациента. В некоторых вариантах осуществления полипептиды представляют собой антитела.
[0027] Эти и другие варианты осуществления дополнительно описаны путем подробного описания, которое следует ниже.
Краткое описание чертежей
[0028] Фигура 1 представляет собой схематический чертеж, изображающий общий дизайн исследования. Дизайн исследования обеспечивает оценку клинически и молекулярных изменений у пациентов с раком молочной железы на поздней стадии после неоадъювантного лечения на основе бевацизумаба (bev) с последующей химиотерапией с bev или без него.
[0029] Фигура 2 представляет собой схему распределения участников исследования, демонстрирующую распределение случайным образом 90 пациентов в группы лечения bev или плацебо и число пациентов, которые полностью завершили исследование.
[0030] Фигура 3 представляет собой график, демонстрирующий, что экспрессия CD 144 (VE-кадгерин) не изменяется после лечения bev (лечения с низкой дозой bev или с высокой дозой bev).
[0031] Фигура 4 представляет собой график, демонстрирующий, что экспрессия DLL4 (дельта-подобного лиганда 4), нормализованная на CD144, понижается после лечения bev (лечения с низкой дозой bev или с высокой дозой bev).
[0032] Фигура 5 представляет собой график, демонстрирующий, что экспрессия ангиопоэтина 2 (ANGPT2) понижается после лечения bev.
[0033] Фигура 6 представляет собой график, демонстрирующий, что экспрессия фактора V повышается после лечения bev.
[0034] Фигура 7 представляет собой график, демонстрирующий, что экспрессия фактора VIII (AHF) повышается после лечения bev.
[0035] Фигура 8 представляет собой график, демонстрирующий, что экспрессия синтазы оксида азота (NOS2 или индуцируемой NOS (iNOS)) понижается после лечения bev.
Подробное описание предпочтительных вариантов осуществления
I. Введение
[0036] Настоящее изобретение относится к способам и композициям для мониторинга и/или идентификации пациентов, чувствительных или реагирующих на лечение антагонистами VEGF, например, антителами против VEGF. Изобретение основано на открытии, что определение уровней экспрессии по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 генов, перечисленных в таблице 1, до и/или после лечения антагонистом VEGF (таким как антитело против VEGF) является пригодным для идентификации пациентов, чувствительных или реагирующих на лечение антагонистом VEGF, например, антителом против VEGF.
II. Определения
[0037] Термины "биомаркер" и "маркер" используют взаимозаменяемо в настоящем описании для обозначения молекулярного маркера на основе ДНК, РНК, белка, углевода или гликолипида, экспрессию или наличию которого в образце индивидуума или пациента сап можно детектировать стандартными способами (или способами, описываемыми в настоящем описании), и который является пригодным для мониторинга восприимчивости или чувствительности являющегося млекопитающим индивидуума к антагонисту VEGF. Такие биомаркеры включают, но не ограничиваются ими, гены, перечисленные в таблице 1. Экспрессию такого биомаркера можно определять, как являющеюся выше или ниже в образце, получаемом у пациента, чувствительного или реагирующего на антагонист VEGF, по сравнению с эталонным уровнем (включая, например, средний уровень экспрессии биомаркера в образцах у группы/популяции пациентов, тестируемых на восприимчивость к антагонисту VEGF; уровень в образце, ранее полученном у индивидуума в предшествующий момент времени, или уровень в образце у пациента, который получал ранее лечение антагонистом VEGF (таким как антитело против VEGF) при лечении первичной опухоли, и у которого в настоящее время выявляют уровень в образце у пациента, который получал ранее лечение антагонистом VEGF (таким как антитело против VEGF) при лечении первичной опухоли, и у которого в настоящее время выявляют метастазы). Индивидуумы с уровнем экспрессии, который является больше или меньше чем эталонный уровень экспрессии по меньшей мере одного гена, такого как указанные выше гены, можно идентифицировать как индивидуумов/пациентов, которые с большой вероятность реагируют на лечение антагонистом VEGF. Например, такие индивидуумы/пациенты, у которых выявляют уровни экспрессии генов не более 50%, 45%, 40%, 35%, 30%, 25%, 20%, 15%, 10% или 5% относительно (т.е. выше или ниже) эталонного уровня (такого как средний уровень, указанный выше), можно идентифицировать как индивидуумов/пациентов, которые с большой вероятностью реагируют на лечение антагонистом VEGF, таким как антитело против VEGF.
[0038] Термины "образец" и "биологический образец" используют взаимозаменяемо для обозначения любого биологического образца, получаемого от индивидуума, включая жидкости организма, ткани организма (например, опухолевую ткань), клетки или другие источники. Жидкости организма представляют собой, например, лимфу, сыворотку, свежую донорскую кровь, мононуклеарные клетки периферической крови, замороженную цельную кровь, плазму (включая свежую или замороженную), мочу, слюну, семенную жидкость, синовиальную жидкость и цереброспинальную жидкость. Образцы также включаю ткань молочной железы, ткань почки, ткань толстой кишки, ткань головного мозга, мышечную ткань, синовиальную ткань, кожу, волосяную фолликулу, костный мозг и опухолевую ткань. Способы получения биопсий ткани и жидкостей организма у млекопитающих хорошо известны в данной области.
[0039] "Эффективная реакция" пациента или "восприимчивость" или "чувствительность" пациента к лечению антагонистом VEGF относится к клиническому или терапевтическому положительному действию, обеспечиваемому пациенту, подвергающемуся риску или страдающему ангиогенным нарушением, за счет или в результате лечения антагонистом VEGF, таким как антитело против VEGF. Такое положительное действие включает клеточные или биологические ответы, полный ответ, частичный ответ, стабильное заболевание (без прогрессирования или рецидива) или реакцию с поздним рецидивом у пациента за счет или в результате лечения антагонистом. Например, эффективный ответ может представлять собой уменьшенный размер опухоли или выживаемость без прогрессирования заболевания у пациента, у которого диагностировали экспрессию одного или более биомаркеров, указанных выше, способом, описываем в настоящем описании, по сравнению с пациентом, у которого не экспрессируются один или более биомаркеров таким образом. По экспрессии генетического биомаркера(ов) эффективно прогнозируют или прогнозируют с высокой чувствительностью такой эффективный ответ.
[0040] "Антагонисты", как используют в настоящем описании, относятся к соединениям или средствам, которые ингибируют или снижают биологическую активность молекулы, с которой они связываются. Антагонисты включают антитела, пептиды с синтетической или нативной последовательностью, иммуноадгезины, и низкомолекулярные антагонисты, которые связываются с VEGF, необязательно конъюгированные или слитые с другой молекулой. "Блокирующее" антитело или антитело-"антагонист" представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, с которым оно связывается.
[0041] "Антитело-агонист", как используют в настоящем описании, представляет собой антитело, которое частично или полностью имитирует по меньшей мере один вид функциональной активности представляющего интерес полипептида.
[0042] Термин "антитело" в настоящем описании используется в самом широком смысле и конкретно включает моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител и фрагментов антител при условии, что они проявляют желательную биологическую активность.
[0043] "Выделенное" антитело представляет собой антитело, которое идентифицировали и выделили и/или получили из компонента его природного окружения. Загрязняющие компоненты его природного окружения представляют собой вещества, которые препятствуют исследовательским, диагностическим или терапевтическим применениям антитела и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах осуществления антитело очищают (1) до более 95% по массе антитела, как определяют, например, способом Лоури, и в некоторых вариантах осуществления до более 99% по массе; (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием, например, секвенатора с вращающимся стаканом, или (3) до гомогенности посредством SDS-PAGE в восстановительных или невосстановительных условиях использованием, например, красителя Кумасси синего или серебряного. Выделенное антитело включает антитело in situ в рекомбинантных клетках, т.к. не содержится по меньшей мере один компонент природного окружения антитела. Однако, как правило, выделенное антитело получают по меньшей мере посредством одной стадии очистки.
[0044] "Нативные антитела", как правило, представляют собой гетеротетрамерные гликопротеины приблизительно 150000 Дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, при этом число дисульфидных связей изменяется в тяжелых цепях различных изотипах иммуноглобулина. Каждые тяжелые и легкие цепи также содержат расположенные на равном расстоянии внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь содержит на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь содержит вариабельный домен на одном конце (VL) и константный домен на другом конце; константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Полагают, что конкретные аминокислотные остатки образуют область контакта между вариабельными доменами легких и тяжелых цепей.
[0045] "Вариабельная область" или "вариабельный домен" антитела относится к амино-концевым доменам тяжелой или легкой цепи антитела. Вариабельный домен тяжелой цепи может быть обозначен как "VH". Вариабельный домен легкой цепи может быть обозначен как "VL". Эти домены, как правило, представляют собой наиболее вариабельные части антитела и содержат антигенсвязывающие участки.
[0046] Термин "вариабельный" относится к тому факту, что последовательности определенных участков вариабельных доменов в значительной степени отличаются в антителах и используются для связывания и специфичности каждого конкретного антитела для его конкретного антигена. Однако вариабельность не распределяется равномерно на всем протяжении вариабельных доменов антител. Она сосредоточена в трех сегментах, называемых гипервариабельными областями (HVR), в вариабельных доменах легкой цепи и тяжелой цепи. Более высококонсервативные участки вариабельных доменов называются каркасными областями (FR). Каждый из вариабельных доменов нативных тяжелых и легких цепей состоит из четырех областей FR, преимущественно принимая конфигурацию бета-листа, соединенных тремя HVR, которые образуют петли, соединяющие и в некоторых случаях образующие часть структуры бета-листа. HVR в каждой цепи удерживаются вместе в непосредственной близости посредством областей FR, и где HVR из другой цепи способствуют образованию антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, MD (1991)). Константные домены непосредственно не участвуют в связывании антитела с антигеном, но обладают различными эффекторными функциями, такими как участие антитела в антителозависимой клеточной токсичности.
[0047] "Легкие цепи" антител (иммуноглобулины) от любых видов позвоночных можно разделить на один из двух четко отличающихся типов, называемых каппа (κ) и лямбда (λ), в зависимости от аминокислотных последовательностей их константных доменов.
[0048] В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей антитела (иммуноглобулины) можно разделять на различные классы. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно дополнительно разделить на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов называются α, δ, ε, γ и μ соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны и описаны в основном, например, у Abbas et al., Cellular and Mol. Immunology, 4th ed. (W.B. Saunders, Co., 2000). Антитело может представлять собой часть более крупной слитой молекулы, образованной ковалентной или нековалентной ассоциацией антитела с одним или более других белков или пептидов.
[0049] Термины "полноразмерное антитело", "интактное антитело" и "целое антитело" используют в настоящем описании взаимозаменяемо для обозначения антитела в его по существу интактное форме, не принадлежащих к антителу фрагментов, как определяют ниже. В частности, термины обозначают антитело с тяжелыми цепями, которые содержат Fc-область.
[0050] "Голое антитело" для целей настоящего описания представляет собой антитело, которое не конъюгировано с цитотоксической молекулой или радиоактивной меткой.
[0051] "Фрагменты антител" содержат участки интактного антитела, предпочтительно содержащие его антигенсвязывающую область. Примеры фрагментов антител включают Fab, Fab', F(ab')2 и фрагменты Fv, диатела, линейные антитела, молекулы одноцепочечные антител и полиспецифические антитела, образованные фрагментами антител.
[0052] Расщепление папаином антител приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых фрагменты"Fab", каждый из которых содержит один антигенсвязывающий участок, и остаточного фрагмента "Fc", название которого отражает его способность быстро кристаллизоваться. Обработка пепсином приводит к образованию фрагмента F(ab')2, который содержит два антигенсвязывающих участки и все еще является способным перекрестно связываться с антигеном.
[0053] "Fv" представляет собой минимальный фрагмент антитела, который содержит полный антигенсвязывающий участок. В одном из вариантов осуществления двухцепочечная форма Fv состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в тесной нековалентной ассоциации. В одноцепочечной форме Fv (scFv) один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи могут быть ковалентно связаны гибким пептидным линкером, таким образом, что легкие и тяжелые цепи могут ассоциировать с образованием "димерной" структуры, аналогичной структуре в двухцепочечной форме Fv. Именно в этой конфигурации взаимодействуют три HVR каждого вариабельного домена, определяя антигенсвязывающий участок на поверхности димера VH-VL. В совокупности, шесть HVR обеспечивают антигенсвязывающую специфичность антитела. Однако даже один вариабельный домен (или половина Fv, содержащего только три HVR, специфичных к антигену) обладает способностью распознавать и ввязываться с антигеном, однако с более низкой аффинности по равнению полным участком связывания.
[0054] Фрагмент Fab содержит вариабельные домены тяжелой и легкой цепей, а также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких остатков на C-конце тяжелой цепи домена CH1, включая один или более цистеинов из шарнирной области антитела. В настоящем описании Fab'-SH представляет собой обозначение для Fab', в котором остаток(и) цистеина константных доменов несут свободную тиольную группу. Фрагменты F(ab')2 антител исходно получают в виде пары фрагментов Fab', которые содержат шарнирные цистеины между ними. Также известны другие типы химического связывания фрагментов антител.
[0055] "Одноцепочечные Fv" или фрагменты "scFv" антител одержат домены VH и VL антитела, где эти домены содержатся в одной полипептидной цепи. Как правило, полипептид scFv дополнительно содержит полипептидный линкер между доменами VH и VL, который обеспечивает возможность scFv образовывать желаемую структуру для связывания антигена. Для обзора scFv см., например, Pluckthiin, The Pharmacology of Mono-clonal Antibodies, vol. 113, Rosenburg and Moore eds. (Springer-Verlag, New York: 1994), pp 269-315.
[0056] Термин "диатела" относится к фрагментам антител с двумя антигенсвязывающими участками, где фрагменты содержат вариабельный домен (VH) тяжелой цепи, соединенный с вариабельным доменом (VL) легкой цепи в той же самой полипептидной цепи (VH-VL). С использованием линкера, который является слишком коротким, чтобы обеспечивать возможность спаривания между двумя доменами на одной и той же цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и образуют два антигенсвязывающих участка. Диатела могут быть бивалентными или биспецифическими. Более полно диатела описаны, например, в EP 404097, WO 1993/01161, Hudson et al., Nat. Med., 9:129-134 (2003) и Hollinger et al., PNAS USA, 90: 6444-6448 (1993). Триотела и тетратела также описаны у Hudson et al., Nat. Med., 9:129-134 (2003).
[0057] Термин "моноклональное антитело", как используют в настоящем описании, относится к антителу, получаемому из популяции по существу гомогенных антител, т.е. популяции, содержащей отдельные антитела, которые являются идентичными за исключением возможных мутаций, например, природных мутаций, которые могут содержаться в незначительных количествах. Таким образом, определение "моноклональное" указывает на характер антитела, которое не является смесью отдельных антител. В определенных вариантах осуществления такое моноклональное антитело, как правило, включает антитело, содержащее полипептидную последовательность, которая связывается с мишенью, где связывающую мишень полипептидную последовательность получали способом, который включает отбор отдельной связывающей мишень полипептидной последовательности из популяции полипептидных последовательностей. Например, способ отбора может представлять собой отбор уникального клона из популяции клонов, таких как совокупность гибридомных клонов, фаговых клонов или клонов рекомбинантной ДНК. Следует понимать, что выбранную связывающую мишень последовательность можно дополнительно изменять, например, для улучшения аффинности к мишени, для гуманизации связывающей мишень последовательности, для улучшения ее продукции в культуре клеток, для уменьшения ее иммуногенности in vivo, для получения полиспецифического антитела и т.д., и что антитело, содержащее измененную связывающую мишень последовательность, также является моноклональным антителом по настоящему изобретению. В отличие от препаратов поликлональных антител, которые, как правило, содержат различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело препарата моноклональных антител направлено против одной детерминанты на антигене. Наряду с их специфичностью препараты моноклональных антител обеспечивают преимущество, которое заключается в том, что они, как правило, не загрязнены другими иммуноглобулинами.
[0058] Определение "моноклональное" указывает на характер антител, как получаемого по существу из гомогенной популяции антител, и его не следует интерпретировать как предусматривающее получение антитела каким-либо конкретным способом. Например, моноклональные антитела для использования в соответствии с настоящим изобретением, можно получать различными способами, включая, например, гибридомным способом (например, Kohler and Milstein., Nature, 256:495-497 (1975); Hongo et al., Hybridoma 14 (3):253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and Т-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981)), способами рекомбинантных ДНК (см., например, патент США №4816567), способами фагового дисплея (см., например, Clackson et al., Nature, 352:624-628 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1992); Sidhu et al., J. Mol. Biol., 338(2):299-310 (2004); Lee et al., J. Mol. Biol., 340(5):1073-1093 (2004); Fellouse, PNAS USA, 101(34): 12467-12472 (2004), и Lee et al., J. Immunol. Methods, 284(1-2):119-132 (2004), и способами получения антител человека или подобных антителу человека у животных, которые содержат части или все локусы иммуноглобулина человека или гены, кодирующие последовательности иммуноглобулина человека (см., например, WO 1998/24893, WO 1996/34096, WO 1996/33735, WO 1991/10741, Jakobovits et al., PNAS USA, 90:2551 (1993), Jakobovits et al., Nature, 362: 255-258 (1993), Bruggemann et al., Year in Immunol., 7:33 (1993), патенты США №5545807, 5545806, 5569825, 5625126, 5633425 и 5661016; Marks et al., Bio/Technology, 10:779-783 (1992); Lonberg et al., Nature, 368:856-859 (1994); Morrison, Nature, 368:812-813 (1994); Fishwild et al., Nature Biotechnol., 14:845-851 (1996); Neuberger, Nature Biotechnol., 14:826 (1996), и Lonberg and Huszar, Intern. Rev. Immunol., 13:65-93 (1995).
[0059] Моноклональные антитела в настоящем описании конкретно включают "химерные" антитела, в которых участок тяжелой и/или легкой цепи является идентичным или гомологичным соответствующим последовательностям в антителах, получаемых из конкретных видов или принадлежащих к конкретному классу или подклассу антител, при этом оставшаяся часть цепи(ей) является идентичной или гомологичной соответствующим последовательностям в антителе, получаемом из другого вида или принадлежащим к другому классу или подклассу антител, а также фрагменты таких антител при условии, что они проявляют желательную биологическую активность (например, патент США №4816567 и Morrison et al., PNAS USA, 81:6851-6855 (1984)). Химерные антитела включают антитела PRIMATIZED®, где антигенсвязывающую область антитела получают из антитела, получаемого, например, иммунизацией обезьян, являющихся макаками, представляющим интерес антигеном.
[0060] "Гуманизированные" формы не принадлежащих человеку антител (например, мыши) представляют собой химерные антитела, которые содержат минимальную последовательность, получаемую из не принадлежащего человеку иммуноглобулина. В одном из вариантов осуществления гуманизированное антитело представляет собой иммуноглобулин человека (реципиентное антитело), в котором остатки из HVR реципиента заменяют остатками из HVR не являющегося человеком вида (донорного антитела), таким как мышь, крыса, кролик или не являющийся человеком примат, обладающего желаемо специфичностью, аффинностью и/или емкостью. В некоторых случаях остатки FR иммуноглобулина человека заменяют соответствующими не принадлежащими человеку остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются в реципиентном антителе или в донорном антителе. Такие модификации можно проводить для дополнительного улучшения характеристик антитела. Как правило, гуманизированное антитело содержит по существу все по меньшей мере из одного и как правило двух вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют гипервариабельным петлям не принадлежащего человеку иммуноглобулина, и все или по существу все FR представляет собой FR последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также содержит по меньшей мере у