Ингибитор вируса гепатита в (вгв)
Иллюстрации
Показать всеНастоящее изобретение относится к новым ингибиторам вируса гепатита В (ВГВ, HBV) в качестве химиотерапевтических средств для лечения ВГВ. Эти соединения связываются с кор-антигеном ВГВ и вызывают формирование аберрантных вирусных капсид, не несущих вирусный геном, что приводит к образованию и секреции дефектных (невирулентных) вирусных частиц. Согласно изобретению ингибитор ВГВ представляет собой соединение общей формулы 1, 1.3 и 2
,
где R представляет собой водород или метил; n=1, 2 или 3,
Соединение формулы 2 является новым. Способ получения соединений 1, 2 и 1.3 заключается в ацилировании 3-хлоранилина (Е1) или 4-метокси-3-хлоранилина соответственно 1-метил-4-сульфамоил-1Н-пиррол-2-карбоновой кислотой общей формулы Е2 или 3-циклопентилсульфамоил-4-фтор-бензойной кислотой Е3
8 н. и 5 з.п. ф-лы, 6 табл., 8 пр.
Реферат
Настоящее изобретение относится к ингибиторам вируса гепатита В (ВГВ, HBV) в качестве химиотерапевтических средств для лечения ВГВ.
Гепатит В - это инфекционное воспалительное заболевание печени, возникающее вследствие внедрения в организм ВГВ и представляющее серьезную глобальную проблему здравоохранения. Он может вызывать как острые, так и хронические заболевания и подвергать людей высокому риску смерти от цирроза и рака печени.
По оценкам ВОЗ, 257 миллионов человек живут с инфекцией ВГВ. В 2015 году у пациентов, инфицированных ВГВ, было 887000 случаев смерти, в основном из-за осложнений (включая цирроз и гепатоцеллюлярную карциному). Гепатит В является важной профессиональной опасностью для медицинских работников. Тем не менее, это может быть предотвращено в настоящее время доступной, безопасной и эффективной вакциной. Вакцина против гепатита В доступна с 1982 года. Вакцина эффективна на 95% для профилактики инфекции и развития хронических заболеваний и рака печени из-за гепатита В.
Распространенность ВГВ наиболее высока в Регионе Западной части Тихого океана и Африканском регионе ВОЗ, где инфицировано соответственно 6,2% и 6,1% взрослого населения. В Регионе Восточного Средиземноморья ВОЗ, регионе Юго-Восточной Азии ВОЗ и Европейском регионе ВОЗ, соответственно, инфицировано 3,3%, 2,0% и 1,6% населения в целом. В регионе Америки инфицировано 0,7% населения [http://www.who.int/mediacentre/factsheets/fs204/en/]. Число инфицированных в России по разным оценкам достигает от 3 до 6 млн. человек. Заболеваемость хроническими формами гепатита В, в целом по населению, находится на уровне 13-14 на 100 тыс. населения Российской Федерации [http://58.rospotrebnadzor.ru/].
ВГВ уникален среди патогенных вирусов человека, относится к гепаднавирусам - ДНК-содержащим гепатотропным вирусам. ВГВ имеет сферическую форму, диаметр 42 нм, сложную структуру. В центре нуклеокапсида, состоящего из 90 димеров белка кор-антигена (HBcAg), расположен геном вируса, представленный частично двух цепочечной кольцевой ДНК, и фермент ДНК-полимераза. Наружная липопротеиновая оболочка содержит поверхностный антиген HBsAg (австралийский антиген), который имеет 4 подтипа, обладающих антигенными различиями. Существуют и мутантные штаммы вируса по антигенам HBsAg и HbeAg. Процесс репликации вируса сложен, возможно образование полноценных вирусов и дефектных, состоящих из HBsAg-частиц, которые не имеют инфекционных свойств. В последние годы открыты новые антигены ВГВ, однако роль их неясна. HBeAg и HBsAg циркулируют в крови, HBcAg обнаруживается только в ткани печени, антитела образуются ко всем основным антигенам - анти-НВс, анти-НВе и анти-HBs. ВГВ отличается исключительно высокой устойчивостью в окружающей среде. При 100°С погибает через 30 мин, в холодильнике сохраняется до года, в замороженном состоянии - 20 лет, в сухой плазме - 25 лет. Раствор 1-2% хлорамина инактивирует вирус через 2 ч, а 1,5% раствор формалина - через 7 сут. При автоклавировании при 120°С вирус гибнет через 5 мин [http://medbe.ru].
Несмотря на наличие эффективной профилактической вакцины против ВГВ, бремя хронической инфекции ВГВ по-прежнему является серьезной неудовлетворенной мировой медицинской проблемой из-за субоптимальных вариантов лечения и устойчивых темпов новых инфекций в большинстве районов развивающегося мира. Современные методы лечения ограничиваются только двумя классами агентов (интерфероном и нуклеозидными аналогами - ингибиторами вирусной полимеразы). Лекарственная устойчивость, низкая эффективность и проблемы переносимости ограничивают их воздействие. Низкие скорости излечения ВГВ объясняются, по меньшей мере, частично присутствием и стойкостью ковалентно замкнутой кольцевой ДНК (cccDNA) в ядре инфицированных гепатоцитов. Однако стойкое подавление ДНК ВГВ замедляет прогрессирование заболевания печени и помогает предотвратить гепатоцеллюлярную карциному. Текущие цели терапии для ВГВ-инфицированных пациентов направлены на снижение сывороточной ДНК ВГВ до низкого или неопределяемого уровня и, в конечном счете, снижение или предотвращение развития цирроза и гепатоцеллюлярной карциномы.
У большинства людей лечение не излечивает инфекцию ВГВ, а только подавляет репликацию вируса. Поэтому большинство людей, которые начинают лечение ВГВ, должны продолжать его всю жизнь [http://www.who.int/mediacentre/factsheets/fs204/en/].
В этой связи в терапии ВГВ существует потребность в новых терапевтических агентах, которые лечат, улучшают или предотвращают ВГВ-инфекцию. Введение этих терапевтических агентов инфицированному ВГВ пациенту либо в виде монотерапии, либо в сочетании с другими анти-ВГВ препаратами или вспомогательными методами приведет к значительному улучшению прогноза, уменьшению прогрессирования заболевания и его излечения.
Вирусные капсиды ВГВ, состоящие из молекул кор-антигена, играют существенную роль в жизненном цикле ВГВ. Капсиды ВГВ защищают вирусный геном при его передаче между клетками, а также играют центральную роль в процессе вирусной репликации, включая инкапсидацию и репликацию вирусного генома, образование и секрецию вирусных частиц. Вирусные капсиды также реагируют на изменение внешних условий при попадании в клетку, и обеспечивают освобождение вирусного генома от вирусных белков оболочки. Было показано, что правильная сборка вирусных капсид необходима для вирулентности вирусных частиц.
Важные функции кор-антигена накладывают существенные эволюционные ограничения на его первичную структуру, что приводит к низкой вариабельности последней. В соответствии с этим, мутации в гене кор-антигена, нарушающие его самосборку в вирусные капсиды, приводят к полной или частичной потере жизнеспособности вируса. Чем меньше вариабельности наблюдается в молекулярной мишени лекарственного препарата, тем менее вероятно появление в клинике жизнеспособных мутантов вируса, резистентных к препарату. Действительно, спонтанные мутации в гене кор-антигена наблюдаются только в 4 из 183 кодонов. Таким образом, ингибиторы кор-антигена могут обладать меньшей вероятностью развития резистентности по сравнению с применяемыми в настоящее время препаратами. Далее, терапия, направленная на ингибирование кор-антигена возможно будет менее подвержена развитию резистентности по сравнению с традиционной терапией, направленной на ингибирование активных центров ферментов. Описанные ранее антивирусные препараты для ВИЧ, риновирусов и ВГВ, связывающиеся с вирусными капсидами и ингибирующие их функции, являются фармакологическим доказательством того, что вирусный кор-антиген является перспективной молекулярной мишенью для разработки антивирусных препаратов.
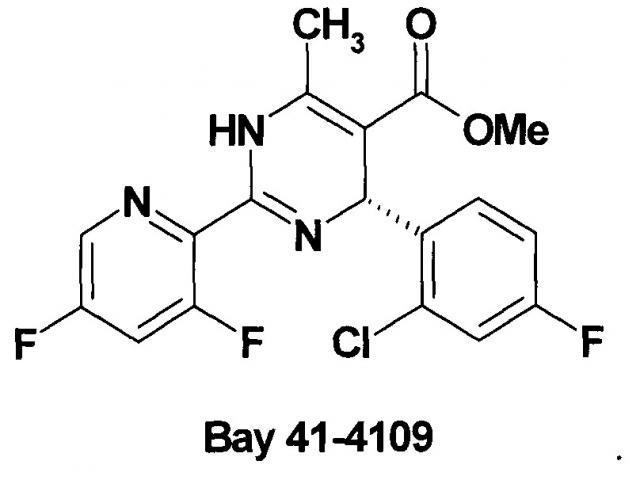
Одним из первых достаточно эффективных ингибиторов кор-антигена ВГВ ин витро является гетероарилдигидропиримидин BAY 41-4109. Противовирусная активность BAY 41-4109 на клетках HepG2.2.15, конститутивно экспрессирующие ВГВ, показали IC50 около 202 нМ без клеточной токсичности [N. Brezillon at al. Antiviral activity of Bay 41-4109 on hepatitis В virus in humanized Alb-uPA/SCID mice. PLoS One. 2011; 6(12): e25096. doi:10.1371/journal.pone.0025096. Epub 2011 Dec 5.].
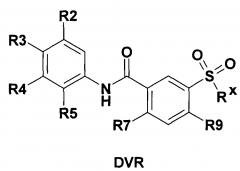
Сравнительно недавно была предложена фармацевтическая композиция [Patent ЕР 3085368, prior. 01.07.2011], включающая по меньшей мере одно соединение общей формулы DVR
где:
R2 представляет собой заместитель выбранный из группы, включающей Н, СН3, CF3, F и О;
R3 представляет собой заместитель выбранный из группы, включающей Н, СН3, F и Cl;
R4 представляет собой заместитель выбранный из группы, включающей Н, СН3, F и Cl;
R5 представляет собой заместитель выбранный из группы, включающей Н и Cl; R7 представляет собой заместитель выбранный из группы, включающей Н, Cl, F и Br;
R9 представляет собой заместитель выбранный из группы, включающей Н, СН3, F и Cl;
Rx представляет собой заместитель выбранный из группы, включающей фрагменты первичных и вторичных аминов, азепан-1-ил, пиперидин-1-ил, морфолин-4-ил и тиоморфолин-4-ил.
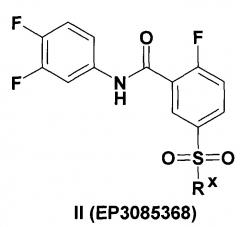
Наиболее активные соединения в ЕР 3085368 являются N-(3,4-дифторфенил)-2-фтор-5-сульфамоил-бензамиды (II) представленные в табл. 7 на страницах 37 и 38 ЕР 3085368, в которых Rx = втор-бутиламино, циклопентиламино, циклогептиламино: ЕС50 = 0.39 мМ, СС50 > 50 мМ в клеточной линии AML 12HBV10.
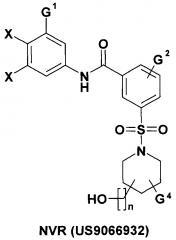
Недавно был предложен также способ лечения инфекции ВГВ у нуждающихся в ней индивидуумов, включающий введение индивидууму терапевтически эффективного количества сульфамоилбензамида (СБА) общей формулы NVR [US 9066932, prior. 21.12.2011]. Эти СБА являются ингибиторов кор-антигена ВГВ. В патенте представлены многочисленные соединения, соответствующие общей формуле NVR, для которых отсутствуют данные по их активности. В таблицах 1-3 представлены соединения общей формулы NVR, для которых приведена «активность» по отношению к ВГВ более 50% при их концентрации 10 мМ. Это значит, что активность соединения общей формулы NVR имеет значение ЕС50 < 10 мМ (точные значения IC50 для отдельных соединений в патенте не приводится).
где: X и G1 представляют собой галоген, G2 представляют собой С1-С4 алкил или галоген, G4 представляют собой С1-С4 алкил, галоген или ОН.
Опубликована также патентная заявка WO 2014033170 (prior. 28.08.2012) в которой заявляются новые соединения общей формулы А1 и фармацевтические композиции, включающие эти соединения
где В - представляет собой 5-ти или 6-ти членный ароматический цикл, необязательно содержащий один или несколько гетероатомов, каждый из которых независимо выбран из группы, состоящей из О, S и N, и необязательно замещенный одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из водорода, галогена, С1-С3 алкила, CN, CFH2, CF2H и CF3;
R1 представляет собой водород или С1-С3 алкил;
R2 представляет собой С1-С6 алкил, С1-С3 алкил, бензил, С(=O)-R5, CFH2, CF2H, CF3 или 3-7-членное насыщенное кольцо, необязательно содержащее один или несколько гетероатомов, каждый из которых независимо выбран из группы, О, S и N, такое 3-7-членное насыщенное кольцо или С1-алкалкил, необязательно замещенный одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из водорода, галогена, С1-С4-алкилокси, оксо, С(=О)-С1-С3 алкил, С1-С4-алкил, ОН, CN, CFH2, CF2H и CF3;
или R1 и R2 вместе с азотом, к которому они присоединены, образуют фрагмент 1,4-диокса-8-азаспиро[4,5] или 5-7-членное насыщенное кольцо, необязательно содержащее один или несколько дополнительных гетероатомов, каждый из которых независимо выбран из группы, состоящей из О, S и N, такое 5-7-членное насыщенное кольцо необязательно замещено одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из водорода, галогена, С1-С4 алкилокси, оксо, С(=О)-С1-С3-алкила, С1-С4алкила, ОН, CN, CFH2, CF2, Н и CF3.
В этом ряду соединений имеется значительное число ингибиторов с наномолярной активностью ЕС50 < 300 nM в клеточной линии HepG2.2.15. В заявке WO 2014033170 максимальную активность с ЕС50 < 100 nM показали соединения 85 (ЕС50 = 50 nM), 93 (ЕС50 = 70 nM), 99 (ЕС50 = 90 nM), 183 (ЕС50 = 80 nM), 201 (ЕС50 = 60 nM) и 222 (ЕС50 = 50 nM),
Позже был опубликован скрининг библиотеки, состоящей из 26 900 малых молекул, который привел к открытию ряда СБА, соответствующих общей формуле NVR, которые значительно уменьшали количество внутриклеточной ДНК HBV. Наиболее активными СБА оказались соединения DVR-23, DVR-43 и DVR-56, которые проявили суб- или низкомикромолярную активность как в клетках AML12HBV10, так и в HepDES19 (Таблица 1). Все три соединения DVR-23, DVR-43 и DVR-56 имеют общие структурные особенности, включают в определенных положениях три атома фтора и алкилсульфамидный фрагмент. Авторы данной работы считают, что это наилучшая комбинация заместителей для оптимальной активности. [М.R. Campagna, F. Liu, R. Мао, С. Mills, D. Cai, F. Guo, X. Zhao, H. Ye, A. Cuconati, H. Guo, J. Chang, X. Xu, Т.M. Block and J.T. Guo, J. Virol., 2013, 87, 6931-6942.].
Дальнейшая оптимизация структуры ингибиторов кор-антигена ВГВ в ряду СБА привела к соединению NVR 3-778, структура которого до настоящего времени полностью не раскрыта.
Ингибитор NVR 3-778 имеет ЕС50 = 0,24 мМ в клетках HepG2.2.15 [E.J. Ganel at al. Phase 1a Safety and Pharmacokinetics of NVR 3-778, a Potential First-In-Class HBV Core Inhibitor, https://noviratherapeutics.com/wp-content/uploads/2014/11/Novira_2014_AASLD_poster_LB-19.pdf]. Результаты международного исследовании фазы 1b (64 пациента, ранее не получавших никакого лечения гепатитом В; шесть когорт: 100 мг, 200 мг, 400 мг ежедневно, 600 мг два раза в день и 600 мг два раза в день в сочетании С пегилированным интерфероном) показали, что NVR 3-778 эффективен при лечении ВГВ и хорошо переносится [M-F Yuen et al. Phase lb Efficacy and Safety of NVR 3-778, a First-In-Class HBV Core Inhibitor, in HBeAg-Positive Patients with Chronic HBV Infection, [http://www.natap.org/2016/EASL/EASL_91.htm].
Несмотря на достигнутые результаты по разработке ингибиторов кор-антигена ВГВ, остается актуальным расширение ассортимента ингибиторов ВГВ для терапии ВГВ, в частности, с более высокой активностью. Введение этих терапевтических агентов инфицированному ВГВ пациенту либо в виде монотерапии, либо в сочетании с другими анти-ВГВ препаратами или вспомогательными методами приведет к значительному уменьшению прогрессирования этого заболевания и его излечению.
Предметом данного изобретения являются новые ингибиторы ВГВ для лечения и профилактики инфекций ВГВ человека. Заявляемые ингибиторы обладают высокой антивирусной активностью ин витро, благоприятным метаболическим профилем, распределением по тканям, безопасностью и другими привлекательными фармацевтическими свойствами, и пригодны для применения в клинике.
Ниже приведены определения различных терминов, используемых для описания данного изобретения. Эти определения применимы к терминам, как они использованы в данном описании и формуле изобретения, если иным не ограничены в конкретных случаях либо по отдельности, либо как часть большей группы.
Термин «алкил», используемый здесь, относится к насыщенным с линейной или разветвленной цепью углеводородным радикалам, содержащим от одного до шести атомов углерода. Примеры алкильных радикалов С1-С6, включают, но не ограничиваются ими, метил, этил, пропил, изопропил, н-бутил и трет-бутил.
Термин «циклоалкил» означает моновалентную насыщенную карбоциклическую группу, которая может быть моноциклической или мультициклической. Репрезентативные циклоалкильные группы включают в себя, в качестве примеров, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и пр.
Термин «необязательно замешенный» означает, что упомянутая группа может быть замещена в одном или более положениях любым одним или любой комбинацией радикалов.
Термин «кристаллическая форма» означает структуру вещества, характеризующуюся упаковкой образующих ее молекул в один из видов кристаллической решетки.
Термин «поликристаллическая форма» означает структуру вещества, имеющую поликристаллическое строение, т.е. состоящую из множества мелких монокристаллов, т.е. кристаллитов определенной кристаллической формы.
Термин «активный компонент» (лекарственное вещество) относится к физиологически активному веществу синтетического или иного (биотехнологического, растительного, животного, бактериального и так далее) происхождения, обладающему фармакологической активностью, которое является активным ингредиентом фармацевтической композиции.
Термин «лекарственный препарат» означает вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и др. готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
Термин «терапевтический коктейль» представляет одновременно администрируемую комбинацию двух и более лекарственных препаратов, обладающих различным механизмом фармакологического действия, и направленных на различные биомишени, участвующие в патогенезе заболевания.
Термин «фармацевтическая композиция» обозначает композицию, включающую в себя активное соединение (субстанцию) и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного компонента, одного или в комбинации с другим активным компонентом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
Термин «инертный наполнитель», используемый в данном описании, относится к соединению, которое используют для получения фармацевтической композиции, и, как правило, безопасному, нетоксичному и ни биологически, ни иным образом нежелательному, и включает в себя вспомогательные вещества, которые являются приемлемыми для применения в ветеринарии, а также фармакологически приемлемыми для человеческого использования. Соединения по данному изобретению могут быть введены отдельно, но обычно их будут вводить в смеси с одним или более фармацевтически приемлемыми эксципиентами, разбавителями или носителями, выбранными с учетом предполагаемого пути введения и стандартно фармацевтической практики.
Термин «терапевтически эффективное количество», используемый здесь, означает количество субстанции, пролекарства или лекарства, необходимое для уменьшения симптомов заболевания у субъекта. Доза субстанции, пролекарства или лекарства будет соответствовать индивидуальным требованиям в каждом конкретном случае. Эта доза может варьироваться в широких пределах в зависимости от многочисленных факторов, таких как тяжесть заболевания, подлежащего лечению, возраста и общего состояния здоровья пациента, других лекарственных средств, с помощью которых пациент проходит лечение, способа и формы введения и опыта лечащего врача. Для перорального введения суточная доза составляет приблизительно от 0,01 до 10 г, включая все значения между ними, в день в монотерапии и/или в комбинированной терапии. Предпочтительная суточная доза составляет примерно от 0,1 до 7 г в день. Как правило, лечение начинают с большой начальной «нагрузочной дозы», чтобы быстро уменьшить или устранить вирус, сопровождающей убывающую дозу до уровня,, достаточного для предотвращения всплеска инфекции.
Термин «субъект» означает млекопитающее, которое включает, но не ограничивается ими, крупный рогатый скот, свиней, овец, кур, индеек, буйволов, лам, страусов, собак, кошек и человека, предпочтительно субъектом является человек.
Термин «фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или приготовлены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные (Подробное описание свойств таких солей дано в Berge S.M., et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкил аммония, например, такие как, холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин, орнитин и аргинин.
Предметом данного изобретения являются новый ингибитор ВГВ, представляющий собой 1-метил-4-сульфамоил-1Н-пиррол-2-(3-хлорфенил)карбоксамид общей формулы 1 или N-(3-хлорфенил)-5-циклопентилсулфамоил-2-фторобензамид формулы 2, его изотопно-обогащенный аналог, фармацевтически приемлемую соль, гидрат, сольват, кристаллическую или поликристаллическую форму,
где R представляет собой водород или метил; n=1, 2 или 3.
Предпочтительными ингибиторами общей формулы 1 являются 4-(пирролидин-1-сульфонил)-1-метил-1Н-пиррол-2-(3-хлорфенил)карбоксамид (1.1), 1-метил-4-(3-метилпиперидин-1-сульфонил)-1Н-пиррол-2-(3-хлорфенил)карбоксамид (1.2), 1-метил-4-(3-метилпиперидин-1-сульфонил)-1Н-пиррол-2-(3-хлор-4-метоксифенил)-карбоксамид (1.3) и 4-(азепан-1-сульфонил)-1-метил-1Н-пиррол-2-(3-хлорфенил)карбоксамид (1.4), их изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты, кристаллические и поликристаллические формы.
Неожиданно новые ингибиторы общей формулы 1 и формулы 2 имеют сравнимую или более высокую активность, чем известные аналоги (таблица 2). В ряду новых ингибиторов соединение формулы 2 является рекордсменом по активности (ЕС50 = 0,042 цМ) в сравнении с наиболее активными известными ингибиторами ВГВ.
Неожиданный результат состоит также в том, что ближайшие по структуре известные соединения DVR-63 и DVR-83 по патенту ЕР 3085368 и ингибиторы 43 и 62 по патентной заявке WO 2014033170 являются микромолярными ингибиторами (Таблица 3) и уступают по активности новым ингибиторам (Таблица 2) на 1-2 порядка.
Новые ингибиторы общей формулы 1 и формулы 2, оказались также более активными чем ингибиторы DVR-23, DVR-43 и DVR-56 (Таблица 1), имеющие до настоящего изобретения наилучшую комбинацию заместителей (включающую 3,4-дифторфанилиновый фрагмент) для оптимальной активности [М.R. Campagna, F. Liu, R. Мао, С. Mills, D. Cai, F. Guo, X. Zhao, H. Ye, A. Cuconati, H. Guo, J. Chang, X. Xu, Т.M. Block and J.T. Guo, J. Virol., 2013, 87, 6931-6942.], и более активны, чем ингибитор NVR 3-778 [E.J. Ganel at al. Phase la Safety and Pharmacokinetics of NVR 3-778, a Potential First-In-Class HBV Core Inhibitor, https://noviratherapeutics.com/wp-content/uploads/2014/11/ Novira_2014_AASLD_ poster_LB-19.pdf].
Предметом данного изобретения являются фармацевтическая композиция, в форме таблетки, желатиновой капсулы, пилюли, порошка, гранулы или жевательной резинки для комбинированной терапии гепатита В, содержащая в терапевтически эффективном количестве ингибитор общей формулы 1 или формулы 2, в том числе выбранный из ингибиторов ВГВ формулы 1.1, 1.2, 1.3 или 1.4, и необязательно вспомогательные вещества.
Противовирусная комбинаторная терапия, в то числе ВГВ, в последние годы успешно развивается и заключается в использовании комбинации препаратов ВГВ с разным механизмом действия. В частности в случае вируса гепатита В используют или предполагаются к использованию нуклеозидные ингибиторы ДНК-полимеразы ВГВ, сходной с обратной транскриптазой ВИЧ (NRTI).
В качестве NRTI используют Ламивудин формулы 4а [https://www.gsksource.com/pharma/content/dam/GlaxoSmithKline/US/en/Prescribing_Information/Epivir-HBV/pdf/EPIVIR-HBV-PI-PIL.PDF]. Фторзамещенный Ламивудин, известный как Эмтрицитабин (Brand Name: Emtriva) формулы 4b [https://www.ncbi.nlm.nih.gov/pubmed/ 16323102], в настоящее время используется в комбинированной терапии ВИЧ [https://en.wikipedia.org/wiki/Emtricitabine], но еще не одобрен в качестве препарата для лечения ВГВ [https://aidsinfo.nih.gov/drugs/208/emtricitabine/0/patient]
Недавно были получены новые NRTI, представляющие собой фосфорамидатные производные Ламивудина и Эмтрицибина формулы 4с-l, обладающие противо-ВГВ активностью и представляющие интерес для комбинаторной терапии ВГВ [Pat. Appl. US 15221613 (2016). Пат. заявка RU 2017/106611 (2017)]
4: R=i-Pr (2c,h), CH2=CHCH2 (2d,i), CH3OCH2CH2 (2e,j), циклобутил (2f, k), i-PrOC(O)C(S)H(CH3)(2g,l). C(S) - хиральный атом углерода.
В качестве NRTI используют Тенофовир дизопроксил фумарат (Viread®) формулы 5 [https://www.accessdata.fda.gov/drugsatfda_docs/label/2012/022577lbl.pdf] и Тенофовир алафенамид полуфумарат (TAF, Vemlidy®) формулы 6а [https://www.gilead.com/~/media/files/pdfs/medicines/liver-disease/vemlidy/vemlidy_pi.pdf?la=en].
Недавно были получены новые NRTI, представляющие собой фосфорамидатные производные Тенофовира формулы 6b-r, обладающие противо-ВГВ активностью (Таблица 4) и представляющие интерес для комбинаторной терапии ВГВ [Pat. Appl. US 15221613 (2016). Пат. заявки RU 2017/106609 (2017); RU 2017/106610 (2017); RU 2017/106611 (2017); RU 2017/106615 (2017)].
X=HO2CCH=CHCO2H, n=1 : R=СН2=СНСН2 (6b,j), СН3ОСН2СН2 (6с,k), циклобутил (6d,I), i-PrOC(O)C(S)H(CH3)(6e,m).
X=HO2CCH=CHCO2H,; n=0,5 : R=CH2=CHCH2 (6f, n), циклобутил (6g,o).
X=HCl, n=1 : R=i-Pr (6h,p), циклобутил, (6i,r).
Предметом данного изобретения является комбинированный лекарственный препарат в форме таблетки, желатиновой капсулы, пилюли, порошка, гранулы или жевательной резинки для комбинированной терапии гепатита В, содержащий в терапевтически эффективном количестве ингибитор общей формулы 1.1, 1.2, 1.3, 1.4 или формулы 2, NRTI и необязательно вспомогательные вещества.
Лучшие результаты достигаются, если в качестве NRTI используют соединение, выбранное из ряда 4а-l, 5 и 6а-r.
Более предпочтительным NRTI является Ламивудин формулы 4а и его производное формулы 4c-g, более предпочтительным NRTI является замещенный Тенофовир формулы 6j, g-r.
Предметом данного изобретения является способ лечения субъекта, инфицированного ВГВ, включающий введение субъекту терапевтически эффективной дозы фапмацевтической крмпозиции в форме таблетки, желатиновой капсулы, пилюли, порошка, гранулы или жевательной резинки, содержащего ингибитор кор-антигена ВГВ общей формулы 1.1, 1.2, 1.3, 1.4 или формулы 2 и необязательно вспомогательные вещества.
Предметом данного изобретения является также способ лечения субъекта, инфицированного ВГВ, включающий введение субъекту терапевтически эффективной дозы комбинированной фармацевтической композиции в форме таблетки, желатиновой капсулы, пилюли, порошка, гранулы или жевательной резинки, содержащей ингибитор кор-антигена ВГВ общей формулы 1 или 1.1 или 1.2, в том числе выбранный из ингибиторов кор-антигена ВГВ формулы 1.1, 1.2, 1.3, 1.4 или формулы 2, NRTI и необязательно вспомогательные вещества.
Предпочтительным вариантом является способ с использованием комбинированной фармацевтической композиции, включающей в качестве NRTI соединение выбранное из соединений формул 4а-l 3, 6а-r и необязательно вспомогательные вещества.
Более предпочтительным вариантом является способ с использованием комбинированного лекарственного препарата, включающего в качестве предшественника NRTI Ламивудин формулы 2а или его производное формулы 2c-g, замещенный Тенофовир формулы 4j, g-r и необязательно вспомогательные вещества.
Предметом данного изобретения является способ производства лекарственного препарата для комбинированной терапии гепатита В, смешиванием терапевтически эффективного количества ингибитора ВГВ общей формулы 1 или формулы 2 и вспомогательных веществ с последующей переработкой полученной смеси в таблетки, желатиновые капсулы, пилюли, порошки, гранулы или жевательные резинки.
Предметом данного изобретения является также способ производства комбинированного лекарственного препарата для лечения гепатита В, смешиванием терапевтически эффективного количества ингибитора кор-антигена ВГВ общей формулы 1 или формулы 2, NRTI и вспомогательных веществ с последующей переработкой полученной смеси в таблетки, желатиновые капсулы, пилюли, порошки, гранулы или жевательные резинки.
Предметом данного изобретения является способ ингибирования кор-антигена ВГВ, включающий введение в клетку соединения общей формулы 1 или формулы 2, его изотопно-обогащенного аналога, фармацевтически приемлемой соли, гидрата, сольвата, кристаллической и поликристаллической формы.
Предметом данного изобретения является также способ ингибирования ВГВ, включающий введение в клетку соединения общей формулы 1 или формулы 2, его изотопно-обогащенного аналога, фармацевтически приемлемой соли, гидрата, сольвата, кристаллической и поликристаллической формы, и NRTI.
Новые ингибиторы представляют собой соединения, структурные формулы которых известны. Однако в научной и патентной литературе отсутствуют данные об способе их получения, физико-химических, спектральных свойствах, а также об их биологической активности.
Поэтому предметом данного изобретения является также способ получения соединений общей формулы 1 и формулы 2, их изотопно-обогащенных аналогов, фармацевтически приемлемых солей, гидратов, сольватов, кристаллических и поликристаллических форм.
Способ получения соединений общей формулы 1 или формулы 2, включающий ацилирование 3-хлоранилина (Е1) соответственно 1-метил-4-сульфамоил-1Н-пиррол-2-карбоновой кислотой общей формулы Е2 или 3-циклопентилсульфамоил-4-фтор-бензойной кислотой Е3.
Е2: R и n имеют вышеуказанное значение.
Настоящее изобретение далее будет описано в связи с определенными вариантами осуществления, которые не предназначены для ограничения его объема. Напротив, настоящее изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем формулы изобретения. Таким образом, следующие примеры, которые включают в себя конкретные варианты, иллюстрируют, но не ограничивают настоящее изобретение.
Пример 1. Синтез 4-(пирролидин-1-сульфонил)-1-метил-1Н-пиррол-2-(3-хлорфенил)карбоксамид (1.1), 1-метил-4-(3-метилпиперидин-1-сульфонил)-1Н-пиррол-2-(3-хлорфенил)карбоксамид (1.2), 1-метил-4-(3-метилпиперидин-1-сульфонил)-1Н-пиррол-2-(3-хлор-4-метоксифенил)-карбоксамид (1.3) и 4-(азепан-1-сульфонил)-1-метил-1Н-пиррол-2-(3-хлорфенил)карбоксамид (1,4). Синтез сульфамоилпирролкарбоксамидов 1.1, 1.2, 1.3 и 1.4 осуществляли по схеме 1.
Схеме 1. Схема синтеза сульфамоилпирролкарбоксамидов 1.2(1), 1.2(2) и 1.2(5).
В трехгорлую круглодонную колбу, снабженную герметичной механической мешалкой, капельной воронкой и эффективным обратным холодильником, загружают раствор 1 моль трихлорацетилхлорида в 200 мл безводного эфира. К полученному раствору прибавляют при перемешивании по каплям в течение 3 ч раствор 0,94 моль свежеперегнанного 1-метил-1Н-пиррола (Е10) в 640 мл безводного эфира. Реакционную массу дополнительно перемешивают 1 ч, а затем медленно добавляют раствор 100 г (0,72 моль) карбоната калия в 300 мл воды. Органический слой отделяют и сушат над сульфатом магния, обрабатывают 6 г норита и фильтруют. Растворитель удаляют на паровой бане, а остаток растворяют в 225 мл гексана. Полученный темный раствор кристаллизовали при охлаждении льдом и перекристаллизовывали из гексана. Получали 2,2,2-трихлор-1-(1-метил-1Р-пиррол-2-ил)этанон (E11) с выходом 60%. Растворяют 2,5 г (0,04 моль) натрия в 300 мл безводного этаноле. К полученному раствору постепенно добавляют 0,3 моль соединения E11. Полученный раствор перемешивают в 4 ч, затем упаривают в вакууме досуха. Маслянистый остаток распределяли при перемешивании между 200 мл эфира и 25 мл 3N HCl. Эфирный слой отделяли, а водный промывали 100 мл эфира. Эфирные растворы объединяли, промывали 25 мл насыщенного водного раствора бикарбоната натрия, сушили над сульфатом магния и концентрировали. Полученный сырой продукт очищали колоночной хроматографией на силикагеле. Получали этил 1-метил-1Н-пиррол-2-карбоксилат (Е12) с выходом 45-50% в виде вязкого масла.
Добавляют в течение 30 мин к 64 мл (0,96 моль) хлорсульфоновой кислоты при интенсивном перемешивании и при 10°С 20 г (0,16 моль) соединения Е12. Реакционную смесь перемешивали при 20°С в течение 4 ч и выливали после охлаждения на 300 г льда. Осадок соединения отфил