Способ предсказания терапевтической эффективности ингибитора pi3k/akt/mtor на основании экспрессии phlda1 или pik3c2b
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к оценке терапевтической эффективности химиотерапии с использованием противоопухолевого средства, и может быть использовано в медицине. Изобретение позволяет предсказывать терапевтическую эффективность химиотерапии с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTORна основе имидазо-оксазина, у пациента, страдающего раком, на основании уровня экспрессии PHLDA1 и/или PIK3C2B в выделенном от пациента биологическом образце. 2 н. и 3 з.п. ф-лы, 4 ил., 3 пр.
Реферат
Область техники
[0001]
Перекрестная ссылка на родственную заявку
По настоящему изобретению испрашивается приоритет заявки на патент Японии 2013-129591, поданной 20 июня 2013, содержание которой полностью включено путем ссылки.
Область техники
Настоящее изобретение относится к способу предсказания терапевтической эффективности химиотерапии с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, к противоопухолевому средству и к набору.
Уровень техники
[0002]
Сигнальный путь PI3K/AKT/mTOR регулирует различные важные функции клеток, такие как пролиферация клеток, устойчивость к апоптозу и метаболизм углеводов. Известно, что этот путь является гиперактивным в широком диапазоне злокачественных опухолей (Непатентная литература 1). Клинические испытания проводили на многих ингибиторах PI3K/AKT/mTOR, используемых в качестве противоопухолевых средств (например, ингибитор PI3K, ингибитор AKT, ингибитор mTOR или двойной ингибитор PI3K-mTOR). Однако, особенно в клинических испытаниях с использованием PI3K или AKT-нацеливаемого ингибитора в качестве единственного лекарственного средства, ни один из них пока не продемонстрировал удовлетворительные клинические результаты (Непатентная литература 2).
[0003]
Молекулярно нацеленные лекарственные средства, такие как ингибиторы PI3K/AKT/mTOR, могут обычно показывать высокий потенциал на опухолевых клетках, в которых молекулы-мишени высоко экспрессируются или являются гиперактивными. Таким образом, важно стратифицировать пациентов, используя терапевтически эффективный прогностический маркер для выбора группы пациентов, для которых ожидаются благоприятные воздействия (Непатентная Литература 3). Что касается ингибиторов PI3K/AKT/mTOR, мутация PIK3CA, делеция PTEN и т.п. были исследованы в качестве терапевтически эффективного прогностического маркера в клинической практике (Непатентная литература 4).
[0004]
Как отмечено выше, интенсивно разрабатывались различные ингибиторы PI3K/AKT/mTOR. Тем не менее, их терапевтическая эффективность в отношении всех пациентов, пациентов, страдающих раком, осталась неудовлетворительной, и не было обнаружено терапевтически эффективных прогностических маркеров, пригодных для стратификации пациентов для того, чтобы выбрать группу пациентов, которые, вероятно, в достаточной степени ответят на ингибиторы PI3K/AKT/mTOR.
Список литературы
Непатентная литература
[0005]
Непатентная литература 1: Nature Reviews Cancer 2, 489-501 (2002)
Непатентная литература 2: Nature Reviews Cancer 9, 550-562 (2009)
Непатентная литература 3: Nature Reviews Clinical Oncology 8, 587-596 (2011)
Непатентная литература 4: Lancet Oncology 12, 594-603 (2011)
Сущность изобретения
Техническая задача
[0006]
Цель настоящего изобретения состоит в разработке химиотерапии с использованием ингибитора PI3K/AKT/mTOR, которая произвела бы превосходный противоопухолевый эффект у пациента, страдающего раком.
Решение задачи
[0007]
Авторы настоящего изобретения проводили обширное исследование относительно отношения между экспрессией различных генов и терапевтической эффективностью ингибиторов PI3K/AKT/mTOR и обнаружили, что ингибиторы PI3K/AKT/mTOR (в частности, транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол) имеют значительный высокий противоопухолевый эффект на пациентов, страдающих раком, демонстрирующих низкий уровень экспрессии PHLDA1 или высокий уровень экспрессии PIK3C2B. Таким образом, авторы осуществили настоящее изобретение.
[0008]
Не было никаких отчетов относительно отношения ингибиторов PI3K/AKT/mTOR к PHLDA1 либо к PIK3C2B.
[0009]
В частности, настоящее изобретение относится к следующим способу, противоопухолевому средству и набору.
Пункт 1.
Способ предсказания терапевтической эффективности химиотерапии с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, у пациента, страдающего раком, на основании уровня экспрессии PHLDA1 и/или PIK3C2B в опухолевых клетках, выделенных от пациента, страдающего раком.
Пункт 2.
Способ согласно Пункту 1, включающий следующие стадии (1) и (2):
(1) измерение уровня экспрессии PHLDA1 и/или PIK3C2B в биологическом образце, содержащем опухолевые клетки, выделенном от пациента; и
(2) предсказание, что для пациента вероятен достаточный ответ на химиотерапию с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, когда уровень экспрессии PHLDA1, измеренного на стадии (1), равен или ниже предопределенной пороговой точки, или когда уровень экспрессии PIK3C2B, измеренного на стадии (1), равен или выше предопределенной пороговой точки.
[0010]
Пункт 3.
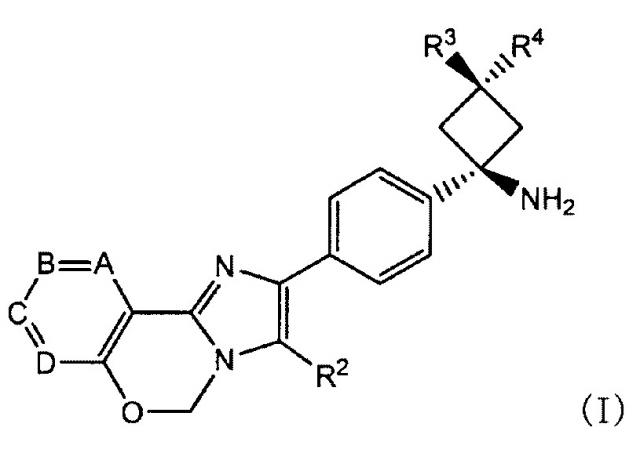
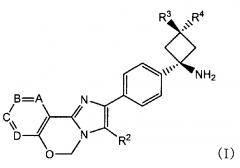
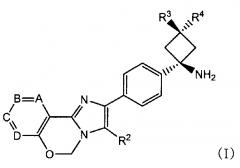
Способ согласно Пункту 1 или 2, в котором ингибитор PI3K/AKT/mTOR представляет собой соединение имидазо-оксазина, представленное формулой (I), или его фармацевтически приемлемую соль
[0011]
[0012]
в которой
A, B, C и D обозначают C-R1a, C-R1b, C-R1c и C-R1d, соответственно, или один или два из таким образом определенных A, B, C и D заменены азотом;
по меньшей мере два из R1a, R1b, R1c и R1d обозначают водород, и другой(другие) каждый обозначает(обозначают) галоген, циано, C1-6 алкил, необязательно замещенный одной или более гидроксильными группами, C1-6 алкокси, карбонил, имеющий гидроксил, амино, необязательно замещенный моно- или ди(C1-6 алкил)амино или моно- или ди(C1-6 алкокси)амино в качестве заместителя, или ненасыщенную гетероциклическую группу;
R2 обозначает фенил, пиридил или тиенил;
R3 обозначает водород, метил, этил или циклопропил; и
R4 обозначает водород или гидроксил;
или ингибитор PI3K/AKT/mTOR представляет собой AMG-319, AZD-6482, BYL-719, копанлисиб (BAY-80-6946), GDC-0032, GDC-0084, GSK-1059615, GSK-2126458, GSK-2636771, иделалисиб (CAL-101), IPI-145, MLN-1117 (INK-1117), PA-799 (CH-5132799), пиктилисиб (GDC-0941), пиларалисиб (XL-147), SF-1126, сонолисиб (PX-866), воксталисиб (SAR-245409, XL-765), афуресертиб гидрохлорид (GSK-2110183), ARQ-092, AZD5363, энзастаурин гидрохлорид, GDC-0068, GSK-2141795, GSK690693, LY-2780301, MK-2206, перифосин, трицирибин фосфат (VQD-002), AZD-2014, AZD-8055, CC-115, CC-223, DS-3078, эверолимус, темсиролимус, ME-344, MLN-0128 (INK-128), OSI-027, PWT-33597, ридафоролимус, сиролимус, дактолисиб (BEZ235), DS-7423, GDC-0980, NVP-BGT-226, PF-04691502, PF-05212384 (PKI-587) или PWT-33597.
Пункт 4.
Способ согласно Пункту 3, в котором соединение имидазо-оксазина, представленное формулой (I), представляет собой соединение, в котором A, B, C и D обозначают C-R1a, C-R1b, C-R1c и C-R1d, соответственно, или любой один или два из таким образом определенных A, B, C и D заменены азотом;
по меньшей мере два из R1a, R1b, R1c и R1d обозначают водород, и другой(другие) каждый обозначает(обозначают) хлор, фтор, циано, метил, гидроксиметил, метокси, этокси, карбоксил, карбамоил, метиламинокарбонил, этиламинокарбонил, гидроксиэтиламинокарбонил, этоксиаминокарбонил или пиразолил;
R2 обозначает фенил, пиридил или тиенил;
R3 обозначает водород, метил, этил или циклопропил; и
R4 обозначает водород или гидроксил.
[0013]
Пункт 5.
Способ согласно Пункту 3 или 4, в котором соединение имидазо-оксазин, представленное формулой (I), представляет собой любое из следующих соединений (a)-(t),
(a) транс-3-амино-1-циклопропил-3-(4-(10-фтор-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(b) транс-3-амино-1-циклопропил-3-(4-(10-фтор-3-(пиридин-4-ил)-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(c) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(d) транс-3-амино-1-циклопропил-3-(4-(10-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(e) транс-3-амино-1-циклопропил-3-(4-(9-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(f) транс-3-амино-1-циклопропил-3-(4-(8-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(g) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(h) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(i) транс-3-амино-1-этил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(j) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(k) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(l) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[4,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(m) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[4,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(n) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,2-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(o) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c] пиразино [2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(p) транс-3-амино-3-(4-(9-(гидроксиметил)-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)-1-метилциклобутанол,
(q) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-9-карбонитрил,
(r) транс-3-амино-1-метил-3-(4-(3-фенил-9-(1H-пиразол-5-ил)-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(s) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-N-метил-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-8-карбоксамид, и
(t) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-N-этокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-8-карбоксамид.
Пункт 6.
Способ согласно любому из Пунктов 1-5, в котором ингибитор PI3K/AKT/mTOR представляет собой MK-2206, BEZ235, GDC-0941, сиролимус или транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол.
Пункт 7.
Противоопухолевое средство для лечения пациента, страдающего раком, включающее ингибитор PI3K/AKT/mTOR, причем пациент, страдающий раком, имеет опухолевые клетки, в которых уровень экспрессии PHLDA1 равен или ниже предопределенной пороговой точки или уровень экспрессии PIK3C2B равен или выше предопределенной пороговой точки.
[0014]
Пункт 8.
Противоопухолевое средство, включающее ингибитор PI3K/AKT/mTOR, которое вводят пациенту, для которого предсказана вероятность достаточного ответа на химиотерапию с использованием противоопухолевого средства способом, включающим следующие стадии (1) и (2):
(1) измерение уровня экспрессии PHLDA1 и/или PIK3C2B в биологическом образце, содержащем опухолевые клетки, выделенном от пациента; и
(2) предсказание, что для пациента вероятен достаточный ответ на химиотерапию с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, когда уровень экспрессии PHLDA1, измеренный на стадии (1), равен или ниже предопределенной пороговой точки, или когда уровень экспрессии PIK3C2B, измеренный на стадии (1), равен или выше предопределенной пороговой точки.
Пункт 9.
Набор, включающий реактив для измерения уровня экспрессии PHLDA1 и/или PIK3C2B, предназначенный для предсказания терапевтической эффективности химиотерапии с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, у пациента, страдающего раком, способом, включающим следующие стадии (1) и (2):
(1) измерение уровня экспрессии PHLDA1 и/или PIK3C2B в биологическом образце, содержащем опухолевые клетки, выделенном от пациента; и
(2) предсказание, что для пациента вероятен достаточный ответ на химиотерапию с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, когда уровень экспрессии PHLDA1, измеренный на стадии (1), равен или ниже предопределенной пороговой точки, или когда уровень экспрессии PIK3C2B, измеренный на стадии (1), равен или выше предопределенной пороговой точки.
Пункт 10.
Способ лечения пациента, страдающего раком, включающий введение противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, пациенту, для которого способом согласно любому из Пунктов 1-6 предсказана вероятность достаточного ответа на химиотерапию с использованием противоопухолевого средства.
Пункт 11.
Противоопухолевое средство, включающее ингибитор PI3K/AKT/mTOR, для применения в лечении пациента, страдающего раком, для которого способом согласно любому из Пунктов 1-6 предсказана вероятность достаточного ответа на химиотерапию с использованием противоопухолевого средства.
[0015]
Настоящее изобретение дополнительно включает следующий объект.
Пункт 12.
Способ тестирования терапевтической эффективности химиотерапии с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, на пациенте, страдающем раком, на основании уровня экспрессии PHLDA1 и/или PIK3C2B в опухолевых клетках пациента, страдающего раком.
[0016]
Пункт 13.
Способ согласно Пункту 12, включающий следующие стадии (1) и (2):
(1) измерение уровня экспрессии PHLDA1 и/или PIK3C2B в биологическом образце, содержащем опухолевые клетки, выделенном от пациента; и
(2) предсказание, что для пациента вероятен достаточный ответ на химиотерапию с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, когда уровень экспрессии PHLDA1, измеренный на стадии (1), равен или ниже предопределенной пороговой точки, или когда уровень экспрессии PIK3C2B, измеренный на стадии (1), равен или выше предопределенной пороговой точки.
Полезные эффекты изобретения
[0017]
Настоящее изобретение относится к новому способу предсказания терапевтической эффективности ингибитора PI3K/AKT/mTORов у пациента, страдающего раком. В частности, способ согласно настоящему изобретению позволяет предсказать, на основании экспрессии PHLDA1 и/или PIK3C2B, показывает ли пациент, страдающий раком, чувствительность к ингибитору PI3K/AKT/mTORам. Это позволяет осуществить выбор подходящих лекарственных средств и избежать ненужного лечения при лечении рака, таким образом обеспечивая возможность планирования подходящего режима введения или изменения подходящего режима введения.
Краткое описание чертежей
[0018]
Фиг.1 показывает корреляцию между уровнем экспрессии PHLDA1 или PIK3C2B и чувствительностью к ингибиторам PI3K/AKT/mTOR.
Фиг.2 показывает результаты анализа нокдауна гена PHLDA1, уровня экспрессии белка и статуса фосфорилирования.
Фиг.3 показывает результаты анализа изменения чувствительности к ингибиторам PI3K/AKT/mTOR, вызванным нокдауном гена PIK3C2B.
Фиг.4 показывает сравнение измерения уровня экспрессии PHLDA1/PIK3C2B с измерением обычной мутации PIK3CA/делеции PTEN в предсказании терапевтической эффективности ингибитора PI3K/AKT/mTORе.
Описание вариантов осуществления
[0019]
Способ прогноза согласно настоящему изобретению предназначен для предсказания или тестирования терапевтической эффективности химиотерапии с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, у пациента, страдающего раком, на основании уровня экспрессии PHLDA1 и/или PIK3C2B в биологическом образце, содержащем опухолевые клетки, выделенном от пациента, страдающего раком.
[0020]
Частные примеры рака, рассматриваемые в настоящем изобретении, включают рак головы и шеи, рак пищеварительного органа (рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак печени, рак желчевыводящих путей (например, рак желчного пузыря и желчного протка), рак поджелудочной железы, рак тонкого кишечника, рак толстого кишечника (например, колоректальный рак, рак ободочной кишки и рак прямой кишки), рак легкого (например, немелкоклеточный рак легкого и мелкоклеточный рак легкого), рак молочной железы, рак яичника, рак матки (например, рак шейки матки и рак эндометрия), рак почек, рак мочевого пузыря и рак предстательной железы. "Рак" в рамках изобретения включает не только первичные опухоли, но также и опухоли, распространяющиеся в другие органы (например, печень). "Пациент, страдающий раком" в рамках изобретения включает не только пациентов, у которых в настоящее время имеются опухолевые клетки, но также и пациенты, у которых опухолевые клетки исчезли или перестали выявляться в результате лечения, такого как хирургическая операция и химиотерапия.
“Ингибитор PI3K/AKT/mTOR” согласно настоящему изобретению особенно не ограничен, при условии, что ингибитор представляет собой лекарственное средство, которое имеет ингибирующую активность в отношении сигнальной гиперактивности в сигнальном пути PI3K/AKT/mTOR. Примеры включают ингибиторы, которые имеют мишенью одну или две или более молекул, выбранные из группы, состоящей из PI3K, AKT и mTOR. Ингибиторами предпочтительно являются ингибитор PI3K, ингибитор AKT, ингибитор mTOR или двойной ингибитор PI3K-mTOR. Эти ингибиторы могут дополнительно иметь ингибирующую активность против молекул-мишеней, отличных от PI3K, AKT и mTOR. Термин "ингибитор" в рамках изобретения включает не только лекарственные средства для ингибирования активности молекул-мишеней, но также и лекарственные средства для ингибирования экспрессии молекул-мишеней. Вид ингибитора PI3K/AKT/mTOR особенно не ограничен, и примеры включают низкомолекулярные соединения, антитела, антисмысловые олигонуклеотиды, siРНК и аптамеры.
[0021]
В предпочтительном варианте осуществления настоящего изобретения, частные примеры ингибиторов PI3K/AKT/mTOR включают соединения имидазо-оксазина, представленные формулой (I), и их соли. Соединения имидазо-оксазина, представленные формулой (I), могут быть использованы в качестве ингибиторов фермента AKT.
[0022]
В формуле (I) A, B, C и D обозначают C-R1a, C-R1b, C-R1c и C-R1d, соответственно, или один или два из таким образом определенных A, B, C и D заменены азотом.
[0023]
Примеры галогенов, представленных R1a, R1b, R1c или R1d, включают хлор, бром, фтор и йод, и предпочтительно хлор и фтор.
[0024]
C1-6 алкил в “C1-6 алкиле, необязательно замещенном одной или более гидроксильными группами”, представленном R1a, R1b, R1c или R1d, представляет собой прямой или разветвленный алкил, имеющий от 1 до 6 атомов углерода, включая метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил и гексил, предпочтительно C1-3 алкил, и более предпочтительно метил. Число гидроксильных групп (заместителей) составляет от 0 до 2, и предпочтительно 0 или 1.
[0025]
“C1-6 алкокси”, представленный R1a, R1b, R1c или R1d, представляет собой прямой или разветвленный алкокси, имеющий от 1 до 6 атомов углерода, включая метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси и трет-бутокси, предпочтительно C1-3 алкокси, и более предпочтительно метокси и этокси.
[0026]
“Карбонил, имеющий гидроксил, амино, необязательно замещенный моно- или ди(C1-6 алкил)амино или моно- или ди(C1-6 алкокси) амино в качестве заместителя”, представленный R1a, R1b, R1c или R1d, представляет собой карбонил, имеющий гидроксил в качестве заместителя (то есть, карбоксил), карбонил, имеющий амино в качестве заместителя (то есть, карбамоил), необязательно замещенный моно или ди(C1-6 алкил)аминокарбонил, или моно или ди(C1-6 алкокси)аминокарбонил.
[0027]
“Моно или ди(C1-6 алкил)аминокарбонил” в “необязательно замещенном моно или ди(C1-6 алкил)аминокарбониле” “карбонила, имеющего гидроксил, амино, необязательно замещенный моно- или ди(C1-6 алкил)амино или моно- или ди(C1-6 алкокси)амино в качестве заместителя”, представленного R1a, R1b, R1c или R1d, представляет собой аминокарбонил, имеющий одну или две C1-6 алкильные группы, описанные выше, предпочтительно моно или ди(C1-3 алкил)аминокарбонил, и более предпочтительно метиламинокарбонил, диметиламинокарбонил, или этиламинокарбонил. Заместитель предпочтительно представляет собой гидроксил. Количество заместителей, если они содержатся, предпочтительно равно одному.
[0028]
Моно или ди(C1-6 алкокси)аминокарбонил представляет собой аминокарбонил, имеющий одну или две C1-6 алкоксигруппы, описанные выше, предпочтительно моно или ди(C1-3 алкокси)аминокарбонил, и более предпочтительно этоксиаминокарбонил.
[0029]
“Карбонил, имеющий гидроксил, амино, необязательно замещенный моно- или ди(C1-6 алкил)амино или моно- или ди(C1-6 алкокси) амино в качестве заместителя”, представленный R1a, R1b, R1c или R1d, особенно предпочтительно представляет собой карбоксил, карбамоил, метиламинокарбонил, этиламинокарбонил, гидроксиэтиламинокарбонил или этоксиаминокарбонил.
[0030]
“Ненасыщенная гетероциклическая группа”, представленная R1a, R1b, R1c или R1d, представляет собой моноциклическую или бициклическую 5-10-членную ненасыщенную гетероциклическую группу, имеющую от одного до четырех гетероатомов из числа N, S и O. Примеры включают имидазолил, тиенил, фурил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, триазолил, тетразолил, пиридил, пиразил, пиримидинил, пиридазинил, индолил, изоиндолил, индазолил, бензофуранил, бензоимидазолил, бензоксазолил, бензотиазолил, пуринил, хинолил, изохинолил, хиназолинил и хиноксалил, причем пиразолил является предпочтительным.
[0031]
Частные примеры предпочтительных соединений имидазо-оксазина, представленных формулой (I), включают следующие соединения (a)-(t).
[0032]
(a) транс-3-амино-1-циклопропил-3-(4-(10-фтор-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(b) транс-3-амино-1-циклопропил-3-(4-(10-фтор-3-(пиридин-4-ил)-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(c) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(d) транс-3-амино-1-циклопропил-3-(4-(10-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(e) транс-3-амино-1-циклопропил-3-(4-(9-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(f) транс-3-амино-1-циклопропил-3-(4-(8-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(g) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(h) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(i) транс-3-амино-1-этил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(j) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(k) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол (в дальнейшем называемый “Соединение I”),
(l) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[4,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(m) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[4,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(n) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,2-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(o) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c] pyrazino [2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(p) транс-3-амино-3-(4-(9-(метил гидрокси)-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)-1-метилциклобутанол,
(q) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-9-карбонитрил,
(r) транс-3-амино-1-метил-3-(4-(3-фенил-9-(1H-пиразол-5-ил)-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(s) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-N-метил-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-8-карбоксамид, и
(t) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-N-этокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-8-карбоксамид
Примеры фармацевтически приемлемых солей соединений имидазо-оксазина, представленных формулой (I), включают соли присоединения с кислотой, образованные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; присоединения с кислотой, образованные с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, угольная кислота, пикриновая кислота, метансульфоновая кислота, паратолуолсульфоновая кислота и глутаминовая кислота; соли, образованные с неорганическими основаниями, такими как натрий, калий, магний, кальций и алюминий; соли, образованные с органическими основаниями, такие как метиламин, этиламин, меглумин и этаноламин; соли, образованные с основными аминокислотами, такими как лизин, аргинин и орнитин; и соли аммония. Соединения имидазо-оксазина, представленные формулой (I), включают энантиомеры и гидраты.
[0033]
Соединения имидазо-оксазина, представленные формулой (I), или их фармацевтически приемлемые соли могут быть получены в соответствии с процедурой, описанной в WO2012/137870.
[0034]
В другом предпочтительном варианте осуществления настоящего изобретения, частные примеры ингибиторов PI3K/AKT/mTOR являются следующими: частные примеры ингибиторов PI3K включают AMG-319, AZD-6482, BYL-719, копанлисиб (BAY-80-6946), GDC-0032, GDC-0084, GSK-1059615, GSK-2126458, GSK-2636771, иделалисиб (CAL-101), IPI-145, MLN-1117 (INK-1117), PA-799 (CH-5132799), пиктилисиб (GDC-0941), пиларалисиб (XL-147), SF-1126, сонолисиб (PX-866) и воксталисиб (SAR-245409, XL-765); частные примеры ингибиторов AKT включают афуресертиб гидрохлорид (GSK-2110183), ARQ-092, AZD5363, энзастаурин гидрохлорид, GDC-0068, GSK-2141795, GSK690693, LY-2780301, MK-2206, перифосин и трицирибин фосфат (VQD-002); частные примеры ингибиторов mTOR включают AZD-2014, AZD-8055, CC-115, CC-223, DS-3078, эверолимус, темсиролимус, ME-344, MLN-0128 (INK-128), OSI-027, PWT-33597, ридафоролимус и сиролимус; и частные примеры двойных ингибиторов PI3K-mTOR включают дактолисиб (BEZ235), DS-7423, GDC-0980, NVP-BGT-226, PF-04691502, PF-05212384 (PKI-587) и PWT-33597. Эти ингибиторы коммерчески доступны, и могут также быть получены в соответствии с обычными известными процедурами.
[0035]
Из перечисленных выше ингибиторов PI3K/AKT/mTOR, MK-2206, BEZ235, GDC-0941, сиролимус и транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол являются более предпочтительными, и транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол является особенно предпочтительным с точки зрения эффектов стратификиции PHLDA1 и/или PIK3C2B.
[0036]
Лекарственная форма противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR согласно настоящему изобретению, особенно не ограничена и может быть выбрана из обычно известных лекарственных форм в зависимости от типа ингибитора PI3K/AKT/mTOR. Частные примеры включают пероральные лекарственные средства (например, таблетки, таблетки, покрытые оболочкой, порошковые лекарственные средства, гранулированные лекарственные средства, капсулы и жидкие лекарственные средства), инъецируемые лекарственные средства, суппозитории, пластыри и мази. Противоопухолевое средство может быть получено в соответствии с обычными известными процедурами с использованием фармакологически приемлемого носителя в зависимости от лекарственной формы. Примеры носителей включают такие, которые широко используются в типичных лекарственных средствах, такие как эксципиенты, связующие, дезинтеграторы, лубриканты, разбавители, солюбилизирующие средства, суспендирующие агенты, средства для придания тоничности, регуляторы рН, буферы, стабилизаторы, красители, ароматизаторы и средства, маскирующие аромат.
[0037]
“Химиотерапия с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR” согласно настоящему изобретению относится к химиотерапии, в которой вводят по меньшей мере противоопухолевое средство, включающее ингибитор PI3K/AKT/mTOR согласно настоящему изобретению. Химиотерапия включает не только химиотерапию с отдельным использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, но также и химиотерапию с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR, в комбинации с одним или более другими противоопухолевого средствами.
Количество ингибитора PI3K/AKT/mTOR, содержащегося в противоопухолевом средстве, варьирует в зависимости от симптомов пациента, получающего лечение средством, лекарственной формы средства и т.п. Однако предпочтительное количество ингибитора PI3K/AKT/mTOR в стандартной лекарственной форме обычно составляет приблизительно от 0,05 до 1000 мг для перорального лекарственного средства, приблизительно от 0,01 до 500 мг для инъецируемого лекарственного средства, и приблизительно от 1 до 1000 мг для суппозитория. Суточная доза противоопухолевого средства в вышеописанных лекарственных формах варьирует в зависимости от симптомов, массы тела, возраста, пола и других факторов пациента, и таким образом не может быть определена безусловно. Однако суточная доза средства для взрослого (масса тела: 50 кг) может обычно составлять приблизительно от 0,05 до 5000 мг, и предпочтительно от 0,1 до 1000 мг, и средство в таком количестве предпочтительно вводят в единственной дозе или в двух или трех разделенных дозах в сутки.
[0038]
Схему введения для химиотерапии предпочтительно определяют в зависимости от таких условий, как тип ингибитора PI3K/AKT/mTOR, наличие или отсутствие совместно используемого лекарственного средства, история лечения, стадия заболевания, наличие или отсутствие метастазов и возраст и пол пациента.
[0039]
Химиотерапия не делает никакого различия относительно того, прибегают ли к хирургии для удаления опухоли в течение химиотерапии, или до или после химиотерапии. Химиотерапия может быть любой из следующего: химиотерапия, которая не включает удаление опухоли, предназначенная в значительной степени для эффекта продления жизни; предоперационная адъювантная химиотерапия, включающая удаление опухоли, уменьшившейся после химиотерапии, предназначенная в значительной степени для уменьшения опухоли; и послеоперационная адъювантная химиотерапия, осуществляемая в превентивных целях после удаления опухоли, предназначенная в значительной степени для подавления рецидива или метастазирования.
[0040]
“Терапевтическая эффективность” в настоящем изобретении может быть оценена на основании эффектов сокращения опухоли, подавления рецидива или метастазирования, эффектов продления жизни и других эффектов, как описано выше. Фраза “для пациента вероятен достаточный ответ на химиотерапию с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR”, указывает, что терапевтическая эффективность у пациента, демонстрирующего низкий уровень экспрессии PHLDA1 или высокий уровень экспрессии PIK3C2B, заметно превосходит терапевтическую эффективность у пациента, демонстрирующего высокий уровень экспрессии PHLDA1 или низкий уровень экспрессии PIK3C2B, причем превосходство демонстрируется статистически значимым различием между ними.
[0041]
Биологический образец в настоящем изобретении особенно не ограничен, при условии, что образец выделен от пациента, страдающего раком, и содержит опухолевые клетки. Примеры включают жидкости организма (например, кровь, мочу и волосы скальпа), ткани (например, образцы биопсии ткани и иссеченные органы), их экстракты и культуры. Способ выделения биологического образца может быть соответственно выбран в зависимости от типа биологического образца.
[0042]
PHLDA1 (Подобный гомологии плекстрина домен семейства А член 1), индикатор согласно настоящему изобретению, является одним типом нуклеопротеида, имеющего домен гомологии плекстрина, и как сообщают, связан с антиапоптотическим действием инсулиноподобных факторов роста. Ассоциация PHLDA1 с путем PI3K/AKT/mTOR была неизвестна.
[0043]
PIK3C2B (фосфатидилинозитол-4-фосфат 3-киназа, каталитической субъединицы типа 2 бета), индикатор согласно настоящему изобретению, включен в суперсемейство PI3K. Однако, в отличие от PIK3CA, об ассоциации которого с ингибиторами PI3K/AKT/mTOR сообщалось, PIK3C2B является членом семейства PI3K класса II и не имеет регуляторной субъединицы.
[0044]
В способе прогноза согласно настоящему изобретению нет никаких специфических ограничений того, что подвергают измерению для того, чтобы измерить уровень экспрессии, при условии, что уровень экспрессии может быть измерен количественно или полуколичественно. Примеры включают уровень экспрессии мРНК, количество копий ДНК и уровня экспрессии белка.
[0045]
Уровень экспрессии мРНК, когда его выбирают для измерения, может быть измерен с использованием зонда или праймера, который специфически гибридизуется к мРНК PHLDA1 или PIK3C2B в соответствии с традиционно используемой методикой для измерения уровня экспрессии мРНК, такой как Нозерн-блоттинг, RT-ПЦР, ПЦР в реальном времени, микроматрица ДНК и гибридизация in situ.
[0046]
Количество копий ДНК, когда его выбирают для измерения, может быть измерено с использованием зонда, которое специфично гибридизуется с ДНК PHLDA1 или PIK3C2B в соответствии с традиционно используемой методикой для измерения количества копий ДНК, такой как гибридизация in situ, матрица CGH, микроматрица ДНК и Саузерн-блоттинг.
[0047]
Уровень экспрессии белка, когда его выбирают для измерения, может быть измерен с использованием антитела, которое специфически распознает белок PHLDA1 или PIK3C2B в соответствии с традиционно используемым иммунологическим анализом, таким как ELISA, Вестерн-блоттинг и иммуногистохимическое окрашивание.
[0048]
Праймер и зонд в настоящем изобретении могут быть получены как полинуклеотид, который специфически гибридизуется с ДНК или мРНК человеческого PHLDA1 или человеческого PIK3C2B на основе известной информации о последовательностях ДНК или мРНК человеческого PHLDA1 или человеческого PIK3C2B (человеческая ДНК PHLDA1: GenBankID NC_000012.11, мРНК: GenBankID NM_007350; человеческая ДНК PIK3C2B: GenBankID NC_000001.10, мРНК: GenBankID NM_002646) в соответствии с обычной известной методикой. Длина праймера составляет от 10 до 50 оснований, предпочтительно от 15 до 50 оснований, и более предпочтительно от 18 до 35 оснований. Длина зонда составляет от 15 оснований до полной длины основания, предпочтительно от 20 оснований до полной длины основания, и более предпочтительно от 30 оснований до полной длине основания.
[0049]
Праймер и зонд не обязательно должны иметь полную комплементарность, при условии, что они могут специфически гибридизоваться с ДНК или мРНК PHLDA1 или PIK3C2B. Праймер и зонд представляют собой, каждый, полинуклеотид, который имеет по меньшей мере 70%, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95%, и особенно более предпочтительно по меньшей мере 98%-ую идентичность соответствующей последовательности основания.
[0050]
Фраза “специфически гибридизуется” в настоящем изобретении означает, что в строгих условиях гибридизации, образуется специфический гибрид и не образуется неспецифический гибрид. Строгие условия гибридизации могут быть определены на основании температуры плавления (Tm) нуклеиновой кислоты, которая образует гибрид в соответствии с обычной известной процедурой. Частные примеры условий промывки, которые могут поддерживать гибридизованное состояние, обычно включают состояния по существу “1×SSC, 0,1% SDS, 37°C”, более строгие условия - по существу “0,5×SSC, 0,1% SDS, 42°C”, и еще более строгие условия - по существу “0,1×SSC, 0,1% SDS, 65°C.”
[0051]
Зонд или праймер могут быть мечены обычно используемым радиоактивным веществом, флюоресцентным веществом, хемилюминесцентным веществом или ферментом для легкой детекции.
[0052]
Антитело в настоящем изобретении особенно не ограничено, при условии, что антитело может специфически распознавать белок PHLDA1 или PIK3C2B. Антитело может быть моноклональным антителом или поликлональным антителом и может быть фрагментом антитела, таким как фрагмент Fab и фрагмент F(ab’)2. Антитело может быть получено в соответствии с обычной известной процедурой (например, Current Protocols in Molecular Biology edit. Ausubel et al. (1987), Publish. John Wiley and Sons. Section 11.12-11.13) на основе известной информации аминокислотной последовательности белка человеческого PHLDA1 или человеческого PIK3C2B (человеческий PHLDA1 GenBankID NP_031376; человеческий PIK3C2B GenBankID NP_002637). Альтернативно, могут также использоваться коммерчески доступные антитела. Примеры античеловеческих антител PHLDA1 для использования включают Abcam Cat. #ab67849 и Abnova Cat. #H00022822-B01P, и примеры античеловеческих антител PIK3C2B включают Abcam Cat. #ab55589 и Abgent Cat. #AP3309a.
[0053]
В способе прогноза согласно настоящему изобретению, когда низкий уровень экспрессии PHLDA1 и/или высокий уровень экспрессии PIK3C2B наблюдается в опухолевых клетках пациента, страдающего раком, для пациента, страдающего раком, делают предсказание вероятности достаточного ответа на химиотерапию с использованием противоопухолевого средства, включающего ингибитор PI3K/AKT/mTOR.
[0054]
“Низкий уровень экспрессии PHLDA1” в рамках изобретения указывает, ч