Способ определения посттрансплантационного химеризма при анализе точечных мутаций замены оснований в генах f2, f5, f7, f13, fgb, itga2, itgb3, pai-1
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к гематологии, и предназначено для определения посттрансплантационного донорского химеризма при анализе точечных мутаций замены оснований в генах тромбофилии. Для оценки химеризма анализируют однонуклеотидные полиморфизмы генов F2, F5, F7, F13, FGB, ITGA2, ITGB3, PAI-1 методом полимеразной цепной реакции в режиме реального времени. В случае обнаружения у реципиента аллельных специфичностей, отсутствующих у донора, определяют наличие химеризма, а в случае определения у донора алелля, отсутствующего у реципиента, - отсутствие химеризма после трансплантации аллогенных гемопоэтических стволовых клеток (ГСК). Изобретение обеспечивает создание способа оценки гемопоэтического химеризма на основании анализа информативных аллелей в генах F2, F5, F7, F13, FGB, ITGA2, ITGB3, PAI-1. Предлагаемый способ позволяет определить маркерные локусы, необходимые для оценки состояния больного после трансплантации ГСК. 3 табл., 2 пр.
Реферат
Изобретение относится к области медицины, в частности к гематологии и может быть использовано для оценки донорского химеризма после трансплантации костного мозга и гемопоэтических стволовых клеток путем определения точечных мутаций замены оснований в генах F2, F5, F7, F13, FGB, ITGA2, ITGB3, PAI-1 методом полимеразной цепной реакции (ПЦР) в режиме реального времени.
Цель изобретения - разработка способа определения посттрансплантационного химеризма при анализе полиморфизма генов F2, F5, F7, F13, FGB, ITGA2, ITGB3, PAI-1.
Аллогенная трансплантация гемопоэтических стволовых клеток (аллоТГСК) является эффективным методом лечения тяжелых заболеваний системы крови и иммунной системы. Несмотря на достигнутые успехи в области трансплантологии, аллоТГСК сопряжена с развитием острой и хронической реакции «трансплантат против хозяина», возможностью отторжения трансплантата, возникновением рецидивов основного заболевания. Мониторинг приживления гемопоэтических стволовых клеток путем оценки посттрансплантационного химеризма необходим для оценки состояния кроветворной системы и планирования цитостатической и иммунносупрессивной терапии [1]. Генетический химеризм - это одновременное присутствие в организме двух и более маркеров генетически различных клеточных линий. Выделяют полный донорский химеризм, смешанный химеризм и отсутствие химеризма (отторжение трансплантата) [7].
Известен способ диагностики химеризма цитогенетическим методом. Данный метод не обладает достаточной чувствительностью и используется при различиях донора и реципиента по полу или при наличии у пациента хромосомных особенностей. Недостатком является сложность получения метафазных пластинок хромосом при малой клеточности костного мозга. Метод флюоресцентной гибридизации in situ (FISH) обладает рядом преимуществ перед стандартной цитогенетикой, т.к. не предусматривает культивирования клеток, но, также как и метод количественного определения Y-хромосомы [5], данный способ может быть использован только при различиях донора и реципиента по полу [4].
Известен способ мониторинга химеризма по результатам исследования антигенов эритроцитов. Необходимым условием для проведения данного метода являются различия между донором и реципиентом по каким-либо антигенам систем АВО, Резус, Келл, MNS Даффи, Левис, Кидд. Преимуществами способа являются простота и высокая скорость выполнения. Недостатками данного способа являются относительно низкая чувствительность (1-5%) и возможность использования только через 4 недели и позже после аллоТГСК [3].
Известен способ выявления сателлитных последовательностей, характеризующихся высокой степенью полиморфизма. Исследование заключается в определении минисателлитов (10-70 пар оснований) (variable number tandem repeats, VNTR) или микросателлитов (2-5 пар оснований) (short tandem repeats, STR) [6]. Методы исследования, основанные на анализе STR, отличаются высокой чувствительностью (от 1 до 0,001%), быстротой и простотой в исполнении, возможностью количественной оценки химеризма.
Наиболее близким к предполагаемому изобретению является исследование полиморфизма InDel, типа генетической вариации, при котором специфическая нуклеотидная последовательность присутствует (инсерция) или отсутствует (делеция) [8]. Главным преимуществом InDel ПЦР по сравнению с мультиплексной STR ПЦР является отсутствие конкуренции и влияния эффекта «плато» на результат реакции ПЦР [1], что делает данный способ наиболее чувствительным из всех перечисленных.
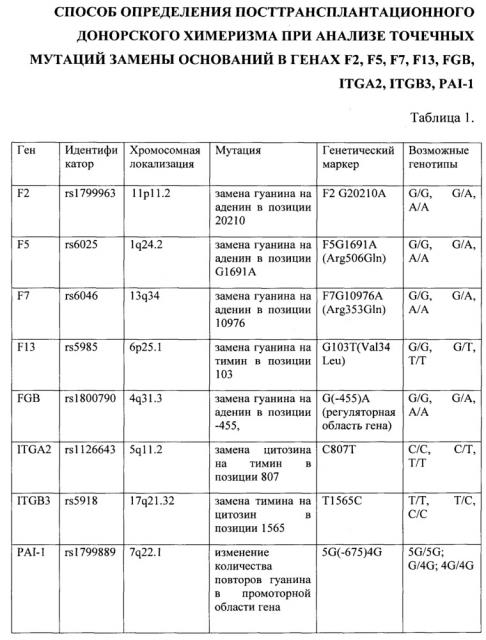
Техническим результатом заявляемого изобретения является создание способа оценки гемопоэтического химеризма на основании анализа информативных аллелей в генах F2, F5, F7, F13, FGB, ITGA2, ITGB3, PAI-1. Технология анализа однонуклеотидных полиморфизмов (single nucleotide polymorphisms - SNPs) позволяет выявить замену в нуклеотидной последовательности ДНК и три варианта генотипа: гомозиготность с исходной последовательностью нуклеотидов, гетерозиготность и гомозиготность с заменой в последовательности нуклеотидов. Предлагаемый способ позволяет определить маркерные локусы, необходимые для оценки состояния больного после трансплантации ГСК.
Для достижения указанного результата в соответствии с аналогом (Alizadeh М., 2002) проводят типирование генов донора и реципиента и выявляют информативные аллели, позволяющие дифференцировать ДНК донора и реципиента. В отличие от прототипа, в котором проводится ГТЦР коротких тандемных повторов (STR-PCR) биаллельных генетических систем S01-S11, в предлагаемом способе осуществляется анализ однонуклеотидных полиморфизмов генов F2, F5, F7, F13, FGB, ITGA2, ITGB3, PAI-1. Анализ химеризма проводится методом ПЦР в режиме реального времени.
В процессе проведения патентно-информационного поиска не выявлено источников, порочащих новизну предполагаемого изобретения.
Заявляемое изобретение разработано в лаборатории иммуногематологии ФГБУН КНИИГиПК ФМБА России в соответствии с планом научно-исследовательской работы.
Способ осуществляется следующим образом: Этап 1. Исследуют полиморфизм генов F2, F5, F7, F13, ITGA, ITGB, FGB, PAI-1 у донора и реципиента. С этой целью проводят выделение ДНК из периферической крови донора и реципиента согласно инструкции, прилагающейся к наборам реагентов. Маркируют пробирки для каждого исследуемого образца и отрицательного контроля в расчете на восемь полиморфизмов. В пробирки вносят соответствующие смеси для амплификации, ПЦР-буфер, Taq-полимеразу, исследуемый образец ДНК (100 нг) и отрицательный контрольный образец. Пробирки устанавливают в блок детектирующего амплификатора. ПЦР проводят при следующих параметрах: 2 мин при 80°С, 5 мин при 94°С с последующей амплификацией продуктов в течение 5 циклов (94°С - 30 сек, 67°С - 10 сек), 45 циклов (94°С - 5 сек, 67°С - 5 сек),1 цикл (25°С - 30 сек), 50 циклов (25°С - 15 сек). Смесь для амплификации содержит флуоресцентные метки Fam и Hex для соответствующего варианта полиморфизма. В конце амплификации осуществляется температурное плавление дуплексов (ампликон + сигнальный зонд), изменяющее уровень флуоресценции. Анализ кривых плавления позволяет определить специфичность фрагментов ДНК. Оба варианта искомой последовательности определяются в одной пробирке при одновременной гибридизации с двумя альтернативными типирующими зондами с различными флуорофорами. Описание SNP-генов, используемых в исследовании, представлено в таблице 1.
Этап 2. Определение информативных генов, позволяющих выявить аллельные различия донора и реципиента. Аллель считается информативным, если он позитивен для реципиента и негативен для донора или наоборот. Для определения процента донорского химеризма строят калибровочную кривую для выбранных информативных аллелей в серии разведений ДНК реципиента в ДНК донора (100, 10-1, 10-2, 10-4, 10-5), содержащих следующее отношения ДНК:
- 100% ДНК донора;
- 10% ДНК реципиента и 90% ДНК донора;
- 1% ДНК реципиента и 99% ДНК донора;
- 0,1% ДНК реципиента и 99,9% ДНК донора;
- 0,01% ДНК реципиента и 99,99% ДНК донора.
Этап 3. Исследование гемопоэтического химеризма проводят на 28, 42, 56, 70, 100, 120 дни после трансплантации, при этом анализируют информативные аллели. Протокол амплификации должен соответствовать описанному в «Этап 1». Оценку количественных значений химеризма осуществляют с использованием формулы:
Химеризм, %=2-DDCt × 100%,
где DDCt - разница между уровнями пороговой флуоресценции исследуемого маркера и референсного гена в исследуемом образце разведения и в образце ДНК донора.
Представленные ниже клинические примеры подтверждают возможность использования заявляемого способа при оценке гемопоэтического химеризма после аллоТГСК.
Пример 1.
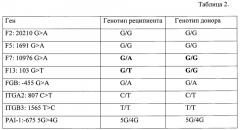
Пациент С, 44 года, с диагнозом: Миелодиспластический синдром: рефрактерная анемия с избытком бластов (RAEB-1) IPSS-1.5. АллоТКМ после немиелоаблативного режима кондиционирования выполнена 21.01.2016 от HLA-идентичного родственного донора (сестра, возраст 47 лет). Результаты типирования генов тромбофилии методом ПЦР в режиме реального времени представлены в таблице 2. Перед трансплантацией были выявлены информативные маркеры - гены F7 и F13, в которых у реципиента имелись аллельные специфичности, отсутствующие у донора.
Выстроена калибровочная кривая в серии разведений ДНК донора в ДНК реципиента (100, 10-1, 10-2, 10-4, 10-5). Мониторинг химеризма проведен через 28, 42, 60, 70, 90, 100, 120, 300, 330 дней после аллоТГСК. Донорский химеризм >95% зарегистрирован в 28 и 42 дни. Донорский химеризм >99% определен с 60 дня и далее. Клинической картины отторжения или недостаточности трансплантата не наблюдалось. Больной в настоящее время не получает иммуносупрессивную терапию, ведет полноценную жизнь хорошего качества.
Пример 2.
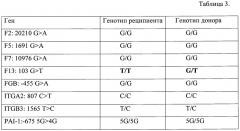
Пациент С., 24 года с диагнозом Острый миелобластный лейкоз высокий риск. АллоТГСК с немиелоаблативным режимом кондиционирования выполнена 05.09.2016 для консолидации ремиссии 1. Донором явилась HLA-идентичная сестра больного (27 лет). С целью выявления маркеров посттрансплантационного химеризма проведено исследование генов тромбофилии. Результаты типирования представлены в таблице 3. Информативным маркером явился ген F13, в котором у донора был определен аллель G, отсутствующий у реципиента. Построена калибровочная кривая в серии разведений ДНК донора и реципиента. Исследование гемопоэтического химеризма выполнено на 28, 42, 60 дни после аллоТГСК. Донорский химеризм >95% регистрировался в 28 и 45 дни. При исследовании на 60 день донорский химеризм не превышал 5%. Наблюдались признаки отторжения трансплантата. Больной умер на +65 сутки после трансплантации от тяжелого сепсиса, септического шока.
Список литературы:
1. Лавриненко В.А., Савицкая Т.В., Волочник Е.В., Марейко Ю.Е., Алейникова О.В. Количественный анализ химеризма после аллогенной трансплантации гемопоэтических стволовых клеток молекулярно-генетическими методами // Онкогематология, 2014, 9(2): 29-36.
2. Alizadeh М., Bernard М., Danic В. et al. Quantitative assessment of hematopoietic chimerism after bone marrow transplantation by real-time quantitative polymerase chain reaction. Blood 2002; 99(12): 4618-25.
3. Bader P., Niethammer D., Willasch A., Kreyenberg H., Klingebiel T. How and when should we monitor chimerism after allogeneic stem cell transplantation? // Bone Marrow Transpantation, 2005, 35(2): 107-119.
4. Fehse В., Chuchlovin A., Kuhcke K. et al. Real-time quantitative Y chromosome-specific PCR (QYCS-PCR) for monitoring hematopoietic chimerism after sex-mismatched allogeneic stem cell transplantation // J. Hematother. Cell Res., 2001, 10(3): 419-425.
5. Koldehoff M., Steckel N.K., Hlinka M. et al. Quantitative analysis of chimerism after allogeneic stem cell transplantation by real-time polymerase chain reaction with single nucleotide polymorphisms, standard tandem repeats, and Y-chromosome-specific sequences // Am. J. Hematol., 2006, 81(10): 735-16.
6. Kreyenberg H., Holle W., Mohrle S. et al. Quantitative analysis of chimerism after allogeneic stem cell transplantation by PCR amplification of microsatellite markers and capillary electrophoresis with fluorescence detection: the Tuebingen experience // Leukemia, 2003, 17: 237-240.
7. Kristt D., Israeli M., Narinski R. et al. Hematopoietic chimerism monitoring based on STRs: quantitative platform performance on sequential samples // J. Biomolecular Techniques., 2005; 16(4): 378-89.
8. Rodriguez-Murillo L. and Salem R.M. Insertion/Deletion Polymorphism. In M.D. Gellman & J.R. Turner (eds.). // Encyclopedia of behavioral medicine. New York: Springer, 2013, part 16: 1076.
Способ определения посттрансплантационного донорского химеризма при анализе точечных мутаций замены оснований в генах тромбофилии, включающий в себя получение образцов ДНК, проведение генотипирования донора и реципиента, определение информативных маркеров химеризма, посттрансплантационный мониторинг гемопоэтического химеризма, отличающийся тем, что для оценки химеризма анализируют однонуклеотидные полиморфизмы генов F2, F5, F7, F13, FGB, ITGA2, ITGB3, PAI-1, причем в качестве метода детекции используют полимеразную цепную реакцию в режиме реального времени, при этом определяют три варианта генотипа: гомозиготность с исходной последовательностью нуклеотидов, гетерозиготность и гомозиготность с заменой в последовательности нуклеотидов, и в случае обнаружения у реципиента аллельных специфичностей, отсутствующих у донора, определяют наличие химеризма, а в случае определения у донора алелля, отсутствующего у реципиента, - отсутствие химеризма после трансплантации аллогенных гемопоэтических стволовых клеток.