Производные пиридилкетона, способ их получения и их фармацевтическое применение
Иллюстрации
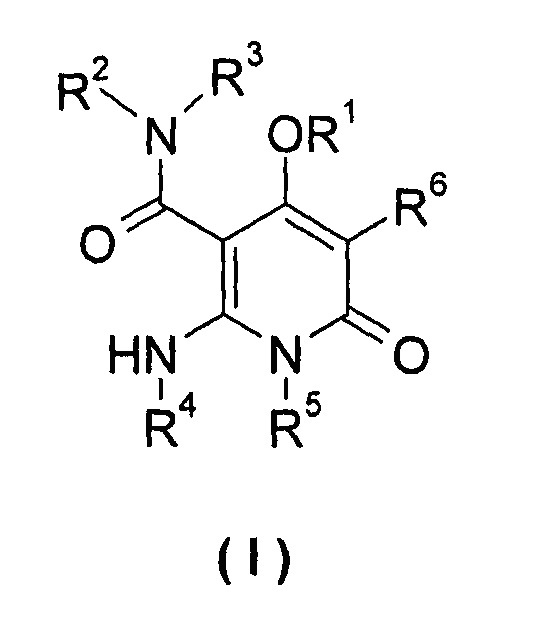
Показать всеИзобретение относится к производным пиридилкетона формулы (I) или его фармацевтически приемлемым солям:
где: R1 выбран из группы, состоящей из фенила и пиридила, где независимо друг от друга каждый из фенила и пиридила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, алкила, галогеналкила, -OR7, -C(O)R7, -C(O)NHR7, -NHC(O)R7, -NHC(O)OR7 и -NHS(O)mR7; R2 представляет собой водород; R3 выбран из группы, состоящей из водорода и алкила, где алкил необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из -OR7; R4 представляет собой фенил, где фенил необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена и алкила; R5 выбран из группы, состоящей из водорода и алкила; R6 выбран из группы, состоящей из водорода, галогена и алкила; R7 выбран из группы, состоящей из водорода, алкила, С3-6циклоалкила, 5- или 6-членного гетероциклила, где независимо друг от друга каждый из указанных радикалов необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из алкила и галогена; где гетероциклил содержит один или два гетероатома, выбранные из группы, состоящей из N, О и S(O)m; независимо друг от друга каждый из R8 и R9 выбран из группы, состоящей из водорода или алкила; и m равно 2, и их применению в качестве ингибиторов MEK, и особенно в качестве терапевтических средств для лечения рака. 8 н. и 4 з.п. ф-лы, 4 табл., 33 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым производным пиридона, способу их получения, содержащим их фармацевтическим композициям и их применению в качестве ингибиторов МЕК, и особенно в качестве терапевтических средств для лечения рака.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Статистические данные из Министерства здравоохранения Китая в 2008 году показали, что в Китае каждый год имеется приблизительно 2,127 миллиона новых случаев новообразований, из которых приблизительно 1,06 миллиона составляют новые случаи злокачественных новообразований; в то же время было зарегистрировано около 2,685 миллионов существующих пациентов с новообразованиями, из которых насчитывалось около 1,485 миллионов существующих пациентов со злокачественными новообразованиями. Министр здравоохранения Чэнь Чжу отметил на 21-м Всемирном конгрессе против рака, что за последние 30 лет смертность от рака в Китае увеличилась на 80%, ежегодное число смертей, вызванных раком, составило 1,8 миллиона, и рак стал первой причиной смерти для жителей Китая. По данным опроса "China Health Statistics Yearbook 2012", уровень смертности от злокачественных новообразований увеличивался, основными пятью типами злокачественных новообразований были рак легких, рак печени, рак желудка, рак пищевода и колоректальный рак соответственно, при этом быстрее всего возрастала смертность от рака легких и рака печени, и эти два рака занимают первое место по смертности среди заболеваний, вызванных злокачественными новообразованиями.
За последние полвека в области терапии опухолей были сделаны многие достижения. При тщательном изучении генетики и биологии опухолей было найдено множество ключевых внутриклеточных сигнальных путей, связанных с опухолью. Через эти внутриклеточные пути раковые клетки проводят внеклеточный сигнал до внутриклеточной трансдукции и регулируют активности, такие как непрерывная пролиферация и апоптоз, для поддержания злокачественноых фенотипов, и, с другой стороны, для создания устойчивости к лечению путем регулирования специфических генов и их белковых продуктов. Аномалия МАРК-киназного пути, приводящая к неконтролируемой клеточной пролиферации и замедлению дифференцировки, тесно связана с туморогенезом, в результате, МАРК-киназный сигнальный путь стал предпочтительной мишенью для разработки лекарств для лечения рака.
Серин/треонин митоген-активируемые протеинкиназы (МАРК, также называемые киназами, регулируемыми внеклеточными сигналами, ERK (от англ. extracellular signal-regulated)) активируются рецептором тирозинкиназы (например, рецептором ЭФР (эпидермального фактора роста)) и/или цитокиновым рецептором, связанным с гетеротримером G белка. МАРК могут взаимодействовать с внутриклеточными сигналами, инициированными различными вторичными мессенджерами, затем фосфорилироваться и регулировать активность различных ферментов и транскрипционных факторов (таких как NF-кВ, Rsk 90, фосфолипаза А2, с-Мус, CREB, Ets-1, АР-1 и c-jun, и т.д.). Среди путей МАРК, участвующих в нормальном и аномальном росте клеток, Ras/Raf/МЕК/Erk киназный путь является одним из наиболее хорошо изученных и наиболее важных путей. Более десяти лет назад ученые обнаружили, что белок семейства Erk-киназ участвует в промотировании пролиферации. В последующих исследованиях было быстро выявлено семейство МЕК, стоящее выше киназы ERK, после чего было установлено, что Raf может активировать МЕК, вышестоящим для Raf является Ras, относящийся к G-белку и связывающийся с активированной ГТФ, что может непрямым образом активировать Raf. Мутация гена Ras обнаружена приблизительно в 30% злокачественных новообразований у пациентов, частота мутаций Ras гена составляет даже до 90% при раке поджелудочной железы. Частота мутаций B-Raf составляет 50-70% при меланоме, 35% при раке яичников, 30% при раке щитовидной железы, и 10% при раке толстой кишки. Аналогично, МЕК могут быть активированы с помощью МЕК-киназы (также известной как МЕКК), не зависящей от Raf.
МЕК, также известные как киназы МАР-киназ (МАРКК или Erk-киназы), принадлежат к биспецифическим киназам, МЕК могут фосфорилировать серин/треониновые остатки и тирозиновые остатки МАРК (p44MAPK(Erk 1) и p42MAPK(Erk 2)) (сайтами фосфорилирования Erk1 являются Т202 и Y204, сайтами фосфорилирования Erk2 являются Т183 и Y185). Семейство МЕК включает пять генов: МЕК1, МЕК2, МЕКЗ, МЕК4 и МЕК5. N-терминальный конец МЕК является негативной регуляторной областью; С-концевой каталитический домен имеет функции связывания с Erk и активирования Erk. Тесты показали, что нокаут регуляторных областей МЕК1 приведет к ингибированию внутренней активности МЕК1 и Erk.
МЕК1, обладающий молекулярной массой около 44 кДа, имеющий в совокупности 393 аминокислоты, в основном экспрессируется в тканях взрослого организма, в особенности в ткани головного мозга. След экспрессии МЕК1 также может быть обнаружен в ходе эмбрионального развития. Активность МЕК1 инициируется фосфорилированием S218 и S222. Исследования показали, что в клетках NIH3T3 активность МЕК1 возрастает, когда фосфорилируются остатки аспарагиновой или глутаминовой кислот, и также увеличивается образование колоний. Внутренняя активность МЕК1 способствует старению клеток и экспрессии р53 и p16INK4a в первичной культуре клеток. Тем не менее, роль МЕК1 противоположна в иммортализованных клетках и p16INK4a или р53-дефицитных клетках. МЕК2, обладающий молекулярной массой около 45 кДа, имеет 79% сходство последовательностей с МЕК1, а его активность инициируется фосфорилированием S226 и S222. Каталитические активности при фосфорилировании МЕК1 и МЕК2 различны для различных изоформ МАРК, Erk1 и Erk2. МЕК 3, МЕК 4 и МЕК5 не играют роли посредством воздействия на Erks.
В настоящее время существует множество соединений для специфического ингибирования Raf и МЕК посредством сигнального пути МАРК, проходящих клинические испытания и находящихся на пострегистрационной стадии. При этом сорафениб (Bay 43-9006), выставленный на рынок в 2006 году, является неспецифическим серин/треонин и тирозин киназным ингибитором нацеленным на Raf, МЕК, VEGFR2/3, Flt-3, PDGFR, c-Kit и т.д. Специфические ингибиторы B-Raf, такие как дабрафениб (GSK2118436) и вемурафениб (PLX4032), показали хорошие клинические результаты, но их продолжительность не была достаточно длительной, в то же время клинические исследования показали, что симптомы большинства пациентов, получавших эффективное лечение PLX4032, рецидивировали, и было высказано предположение о том, что долговременное лечение ингибиторами B-Raf может вызвать приобретенную устойчивость к лекарству и сделать пациентов нечувствительными к ингибиторам B-Raf. Для того чтобы преодолеть устойчивость пациентов, в клинической терапии ингибиторы МЕК часто комбинируют с ингибиторами B-Raf. Специфический МЕК1/2 ингибитор траметиниб (GSK-1120212), разработанный GSK, уже вступил в стадию предварительной регистрации, другие ингибиторы МЕК1/2, такие как селуметиниб (AZD-6422), пимасертиба гидрохлорид (AS-703026) и TAK-733 и другие, достигли клинической стадии испытаний. Тем не менее, никаких данных по взаимодействию между этими ингибиторами МЕК и Erk1 или Erk2 не было раскрыто.
Был раскрыт ряд патентных заявок на ингибиторы МЕК, в том числе WO 2007096259, WO 2010003022 и WO 2012162293 и т.д.
Для достижения лучших онкотерапевтических целей, а также для более полного удовлетворения потребностей рынка, авторы надеятся разработать новое поколение ингибиторов сигнальных путей МАРК, в частности, ингибиторов МЕК, обладающих высокой эффективностью и низкой токсичностью. Настоящее изобретение относится к новым структурным ингибиторам МЕК, и было обнаружено, что соединения, обладающие такими структурами, имеют низкое ингибирование CYP450, хорошую активность, и обладают превосходной антипролиферативной активностью в отношении раковых клеток.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
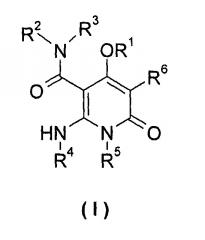
Настоящее изобретение относится к соединению формулы (I), его таутомеру, мезомеру, рацемату, энантиомеру или диастереомеру, а также их смеси, и его фармацевтически приемлемой соли:
где:
R1 выбран из группы, состоящей из циклоалкила, гетероциклила, арила и гетероарила, где независимо друг от друга каждый из циклоалкила, гетероциклила, арила и гетероарила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, циано-, нитро-, алкила, галогеналкила, гидроксиалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -OR7, -C(O)OR7, -OC(O)R7, -O(CH2)nC(O)OR7, -C(O)R7, -C(O)NHR7, -NHC(O)R7, -NHC(O)OR7, -NHS(O)mR7, -NR8R9, -OC(O)NR8R9 и -C(O)NR8R9;
независимо друг от друга каждый из R2 и R3 выбран из группы, состоящей из водорода и алкила, где алкил необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, циано-, нитро-, алкенила, алкинила, гетероциклила, арила, гетероарила, -OR7, -C(O)OR7, -OC(O)R7, -O(CH2)nC(O)OR7, -C(O)R7, -NHC(O)R7, -NHC(O)OR7, -NHS(O)mR7 -NR8R9, -OC(O)NR8R9 и -C(O)NR8R9;
R4 выбран из группы, состоящей из арила и гетероарила, где независимо друг от друга каждый из арила и гетероарила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, циано-, гидрокси-, нитро-, алкила, галогеналкила, гидроксиалкила, алкенила, алкинила, гетероциклила, арила, гетероарила, -OR7, -C(O)OR7, -OC(O)R7, -O(CH2)nC(O)OR7, -C(O)R7, -NHC(O)R7, -NHC(O)OR7, -NHS(O)mR7, -NR8R9, -OC(O)NR8R9 и -C(O)NR8R9;
R5 выбран из группы, состоящей из водорода, алкила, алкенила и алкинила, где независимо друг от друга каждый из алкила, алкенила и алкинила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, гидрокси-, алкокси-, циано- и галогеналкила;
R6 выбран из группы, состоящей из водорода, галогена и алкила, где алкил необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, гидрокси-, циано-, нитро-, алкокси-, циклоалкила, гетероциклила, арила и гетероарила;
R7 выбран из группы, состоящей из водорода, алкила, циклоалкила, гетероциклила, арила и гетероарила, где независимо друг от друга каждый из алкила, циклоалкила, гетероциклила, арила и гетероарила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из алкила, галогена, гидрокси-, алкокси-, циклоалкила, гетероциклила, арила, гетероарила, карбоксила и алкоксикарбонила;
независимо друг от друга каждый из R8 и R9 выбраны из группы, состоящей из водорода, алкила, циклоалкила, гетероциклила, арила и гетероарила, где независимо друг от друга каждый из алкила, циклоалкила, гетероциклила, арила и гетероарила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из алкила, галогена, гидрокси-, алкокси-, циклоалкила, гетероциклила, арила, гетероарила, карбоксила и алкоксикарбонила;
альтернативно, R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклил, где гетероциклил содержит один или несколько гетероатомов, выбранных из группы, состоящей из N, О или S(O)m, и гетероциклил необязательно дополнительно замещен одной или несколькими группами, выбранными из группы, состоящей из алкила, галогена, гидрокси-, алкокси-, циклоалкила, гетероциклила, арила, гетероарила, карбоксила и алкоксикарбонила;
m равно 0, 1 или 2; и
n равно 0, 1 или 2.
В предпочтительном воплощении настоящего изобретения, в соединении формулы (I) или его таутомере, мезомере, рацемате, энантиомере или диастереомере, или их смеси, или его фармацевтически приемлемой соли, где R1 выбран из группы, состоящей из арила и гетероарила, где каждый из арила и гетероарила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, циано-, нитро-, алкила, галогеналкила, гидроксиалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -OR7, -C(O)OR7, -OC(O)R7, O(CH2)nC(O)OR7, -C(O)R7, -C(O)NHR7, -NHC(O)R7, -NHC(O)OR7, -NHS(O)mR7, -NR8R9, -OC(O)NR8R9 и -C(O)NR8R9, и R7, R8, R9, m и n являются такими, как определено в формуле (I).
В другом предпочтительном воплощении настоящего изобретения, в соединении формулы (I) или его таутомере, мезомере, рацемате, энантиомере или диастереомере, или их смеси, или его фармацевтически приемлемой соли, где R1 выбран из группы, состоящей из фенила и пиридила, где каждый из фенила и пиридила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из алкила, галогена, галогеналкила, -OR7, -C(O)NHR7, -NHC(O)R7, -NHC(O)OR7 и -NHS(O)mR7, и R7 и m являются такими, как определено в формуле (I).
В другом предпочтительном воплощении настоящего изобретения, в соединении формулы (I) или его таутомере, мезомере, рацемате, энантиомере или диастереомере, или их смеси, или его фармацевтически приемлемой соли, где R2 представляет собой водород, R3 выбран из группы, состоящей из водорода и алкила, где алкил необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, циано-, нитро-, алкила, алкенила, алкинила, гетероциклила, арила, гетероарила, -OR7, -C(O)OR7, -OC(O)R7, -O(CH2)nC(O)OR7, -C(O)R7, -NHC(O)R7, -NHC(O)OR7, -NHS(O)mR7, -NR8R9, -OC(O)NR8R9 и -C(O)NR8R9, и R7, R8, R9, m и n являются такими, как определено в формуле (I).
В еще одном предпочтительном воплощении настоящего изобретения, в соединении формулы (I) или его таутомере, мезомере, рацемате, энантиомере или диастереомере, или их смеси, или его фармацевтически приемлемой соли, где R4 представляет собой арил, где арил необязательно замещен одним или несколькими атомами галогена.
В другом предпочтительном воплощении настоящего изобретения, в соединении формулы (I) или его таутомере, мезомере, рацемате, энантиомере или диастереомере, или их смеси, или его фармацевтически приемлемой соли, где R5 представляет собой алкил, где алкил необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, гидрокси-, алкокси-, циано- и галогеналкила.
В другом предпочтительном воплощении настоящего изобретения, в соединении формулы (I) или его таутомере, мезомере, рацемате, энантиомере или диастереомере, или их смеси, или его фармацевтически приемлемой соли, где R6 выбран из группы, состоящей из водорода или галогена.
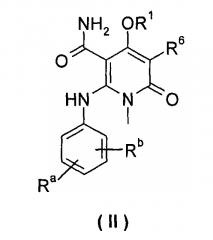
В другом предпочтительном варианте осуществления настоящего изобретения, соединение формулы (I) или его таутомер, изомер, рацемат, энантиомер или диастереомер, или их смесь, или его фармацевтически приемлемая соль, является соединением формулы (II), или его таутомером, изомером, рацематом, энантиомером или диастереомером, или их смесью, или его фармацевтически приемлемой солью:
каждый из Ra и Rb выбран из группы, состоящей из водорода, галогена, алкила или галогеналкила;
R1 выбран из группы, состоящей из фенила и пиридинила, где каждый из фенила и пиридила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из алкила, галогена, галогеналкила, -OR7, -C(O)NHR7, -NHC(O)R7, -NHC(O)OR7 and -NHS(O)mR7;
R6 выбран из группы, состоящей из водорода, галогена и алкила, где алкил необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, гидрокси-, циано-, нитро-, алкокси-, циклоалкила, гетероциклила, арила и гетероарила; и
R7 выбран из группы, состоящей из водорода, алкила, циклоалкила, гетероциклила, арила и гетероарила, где каждый из алкила, циклоалкила, гетероциклила, арила и гетероарила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из алкила, галогена, гидрокси-, алкокси-, циклоалкила, гетероциклила, арила, гетероарила, карбоксила и алкоксикарбонила.
В другом предпочтительном воплощении настоящего изобретения, в соединении формулы (I) или его таутомере, мезомере, рацемате, энантиомере или диастереомере, или их смеси, или его фармацевтически приемлемой соли, где R7 выбран из группы, состоящей из водорода, алкила, циклоалкила и гетероциклила, где алкил необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, гидрокси- и алкокси-.
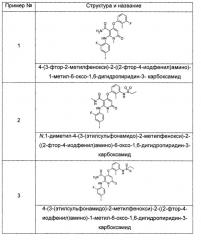
Типичные соединения по настоящему изобретению включают следующие, но не ограничиваются ими:
или их таутомером, мезомером, рацематом, энантиомером или диастереоизомером, или их смесью, или их фармацевтически приемлемой солью.
В другом аспекте настоящее изобретение относится к соединению формулы (IA) или его таутомеру, мезомеру, рацемату, энантиомеру или диастереомеру, или его фармацевтически приемлемой соли, которые могут быть использованы в качестве промежуточного продукта для получения соединения формулы (I), или его таутомера, изомера, рацемата, энантиомера, или его диастереомера,
где:
R1, R4 до R6 представляют собой такие, как определено в формуле (I);
PG выбран из группы, состоящей из алкила и амино-защитной группы, где амино-защитной группой предпочтительно является бензил; каждый из алкила и бензила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, циано-, нитро-, алкила, циклоалкила, гетероциклила, гетероарила и -OR7; и
R7 выбран из группы, состоящей из водорода, алкила, циклоалкила, гетероциклила, арила и гетероарила, где каждый из алкила, циклоалкила, гетероциклила, арила и гетероарила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из алкила, галогена, гидрокси-, алкокси-, циклоалкила, гетероциклила, арила, гетероарила, карбоксила и алкоксикарбонила.
Типичные соединения формулы (IA) по настоящему изобретению включают следующие, но не ограничиваются ими:
или их таутомер, мезомер, рацемат, энантиомер или диастереоизомер, или их смесь или их фармацевтически приемлемая соль.
В другом аспекте настоящее изобретение относится к способу получения соединения формулы (IA) или его таутомера, мезомера, рацемата, энантиомера или диастереомера, или их смеси, или его фармацевтически приемлемой соли, включающий стадию:
взаимодействия соединения формулы (Ii) с нуклеофилом R1H с получением соединения формулы (IA);
где: R1, R4 до R6 представляют собой такие, как определено в формуле (I);
-OG является уходящей группой, предпочтительно сульфонилокси-;
PG выбран из группы, состоящей из алкила и амино-защитной группы, где амино-защитная группа предпочтительно представляет собой бензил; каждый из алкила и бензила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, циано-, нитро-, алкила, циклоалкила, гетероциклила, арила, гетероарила и - OR7; и
R7 выбран из группы, состоящей из водорода, алкила, циклоалкила, гетероциклила, арила и гетероарила, где каждый из алкила, циклоалкила, гетероциклила, арила и гетероарила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из алкила, галогена, гидрокси-, алкокси-, циклоалкила, гетероциклила, арила, гетероарила, карбоксила и алкоксикарбонила.
В вышеуказанном техническом решении щелочные условия обеспечивают с помощью реагента, включающего органическую щелочь и неорганическую щелочь, где органическая щелочь включает, не ограничиваясь, триэтиламин, пиридин, 2,6-лутидин, метоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, n-бутиллитий, трет-бутоксид калия и бромид тетрабутиламмония; и неорганическая щелочь включает, не ограничиваясь, гидрид натрия, карбонат натрия, бикарбонат натрия, карбонат калия, бикарбонат калия, карбонат цезия, гидроксид лития, гидроксид натрия и гидроксид калия; щелочной реагент предпочтительно представляет собой неорганическую щелочь, более предпочтительно гидрид натрия или карбонат цезия.
В другом аспекте настоящее изобретение относится к способу получения соединения формулы (I), или его таутомера, мезомера, рацемата, энантиомера или диастереомера, или их смеси, или его фармацевтически приемлемой соли, включающему стадию:
раскрытия кольца соединения формулы (IA) в щелочных условиях, необязательного удаления амино-защитной группы PG, с получением соединения формулы (I);
где:
R1-R6 являются такими, как определено в формуле (I);
PG выбран из группы, состоящей из алкила и амино-защитной группы, где амино-защитная группа предпочтительно представляет собой бензил; каждый из алкила и бензила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из галогена, циано-, нитро-, алкила, циклоалкила, гетероциклила, арила, гетероарила и -OR7; и
R7 выбран из группы, состоящей из водорода, алкила, циклоалкила, гетероциклила, арила и гетероарила, где каждый из алкила, циклоалкила, гетероциклила, арила и гетероарила необязательно замещен одной или несколькими группами, выбранными из группы, состоящей из алкила, галогена, гидрокси-, алкокси-, циклоалкила, гетероциклила, арила, гетероарила, карбоксила и алкоксикарбонила.
В вышеуказанном техническом решении щелочные условия обеспечивают с помощью реагента, включющего органическую щелочь и неорганическую щелочь, где указанная органическая щелочь включает, не ограничиваясь, триэтиламин, пиридин, 2,6-лутидин, метоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, n-бутиллитий, трет-бутоксид калия и бромид тетрабутиламмония; и неорганическая щелочь включает, не ограничиваясь, гидрид натрия, карбонат натрия, бикарбонат натрия, карбонат калия, бикарбонат калия, карбонат цезия, гидроксид лития, гидроксид натрия и гидроксид калия; щелочной реагент в реакции с раскрытием колца в способе по настоящему изобретению предпочтительно представляет собой неорганическую щелочь, более предпочтительно гидроксид лития, гидроксид натрия или метилат натрия.
Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера или диастереомера, или их смеси, или его фармацевтически приемлемой соли, и фармацевтически приемлемый носитель, разбавитель или наполнитель.
Настоящее изобретение также относится к применению соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера или диастереомера или их смеси, или его фармацевтически приемлемой соли, или содержащей его фармацевтической композиции, для получения лекарственного средства для ингибирования МЕК.
Настоящее изобретение также относится к применению соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера или диастереомера или их смеси, или их фармацевтически приемлемой соли, или содержащей его фармацевтической композиции, для получения лекарственного средства для лечения воспалительного расстройства, аутоиммунного заболевания, сердечно-сосудистого расстройства, пролиферативного заболевания или ноцицептивного расстройства, где пролиферативное заболевание может представлять собой рак (как определено ниже).
Настоящее изобретение также относится к применению соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера или диастереомера или их смеси, или его фармацевтически приемлемой соли, или содержащей его фармацевтической композиции, для получения лекарственного средства для лечения рака, где рак выбран из группы, состоящей из меланомы, опухоли головного мозга (глиомы, включая астроцитому и олигодендроглиому и т.д.), рака пищевода, рака желудка, рака печени, рака поджелудочной железы, колоректального рака (рака толстой кишки, рака прямой кишки, и т.д.), рака легкого (немелкоклеточного рака легкого, мелкоклеточного рака легкого, первичного или метастатического плоскоклеточного рака и т.д.), рака почки, рака молочной железы, рака яичников, рака предстательной железы, рака кожи, нейробластомы, саркомы, остеохондромы, остеомы, остеосаркомы, семиномы, рака яичка, рака матки (рака шейки матки, рака эндометрия, и т.д.), рака головы и шеи (рака костей верхней челюсти, рака гортани, рака носоглотки, рака языка, рака полости рта и т.д.), множественной миеломы, злокачественной лимфомы (ретикулярно-клеточной саркомы, лимфосаркомы, лимфомы Ходжкина и т.д.), истинной полицитемии, лейкемии (острого миелоидного лейкоза, хронического миелоидного лейкоза, острого лимфобластного лейкоза, хронического лимфоцитарного лейкоза и т.д.), рака щитовидной железы, рака мочеточника, рака мочевого пузыря, рака желчного пузыря, холангиокарциномы, хориокарциномы и педиатрических опухолей (саркомы Юинга, саркомы Вильмса, рабдомиосаркомы, ангиосаркомы, фетального рака яичка, нейробластомы, ретинобластомы, гепатобластомы, нефробластомы и т.д.).
Настоящее изобретение также относится к применению соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера или диастереомера или их смеси, или его фармацевтически приемлемой соли, или содержащей его фармацевтической композиции, для получения лекарственного средства для лечения рака, где рак предпочтительно представляет собой колоректальный рак или рак легких.
Настоящее изобретение также относится к способу ингибирования активности МЕК, включающему стадию введения субъекту, нуждающемуся в таком введении, терапевтически эффективного количества соединения формулы (I), или его таутомера, мезомера, рацемата, энантиомера, диастереомера, или их смеси, или его фармацевтически приемлемой соли, или содержащей его фармацевтической композиции.
Дополнительно, настоящее изобретение относится к способу лечения воспалительного расстройства, аутоиммунного заболевания, сердечнососудистого расстройства, пролиферативного заболевания или ноцицептивного расстройства, включающему стадию введения субъекту, нуждающемуся в таком введении, терапевтически эффективного количества соединения формулы (I), или его таутомера, мезомера, рацемата, энантиомера, или диастереомера, или их смеси, или его фармацевтически приемлемой соли, или содержащей его фармацевтической композиции, где пролиферативное расстройство может представлять собой рак (как определено ниже).
Настоящее изобретение дополнительно относится к способу лечения рака, включающему стадию введения субъекту, нуждающемуся в таком введении, терапевтически эффективного количества соединения формулы (I), или его таутомера, мезомера, рацемата, энантиомера или диастереомера, или их смеси, или его фармацевтически приемлемой соли, или содержащей его фармацевтической композиции, где рак выбран из группы, состоящей из меланомы, опухоли головного мозга (глиомы, включая астроцитому и олигодендроглиому, и т.д.), рака пищевода, рака желудка, рака печени, рака поджелудочной железы, колоректального рака (рака толстой кишки, рака прямой кишки, и т.д.), рака легкого (немелкоклеточного рака легкого, мелкоклеточного рака легкого, первичного или метастатического плоскоклеточного рака и т.д.), рака почки, рака молочной железы, рака яичников, рака предстательной железы, рака кожи, нейробластомы, саркомы, остеохондромы, остеомы, остеосаркомы, семиномы, рака яичка, рака матки (рака шейки матки, рака эндометрия, и т.д.), рака головы и шеи (рака костей верхней челюсти, рака гортани, рака носоглотки, рака языка, рака полости рта и т.д.), множественной миеломы, злокачественной лимфомы (ретикулярно-клеточной саркомы, лимфосаркомы, лимфомы Ходжкина и т.д.), истинной полицитемии, лейкемии (острого миелоидного лейкоза, хронического миелоидного лейкоза, острого лимфобластного лейкоза, хронического лимфоцитарного лейкоза и т.д.), рака щитовидной железы, рака мочеточника, рака мочевого пузыря, рака желчного пузыря, холангиокарциномы, хориокарциномы и педиатрических опухолей (саркомы Юинга, саркомы Вильмса, рабдомиосаркомы, ангиосаркомы, фетального рак яичка, нейробластомы, ретинобластомы, злокачественной опухоли печени, нефробластомы и т.д.).
Настоящее изобретение также относится к соединению формулы (I) или его таутомеру, мезомеру, рацемату, энантиомеру, диастереомеру или их смеси, или его фармацевтически приемлемой соли, или содержащей его фармацевтической композиции, для применения в качестве лекарственного средства для ингибирования активности МЕК.
Настоящее изобретение также относится к соединению формулы (I) или его таутомеру, мезомеру, рацемату, энантиомеру или диастереомеру или их смеси, или его фармацевтически приемлемой соли, или содержащей его фармацевтической композиции, для применения в качестве лекарственного средства для лечения воспалительного расстройства, аутоиммунного заболевания, сердечно-сосудистого расстройства, пролиферативного заболевания или ноцицептивного расстройства, где пролиферативное заболевание может представлять собой рак.
Настоящее изобретение также относится к соединению формулы (I) или его таутомеру, мезомеру, рацемату, энантиомеру или их диастереомеру или их смеси, или его фармацевтически приемлемой соли, или содержащей его фармацевтической композиции, для применения в качестве лекарственного средства для лечения рака, где рак выбран из группы, состоящей из меланомы, опухоли головного мозга (глиомы, включая астроцитому и олигодендроглиому и т.д.), рака пищевода, рака желудка, рака печени, рака поджелудочной железы, рака прямой кишки (ракы толстой кишки, колоректальныого рака, и т.д.), рака легкого (немелкоклеточного рака легкого, мелкоклеточного рака легкого, первичного или метастатического плоскоклеточного рака и т.д.), рака почки, рака молочной железы, рака яичников, рака предстательной железы, рака кожи, нейробластомы, саркомы, остеохондромы, остеомы, остеосаркомы, семиномы, рака яичка, рака матки (рака шейки матки, рака эндометрия, и т.д.), рака головы и шеи (рака костей верхней челюсти, рак гортани, рака носоглотки, рака языка, рака полости рта и т.д.), множественной миеломы, злокачественной лимфомы (ретикулярно-клеточной саркомы, лимфосаркомы, лимфомы Ходжкина и т.д.), истинной полицитемии, лейкемии (острого миелоидного лейкоза, хронического миелоидного лейкоза, острого лимфобластного лейкоза, хронического лимфоцитарного лейкоза и т.д.), рака щитовидной железы, рака мочеточника, рака мочевого пузыря, рака желчного пузыря, холангиокарциномы, хориокарциномы и педиатрических опухолей (саркомы Юинга, саркомы Вильмса, рабдомиосаркомы, ангиосаркомы, фетального рака яичка, нейробластомы, ретинобластомы, гепатобластомы, нефробластомы и т.д.).
Фармацевтическая композиция, содержащая активный ингредиент, может находиться в форме, подходящей для перорального введения, например, в форме таблеток, пастилок, таблеток для рассасывания, водных или масляных суспензий, дисперсных порошков или гранул, эмульсий, твердых или мягких капсул, или сиропов, или эликсиров. Композиции, предназначенные для перорального применения, необязательно получают в соответствии с известными способами, и такие композиции могут содержать один или несколько агентов, выбранных из группы, состоящей из подсластителей, ароматизаторов, красителей и консервантов, добавляемых для получения фармацевтически лучших и приятных на вкус препаратов. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, пригодными для изготовления таблеток. Эти наполнители могут представлять собой инертные наполнители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующе агенты, такие как микрокристаллическая целлюлоза, кроскармеллоза натрия, кукурузный крахмал или альгиновая кислота; связующие агенты, такие как крахмал, желатин, поливинилпирролидон или аравийская камедь; и лубриканты, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть непокрытыми оболочкой или покрытыми известными способами для маскировки вкуса лекарственного средства или задержки дезинтеграции и абсорбции в желудочно-кишечном тракте, обеспечивая тем самым пролонгированное высвобождение в течение длительного периода. Например, может быть использован водорастворимый маскирующий вкус материал, такой как гидроксипропилметилцеллюлоза или гидроксипропилцеллюлоза, или материал для увеличения времени, такой как этил целлюлоза или бутират ацетатцеллюлозы.
Пероральные композиции также могут быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, таким как карбонат кальция, фосфат кальция или каолин, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водорастворимым носителем, таким как полиэтиленгликоль, или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии содержат активное вещество с добавкой наполнителей, подходящих для получения водных суспензий. Такими наполнителями являются суспендирующие агенты, такие как натрий-карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон и аравийская камедь; диспергирующие или смачивающие агенты, которые могут представлять собой природные фосфатиды, такие как лецитин, или продукты конденсации алкилен оксида с жирными кислотами, такие как стеарат полиоксиэтилена, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, такими как гептадекаэтиленокси цетанол, или продукты конденсации этилен оксида с неполными сложными эфирами, полученными из жирных кислот и гекситов, такие как моноолеат полиоксиэтиленсорбитана, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и ангидридов гексита, такие как моноолеат полиэтиленсорбитана. Водные суспензии могут также содержать один или несколько консервантов, таких как этилпарабен или н-пропилпарабен, один или несколько красителей, один или несколько вкусовых добавок и один или несколько подсластителей, таких как сахароза, сахарин или аспартам.
Масляные суспензии могут быть получены путем суспендирования активного ингредиента в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, такой как пчелиный воск, твердый парафин или цетиловый спирт. Указанные выше подсластители и вкусовые добавки могут быть добавлены для получения приятного на вкус препарата. Эти композиции могут быть презервированы пу