Фотохромные 3-(2,5-диметилтиофен-3-ил)-4-(1-алкил-2-диметил-5-метокси-1н-индол-3-ил)фуран-2,5-дионы с модулируемой флуоресценцией
Иллюстрации
Показать всеИзобретение относится к новым производным ряда 3-тиофенил-4-индолилфуран-2,5-дионов, а именно к 3-(2,5-диметилтиофен-3-ил)-4-(1-алкил-2-диметил-5-метокси-1Н-индол-3-ил)фуран-2,5-дионам общей формулы 1, в которой Alk = Me (a), Et (b), CH2Ph (с). Технический результат – получены новые соединения, которые могут найти свое применение в качестве фотохромов с модулируемыми под воздействием света флуоресцентными свойствами. 4 з.п. ф-лы, 1 табл., 3 пр.
Реферат
Изобретение относится к новым производным ряда 3-тиофенил-4-индолилфуран-2,5-дионов, а именно к 3-(2,5-диметилтиофен-3-ил)-4-(1-алкил-2-диметил-5-метокси-1Н-индол-3-ил)фуран-2,5-дионам общей формулы 1, проявляющим свойства фотохромов с модулируемыми под воздействием света флуоресцентными свойствами.
,
где Alk=Me (a), Et (b), CH2Ph (с).
Синтез и исследование фотохромных органических соединений составляют одну из важнейших проблем физической органической химии. Возможность фотомодуляции их физических свойств (эмиссионных, магнитных и др.) определяет главное направление их использования в качестве светочувствительных компонентов материалов для оптической записи информации (Organic photochromic and thermochromic compounds, eds. J.C. Crano, R.J. Guglielmetti, Plenum Press, N.Y., 1999; J. Zhang, Q. Zou, H. Tian, Photochromic materials: more than meets the eye, Adv. Mater., 2013, vol. 25, p. 378-399; V.I. Minkin, Bistable organic, organometallic, and coordination compounds for molecular electronics and spintronics, Russ. Chem. Bull., 2008, vol. 57, N 4, p. 687-717; V.A. Barachevsky, M.M. Krayushkin, Photochromic organic compounds for optical memory. Russ. Chem. Bull., 2008, vol. 57, N 4, p. 867-875). Фотохромные системы должны обладать термической стабильностью обеих изомерных форм, высокой устойчивостью к фотодеградации и выдерживать многократное повторение циклов «фотоокрашивание - фотообесцвечивание» без изменения молекулярного коэффициента экстинкции полос поглощения. Существенным фактором является наличие флуоресцентных свойств у исходной формы, либо (что предпочтительнее) у фотоиндуцированной окрашенной формы бистабильных фотохромов, поскольку это позволяет осуществлять недеструктивное считывание информации. Емкость устройств с использованием органических фотохромов может достигать около при использовании ультрафиолетового излучения. Важная роль в этом плане принадлежит дигетарилэтенам (в том числе с фуран-2,5-дионовым мостиком), которые обладают значительной устойчивостью, характеризуются высокой термической стабильностью как исходной, так и фотоиндуцированной форм и могут проявлять флуоресцентные, магнитные, хемосенсорные и комплексообразующие свойства (М. Irie, Diarylethenes for memories and switches, Chem. Rev., 2000, vol. 100, N 5, p. 1685-1716; M. Irie, T. Fukaminato, K. Matsuda, S Kobatake, Photochromism of diarylethene molecules and crystals: Memories, switches, and actuators, Chem. Rev., 2014, vol. 114, N 24, p. 12174-12277; H. Tian, Y. Feng, Next step of photochromic switches, J. Mater. Chem., 2008, vol. 18, N 14, p. 1617-1622; M.-H. Zheng, W. Sun, J.-Y. Jin, C.-H. Yan, Molecular keypad locks based on gated photochromism and enhanced fluorescence by protonation effects, J. Fluorescence, 2014, vol. 24, N 4, p. 1169-1176; E.C. Harvey, B.L. Feringa, J.G. Vos, W.R. Browne, M.T. Pryce, Transition metal functionalized photo- and redox-switchable diarylethene based molecular switches, Coord. Chem. Rev., 2015, vol. 282-283, p. 77-86). Их облучение УФ-светом приводит к гексатриен-циклогексадиеновой перегруппировке открытой (обычно бесцветной) формы в окрашенный циклический изомер. Эти изомерные формы не перегруппировываются друг в друга в отсутствии света и обладают существенно различными физико-химическими характеристиками. Наличие эмиссионных свойств у одного из изомеров открывает возможность для получения молекулярных переключателей с флуоресцентной сигнальной функцией и сред для 3D записи информации (K. Matsuda, М. Irie, Diarylethene as a photoswitching unit, J. Photochem. Photobiol. C: Photochem. Rev., 2004, vol. 5, N 2, p. 169-182; C. Yun, J. You, J. Kim, J. Huh, E. Kim, Photochromic fluorescence switching from diarylethenes and its applications, J. Photochem. Photobiol. C: Photochem. Rev., 2009, vol. 10, N 3, p. 111-129; V.Z. Shirinian, D.V. Lonshakov, A.G. Lvov, M.M. Krayushkin, Fluorescent photochromes of diarylethene series: synthesis and properties, Russ. Chem. Rev., 2013, vol. 82, N 6, p. 511-537). Для технического применения крайне важной характеристикой эффективности переключения является интенсивность длинноволновой полосы поглощения циклической формы.
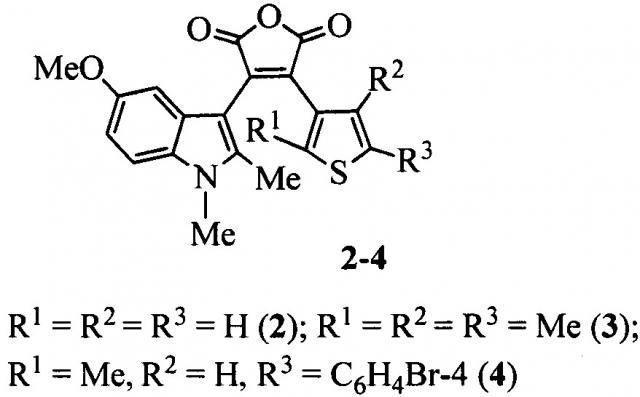
В ряду 3-тиофенил-4-индолилфуран-2,5-дионов известен 3-(5-метокси-1,2-диметил-1H-индол-3-ил)-4-(3-тиенил)фуран-2,5-дион 2 (N.I. Makarova, P.V. Levchenko, E.N. Shepelenko, A.V. Metelitsa, V.S. Kozyrev, V.P. Rybalkin, V.A. Bren, V.I. Minkin. Synthesis and photochromic properties of new nonsymmetric dihetarylethenes - indole and thiophene derivatives, Russ. Chem. Bull., 2011, vol. 60, N 9, p. 1899-1905).
Однако дигетарилэтен 2 характеризуется низкой интенсивностью флуоресценции и не обладает фотохромными свойствами.
В ряду 3-тиофенил-4-индолилфуран-2,5-дионов известен также 4-[2,4,5-триметилтиофен-3-ил]-3-(5-метокси-1,2-диметил-1H-индол-3-ил)фуран-2,5-дион 3 (Т. Yoshida, K. Arishima, F. Ebisawa, М. Hoshino, K. Sukegawa, A. Ishikawa, Т. Kobayashi, М. Hanazawa, Y. Horikawa, Refractive index changes in photochromic diarylethene derivatives in polymethylmethacrylate films, J. Photochem. Photobiol. A, 1996, vol. 95, p. 265-270; Y. Kim, H.Y. Jung, B.H. Chung, Reversible fluorescence photoswitch based on dye-crosslinked dendritic nanoclusters for high-contrast imaging of living biological systems, патент US №20120220734, C09B 69/10, B82Y 5/00, B82Y 15/00, 2011 г.).
Однако фурандион 3 при облучении демонстрирует крайне низкую фотоокрашиваемость.
Наиболее близким по структуре и достигаемому результату является 4-[5-(4-бромфенил)-2-метилтиофен-3-ил]-3-(5-метокси-1,2-диметил-1H-индол-3-ил)фуран-2,5-дион 4 (E.N. Shepelenko, N.I. Makarova, O.G. Karamov, A.D. Dubonosov, V.A. Podshibakin, A.V. Metelitsa, V.A. Bren, V.I. Minkin, Synthesis and Photochromic Properties of Asymmetric Dihetarylethenes Based on 5-Methoxy-l,2-Dimethylindole and 5-(4-Bromophenyl)-2-Methylthiophene, Chem. Heterocycl. Compd., 2014, vol. 50 N 7, p. 932-940).
Однако фурандион 4 при облучении демонстрирует также крайне низкую фотоокрашиваемость - оптическая плотность А в максимуме поглощения циклического изомера не превышает 0.078.
Техническим результатом настоящего изобретения являются новые производные ряда 3-тиофенил-4-индолилфуран-2,5-дионов, которые обладают высокими значениями фотоокрашиваемости и проявляют новое для данного ряда свойство фотохромов с модулируемыми флуоресцентными свойствами.
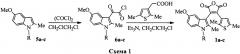
Технический результат достигается 3-(2,5-диметилтиофен-3-ил)-4-(1-алкил-2-диметил-5-метокси-1H-индол-3-ил)фуран-2,5-дионами общей формулы 1, синтез которых осуществляется по Схеме 1.
1,2-Диметил-5-метокси- (5а) (А.Н. Гринев, И.А. Зайцев, Н.К. Веневцева, А.П. Терентьев, Новый метод получения замещенных бензофуранов и индолов, Журн. общ. хим., 1958, т. 28, с. 1853-1855), 2-метил-5-метокси-1-этил- (5b) (A. Saito, S. Oda, Н. Fukaya, Yu. Hanzawa, Rhodium(I)-Catalyzed Synthesis of Indoles: Amino-Claisen Rearrangement of N-Propargylanilines, J. Org. Chem., 2009, vol. 74, N 4, p. 1517-1524) или 1-бензил-5-метокси-2-метил-1H-индол (5c) (А.Н. Гринев, К.А. Склобовский, Синтез производных 1-бензил-5-гидроксииндола, Хим. гетероцикл. соед., 1969, №5, с. 79-81) при взаимодействии с оксалилхлоридом превращаются в соответствующие хлордикетоны 6а-с, которые без выделения из реакционной смеси вступают в реакцию с 2-(2,5-диметилтиофен-3-ил)уксусной кислотой в присутствии триэтиламина и образуют соединения 1а-с.
Ниже приведены примеры получения фурандионов 1а-с.
Пример 1. 3-(2,5-Диметилтиофен-3-ил)-4-(1,2-диметил-5-метокси-1H-индол-3-ил)фуран-2,5-дион (1а). К раствору 0.53 г (3 ммоль) 1,2-диметил-5-метокси-1H-индола (5а) в 5 мл 1,2-дихлорэтана добавляют по каплям 0.26 мл (3 ммоль) оксалилхлорида при 0°С и перемешивают смесь при этой температуре 30 мин. Растворитель отгоняют, к сухому остатку добавляют раствор 0.51 г (3 ммоль) 2-(2,5-диметилтиофен-3-ил)уксусной кислоты и 2.1 мл (15 ммоль) триэтиламина в 7 мл 1,2-дихлорэтана. Реакционную смесь нагревают 1 ч с обратным холодильником и охлаждают. Выпавший осадок отфильтровывают и очищают колоночной хроматографией на силикагеле (элюент -хлороформ). Перекристаллизовывают из метанола. Выход 3-(2,5-диметилтиофен-3-ил)-4-(1,2-диметил-5-метокси-1H-индол-3-ил)фуран-2,5-диона 1а 0.29 г (25%). Красные кристаллы, т.пл. 177-178°С (МеОН). ИК спектр, ν, см-1: 1751, 1820. Спектр ЯМР 1Н (300 МГц, CDCl3) δ: 1.76 (с, 3Н, Me), 2.27 (с, 3Н, Me), 2.38 (с, 3Н, Me), 3.56 (с, 3Н, Me), 3.72 (с, 3Н, Me), 6.36 (с, 1Н, Нтиоф), 6.78-7.18 (м, 3Н, HAr). Найдено (%): С, 66.03; Н, 4.97; N, 3.60. Вычислено для C21H19NO4S (%): С, 66.12; Н, 5.02; N, 3.67.
Пример 2. 3-(2,5-Диметилтиофен-3-ил)-4-(2-метил-5-метокси-1-этил-1H-индол-3-ил)фуран-2,5-дион (1b). Получен по вышеописанной методике с использованием 2-метил-5-метокси-1-этил-1H-индола (0.57 г, 3 ммоль). Выход 0.23 г (21%). Красные кристаллы, т.пл. 168-170°С (МеОН). ИК спектр, ν, см-1: 1753, 1825. Спектр ЯМР 1Н (300 МГц, CDCl3) δ: 1.37 (м, 3Н, Me), 1.70 (с, 3Н, Me), 2.35 (с, 3Н, Me), 2.41 (с, 3Н, Me), 3.57 (с, 3Н, Me), 4.15 (м, 2Н, СН2), 6.36 (с, 1H, Hтиоф), 6.77-7.18 (м, 3Н, HAr). Найдено (%): С, 66.73; Н, 5.30; N, 3.51. Вычислено для C22H21NO4S (%): С, 66.82; Н, 5.35; N, 3.54.
Пример 3. 3-(2,5-Диметилтиофен-3-ил)-4-(1-бензил-2-метил-5-метокси-1H-индол-3-ил)фуран-2,5-дион (1с). Получен по вышеописанной методике с использованием 1-бензил-5-метокси-2-метил-1H-индола (0.75 г, 3 ммоль). Выход 0.39 г (29%). Красные кристаллы, т.пл. 190-192°С (МеОН). ИК спектр, ν, см-1: 1750, 1820. Спектр ЯМР 1Н (300 МГц, CDCl3) δ: 1.76 (с, 3Н, Me), 2.27 (с, 3Н, Me), 2.38 (с, 3Н, Me), 3.56 (с, 3Н, Me), 5.30 (с, 2Н, СН2), 6.38 (с, 1H, Hтиоф), 6.72-7.28 (м, 8Н, HAr). Найдено (%): С, 70.83; Н, 5.10; N, 3.01. Вычислено для C27H23NO4S (%): С, 70.88; Н, 5.07; N, 3.06.
Исследование абсорбционных, флуоресцентных и фотохромных свойств соединений 1а-с
Методы исследования
Спектрально-абсорбционные и спектрально-флуоресцентные характеристики исследовались по стандартным методикам в толуоле при 293 К. Съемка спектров поглощения проводилась на спектрофотометре Varian Cary 100, спектры флуоресценции сняты на спектрофлуориметре Varian Cary Eclipse. Облучение растворов проводилось при помощи ртутной лампы ДРШ-250 с набором интерференционных светофильтров для выделения линий ртутного спектра в кварцевой кювете (=1 см).
Результаты испытаний
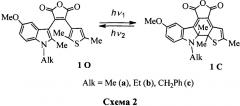
Электронные спектры поглощения фурандионов 1а-с характеризуются полосами поглощения с максимумами в диапазоне 443-450 нм. Молярные коэффициенты экстинкции в максимумах длинноволновых полос поглощения открытых форм О принимают значения (табл. 1). Фурандионы 1а-с проявляют флуоресцентные свойства в толуоле, максимумы полос флуоресценции находятся в спектральном диапазоне 511-524 нм. Спектры возбуждения флуоресценции соответствуют спектрам поглощения, что подтверждает корректность отнесения наблюдаемой эмиссии к исходной нециклической форме О. Облучение растворов соединений 1а-с в толуоле фильтрованным светом ртутной лампы 436 нм приводит к их фиолетовому окрашиванию, связанному с появлением новых длинноволновых полос поглощения в области 598-620 нм (таблица).
а По данным (N.I. Makarova, P.V. Levchenko, E.N. Shepelenko, A.V. Metelitsa, V.S. Kozyrev, V.P. Rybalkin, V.A. Bren, V.I. Minkin. Synthesis and photochromic properties of new nonsymmetric dihetarylethenes - indole and thiophene derivatives, Russ. Chem. Bull., 2011, vol. 60, N 9, p. 1899-1905), b (E.N. Shepelenko, N.I. Makarova, O.G. Karamov, A.D. Dubonosov, V.A. Podshibakin, A.V. Metelitsa, V.A. Bren, V.I. Minkin, Synthesis and Photochromic Properties of Asymmetric Dihetarylethenes Based on 5-Methoxy-l,2-Dimethylindole and 5-(4-Bromophenyl)-2-Methylthiophene, Chem. Heterocycl. Compd., 2014, vol. 50 N 7, p. 932-940)
Наблюдаемые спектральные изменения характерны для процессов фотоинициированной перегруппировки гексатриеновых открытых форм О в циклические 1,3-циклогексадиеновые изомеры С (схема 2).
В отличие от исходных соединений 1а-с О циклические изомеры 1а-с С флуоресценцией не обладают. Облучение растворов фотоизомеров С видимым светом (λ>500 нм) приводит к восстановлению исходной окраски и флуоресценции вследствие быстрой обратной изомеризации в открытые изомеры О.
Таким образом, проведенные исследования показали, что полученные фурандионы 1а-с представляют собой фотохромы с модулируемой светом флуоресценцией (выключение эмиссионных свойств - при воздействии света с длиной волны 436 нм, включение - при воздействии света с длиной волны >500 нм). Как следует из таблицы, соединения 1а-с по сравнению с соединениями 2 и 4 характеризуются значительно большей интенсивностью исходной флуоресценции. Кроме того, фурандионы 1а-с обладают существенно более высокой окрашиваемостью циклической фотоформы (значения оптической плотности А в максимуме полосы поглощения изомеров 1а-с С в 9.6-11.5 раз выше, чем для известного соединения 4).
1. 3-(2,5-Диметилтиофен-3-ил)-4-(1-алкил-2-диметил-5-метокси-1H-индол-3-ил)фуран-2,5-дионы общей формулы 1:
где Alk = Me (a), Et (b), CH2Ph (с).
2. 3-(2,5-Диметилтиофен-3-ил)-4-(1-алкил-2-диметил-5-метокси-1H-индол-3-ил)фуран-2,5-дионы по п. 1, где Alk = Me, а именно 3-(2,5-диметилтиофен-3-ил)-4-(1,2-диметил-5-метокси-1H-индол-3-ил)фуран-2,5-дион (1а).
3. 3-(2,5-Диметилтиофен-3-ил)-4-(1-алкил-2-диметил-5-метокси-1H-индол-3-ил)фуран-2,5-дионы по п. 1, где Alk = Et, а именно 3-(2,5-диметилтиофен-3-ил)-4-(2-метил-5-метокси-1-этил-1H-индол-3-ил)фуран-2,5-дион (1b).
4. 3-(2,5-Диметилтиофен-3-ил)-4-(1-алкил-2-диметил-5-метокси-1H-индол-3-ил)фуран-2,5-дионы по п. 1, где Alk = CH2Ph, а именно 3-(2,5-диметилтиофен-3-ил)-4-(1-бензил-2-метил-5-метокси-1H-индол-3-ил)фуран-2,5-дион (1с).
5. 3-(2,5-Диметилтиофен-3-ил)-4-(1-алкил-2-диметил-5-метокси-1H-индол-3-ил)фуран-2,5-дионы по п. 1, проявляющие свойства фотохромов с модулируемыми под воздействием света флуоресцентными свойствами.