Способ получения производных антрациклина
Иллюстрации
Показать всеРеферат
Союз Советских
Социалнстицвсних
Республик
ОП ИСАНИЕ
ИЗОБРЕТЕНИЯ
g ПАТЕНТУ д„897111 (61) Дополнительный к патенту— (22) Заявлено 14. 11. 77 (21) 2541702/23-04 (23) Приоритет — (32) 16.11 76 (31) 47601/76 (33)Великобритания (51) N. Кл.
С 07 Н 15/24//
A 61 К 31/70 (53} УДК 547.455.
° 07(088. 8) Опубликовано 07.01.82.Бюллетень №1, ; Дата опубликования описания 07.01.82
Иностранцы
Луиджи Бернарди (Италия), Паоло Мази (Я изобретения Антонио Суарато, Федерико Аркамоне (Ита
Иностранная фирма
"Сочиета Фармасьютичи Италия С.п.А" (Италия) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ЛРОИЗВОДНЫХ АНТРАЦИКЛИНА
Изобретение относится к способу получения новых производных антрациклина, обладающих ценными фармакологическими свойствами.
Цель изобретения — получение новых, полезных соединений, расширяюО 0Н ко о он
НЙ (ооударстеенный коиитет
СССР ао делан изобретений н отнрытнй щих арсенал средств воздействия на живой организм.
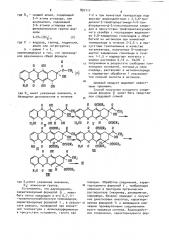
Эта цель достигается путем синтеза последних, основанного на известной реакции гликозидного синтеза Koenig s-Knorr (11, согласно способу получения новых производных антрациклина общей формулы
О
П
LH3
ОН
8971 где R - низший алкил, содержащий
2-4 атома углерода, или циклоалкил, содержащий
3-6 атомов углерода или фенилалкильная группа формулы х-и-(сн ) где Х - водород, галоид, гидроксил, амино или нитрогруппа; г1 - равно 1 и 2, заключающемуся в том, что производное дауномицина общей формулы
1о
О
И
C CHg ) он
О Он го
Z1O O Oa ОН где R< имеет указанные значения, в безводном дихлорметане в течение г5
OLOOX4
О OH
Н/О 0 у Н О®И4
О OCOOQ 0
Н
00 4 К,О О ОМОВ
НО O OCOOR
0 OH где К имеет указанные значения, R4- алкильная группа.
Установлено, что дауномицинон, характеризуемый формулой Я, может быть легко превращен в его б,7,11-триалкоксикарбонильную производную, характеризуемую формулой V,,в результате реакции, проводимой при комнатной температуре с алкилхлорформиатом в присутствии основания, такого как
НК о он н Он
0 000024 О
R O O дп H OOOO
П
11
4 I-2 ч при комнатной температуре под. вергают взаимодействию с 2,3,б-тридеокси-3-трифторацетамидо-4-0-трифторацетил-cL-L-ликсопиранозил хлоридом в присутствии трифторметансульфоната серебра с последующим выделением 0,N-защищенных гликоэидов и обработкой их метанолом при комнатной температуре в течение 2-2,5 ч в присутствии триэтиламина в качестве катализатора, полученные N-трифторацетил защищенные гликозиды в течеwe 1-1,5 ч подвергают контакту с водным раствором 0,15 í. NaOH c получением в результате свободных гликозидных оснований, которые,в csoe очередь, растворяют в метиленхлориде и подвергают обработке 1 эквивалентом соляной кислоты в метаноле.
Целевой продукт выделяют известными приемами.
Способ получения исходного соеди.нения формулы ill может быть представлен следующей схемой пиридин. Обработка соединения, характеризуемого формулой Y, трибромидом алюминия в пригодном органическом растворителе (например, дихлорметан, хлороформ, бензол) приводит к получению диметиловых аналогов, характеризуемых формулой И и являющихся ключевыми промежуточными соединениями всего процесса синтеза, Взаимодейст- . вие соединения, характеризуемого фор5 8971 мулой В, с галидом, характеризуемым общей формулой К„-Y где R„ èìåет указанные значения,Y — хлор, бром или йод, в присутствии основания, такого как окись серебра, карбонат з калия, в органическом растворителе и при температуре 10- 100 С приводит к образованию новых соединений, харак-. теризуемых. формулой й!
Далее проводится обработка слабым 16 органическим основанием, предпочтительно вторичным амином, таким как морфолин, метилпиперазин, и в результате происходит образование соединений, характеризуемых формулой VHI, !3 в которых удалена только фенольная защитная группа. Последняя стадия заключается в слабом гидролизе с помощью разбавленного неорганического основания соединения, характеризуе- 20 мого формулой 9II, в новые агликоны, характеризуемые формулой и .
Пример 1. 4-Диметокси-4-этоксидауномицин гидрохлорид.
К раствору, состоящему из 1,5 г 25
4-диметокси-4-этоксидауномицинона и 1,25 г 2,3,6-тридиокси-3-трифторацетамидо-4-0-трифторацетил-с -Ь-ликсопиранозил хлорида в 100 мл безводного дихлорметана, добавляют раствор, зв состоящий из 0,95 г трифторметансульфоната серебра в безводном диэтиловом эфире, указанный раствор добавляют по каплям при постоянном перемешивании и при комнатной температуре. Спустя один час полученную таким образом реакционную смесь подвергают промыванию водным раствором
ИаНСО и далее подвергают выпариванию до получения сухого продукта. Ос- таток растворяют в метаноле, содержащем 1 каплю триэтиламина, и далее отстаивают в течение 2 ч при комнатной температуре. Растворитель уда- ляют под вакуумом и остаток подвергают хроматографированию (силикагель/хлороформ-ацетон 95/5 об.Ф), в результате получают 0,9 r 4-диметокси-4-этокси-N-трифторацетилдауномицина. 50
0,05 мг 4-диметокси-4-этокси-N-трифторацетилдауномицина растворяют в 30 мл водного раствора 0,15 н.
NaOH и полученный в результате раствор отстаивают в течение 1 ч при комнатной температуре. После окисления щавелевой кислотой и последующей быстрой нейтрализации водным раство11 4 ром NaHCO и полученный продукт подвергают экстрагированию водой и выпариванию до получения сухого продукта.
Полученный остаток растворяют в метиленхлориде и далее обрабатывают 1 эквивалентом НС1 в метаноле. 8 результате добавления диэтилового эфира получают 350 мг 4-диметокси-4-этоксидауномицин гидрохлорида в виде осадка, и этот осадок собирают фильтрацией.
Пример 2. 4-Диметокси-4-изопропилоксидауномицин гидрохлорид.
К раствору, состоящему из 1 г
4-диметокси-4-изопропилоксидауномицинона и 0,95 г 2,3,6-тридиокси-3-трифторацетамидо-4-0-трифторацетил-Ы;L-ликсопиранозил хлорида в 100 мл безводного дихлорметана, добавляют раствор, состоящий из 0,80 г трифторметансульфоната серебра в безводном диэтиловом эфире, причем указанный раствор добавляют по каплям при перемешивании и при комнатной температуре. Спустя 1 ч полученную таким образом реакционную смесь про" мывают водным раствором NaHCOg u выпаривают до получения сухого продукта. Полученный остаток растворяют
-в метаноле, содержащем 1 каплю три" этиламина, -и далее отстаивают при комнатной температуре в течение 2 ч.
Растворитель удаляют под вакуумом, а образовавшийся остаток подвергают хроматографированию (силикагель/хлороформ-ацетон 95/5 об. i) с получением в результате 0,6. г 4-диметокси-4-изопропилокси-N-трифторацетилдауномицина.
0,500 r 4-диметокси-4-изопропилокси-N-трифторацетилдауномицина растворяют в 10 мл ацетона и 30 мл водного 0,15 И раствора NaOH и полученную таким образом смесь отстаивают в течение 1 ч при комнатной температуре. После окисления щавелевой кислотой и последующей быстрой нейтрализации водной NaHCO g полученный продукт экстрагируют водой и выпаривают до получения сухого продукта.
Полученный остаток растворяют в метиленхлориде и обрабатывают эквивалентным количеством НС1 в метаноле. В результате добавления диэтилового эфира получают 0,200 r осадка 4-диметокси-4-изопропилоксидауномицина -идрохлорида, который собирают с помощью фильтрации.
897" 1-1
Пример 3. 4-Диметокси-4-бензилоксидауномицин гидрохлорид.
По примеру 1 из 1 г 4-диметокси-4-бензилоксидауномицинона получают
0,35 г 4-диметокси-4-бензилокси-N- Ю
-трифторацетилдауномицина. 0,5 г
4-диметокси-4-бензилокси-N-трифторацетилдауномицина обрабатывают разбавленной ИаОН по примеру 1 и в результате получают 0,2 r 4-диметокси-4-бензилоксидауномицина гидрохлорида.
Пример 4. 4-Диметокси-4-циклогексилоксидауномицин гидрохлорид.
1,2 г 4-диметокси-4-циклогексилоксидауномицинона подвер гают конденсации с 2,3,6-тридиокси-3-фторацетамидо-4-0-трифторацетил-d,-L-ликсопиранозил хлоридом по примеру 1, и 20 в результате получают 0 5 r 4-диметокси-4-циклогексилокси-й-тpифторацетилдауномицина.
По примеру 1 из 0,5 г 4-диметокси-4-циклогексилокси-N-трифторацетилдауномицина получают,0,18 г
4-диметокси-4-циклогексилоксидауномицин гидрохлорида.
Пример 5. 4-Диметокси-4-н-пропилоксидауномицин гидрохлорид. 30
К раствору, содержащему 1 г 4-диметокси-4-н-пропилоксидауномицинона и 0,95 г 2,3,6-тридиокси-3-трифторацетамидо-4-0-трифторацетил-d;L-ликсопиранозил хлорида в 100 мл безводного дихлорметана, добавляют. по каплям, при перемешивании и при комнатной температуре, раствор, состоящий из 0,8 г трифторметансульфона" та серебра в безводном диэтиловом 40 эфире. Спустя 1 ч полученную таким образом реакционную смесь промывают водным NaHCO>v выпаривают до получения сухого продукта.
Этот остаток растворяют в метаноле, содержащем одну каплю триэтиламина, и далее отстаивают при комнатной температуре в течение 2 ч.
Растворитель отделяют под вакуумом и полученный в результате остаток подвергают хроматографированию (силикагель/хлороформ-ацетон в объемном соотношении 95/5) и в результате получают 0,5 г 4-диметокси-4-нпропилокси-N-трифторацетилдауноми-.
55 цина.
0,5 г 4-диметокси-4-н-пропилокси-Я-трифторацетилдауномицина растворяют в 10 мл ацетона и 30 мл водного, 0,15 М ИаОН, полученный в результа-, те раствор подвергают отстаиванию в течение 1 ч при комнатной температуре.
После окисления щавелевой кислотой и нейтрализации водным раствором
NaHCO полученный продукт подвергают экстрагированию водой, и водный раствор выпаривают под вакуумом с получением остатка сухого продукта.
Этот сухой продукт далее подвергают растворению в метиленхлориде и обрабатывают 1 эквивалентом НС1 в метаноле.
В результате добавления диэтилового эфира получают 0,18 г 4-диметокси-4-н-пропилоксидауномицина гидро-. хлорида, в виде осадка, который собирают Фильтрацией.
Тонкослойная хроматография (ТСХ) на,кизельгельных пластинках F 254 (Иерк) - система растворителей хлоро(форм/метанол/вода 130/60/10 Rf=0,25.
Пример 6. 4-Диметокси-4-н. -бутилоксидауномицин гидрохлорид.
1,5 г 4-диметокси-4-н-бутилоксидауномицинона подвергают взаимодействию с 1,45 r 2,3,6-тридиокси-3-трифторацетамидо-4-0-трифторацетил-с(-N-ликсопиранозил хлорида в безводном дихлорметане и в присутствии 1,2 г трифторметансульфоната серебра по примеру 1.
В результате получают 0,90 r
4-диметокси-4-н"бутилокси-N-трифторацетилдауномицина. Тонкослойная хроматография (TCX) на кизельгельных пластинках Р 2S4 (Иерк) — система растворителей хлороформ/метанол/вода
130/60/10 Ы = 0,54. 0,8 г 4-диметокси-4н-бутилокси-N-трифторацетилдауномицина подвергают гидролизу с водным 0,15 М раствором NaOH по примеру 1, с получением 0,3 г 4-диметокси-4-бутилоксидауномицина гидрохлорида.
Пример 7. 4-Диметокси-4-втор-бутилоксидауномицин гидрохлорид °
0,4 г 4-диметокси-4-втор-бутилоксидауномицинона подвергают обра" ботке 0,39 г 2,3,6-тридиокси-3-трифторацетамидо-4-0-трифторацетил-d.- ;ликсопиранозил хлорида в присутствии 0,3 г трифторметансульфоната серебра по примеру 1 и в результате получают 0,2 г 4-диметокси-4-вторО
It с — ea
ОН
О ОН
R1O O OH OH
Формула изобретения
О
II
0— - бн, ОН
О OH
R1O о ОН
О НЙ
9 8971
-бутилокси- -трифторацетилдауномици- на. 0,15 г 4-диметокси-4-втор-бутилокси-N-трифторацетилдауномицина подвергают обработке водным 0,15 М раствором NaOH по примеру 1 в резуль- s тате получают 0,05 г 4-диметокси-4-втор-бутйлоксидауномицина гидрохлорида.
П р и м, е р 8. 4-Диметокси-4-изо бутилоксидауномицин гидрохлорид.
0,7 r 4-диметокси-4-изобутилокси дауномицинона подвергают обработке
0,63 r 2,3,6-тридиокси-3-трифторацетамидо-4-0-трифторацетил-d,-L-ликсопи ранозилхлорида в присутствии 0,5 r трифторметансульфоната серебра по примеру 1 и в результате получают
0,3 r 4-диметокси-4-изобутилокси-N-трифторацетилдауномицина. 0,25 r
4-диметокси-4-изобутилокси-N-три- 2о фторацетилдауйомицина подвергают обработке водным 0,15 М раствором NaOH по примеру 1 и в результате получают
0,08 r 4-диметокси-4-изобутилокси.1дауномицина гидрохлорида. 25
Тонкослойная хроматография (ТСХ) на кизельгельных пластинках F 254 (Мерк) — система растворителей хлороформ/метанол/вода 130/60/10 Rf
0,54. зе
Способ получения производных антрациклина общей формулы ?
11 10 где R< — низший алкил, содержащий
2-4 атома углерода, или циклоалкил, содержащий 3-6 атомов углерода, или фенилалкильная группа, характеризуемая формулы
2 „ где Х - водород, галоид, гидроксил, амино или нитрогруппа; и равно 1 или 2, отличающийся тем, что производное дауномицина формулы 1ц где R имеет указанные значения, 1 в безводном дихлорметане в течение
1-2 ч при комнатной температуре, подвергают взаимодействию с 2,3,6-1ридиокси-3-трифторацетамидо-4-0-трифторацетил-c(.-.L-ликсопиранозилхлоридом в присутствии трифторметансульфоната серебра с последующим выделением О,N-защищенных гликозидов и обработкой их метанолом при комнатной температуре в течение 2-2,5 ч в присутствии триэтиламина в качестве катализатора, полученные N-трифторацетил защищенные гликозиды в течение 1- 1,5. ч подвергают контакту с водным раствором 0,15 í. NaOH c получением в результате свободных гликозидных оснований, которые затем растворяют в метиленхлориде и подвергают обработке 1 эквивалентом соляной кислоты в метаноле.
Источники информации,,принятые во внимание при экспертизе
1. Кочетков Н.К., Бочков А.Ф., Дмитриев Б.A. Усов А.И., Чижов О.С., Шибаев В.Н. Химия углеводов. М., 1967, с.194.
ВНИИПИ Заказ 11751/47 Тираж 389 Подписное
Филиал ППП "Патент", г. Ужгород, ул.Проектная,4