Способ получения гексагидробензопирано/3,2-с/ пиридинов
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
Союз Советскик
Социалистических республик (61) Дополнительный к патенту (22) Заявлено 2306.78 (2) ) 2629397/23-04 (51) М. Кл. (32) 24 06 ° 77
01.06 ° 78 (33) Франция
С 07 D 471/14
A 61 К 31/44 (23) Приоритет
Государственный комитет
СССР ио делам изобретений и открытий . (31) 7719360
7816376
Опубликовано 230582 Бюллетень )ЧЬ 19 (53) УДК 547.83 ° .07 (08& ° 8) Дата опубликования описания 230592
Иностранцы
Филипп Бриз, Жан-Жак Бертелон и Жан-Клод (Франция) (72) Авторы изобретения
Иностранная фирма Лифа, Лионнэз Эндюстриель Фарма (Франция) (71) Заявитель
1 (54) СПОСОБ ПОЛУЧЕНИЯ РЕКСАГИДРОБЕНЗОПИРЛНО (3, 2-C) ПИРИДИНОВ лы, кто кв, о
В
СООСгКй, г к
Изобретение относится к получению новых эамещенных гексагидробензопирано (3,2-С) пиридинов, которые могут быть использованы в качестве антидепрессантов.
Известна реакция взаимодействия циклогексанона с 3-карбоэтоксикумарином в присутствии ацетата аммония при комнатной температуре в этаноле с последующей обработкой HCV и получением при этом лактама-1-амино-2,3-циклогексанхроман-4-Ж-карбамида уксусной кислоты (1).
Цель изобретения — разработка способа получения не описанных в литературе замещенных гексагидробенэопирано(3,2-с)пиридинов, отличающихся меньшей токсичностью и более высокой активностью по сравнению с известными антидепрессантами, например имипрамином.
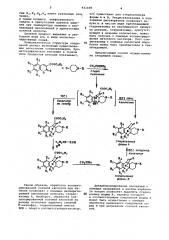
Поставленная цель достигается способом получения гексагидробенэопирано(3,2-С)пиридинов общей формугде R —. низший алкнл илн бенэил;
Е,(" водород, хлор, низшая алкоксигруппа;
R - водород, галоген, кроме иода, низший алкил, низшая алкокси-, нитрогруппа или
R3 с В4 образует бензольное кольцо;
Н4 - Водородi хлорy или их кислотно-аддитивных солей, заключающийся в том, что N-замещенный пиперидон-4 Формулы
I (11)
N где R имеет укаэанные значения, подвергают вэаимодействию с 3-карбэтоксикумарином общей формулы
З4
93ll08 п4
СООС2Н5 СИЗС00884
+ О= И-R
0 Спирт
Кипяченые
СООС2И5
НС1 N OH 2 аФ
СООС2И, к1 R5
R1 5
Стереоизомер форми Я
С2И50И- КОИ
Н йС1 конценщр. кипя чение
C00Cg Н5
СО ИЯа R) Стереоизомер формы 8 где Rg В2,R,R4 имеют укаэанные зна1
1$ чения, в среде низшего алифатического спирта в присутствии ацетата аммония при температуре кипения с последующей циклизацией в присутствии соляной кислоты.
Целевой продукт выделяют в свободном виде иль в виде кислотноаддитивных солей.
Полициклическая структура соеди,нений делает возможным существование нескольких стереоиэомеров. Хроматографическое изучение в тонком слое продуктов реакции показывает, Таким образом, обработка концентрированной соляной кислотой. при кипении позволяет с помощью дегидратирующей циклизации получить стереоиэомер A. Наоборот, обработка концентрированной соляной кислотой на холоде позволяет выделить сложный р-кетозфир, гидролизуемый смесью
КОН - спирт в соответствующую кислоту. что существуют два стереоизомера формы А и В. Рекристаллизация в подходящем растворителе позволяет получить в чистом виде преобладающий
5 стереоизомер из неочищенного продукта реакции. Стереоиэомер, присутствующий в меньшем количестве, может быть получен с помощью концентрирования маточного раствора. Этот стереоиэомер с помощью кислотной обработки может быть преобразован в преобладающий.
Предлагаемый способ осуществляют по следующей схеме:, Декарбоксилирование последней с помощью нагревания в кислом карбонате натрия позволяет выделить стерео60 изомер формы В, перевод которого в соответствующие соединения формы А может быть осуществлен с помощью обработки названного соединения серии В при нагревании соляной кислотой.
931108 т)0 т
20 ро25
40 Ce 10,34; М 8 17 °
: 55
Пример 1. Лактам. (4-аС-амино-2-метил-l, 2, 3, 4,4 сс, 10аС-гексагидро- (10Н) (бензопирано) (3,2-с) (пиридин))-10-ил уксусной кислоты.
С 5 Н 8 Мг02. Мол. вес 258,31.
В 34 л безводного этилового спирта растворяют 2,182 кг (10 моль) кумарин-3-карбоксилата этила, 1,144 кг (10 моль) Н-метил-4-пиперидона, добавляют 1,544 кг (20 моль) ацетата аммония и в течение 72 ч перемешиваю реакционную среду при температуре окружающей среды. На один час доводя до кипения и испаряют около 25 л этилового спирта. Смолистую массу вновь растворяют в 8,9 л концентрированной соляной кислоты и на полчаса доводят до кипения. Реакционную среду охлаждают с помощью ледяной ванны и доводят ее до щелочного рН с помощью 9 л 30%-ного NaOH.. Oáåç- . воживают полученное твердое вещество,которое имеет вид кремовидного п дукта, плавящегося при 228 С. Рекрис .таллизуют последний в 10 л изопропилового спирта. Получают 2,083 кг (выход 70%) ла..<тама (4 d.-амино-2-метил- l, 2, 3, 4, 4сс, 10аС-гексагидро- (10H) бензопирайо (3, 2- c) (пнридин) ) -10-ил уксусной кислоты (продукт A). РГ =
224 С, XRy = 0: 1690 см
Элементный анализ.
Вычислено, % С 69,74; Н 7,02;
N 10,85.
Найдено, %г С 69,62; Н 6,97; и 10 85.
Хлоргидратг PF = 250-252 С (этиCi ловый спирт) .
Хроматография в тонком слое: щелочная 0,1 N силикагелевая пластина; .элюентг метанол — хлороформ — циклогексан (1-3-5): 1 пятно. С помощью концентрирования маточного раствора получают продукт В. Рр. = 232-234оС, ?Нр.= 0: 1680 см .
Элементный анализ.
Вычислено,%: С 69,74; Н 7,02
N 10,85.
Найдено,%: С 69,72; Н 6,90;
N lOI7O.
Переход от В к А. В течение 1 ч поддерживают при кипении 10 г продукта в 100 мл концентрированной соляной кислоты. После охлаждения повышают основность среды с помощью
30%-ного NaOH извлекают с помощью
СНгСгг, сушат над На 804, Упаривают растворитель. Получают белое твердое вещество, физико-химические ха рактеристики которого полностью иден тичны характеристикам продукта А, Пример 2. Лактам (4-ю(.-амино-2-бензил-1,2,.3,4,4<,10аС-гексагидро-(10H)(бензопирано)(3,2-C)(пиридин))-10-ил-. уксусной кислоты.
С Нгг N O . Мол, вес 334,42.
Изготовлен согласно примеру 1, исходя из 47,6 г (0,218 моль) 3-карбэтоксикумарина, 33,4 r (0,218 моль)
N-бензил-4-пиперидона, 34,8 г (0,436 моль) ацетата аммония в 1,9 л безводного этилового спирта. Получают 43,7 г (выход 60%) лактама (4-ф-амино-2-бензил-1,2,3,4,4at,10 -гексагидро(10H)(бенэопирано)(3,2-С)пиридин)-10-ил уксусной кислоты в форме белого твердого вещества.
PF< 192 С (этиловый спирт).
Хлоргидрат: С г 8 CCN O 1 мол. вес
370,87; PFC = 254-255 С (метанол)
IR c = 0 1680 см
Элементный анализ.
Вычислено,%: С 68; Н 6,25; и 7 55
Се 9,56.
Найдено,%: С 68,32; Н 6,53
N 7,84; Се 9,61.
П р .и м е р 3. Лактам 4-а(-амино-2-метил-З-метокси-1,2,3,4,4d,lOoC-гексагидро-(10Н) (бензопирано)(3,2-С)пиридин)-10-ил уксусной кислоты.
CIe Нга КгО . Мол. вес 288,35.
Приготовлен согласно примеру 1, исходя из 93 г (0,375 моль) 8-метокси-З-карбэтоксикумарина, 30,6 г (0,375 моль) N-метил-4-пиперидона, 41,4 r (0,75 моль) ацетата аммония и 3,6 л спирта. Получают 48,6 г (выход 45%) лактама Г4-са-амико-2-метил -б-метокси-1,2,3,4,4аС,10о -гексагидро-(lOH)(бензопирано)(3,2-с)(пиридин)) 10-ил уксусной кислоты в форме белого твердого вещества.
PFс 258оС. С<< Нго "гоз,. мол-вес
288,35.
Хлоргидрат, моногидратг
CIe Н2 С9 Мг 04; мол. вес 34 2,82.
PF g, = 265а С (метанол) ТВ = О
1680 см 1В -ОН = 3.500 см
Элемеитнйй анализ.
Вычислено %г С 56,04; Н 6,76;
Найдено, % | С 56, 23 g Н 6, 39;
Се 1060; N 809.
Пример 4. Лактам (4-ес-амино-8-хлор-2-метил-1,2,3,4,4 „10ас-гексагидро-(10Н)(бензопирано) (3 2-C)(пиридин)(-10-ил уксусной кислоты.
С 5 Н CRNгОЗ. Мол. вес 292,77. !
5 IT
4.1. Продукт А.
В течение 8 ч кипятят 101, 06 г (О, 4 моль) 6-хлор-3-карбэтоксикумарана, 45,16 г (0,4 моль) N-метилпиперидона-4, 61,7 г (0,8 моль) ацетата аммония в 12 л этилового спирта.
Растворитель упаривают, а остаток вновь растворяют в 320 мл концентрированной соляной кислоты и полученный раствор в течение получаса доводят до кипения. Затем подщелачиваит 30%-ным йаОН, охлаждая среду ледяной ванной. Далее разбавляют водой и извлекают хлороформом. ПосI ле просушки над Иаг804 и упаривания получают 148 г бежевого твердо.«
931108
7 го вещества. Перекристаллиэовывают из смеси ацетон — метиловый спирт.
Получают лактам 4-et.-амико-хлор-8-метил-1,2,3,4,4ос,10o ;råêñагидро†(10H)(бензопирано)(3,2-с) (пирилин)) -10-ил уксусной кислоты (выход 47%)..
PF< = 245оС; ХН = 0: 1680 см
Элементный состав.
Вычислено,%: С 61,53; Н 5,85;
CC 12,11) N 9,57.
Найдено, %: С 61,76у Н 5,83;
СВ 12 01; N 9,56.
Хлоргидрат: С, Н,8 СЕ Н О,; мол.вес 329,22. РР = 260-262 С (этиловый спирт).
ИК: С-О:1680 см
Элементный анализ.
Вычислено,% С 54,72; Н 5,51;
Н 8,51; СС 21,54; О 9,72.
Найдено,%: С 54,31; Н 5,85;
N 8,23; С0 21,81; О
Метаносульфонат, 10 г продукта из примера 4.1 растворяют в необходимом количестве хлороформа при
60о С. Охлаждают до 40 С и добавляют
2,5 мл метансульфокислоты в растворе в 7,5 мл хлороформа. С помощью охлаждения получают белый продукт, который отжимают и рекристаллиэуют в метиловом спирте. PF = 265-267 С.
Элементный состав.
Вычислено.Ъ: С 49,42; Н 5 44;ф
СР 9,12; N 7,20.
Найдено,Ъ: С 49,29; Н 5,45у
CO 8,95; N 7,13.
4.2. Продукт В.
4.2.1: Лактам этилового моноэфира (4-е -амино-8-хлор-2-метил- 1,2,3, 4,4<,16а-гексагидро(10Н)(бенэопирано)(3,2-с)(пиридин) 10-ил малоновой кислоты
С{8 Hg(CCN204 Мол. вес 364,827.
В течение 8 ч кипятит 80 г (0,31 моль) 6-хлор-3-карбэтоксикумарина, 35,8 г (0,31 моль) N-метилпиперидона-4, 48,8 г (0,62 моль) аце-. тата аммония в 1240 мл этилового спирта. После упаривания остаток вновь растворяют в 600 мл холодной концентрированной соляной кислоты „ и перемешивают 1 ч. Доводят до щелочного рН с помощью добавления
600 мл ЗОЪ-ной соды и 600 г льда, поддерживая температуру ниже 25 С.
Дважды извлекают, каждый раз с помощью 1 л хлороформа. Органическую
Фазу высушивают на сульфате натрия, испаряют. С помощью рекристаллизации остатка в этиловом спирте получают 63 r указанного продукта с выходом 56%. РГ = 190 С.
ИК: С вЂ” О (эфйр) 1755 см
С вЂ” О (лактам) 1680 см
Элементный анализ.
Вычислено,Ъ: С 59,26; H 5,80;
N 7,68; СР 9,72; О 17,54.
Найдено,Ъ! С 59,23; Н 5,86;
N 7,58.
4.2.2. Лактам <4-оа-амино-.8-хлор-2-метил-1,2,3,4,4о(,10<-гексагидро-(10H)(бензопирано)(3,2-с) (пири5 дин)1 -10-ил малоновой кислоты.
К суспензии в 400 мл этилового спирта 53 r (0,15 моль) продукта из примера 4.2.1 добавляют раствор 21 r (0,375 моль) поташа в 400 мл воды.
Затем в течение часа кипятят, после чего охлаждают до 20 С и доводят рН о до 5-6 с помощью добавления соляной кислоты. Оставляют на ночь и отжимают осадок. Получают 35 г целевого продукта в виде основания с выходом
75,5%. РГ = 210-215 С с разложением.
HK: С вЂ” О 1700 см
0Н 3000 см
4.2.3. Продукт В.
К раствору 2,5 r (0,03 моль) бикарбоната натрия в 100 мл воды добавляют 10 г (0,03 моль) продукта из примера 4.2.2 и кипятят в течение
1 ч. Постепенно образуется осадок.
Затем охлаждают и отжимают. С помощью перекрнсталлизации в зтиловом спирте получают 4,1 г продукта В. PF<
246 С. IRyс = О 1700 см
Элементный анализ.
Вычислено, %: С 61 53; Н 5 83;
30 N 9,57,.
Найдено, %: C 61,36; H 5,85;
N 9,63.
Пример 5. Лактам (4-о -амино-8-бром-2-метил-l, 2, 3, 4,4сс, 10о(35 -гексагидро- (10Н) (бензопирано) (3, 2— c) (пиридин)1 — 10-ил уксусной кислоты.
С(6 Н т BrN10@ Мол. вес 337, 23.
Получают согласно примеру 4. 1, 4р исходя иэ 47 г (О, 158 моль) 6-бром-З-карбэтоксикумарина, 18,1 r (О, 158 моль) N-метилпиперидона-4, 24,4 r (0,316 моль) ацетата аммония и 3 л этилового спирта. После пере45 кристаллизации из смеси ацетона с этиловым спиртом получают 26 г лактама f.4-4. амино-8-бром-2-метил-1,2,3,4,4о(,10 "гексагидро-(10H)(бензопирано)(3,2-с)(пиридин)3 — 10-ил
50 уксусной кислоты, (в д 49Ъ) PF6 =
237-239 С. ХВ = О:1690 см
Элементный анализ.
Вычислено,Ъ: С 53,42; Н 5,08;
Br 23,70 ° N 8,31.
Найдено,Ъ: С 53,60; H 5,08;
Br 23р87; N 8,40.
Соединение в форме цитрата. ИК:
С - О 1700 см
Элементный анализ.
Вычислено,Ъ: С 47,76; H 4,86;
60 N 5 19 ; 0 27,38; Br 14,81.
-Йайдено,Ъ: С 47,26; Н 4,76;
N 5,07;. Br 14,41.
Пример 6. Лактам (4- -ами65 но-2,8-диметил-1,2,3,4,4,10с .-гекса931108 гидро (10H) (бензопирано) (3,2-c) (пиридин)) -10-ил уксусной кислоты.
С(ь Н2оН20 . Мол. вес 272,34.
Получен согласно примеру 4.1, исходя из 60 г (0,258 моль) 6-метил-З-карбэтоксикумарина, 29,6 г 5 (О, 258 моль) N-метилпиперидона-4, 39,9 r (0,516 моль) - ацетата аммония и 2 л этилового спирта. После перекристаллизации из смеси ацетона с этиловым спиртом получают 39, 3 r 10 лак тама (4-а -ами но-2, 8-диметил— 1, 2,3,4,4о, 10of-гексагидро (10H) (бензопиранс) (3, 2- C) (пиридин)) — 10-ил уксусной кислоты (выход 56Ъ). PF
241-243 С. ?В с = О:1680.см
Элементный анализ.
Вычислено,Ъ: С 70,56; Н 7,40;
N 10, 29.
Найдено,Ъ С 70,58; Н 7 41)
И 10,38.
Пример 7. Лактам 1 4-а(;амино-8-ф тор- 2-метил- 1, 2, 3, 4, 4 - 10ос-гексагидро (10Н) (бензопирано) (3,2-C) (пиридин)1 -10-ил уксусной кислоты.
С,(5 Н (7 FNZOZ. Мол. вес 276,31.
7.1.6-Фтор.-З-карбэтоксикумарин.
C(z Н9Г04. Мол. вес 236, 19.
В течение 3 ч кипятят 77 F (О, 55 моль) 4-фтор-2-окси-бензальдегида, 96,6 г (0,604 моль) этилмалоната 220 мл этилового спирта, 2,9 мл пиперидина и 0,3 мл ледяной уксусной кислоты. Выливают в 600 мл охлажденной воды. Фильтруют и перекристаллизуют в этиловом спирте и по- Зэ лучают б-фтор-3-карбэтоксикумарин.
PFC = 108 С.
1Н = О:1710 см (лактон);
1730 см (сложный эфир); RMN (СОСВ3 )
Sppm относительно TMS; 3 Н до 1,4 40 (триплет); 2 Н до 4,35 (квартет);
3 H от 7,2 до 7,6 (массив); 1 Н до
8,5 (синглет) .
7. 2 ° Лактам 4-с6-амино-8-фтор- 45
-2-метил-l, 2,3,4,4о(, 10,-гексагидро (10H) (бензопирано) (3,2-C) (пиридин)) -10-ил уксусной кислоты.
С1 Нп FNZOZ. Мол. вес 276,31. получен согласно примеру 4.1, исходя из 80 г (0,339 моль) 6-фтор-З-карбэтоксикумарина, 38,8 r (0,339 моль) N-метилпиперидона-4, 52,4 г (0,678 моль) ацетата аммония и 2 л этилового спирта. После 55 перекристаллизации в этиловом спирте получают 37,5 r лактама (.4-af,-амино-8-фтор-2-метил-1,2,3,4,4ес,10к -гексагндро(10H)(бенэопирано)(3,2— с) (пиридин)1-10-ил уксусной кислоты 60 (выход 40%). PF< = 226-228 С. 1Нф — О:1680 см
Элементный анализ.
Вычислено,%: С 65,20; H 6,20;
:F 6,88; N 10,40. 65
Найдено,% С 64,,83; Н 6,09;
F 7,20; N 10,49.
Соединение в форме хлоргидрата.
ИК: С - 0 1680 см
Элементный анализ.
Вычислено,Ъ: С 54,47; Н 6,09;
N 8,47; О 14,51у F 5,74; C lE 10,71.
Йайдено,Ъг С 54,83; H 6,97;
И 8,341 СР 10 ° 41.
Пример 8.Лактам (7.-о -амино-2-метил-7аС-8,9,10,11,11ас-гексагидро-(12Н, (бензо) (f)(бензопирано) (3,2:)пиридин1 -10-ил уксусной кислоты.
С(9 Н20И202 Мол. вес 308,39.
Получен,согласно примеру 4. 1, исходя из 70 г (0,261 моль) бензо(Й)-З-карбэтоксикумарина, 30 г (О, 261 жюль) Ф«метилпиперидона-4, 40,4 г (0,522 моль) аиетата аммония и
1500 мл этилового спирта. После перекристаллизации из смеси этилацетата и метилового спирта получают
44,2 r лактама j7-of.-амино-10-метил-7оС,8,9,10,11,11о(.-гексагндро-(12Н)—
-(бензо)(f)(бензопирано)(3,2-C)пиридин) -10-ил уксусной кислоты, (выход
55%) . PFg = 263-265 С. 1В, = О:
1680 см- .
Элементный анализ.
-Вычислено,%: С 74,00; Н 6,54;
N 9,09;
Найдено,Ъ: С 73,91; Н 6,46;
N 8,96.
Пример 9. Лактам (4-о -амиио-7-хлор-2-метнл-l,2,3,4,4о,10ас-гексагидро- (10Н)(бензопирано) (3,2-c)(пиридин)) -10-ил уксусной кислоты.
С15 Н1Т CeN202. Ион. вес 292,77.
9. 1. 7-Хлор-З-карбэтоксикумарин.
С(1 Н9СИО4. Мол. вес. 252,5.
В течение 5 ч доводят до кипения
11,2 r (0,071 моль) хлор-4-окси-2-бензальдегида, 12,5 г (0,072 моль) этилмалоната, 30 мл этилового спирта, 0,4 мл пиперидина и 0,1 мл уксусной кислоты. Реакционную среду охлаждают до 0 С и отжимают образовавшийся осадок. Промывают гексаном и высушивают полученный 7-хлор-30
-карбэтоксикумарин. РР = 122-3 С.
И5 = 0:1760 см (лактон и сложный эфйр) .
RMN (CDCep) 8 ppm относительно
TMS; 3 Н до 1,3 (триплет); 2 Н до
4,35 (квартет); 3 Н от 7,1 до 7,6 (массив) 1 Н до 8,45 (синглет) .
9. 2. Лактам (4-ос-амино-7-хлор-2"метил- l, 2, 3, 4,4af., 10ес- (10Н) (бензопирано) (3,2-С) (пиридин)) -10-ил уксусной кислоты.
Получен согласно примеру 4.1, исходя из 6,5 г (0,026 моль) 7-хлор-3-карбэтоксикумарина, 2,9 r (0,026 моль)
N-метилпиперидона-4,4 г (О, 052 моль1 ацетата аммония и 150. мл этилового спирта. После перекристаллизации
931108
12 в этиловом спирте получают 3 г укаэанного лактама, (выход 40%). РГ, 256-258 С. IRy. = 0 1675 см
Элементный анализ.
Вычислено,%: С 61,53) Н 5,85;
С6 12 11) N 9,57.
Найдено, %! С 61g34g Н 5,86l
СВ 12,40; N 9,63.
П ф и м е р 10. Лактам (.4-К-амино-8-нитро-2-метил- 1,2,3,4оС,10а -(1OH) (бензопирано)(3,2-с) (пиридин))° -10-ил уксусной кислоты.
С(Ь H <> N304 Мол. вес 303, 32.
Получен согласно примеру 4.1, исходя из 70 r (0,27 моль) б-нитро-З-карбэтоксикумарнна, 80,6 г (0,27 моль) И-метилпиперидона-4, 41,3 г (0,54 моль) ацетата аммония и 1,5 л этилового спирта. После перекристаллизации этиловом спирте получают 38,8 г лактама (4-®-амино-8-нитро-2-метил-1,2,3,4,4о,10ьс-гексагидро(10Н)(бензопирано)(3,2-()(пиридин)-10-ил уксусной кислоты, (выход 47,4%) ° PFg = 240-242ОС;
IRq - = 0: 1680 см -9
Элементный анализ
Вычислено, % ° С 59,40 Я 5,65;
И 13,85.
Найдено, %: С 59,25; Н 5,66;
N 13,74, Соединение в форме хлоргидрата. ,ИКт С - О 1680 см
Элементный анализ.
Вычислено,%: С 53,02; Н 5,34;
N 12,37 С0 10,43; О 18t84.
Найдено, %: С 52,94р Н 5,30;
N 12,48; СС10,36.
РР = 230-232ОC,IRg = 0:1680 см
Фе
Элементный анализ.
Вычислено,%: С 66,91; Н 7,01;
N 15,37.
Найдено, %: С 65,77ó Н.6,88;
И 15,22.
Пример ll. Лактам 6,8-дихло р-4-ас- ами но-2-метил- l, 2, 3, 4, 4 g 10 (,-гексагидро- (10Н) (бенэопирано) (3,2-С) (пиридин)) -10-.ил уксусной кислоты.
С(5 Н
Получен согласно примеру 4.1, исходя из 17,8 r (0,062 моль) 6,8-дихлор-З-карбэтоксикумарина, 7,1 г,.
° (0,062 моль) И- метилпиперидона-4, 9,5 r (0,124 моль) ацетата аммония и 800 мп этилового спирта. После перекристаллизации в ацетате этила, получают 7,7 r лактама 6,8-дихлор-4-с(-амино-1,2,3,4,4ас,10аС-гексагидро-(10Н)(бензопирано)(3,2-с) (пиридин)) -10-ил уксусной кислоты, (выхоД 38%) . РГ = 212-216 С; 1Н
= Ог1680 см- .
ЭлЕментный анализ.
Вычислено,%: С 55,05; Н 4,93;
CE 21,57; N 8,56.
Найдено, %: С 54 89; Н 4 96;
С 21 53 N 8,51
Пример 12. Лактам (4- -ами- но-8-метокси-2-метил- l, 2, 3, 4, 4 а 104-гексагидро- (10Н) (бензопирано) (3,2-С) (пиридин)) -10-ил уксусной кислоты.
С(6 НgoN O@ Мол. вес 288, 35.
Получен согласно примеру 4.1, исходя из 35,5 г (0,143 моль) 6-метокси-З-карбэтоксикумарина, 16,4 г (0,143 моль) N-метилпиперидона-4, 22,1 r (0,286 моль) ацетата аммония
)О и 400 мп этилового спирта. С помощью перекристаллизации в изопропиловом спирте получают 26 г лактама (4-е-амино-8-метокси-2-метил-1,2,3,4,4o ., 10ц(.-гексагидро-(lOH)(бензопирано)— †(3,2-С)(пиридин)1 -10-ил уксусной кислоты, (выход 63%) . PF+ = 210212 С, IR = 0:1680 см- .
Элементйый анализ.
Вычислено, %: С 66,65; Н 6,99; щ N 9,71е
Найдено, %: С 66 61; Н 6,89;
N 9,67.
Соединение в форме метансульфоната. ИК: С вЂ” 0:1680 см
Элементный анализ:
Вычислено, %: С 53,11; Н 6,29;
И 7,28 О 24,97; Я 8,34.
Найдено, %: С 52,92; Н 6,54;
N 6,99.
Пример 13. Лактам 4-сС-амино-9-хлор-2-метил-l, 2,3,4,4 10с6-гексагидро-(lOH)(бензопирано)(3,2-e)(пиридин)) -10-ил уксусной кислоты.
С Н7СРИ О . Мол. вес 292,77.
13 ° 1. 5-Хлор-3-карбэтоксикумарин (формула 21) .
С< Н9ССО4. Мол. вес 252, 5.
В течение 5 ч нагревают при кипячении смесь из 15 r (0,0958 моль)
40 2-хлор-б-оксибен зальдегида, 16, 7 г (0,105 моль) этилмалоната, 40 мл этилового спирта, 0,6 мп пиперидина и 0,1 мп уксусной кислоты. После охлаждения отжимают полученный про- ., 45 дукт. Высушивают и получают 14 r 5-хлор-Ç-карбэтоксикумарина, (выход
58%) ° PF = 142, 144 С.
IR9 = 0$1720 см (- С = 0!
1760 см у RMN (CDCBq) S pea относительно TMS 1 Н до 1,45 (триплет);
2 Н до 4,5 (квартет); 3 Н от 7,1 до
7,7 (массив) 1 Н до 8,8 (синглет) .
l3 2. Лактам 1 4-Ж-амино-9- хлор-2-метил- l, 2, 3, 4, 4, 10 -гексагидро (10Н) (бензопирано) (3, 2-C) (пиридинЦ -10-ил уксусной кислоты.
С(Н CKN О . Мол. вес 292,77.
Получен согласно примеру 4.1, исходя из 13,6 г (0,054 моль) 5-хлор-З-карбэтоксикумарина, 6,1 г (0,054 моль) N-метилпиперидона-4, 8,3 r (0,108 моль) ацетата аммония и 240 мл этилового спирта. После перекристаллизации в этиловом спирте получают 6,7 л лактама 4-а,-амино63) -9-хлор-2-метил-2, 3, 4, 4, 10аС-гекса13
931108
30
C(6 Н(yCPNgOg. Мол. вес 306,79.
В автоклав помещают 33 г, (О, 125 моль) 6-хлор-3-карбзтоксикумарина, 14,3 г N-метилпнперндона-4, 24 г метнламина (0,25 моль) в 33%- 65 гидро- (10Í) (бензопирано) (3,2-с) (пиридин)) -10-ил уксусной кислоты, (выход 42i4%) .
PFq = 241-243 С, IRy = О
1680 см
Элементный анализ.
Вычислено, %: С 61,53; Н 5,85;
CR 12,11; N 9,57.
Найдено,%: С 61,36; Н 5,76;
CR 11,98; N 9,61.
Пример 14. Лактам ) 4-фа-ами- 10 но-б-хлор-2-метил-1,2,3«4<,10оС-гексагидро-(10H) (бензопираио)(3,2-С)(пиридин)) -10-ил уксусной кислоты.
С 5 Н(ТСОИ О . Мол. вес 292,77 °
Получен согласно примеру 4.1, ис- 15 ходя из 12 r(0,,048 моль) 8-хлор-3-карбэтоксикумарина, 5,5 г (0,048 моль) N-метилпиперидона-4, 7,4 г (0,096 моль) ацетата аммония и 140 мп этилового спирта. После 20 перекристаллизации в изопропиловом спирте получают 6 г лактама (4-.а(.-амино-6-хлор-2-метил- 1 2,3,4,4Ы,IOd,— гексагидро-(10Н)(бензопиранО)(3,2-C)(пиридин)) -10 ил Уксусной кисло 25 ты, (выход 43%). PF = 206-208ОС
1ЫС = О:1680 см .
Элементный анализ.
Вычислено, %г С 61,53; Н 5,85;
С0 12,11; N 9,57.
Найдено, %: С 61,43; Н 5,78;
СР 12,32; N 9,53.
Пример 15. Лактам (4-Ô-амино-8-хлор-2-фенил-1,2,3,4,4д(,IOcC-гексагидро-(10Н)(бензопирано)(3,2-С)(пиридин)) -10-ил уксусной кислоты.
Cio H 9 CC NgOg . Мол. вес 354, 83.
Получен согласно примеру 4.1, исходя из 16,9 r (0,067 моль) 6-хлор-З-карбэтоксикумарина, 11,7 r 40 (0,067 моль) N- фенилпиперидона-4, 10,5 r (0,134 моль) ацетата аммония и 480 мл этилового спирта. С помощью перекристаллизации в метиловом спирте получают 9,5 r лактама (4-ot.-ами- 45 но-8-хлор-2-фенил-1, 2, 3,4,4 Ф, 10еС-гексагидро- (10Н) (бензопирано) (3, 2-С) (пиридин))-10-ил уксусной кислоты. (выход 40%) . PF = 220-222 С, 1ИСΠ—: 1680 см-1 . 50
Элементный анализ-.
Вычислено,%: С 67,70; Н 5,40;
С< 9,991 N 7,89.
Найдено, %: С. 67,83; Н 5,48;
СЕ986) N786 ° 55
Пример 16. Лактам (4-ас-метиламино-8-хлор-2-фенил-1,2,3,4,4ос, 1ОК-гексагидро (10H) (бензопирано) (3,2,-С) (пиридин)1 — 10-ил уксусной кислоты.
60 ном. растворе этилового спирта и
550 мп этилового спирта. В течение
7 ч температуру поддерживают при
)70-80 С. После охлаждения обрабаты;вают так же, как в примере 4.1. После перекристаллизации в этило ом спирте получают 13 г лактама (.8-хлор-2-метил-4 -метиламин-1,2,3,4,4а(,10к-гексагидро-(10Н}-бензопирано(3,2-с)(пноидин)(-10 мд уксусной кислоты, (выход а34%) .РГ =158-160 С, INC =
= О!1680 см" °
Элементный анализ.
Вычислено, %: С 62,64; H 6,26
Ct 11,56у N 9,13.
Найдено, %: С 62,70 Н 6,36)
CR 11,48; М 9,20.
П р и и е р 17. Лактам (4-е(..-беизиламин-2-метил-8-хлор-1, 2, 3,4, 4 а(, 10а!-гексагидро- (10Н) (бен зопирано) (3, 2-C) (пиридин)) — 10-ил уксусной кислоты.
С 8 3C8N
Получен согласно примеру 4.1, исходя из 25,2 r (0,1 моль) N-метилпиперидона-4, 21, 4 г (О, 2 моль ) бензиламина и 500 мл этилового спирта. После перекристаллизации в динзопропиловом эфире получают 9,5 г лактама 34 -бензиламин-8-хлор-2-метил-1,2,3,4,4о,10ас-гексагидровЂ(10H)(бензопирано)(3,2-C)(пириднн))-10-ил уксусной кислоты; (выход 25%).
PF = 115-117 С, 1ИС = О:1690 см
Элементный анализ.
Вычислено, %г С 69,01; Н 6,05;
CQ 9,261 Н 7,32.
Найдено, %: С 69,14; H 6,15;
СЮ 9,07; N 7,17.
П р и и е р 18. Лактам (2-метил-4 -метиламино-1, 2, 3,4, 4, 10х-гексагидро(10Н)(бензопирано) (3,2-c) (пиридин)) -10-ил уксусной кислоты.
С<< H N Og. Мол. вес 272,34.
Получен согласно примеру 16, исходя из 27,3 г (0,125 моль) 3-карбэтоксикумарина, 14, 3 г N-метилпиперидона-4, 24 г (О, 25 моль) метиламина в 33%-ном растворе этилового спирта и 500 мл этилового спирта. Получают 25 г неочищенного основания цитр4ьт С H)8N Oqр мол. Bdc 464,48.
25 г неочищенного продукта раст.воряют в 120 мл ацетона и добавляют при охлаждении раствор 19,2 r (0,1 моль) лимонной кислоты в 200 мл ацетона. Полученный продукт отжимают и перекристаллиэовывают в этиловом спирте. Получают 14 r цитрата лактама (2-метил-4-<-метиламино-1,2,3,4, 4М,10ж-гексагидро-(10H) (бензопирано)(3,2-C)(пиридин)) — 10-ил уксусной кислоты, (выход 24%). РГ = 180182 С IROC = О:1690 см .
Элементный анализ.
Вычислено, %: С 56,89; Н 6,07у
N 6,03.
931108 соос,н, Формула изобретения г
35
СоставитЕль М. Меркулова
Редактор Н. Егорова Техред М. Рейвес Корректор В. Синицкая
Тираж 448 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и.открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Заказ 3565/90
Филиал ППП Патент, г. ужгород ул. Проектная, 4
Найдено, %: С 56,69; H 5,97;
N 5,92.
Пример 19. Лактам (4- (.-амино-2-бенэил-8-хлор-1, 2, 3,4,4< 10ob-гексагидро (10H) (бензопирано) (3,2-
-С) (пиридин)) -10-ил уксусной кислоты.
C „H ÑÂÍãÎã. Мол. вес 368,8.
Получен исходя из 292 г(11,15 моль) б-хлор-З-карбэтоксикумаоина, 219 г (1,15 моль) N-бензилпиперидона-4, 178 r (2,31 моль) ацетата аммония и
4 л этилового спирта.
После рекристаллизации в этиловом, спирте получают 220,7 r целевого лактама с выходом 52%. PF = 137- 15
139 С, IROC= 0:1680 см
cj
Элементный анализ.
Вычислено, %: С 68,38; Н 5,74;
СР 9,61; N 7,5.
Найдено, Ъ: С 68,14; Н 5,63; 2р
С0 9,48; N 7,44.
Способ получения гексагидробензо" пирано (3,2-с)пиридинов общей формулы 1: где R — низший алкил или бенэил;
R4 — водород, хлор, низшая алкоксигруппа;
К1и R5 водородр 46
Н г — водород, галоген, кроме йо-. да, ни зший алкил, ни зшая алкокси-, нитрогруппа или
R с R4 образует бензольное, кольцо; .45
В4 ВОДОРОД к хлОР g или их кислотно-адцитивных солей, отличающийся тем,что
N-замещенный пиперидон-4 общей формулы 11: R
Я где R имеет указанные значения, подвергают взаимодействию с 3-карбэтоксикумарином общей формулы 111:
В4
О T где R<, R>,- НЗ и R4 имеют указанные значения, в среде низшего алифатического спирта в присутствии ацетата аммония при температуре кипения с последующими циклиэацией в присутствии соляной кислоты и выделением целевого продукта в свободном виде или в виде кислотно-аддитивных солей.
Приоритетпопризнакам: .24.06.77 при
R - бензил, низший алкил;
R4 — водород, низшая алкоксигруппа;
Н1,В4и Н5 — вОДОрОД
R> - водород, галоген, кроме йода, низший алкил или R > и R4 образуют бенэольное кольцо.
01.Q6.78 при
R — бензил, низший алкил; хлор, R - водород;
R> " низшая алкокси-, нитрогруппа;
R4 - хлор;
;R — водород.
Источники информации, принятые во внимание при экспертизе
1. A. Sammour, p. М. АЫас1у. Condensation of З arbamoxycournarin ,with Ketones .in the presence of
Ammonium Acetate or Amines Ind. of
Chemistry, 12, 1973, р. 51-53.