Способ получения производных 1-фурил-3,4-дигидроизохинолина или их гидрохлоридов
Иллюстрации
Показать всеРеферат
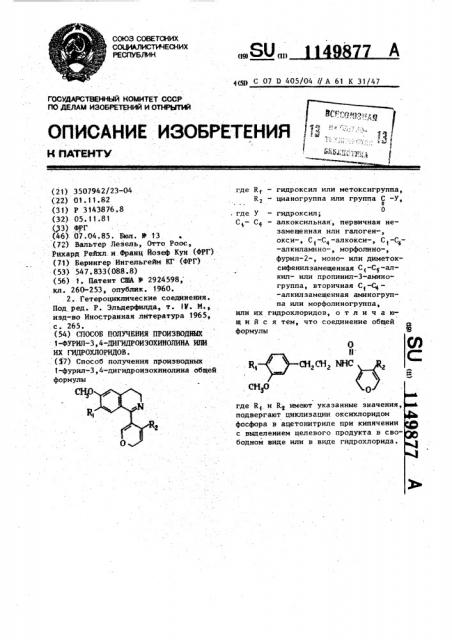
Способ получения производных 1-фурил-З,4-дигидроизохинолииа общей формулы Rf - гидроксйл или метоксигруппа, где R, - цианогруппа или группа С -У, . н у - гидроксйл; где С - алкоксильная, первичная несг замещенная или галоген-, ОКСИ-, С -С -алкокси-, ,-алкиламино- , морфолино-, фурил-2-, моноили диметоксифенилзамещенная С -Су-алкилили пропинил-3-аминогруппа , вторичная С -С -алкилзамещенная аминогруппа или морфолиногруппа, или их гидрохлоридов, о т л и ч а rain и и с я тем, что соединение общей формулы
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН (l% (И) 7 А
»(5И С 07 9 405/04 // A 61 К 31/47
ГОСМЙАРСТЗЕННЫЙ НОМИТЕТ GAP
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНР Щ4Й
ОПИСАНИЕ ИЗОБРЕТЕНИЯ д н naTam. 1 где К(— гидроксил или иетоксигруппа, R — цианогруппа илн группа С -У
2 Э 0
К, (гСнг г
СН,О 0 где К(и R< имеют указанные значения, подвергают циклизации оксихлоридом фосфора в ацетонитриле при кипячении с выделением целевого продукта в свободном виде или в виде гидрохлорида. (21) 3507942/23-04 (22) 01. 11. 82 (31) Р 3143876,8 (32) 05. 11.81 ,(3) ФРГ (46) 07.04.85. Sam. 13 .(72) Вальтер Лезель, Отто Роос, Рихард Рейхл и.Франц йозеФ 1(ун (ФРГ) (71) Берингер Иигельгейм Kl" (ФРГ) (53) 547. 833(088.8) (56) 1, Патент США И 2924598Ä кл. 260-253, опублик. 1960.
2. Гетероциклические соединения.
Под, ред. P. Зльдерфилда, т. ®..И., изд-во Инос.транная литература 1965, с. 265. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
t ÔÓÐÈË-3,4-ДИГИДРОИЗ0ХИНОЛИНА ИЛИ
ИХ ГИДРОХЛОРИДОВ. (f7} Способ получения производных
1-фурнл-3, 4-дигидроизохинолина общей формулы где У вЂ” гидроксил;
С - С» — алкоксильная, первичная незамещенная или галоген-, окси- C -С -алкокси- С -С—
1 4 1 4
-алкиламино-, морфолино-, фурил-2-, моно- или диметоксифенилзамещенная С<-С -алкил- или пропинил-3-аминогруппа, вторичная С -ѻ—
-алкилзамещенная аминогруппа или морфолиногруппа, нли их гидрохлоридов, о т л и ч а юшийся тем, что соединение общей формулы
1149877
Изобретение относится к способам получения новых производных 1-фурил-3,4-дигидроизохинолина общей формулы
СЯО
О fO где R — гидроксил или метоксигруппа, R — цианогруппа или группа С-У т и
О где У вЂ” гидроксил, С, -С - алкоксильная, первичная не 15 замещенная или галоген-, окси-, С1-С -алкокси, .С -С4-алкиламнно-, морфолино-, фурил-2-, моно- или диметоксифенилзамещенная 2О
С -С -алкил- или пронинил-3-аминогруппа, вторичная
С 1-С -алкилзамещениая аминогруппа или морфолиногруппа, 25 или их гидрохлоридов, которые обладают действием, способствующим кровоснабжению.
Известно применение никотината ксантинола в качестве средства для улуч- 3О шения кровоснабжения (lj .
Известен способ получения 1-арил-3,4-дигидроизохинолина циклизацией соответствующего И-ароилфенетиламина оксихлоридом Ц .
Целью изобретения является способ получения новых соединений общей формулы 1, обладающих действием, способствующим кровоснабжению.
Поставленная цель достигается предлагаемым способом получения про1-фурил-3,4-дигидрonsoxHHo
l лина общей формулы 1 или их гидрохлоридов, заключающимся в циклизации соединения общей формулы
4 О
П
2 2 сно
О где К 1 и R имеют указанные значения, оксихлоридом фосфора в ацетонитриле при кипячении.
Целевой продукт выделяют в свободном виде или в виде гидрохлорида. 55
Пример 1. Этиловый эфир 3-(3,4-дигидро-6,7-диметоксиизохинолин-1)-фуран-4-карбоновой кислоты, 50 г (2-(3,4-диметоксифенил) этил) амида 3-карбэтоксифуран-4-карбоновой кислоты растворяют в 120 мл ацетонитрила и прибавляют 18 мл оксихлорида фосфора. Реакционную смесь кипятят
2 ч. Затем упаривают, остаток растворяют в 200 мл метиленхлорида, раствором поташа в ледяной воде подщелачивают. Экстрагируют метиленхлоридом, сушат органическую фазу над сульфатом натрия, удаляют растворитель и очищают на колонке с силикагелем(СН С1 :ИеОН=100;1- 1-00:2).
Выход 37,5 г (797 теории) т.пл.151153 С.
H p и м е р 2. Н -Пропиламид-3-(3,4-дигидро-6,7 -диметокси-изохинолил--1)фуран-4-карбоновой кислоты.
40 г (2-(3,4-диметоксифенил)этил) амида 3-(H-пропиламино-карбонил)фуран-4-карбоновой кислоты растворяют в 400 мл ацетонитрила в вместе с
25 мл оксихлорида фосфора в течение
2 часов нагревают с обратным холодильником. Затем упаривают, остаток растворяют в 200 мл метиленхлорида и раствором поташа в ледяной воде подщелачивают. Дальнейшую переработку проводят по примеру 1.
Для получения гидрохлорида основание растворяют в небольшом количестве этанола и прибавляют этанольную соляную кислоту. Путем добавления по каплям абсолютного простого эфира высаживают гидрохлорид.
Выход:. 24, 1 г (57X от теоретического), т.пл. 199-205 С (разл.) .
Пример 3. Нитрил 3- 3,4-дигидро-6, 7-диметокси-изохинолил-1) фуран-4-карбоновой кислоты.
Повторяют пример 1 с той разницей, что смесь 10 r амида 3- (2-(3,4-диметоксифенил) эти аминокарбонил)фуран-4-карбоновой кислоты, 50 мл ацетонитрила и 30 мп оксихлорида фосфора кипятят в течение 90 мин.
Выход: 7,8 г (777 от теоретического), т.пл. 204-207 С (НС1 из метанола) простого эфира.
Аналогично примерам 1-3 получают соединения общей формулы 1, приведенные в табл. 1.
Фармакологические сравнительные опыты.
Соединения, приведенные в табл. 2, исследуют на их действие на местное кровоснабжение коры головного мозга кошек. На экземплярах мужского и
1149877
Таблица 1 б Ф б
Соединение Вы-.
I ход, (7 от теоВ виде гидрохлорида о
Т.пл., С по при меру риис
Основание 51,4
173-175
НС У 80,8
Основание 66,2
246
167-168 (разл.) 5 СН О
6 СНО
С0 3 сом(сн,), 212-215 (разл.) 7
HCE
92,1
203-205 (разл. ) HC3
88,5
216 (разл.) 75,2
НСЙ
215-2 t8 (разл.) 89,5
195-20О (разл. ) НС1
84,6
222-225 (разл.) HCE
77,1
244-245 (разл . ) НС6
89,0
83,7
162-t65
Соин(снg)g н(СНЗ) 14 СН О
НС0
116.-125 (разл. ) 68,9
216-218 (разл.) HCE
87,3
233-237 (разл.) НС9
63,6
3 женского пола весом 2,5-3,1 кг под пентобарбитальным наркозом (35 мг/кг, внутрибрюшинная дача) с помощью поверхностных зондов .по методу Голенгофена, Хензеля и Гильдебрандта производят измерение теплового клиренса на поверхности мозга. Животные быпи подвержены трахеотомии с произвольным дыханием.
Запись данных замера осуществляют при помощи флювографа.
4 Он cooc2H5
8 СН 0 C0N(CH СН1)2
9 CH O CONH(CH ) Сн
I.
1О сн о сонн{сн ) сн б сн о соннсн сн(сн ) с
12 сн,о сокнсн2сн, сн(сн, ), 13 СН О - СОННСН СвСН
15 СБ,О СОНН(СН,),Н(СН,), 1 6 СН О CGNHCH 2СН2ОСН б1
t 7 (l l t () CONHCH2CH2CH2CX
Полученные данные приведены в табл. 2.
Данные табл. 2 свидетельствуют о том, что новые соединения общей. формулы проявляют лучшую активность, чем известное соединение.
Таким образом, предложен способ получения новьм производных 1-фурил1О -3,4-дигидроизохинолинов, обладающих ценными биологическими свойствами.
1149877 нс
141-144
85,0
183-185 нсГ
72,2 сн о соинсн,сн
221-222
НСР
86,3
86,3 нсе
СН 0 CONHCH CH
23 СН-О СОИНСН СН ,I
186-192 нсг
69,7 сно соинсн нс
231-234
87,7
25 СН 3О СООН
212-213 нсе
68,4
Таблица 2
Изменения церебрального кровоснабжения, 7, при дозе соединения
Соединение по примеру мг/кг (ннутрибрюшинная дача) ) О мг/кг (внутрибрюшннная дача) J. 4
21
43
3 1
44
29
59
15
32
- 18 сн, о соынсн,сн(он) сн, / \
19 СНР СО-И О
/ \.
С,о CONCH CH — й
Продолжение табл. 1
Ф 5 б
У (разл. ) I.149877
Продолжение табл 2
Соединение по примеру
19
40
23
27
39
25
55
Редактор Н. Ланкулич
Заказ 1932/46 Тираж 384 Подпис ное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5!
11ииилл ППП "11атеит", г. Ужгород, ул. Проектная, 4
Никотинат ксантинола (известное соединение).
Изменения церебрального кровоснабжения, Х, при дозе соединения
3 кг/кг (внутрибрюшщнная дача) 10 мг/кг (внутрибрюшннная дача) .4 !
Составитель Н. Нарышкова
Техред Л.Иикеш Корректор Е. Сирохман