Способ получения производных цефалоспорина
Иллюстрации
Показать всеРеферат
Изобретение относится к гетероциклическим соединениям, в частности к получению производных цефалоспорина общей формулы .N Л.у S C-CCfNH-pY Q -Tvj WjIfQ-RKl) ч ORi СОО где Y - СН или N; R - свободный или замещенный карбоксилом или карбамоилом С4 4 алкил или R, - алкинил ; R - ОН; или карбамоил, которые могут.применяться в медицине, Цель - создание более активных веществ указанного класса. Их синтез ведут из соединения формулы .j-S. . , (II) сооЭили ,его аддитивной соли с галоидводородной или пергалогеновой кислотой и соединения формулы; S-C(NH) (COOH) (N-OF,) Y (III), где Y, R, и Rj указаны выше, или в присутствии 1-гидроксибензотриазола и дициклогексилкарбодиимида, или с галоидангидридом или гидрогалогенидом соединения III (лучше в присутствии органического основания). Новые цефалоспорины активнее цефотаксима в отношении Cotrobacter freundii и Pseudomanas maltophilia в 3 и 4-16 раз при токсичности г/кг. 2 табл. СО с 4 4 сл ел 05
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН
А3
„„SU„„14455 (51)4 С 07 D 501/06, 501/46//
// А 61 К,31/545
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ б
Н ПАТЕНТУ б
®
О
СН2М 2 (II) С00(: или,его аддитивной соли с галоидводородной или пергалогеновой кислотой и сое инения о м лы: S-C(NH<)=
=N-СjC(C00H) (=N-OP )J Y (III), где
У, R, и R указаны выше, или 0-20 С в присутствии 1-гидроксибензотриазола и дициклогексилкарбодиииида, или с галоидангидридом или гидрогалогенидом соединения III (лучше в присутствии органического основания). Новые цефалоспорины активнее цефотаксима .в отношении Cotrobacter freundii u (+) (;Н Q> (I) Ps eudomana s mal toph il ia в 3 и 4-16
Я; раз при токсичности LD« 3 r/êã.
00 2 табл.
I Я я с-сохн
Нф 8
P-- м О °
ORi C (21) 4010465/23 04 (22) 13,01.86 (31) 174326/85 (32) 09.08 ° 85 (33) 3Р (46) 15.12.88, Бюл. У 46 (71) Зйсай Ко, Лтд (ЛР) (72) Хироси Ямаути, Исао Сугияма, Исао Санто Сейитиро Номото, Такаси
Камия, Fсимасà Матида и Сигето Hhги (ЛР) (53) 547.869,1.07(088.8) (56) Патент США Ф 4525473, кл. 514202, опублик ° 25- 06.85. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
ЦЕФАЛОСПОРИНА (57) Изобретение относится к гетеро. циклическим соединениям, в частности к получению производных цефалоспорина общей формулы е У вЂ” СН или 1; R(— свободный или замещенный карбоксилом или карбамоилом С -алкил или R — алкинил", R — ОН; СН OH или карбамоил, которые могут применяться в медицине. Цель создание более активных веществ указанного класса, Их синтез ведут из соединения формулы
1445561
Изобретение относится к способу получения новых производных цефалоспорина, которые обладают антибактериальной активностью и могут найти применение в медицине.
Целью изобретения является получение новых антибиотиков цефалоспоринового ряда, обладающих более высокой антибактериальной активностью по сравнению с известными.
Пример 1, Получение 7p-((L)2-(5-амино-1,2,4-тиадиазол-3-ил)2-метоксииминоацетамидо)-3-(4-карба моил-1-хинуклидино)метил-3-цефем-4карбоксилата.
Смесь, состоящую из 2"(5-амино1,2,4-тиадиазол-3-ил)-(L)"2-метоксииминоуксусной кислоты (46 мг), 1-окси-IН-бензотриазолгидрата (35 мг), N,N -дициклогексилкарбодиимида (52 Mr) и N,N-диметилформамида (Iмл), перемешивают при комнатной температуре 3 ч, затем эту смесь фильтруют о 25 и фильтрат охлаждают до 0 С. Получен--ный раствор вводят в охлажденный льдом раствор гидрохлорида 7Р-амино3-(4-карбамо-ил-1-хинуклидино)метил3-цефем-4-карбоновой кислоты (100 мг), И,И-диметилформамида (2 мл) и И,Nдиметиланилина (72 мкл). После перемешивания смешанного раствора при .комнатной температуре в течение 14 ч реакционную смесь фильтруют и фильтрат вводят по каплям в диэтиловый эфир (100 мл) при одновременном перемешивании смеси, Выпавший осадок фильтруют и промывают диэтиловым эфи- ром. К промытому осадку добавляют воду (10 мл) и нерастворимое вещество 10 отфильтровывают. Полученный фильтрат очищают путем хроматографического разделения с обратимой фазой в колонке, наполненной силикагелем, в результате получают целевой продукт (3 мг).
ИК-спектр поглощения (см, Нуйол):
1775.
Спектр ЯМР (Ь, П О): 2,30 (6Н,м), 3,1"4,0 (м.), 4,16 (ЗН, с), 5,43 (IН, д, Х=6 Гц), 5,97 (IН, 3=6 Гц), Пример 2. Получение 7р-((1)2-(5-амино-1,2,4-тиадиазол"3-ил)-2метоксииминоацетамидо)-3-(4-карбамо" ил-1-хинуклидино)метил-3-цефем-4S5 харб оксила та .
Гидрохлорид 7/3-амино-3-(4-карГамоил-1-:хинуклидино)метил-3-цефем-4карбоксилат (2 г) растворяют в смешанном растворе ацетонитрил — вода (1:1) (40 мл) и в раствор вводят триэтиламин (2,08 мл). Полученный раствор охлаждают льдом и в него вводят 2-(5-амино-1,2,4-тиадиазол"3" ил)-(Ь)"2-метоксииминоацетилхлорид (2, 55 r), Смесь перемешивают 50 мин.
В этанол (200 мл) вводят данный реакционный раствор, выпавшее в осадок твердое вещество фильтруют и твердый продукт промывают этанолом и изопропиловым эфиром, в результате получают целевой продукт (450 мг).
ИК-спектр поглощения, а также . спектр ЯМР полученного продукта совпадают с указанными спектрами продукта из примера 1, П р и и е р 3. Получение 7p- ((L)
2-(5-амино)-1,2,4-тиазол-3-ил)-2-метоксииминоацетамидо1-3-(4-карбамоил1-хинуклидино)метил-3-цефем-4-карбоксилата.
7Р-амино-3-(4-карбамоил-1-хинуклидино)метил-3-цефем-4-карбоксилат перхлорат (300 мг) суспендируют в воде (1,5 ил), К суспензии добавляют ацетат натрия тригидрат (437 мг) и метанол ("; мл), К полученному продукту затем добавляют 2-(5-амина"
1,2,4-тиадиазол-3-ил)-2-метоксиимино" ацетилхларид гидрохлорид (180 мг) при 28 С. По окончании реакции через час реакционный продукт охлаждают льдом, чтобы получить кристалличес-. кую массу, которую разделяют фильтрациеи. Массу промывают метанолом и диизопропиловым эфиром соответственно, чтобы получить названный продукт (189 мг), Пример 4. Получение 7 - 1(1.)".-(5-амино-1,2,4-тиадиазол-3-ил)-2метоксииминоацетамидо -3 -(4-карбамо.ил-I õèêóêëèoèíî)метил-3-цефем-4" карбоксилата, 78"амино-3-(4-карбамоил-1-хинуклидино)метил-3-цефем-4-карбоксилат (750 мг) смепивают с водой (5 мл), метанолом (30 мл), ацетатом натрия тригидратом (560 мг) и 2-(5-амино1,2,4-тиадиазол-3-ил)-2-метоксииминоацетилхлорид гидрохлоридом (796 мг), Полученную смесь подвергают реакции о в течение 2 ч при 28 С, охлаждают льдом и оставляют на ночь. Образовавшуюся кристаллическую массу подвергают фильтрации, затем промывают метанолом и диэтиловым эфиром соответственно, получая названный продукт
1445561
C-ОООН
ОВ
Та блица 1
W — — С-СОМН вЂ” Г ()
)1 „ СН2-М г нр s
5 СН
17б5
-СН -ОН
7 СН (275 мг). Фильтрат концентрируют с послелующим. прогоном полученной фазы на хроматографической колонке с силкагелем, получая дополнительно (200 мг} названного продукта, Аналогично примерам 1"4 получают производные цефаласпорина примеров
5-11, физико-.химические свойства которых приведены в табл.1.
Цефалоспорины, получаемые по предлагаемому способу, обладают сильным антибактЪриальным действием как против грамположительных, так и против грамотрицательных бактерий при низкой 15 токсичности(D )до 3 r/êã и более при внутривенном введении мышам).
Результаты испытаний на антибактериальную активность в сравнении с из-. вестными цефалоспориновыми антибиоти- 20 ками приведены в табл.2.
Формула из обретения
Способ получения производных цефа" 25 лоспорина формулы I где Y — гр уппа СН или атом - азота;
R< — свободный или замещенный,б карбоксигруппой или карбамоилом С;-С -алкил или R —.С алкинил;
-СН -CONH 1770 -СН -СН он 1770
К вЂ” гидроксигруппа, карбамоил или гидроксиметил, о т л и ч а ю ш и и с я тем, что, соединение обшей формулы II
НУ
CH2М 82
О
СОО(:) где R имеет указанные значения, или его аддитивную соль с галоидводородной кислотой или пергалогеновой кислотой подвергают взаимодействию в среде растворителя при температуре от 0 С до комнатной с соединением общей формулы III где Y и R, имеют указанные значения, в:присутствии 1-гидроксибензотриазола и дициклагексилкарбодиимида или с галоидангидридом или гидрогалогенидом соединения формулы III необязательно в присутствии органического основания.
2,30 (6Н, м}, 3,30-4,00 (м), 4,10 (ЗН, с.) 5,45 (1Н, д, =6 Гц), 5,97 (1Н, д, 3-б Гц), 7 12 (1Н, с)
2,20 (6Н, m), 3,30-4,00 (m), 4, 18 (ЗН, с) 5, 43 (1Н, -д, J б Гц), 5, 9? (1Н, д, J=á Гц)
1, 96 (6H, м}, 3, 20-4,00 (м), 4, 12 (3H, с}, 5,47 (1Н, д, J=6 Гц), 5, 97 (1Н, д, Ю-б Гц), 7,15 (1Н,в) 1445561
Продолжение табл. 1
8 CH -СН C CH -CONH 1765 о
2, 24 (6Н, м), 3, 20-4, 20 (м), 5»47 (1Н» д» 3 6 Гц)» 5»99 (1Н, д, 3=6 Гц), 7,19 (1Н, с)
2,30 (6Н, м), 3,30-4,20 (и), 5,48 (1Н, д, У6 Гц), 6,00 (1Н, д, J6 Гц), ?,22 (1Н, с)
1,45 (ЗН, m, J=8 Гц), 2,30 (6Н," м), 3,20-4,20 (м), 4,46 (2Н,, кв, J, = Гц),,5 46 (1Н, д, J=6 Гц), 6,00 (1Н, д, J Гц)
2,30 (6Н,м), 3,20-4,30 (м), 5,44 (1Н, д, J 5 Гц), 6,00 (1Н, д, Л5 Гц) 9 СН -СН,СОИН, -СОНН, 1770
-CONH 1770
11 В -СН СООН -CONHs 1765
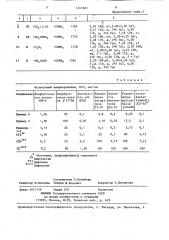
Таблица2
Испытуемый микроорганизм, HIC мкг/мл
Соединение Staphylocoe- Staphyloсаз aureus cocus aure209-P us Е 31106
Escherichia edi
NIHJ
Pseudomonaв
maltophilia
Е 04004
PseudoSerratià
cotrobaeter
fraundii
ЯС-34
monas
aeruginosa
E P-01
marcescens
ЯЯ-75
6,25 0,1
125 01
3,13 0,1
0,2
0,1
1,56
Пример 6
Пример 5
0,8 0,05
1,56 0,05 100
1,56
0,4
0,2
0,1
Примеры
1-4
СТХ
3,13
0 1 50 3 13
1,56
0,1
СТМ
3» 13
3, 13 100
100 100
100
0,2
0,2
0,2
1,56
100
100
-Бактерия, продуцирующая р -лактомазу ,Ф
+Ф
Цефотаксим
Цефотиам
+к»
4(%+ ф
Цефа з олин
Составитель З.Латыпова
Редактор М.Циткина Техред М.Ходанич
Корректор 3»Лончакова
Заказ 6517/59 Тираж 370 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб,, д. 4/5
Производственно-полиграфическое предприятие, r. Ужгород, ул. Проектная, 4