Соединения с гидроксикарбонильными-галогеналкильными боковыми цепями
Иллюстрации
Показать всеИзобретение относится к новому соединению, имеющему следующую общую формулу (2), и способу его получения:
в которой R1 представляет атом водорода или солеобразующий металл, R2 представляет прямую или разветвленную C1-C7 галогеналкильную группу, m представляет целое число от 2 до 14, n представляет целое число от 2 до 7 и А представляет группу, выбранную из следующих формул (3)-(6), (17)-(20), (23), (25) и (26):
где в формуле (6) R3 представляет прямую или разветвленную C1-С5 алкильную группу,
в формулах (18) и (20) R8 представляет прямую или разветвленную C1-C5 алкильную группу, прямую или разветвленную C2-C5 алкенильную группу или прямую или разветвленную С2-С5 алкинильную группу, в формуле (23) каждый из R21, R22, R23 и R24 независимо представляет атом водорода, прямую или разветвленную C1-C5 алкильную группу, прямую или разветвленную C1-C7 галогеналкильную группу, атом галогена или ацильную группу, и в формулах (25) и (26) Х представляет атом галогена, или энантиомеры соединения, или гидраты, или фармацевтически приемлемые соли соединения или его энантиомеров. Изобретение также относится к фармацевтической композиции, обладающей антиэстрогенным действием, содержащей указанное соединение в качестве активного ингредиента, и терапевтическому агенту против рака молочной железы на его основе. 5 н. и 5 з.п. ф-лы, 2 табл.
Реферат
Область техники
Настоящее изобретение относится к гидроксикарбонильным-галогеналкильным производным, разработанным для значительного повышения пероральной активности соединений, обладающих низкой активностью при пероральном введении, соединений, обладающих противоопухолевой активностью, соединений, обладающих эстрогенной активностью или соединений, обладающих антиэстрогенной активностью.
Предпосылки создания изобретения
При лечении заболеваний, вызванных аномальным ростом ткани, который зависит от некоторых половых стероидных гормонов, таких как эстроген, очень важно ингибировать в значительной степени, более предпочтительно исключить полностью, индуцируемое гормоном действие. С этой целью желательно понизить уровень гормона, способного воздействовать на рецепторный сайт стероидного гормона. Например, антиэстрогенные агенты обычно вводят при альтернативной или комбинационной терапии для ограничения продуцирования эстрогена до количества, меньше того, которое требуется для активации сайта рецептора. Однако такие обычные способы блокирования продуцирования эстрогена не могут в достаточной степени ингибировать действие, индуцируемое посредством эстрогенового рецептора. Практически, даже когда эстроген отсутствует полностью, некоторые из рецепторов могут быть активированными. Вследствие этого полагают, что антагонисты эстрогена могут обеспечить лучшее терапевтическое действие в сравнении со способами только блокирования продуцирования полового стероидного гормона. Таким образом, были разработаны многочисленные антагонисты эстрогена. Например, во многих патентных публикациях, включая патенты США №№4760061, 4732912, 4904661, 5395842 и WO 96/22092, описаны различные антиэстрогенные соединения. Однако иногда антагонисты предшествующего уровня техники сами могут действовать в качестве агонистов и, следовательно, скорее активировать рецептор, чем его блокировать. Например, в качестве антиэстрогенного агента наиболее широко используется Тамоксифен. Однако данный агент обладает тем недостатком, что он проявляет эстрогенную активность в некоторых органах (см. М.Harper и A.Walpole, J.Reprod. Fertile., 1967, 13, 101).
В качестве другого нестероидного антиэстрогенного соединения в WO 93/10741 описано производное бензопирана, имеющее аминоэтоксифенильный заместитель(и) (Эндоречерче, Endorecherche), типичным соединением в ряду которых является ЕМ-343, имеющий следующую структуру:
Указанное соединение также обладает агонистическим действием. Следовательно, необходимо разработать антиэстрогенное соединение, которое в достаточной степени или полностью не обладает агонистическим действием и которое может эффективно блокировать эстрогеновый рецептор.
Кроме того, известно, что 7α-замещенные производные эстрадиола, например 7α-(CH2)10CONMeBu производные, являются стероидными антиэстрогенными агентами без агонистического действия (см. ЕР-А 0138504, патент США 4659516). Кроме того, производное эстрадиола, имеющее 7α-(CH2)9SOC5H6F5 заместитель, также описано в качестве 7α-замещенного производного эстрадиола (см. Wakeling et al. Cancer.Res., 1991, 51, 3867).
Нестероидные антиэстрогенные агенты, не обладающие агонистическим действием, впервые были описаны Wakeling et al. в 1987 г. (см. A. Wakeling and Bowler, J. Endocrinol., 1987, 112, R7). Между тем, в патенте США 4904661 описаны производные фенола, обладающие антиэстрогенной активностью. Такие производные фенола обычно имеют нафталиновый каркас и включают, обычно, следующие соединения:
Сообщалось о некоторых производных хромана и тиохромана в качестве антиэстрогенных соединений, не обладающих агонистическим действием (WO 98/25916). Хотя существующие антиэстрогенные соединения, не обладающие агонистическим действием, показывают значительный терапевтический эффект при введении путем внутривенной или подкожной инъекции, они проявляют значительно сниженное терапевтическое действие при пероральном введении вследствие их низкой биодоступности при пероральном пути введения. Следовательно, для удобства при введении желательно разработать антиэстрогенные соединения, которые демонстрируют достаточное действие при пероральном введении и в то же время не обладают агонистическим действием. Также обычно требуется разработать агенты, которые демонстрируют достаточное действие при пероральном введении.
Описание изобретения
Задача настоящего изобретения заключается в разработке гидроксикарбонил-галогеналкильных производных, созданных для значительного повышения пероральной активности соединений, обладающих низкой активностью при пероральном введении, соединений, обладающих противоопухолевой активностью, соединений, обладающих эстрогенной активностью или соединений, обладающих антиэстрогенной активностью, путем усиления их абсорбции из кишечного тракта и/или улучшения их стабильности в отношении метаболизма.
Исследовательская работа авторов данного изобретения была направлена на достижение вышеуказанной задачи, и ими установлено, что боковая цепь общей формулы (1), если она присоединена к исходному каркасу соединений, дает возможность эстрогенным соединениям проявить существенно повышенную активность при пероральном пути введения. Настоящее изобретение было осуществлено на основании этих сведений.
А именно, настоящее изобретение относится к соединению, состоящему из фрагмента и группы, химически связанной с указанным фрагментом, где указанный фрагмент содержит соединение, обладающее низкой активностью при пероральном введении, или его исходный каркас, и указанная группа имеет следующую общую формулу (1):
в которой R1 представляет атом водорода или солеобразующий металл,
R2 представляет прямую или разветвленную C1-C7 галогеналкильную группу,
m представляет целое чисто от 2 до 14 и
n представляет целое число от 2 до 7,
или энантиомерам первоначально указанного соединения, или гидратам, или фармацевтически приемлемым солям соединения или его энантиомеров.
Настоящее изобретение также относится к соединению, состоящему из фрагмента и группы, химически связанной с указанным фрагментом, где указанный фрагмент содержит соединение, обладающее противоопухолевой активностью, или его исходный каркас, и указанная группа имеет следующую общую формулу (1):
в которой R1 представляет атом водорода или солеобразующий металл,
R2 представляет прямую или разветвленную C1-C7 галогеналкильную группу,
m представляет целое чисто от 2 до 14 и
n представляет целое число от 2 до 7,
или энантиомерам первоначально указанного соединения, или гидратам, или фармацевтически приемлемым солям соединения или его энантиомеров.
Кроме того, настоящее изобретение относится к соединению, состоящему из фрагмента и группы, химически связанной с фрагментом, где указанный фрагмент содержит соединение, обладающее эстрогенной активностью, или его исходный каркас, или соединение, обладающее антиэстрогенной активностью, или его исходный каркас, и указанная группа имеет следующую общую формулу (1):
в которой R1 представляет атом водорода или солеобразующий металл,
R2 представляет прямую или разветвленную C1-C7 галогеналкильную группу,
m представляет целое чисто от 2 до 14 и
n представляет целое число от 2 до 7,
или энантиомерам первоначально указанного соединения, или гидратам, или фармацевтически приемлемым солям соединения или его энантиомеров.
Еще, помимо этого, настоящее изобретение относится к соединению, имеющему следующую общую формулу (2):
в которой R1 представляет атом водорода или солеобразующий металл,
R2 представляет прямую или разветвленную C1-C7 галогеналкильную группу,
m представляет целое чисто от 2 до 14,
n представляет целое число от 2 до 1 и
А представляет группу, выбранную из следующих формул (3)-(8) и (10)-(26):
где в формулах (6), (7), (14) и (24) каждый из R3 и R6 представляет прямую или разветвленную C1-C5 алкильную группу, в формулах (10), (11) и (12) Z10 представляет атом водорода или ацильную группу, в формулах (13), (21) и (22) каждый из Z1, Z2, Z3, Z4, Z5 и Z6 независимо представляет атом водорода, гидроксильную группу или прямую или разветвленную C1-C5 алкильную группу, в формуле (15) R7 представляет атом водорода или прямую или разветвленную C1-C5 алкильную группу, в формуле (16) каждый из Z7, Z8 и Z9 независимо представляет атом водорода или гидроксильную группу, в формулах (18) и (20) R8 представляет прямую или разветвленную C1-C5 алкильную группу, прямую или разветвленную C2-C5 алкенильную группу или прямую или разветвленную C2-C5 алкинильную группу, в формуле (23) каждый из R21, R22, R23 и R24 независимо представляет атом водорода, прямую или разветвленную C1-C5 алкильную группу, прямую или разветвленную C1-C7 галогеналкильную группу, атом галогена или ацильную группу и в формулах (25) и (26) Х представляет атом галогена, или энантиомерам соединения, или гидратам, или фармацевтически приемлемым солям соединения или его энантиомеров.
Кроме того, настоящее изобретение относится к фармацевтической композиции, включающей соединение общей формулы (2) в качестве активного ингредиента. Настоящее изобретение также относится к антиэстрогенной фармацевтической композиции, включающей указанное выше соединение в качестве активного ингредиента. Далее настоящее изобретение относится к терапевтическому агенту против рака молочной железы, включающему соединение общей формулы (2) в качестве активного ингредиента.
Как использовано в данном описании, термин “исходный каркас(ы)” относится к частичной структуре, являющейся общей для класса соединений, обладающих одинаковым или подобным фармакологическим действием или физико-химическими свойствами. Исходные каркасы включают, но не ограничиваются ими, следующие структуры: стероид, индол, нафталин, бензофуран, бензотиофен, бензопиран, бензоксазин, 3,4-дифенил[4.3.0]нонан, 4-(1,2-дифенил-1-бутенил)фенол, флавон, эритромицин, алкалоид, цефалоспорин, β-лактам и их производные.
Соединения, обладающие низкой активностью при пероральном введении, относятся к таким соединениям, которые не способны проявлять адекватную активность для желаемого фармакологического действия при пероральном введении, поскольку они слабо абсорбируются из кишечного тракта или быстро метаболизируют в теле. Примеры включают некоторые типы противоопухолевых соединений, некоторые типы эстрогенных соединений (например, эстрадиол) и антиэстрогенные соединения.
Соединения, обладающие противоопухолевой активностью включают все типы соединений, способных ингибировать рост опухоли. Настоящее изобретение имеет особые преимущества для соединений, проявляющих низкую активность при пероральном пути введения.
Соединения, обладающие эстрогенной активностью, относятся к тем соединениям, которые обладают аффинностью к эстрогеновому рецептору и усиливают сигнал, опосредованный эстрогеновым рецептором. Примеры включают эстрадиол.
Соединения, обладающие антиэстрогенной активностью, относятся к тем соединениям, которые обладают антагонистической активностью против фармакологических действий эстрогена. Примеры включают соединения, описанные в упомянутом выше предшествующем уровне развития данной области.
Настоящее изобретение относится к соединениям, где фрагмент химически связан с группой, при этом указанный фрагмент содержит соединение, обладающее низкой активностью при пероральном введении, соединение, обладающее противоопухолевой активностью, соединение, обладающее эстрогенной активностью или соединение, обладающее антиэстрогенной активностью, или исходные каркасы данных соединений, и указанная группа имеет общую формулу (1). Как использовано в данном описании, термин “химически связанный” означает, что группа связана посредством ковалентной связи и тому подобное, включая С-С связь, С-O связь, C-N связь и т.д. Фрагмент, содержащий указанные выше соединения или их исходные каркасы может иметь любую структуру пока возможны данные связи. Для улучшения стабильности против метаболизма и, следовательно, активности при пероральном пути введения предпочтительно используют С-С связь.
Солеобразующие металлы в качестве R1 включают, но не ограничиваются ими, щелочные металлы, такие как натрий и калий, щелочноземельные металлы, такие как магний и кальций, редкоземельные металлы, такие как церий и самарий, а также цинк и олово. Среди них щелочные металлы и щелочноземельные металлы являются предпочтительными.
R1 предпочтительно может представлять атом водорода, щелочной металл и щелочноземельный металл.
Галогены в прямых или разветвленных C1-C7 галогеналкильных группах в качестве R2 включают фтор, хлор, бром и иод, где фтор является предпочтительным. R2 может содержать один или несколько атомов галогена. Когда R2 содержит два или более атомов галогена, они могут быть одинаковыми или различными, предпочтительно одинаковыми атомами галогена. В частности, R2 предпочтительно представляет пергалогеналкильную группу. Алкилы в рассматриваемых прямых или разветвленных C1-C7 галогеналкильных группах включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, н-гексил и н-гептил. Предпочтительными являются прямые или разветвленные C1-C4 алкилы, т.е. метил, этил, н-пропил, изопропил и н-бутил.
Примеры прямой или разветвленной C1-C7 пергалогеналкильной группы в качестве R2 включают перечисленные выше прямые или разветвленные C1-C7 алкильные группы при условии, что они являются пергалогенированными, предпочтительно перфторированными. Также предпочтительными являются пергалогенированные прямые или разветвленные C1-C5 алкильные группы, и группа следующей общей формулы (9):
в которой каждый из R4 и R5, которые могут быть одинаковыми или различными, представляют прямую или разветвленную C1-C3 пергалогеналкильную группу. Из них предпочтительными являются перфторированные группы. Более конкретно, особенно предпочтительными являются перфторметильная группа, перфторэтильная группа, перфтор-н-пропильная группа и перфтор-н-бутильная группа.
В случае, когда R2 в общей формуле (2) представляет группу общей формулы (9), примеры прямой или разветвленной C1-C3 пергалогеналкильной группы в качестве R4 и R5 включают перечисленные выше прямые или разветвленные C1-C3 алкильные группы, при условии, что они являются пергалогенированными, предпочтительно перфторированными. Кроме того, пергалогенированные C1 алкильные группы являются предпочтительными и перфторированная группа является особенно предпочтительной. Более конкретно, перфторметильная группа является предпочтительной.
В случае, когда R2 в общей формуле (2) представляет группу общей формулы (9), R2 предпочтительно представляет 1,1,1,3,3,3-гексафторизопропильную группу.
С учетом данного выше определения, R2 предпочтительно представляет перфторэтильную группу, пертфор-н-пропильную группу, перфтор-н-бутильную группу и 1,1,1,3,3,3-гексафторизопропильную группу.
Примеры прямой или разветвленной C1-C5 алкильной группы, как использовано в данном описании, включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил и 1-этилпропил.
Примеры прямой или разветвленной C2-C5 алкенильной группы, как использовано в данном описании, включают, но не ограничиваются ими, винил, аллил, 1-бутенил, 2-бутенил и 3-бутенил.
Примеры прямой или разветвленной C2-C5 алкинильной группы, как использовано в данном описании, включают, но не ограничиваются ими, этинил, пропинил, 1-бутинил, 2-бутинил и 3-бутинил.
Примеры ацильной группы, как использовано в данном описании, включают, но не ограничиваются ими, алкилкарбонильные группы, такие как формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, капроил и фенилацетил; алкенилкарбонильные группы, такие как акрилоил, пропиолоил, метакрилоил, кротоноил и изокротоноил, и арилкарбонильные гурппы, такие как бензоил.
Примерами прямой или разветвленной C1-C7 галогеналкильной группы в качестве R21, R22, R23 и R24 могут быть те же группы, как перечисленные выше для R2.
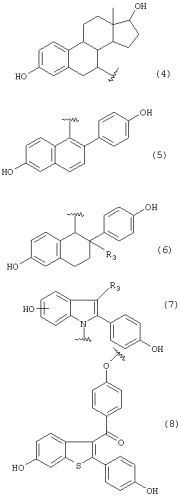
Группа А предпочтительно может представлять любую из групп, имеющих формулы (3)-(8) и (10)-(23), особенно группы, имеющие формулы (3)-(6), (17)-(20) и (23), и более конкретные группы имеют формулы (3), (4) и (17)-(20).
m предпочтительно может представлять целое число от 4 до 10.
n предпочтительно может представлять целое число от 2 до 7.
Группа общей формулы (1), которая представляет собой один из компонентов соединения согласно настоящему изобретению, имеет асимметрический центр, в то время как другой компонент может иметь асимметрический центр. Кроме того, соединение общей формулы (2) согласно настоящему изобретению может иметь асимметрический центр в группе А в дополнение к асимметрическому центру в группе общей формулы (1). По этой причине соединения настоящего изобретения имеют энантиомеры. Предполагается, что все индивидуальные энантиомеры и их смеси включены в объем настоящего изобретения. Когда группа А, имеющая асимметрический центр в стероидном каркасе, представлена одной из формул (3), (4) и (17)-(20), группа общей формулы (1) предпочтительно присоединена к стероидному исходному каркасу в 7α- или 11β-положении.
Также в общих формулах (1) и (2) предпочтительными являются оба соединения с R- и S-конфигурацией асимметрического углерода, к которому присоединена карбоновая кислота или ее металлическая соль.
Среди соединений общей формулы (2) предпочтительными являются те соединения, в которых R1 представляет атом водорода, щелочной металл или щелочноземельный металл; R2 представляет перфторэтильную группу, пертфор-н-пропильную группу, перфтор-н-бутильную группу или 1,1,1,3,3,3-гексафторизопропильную группу, m представляет целое число от 4 до 10 и n представляет целое число от 2 до 6.
Соединения настоящего изобретения могут быть получены в виде гидратов.
Фармацевтически приемлемые соли включают, но не ограничены ими, указанные выше соли металлов, например соли натрия, калия и кальция.
Соединения согласно настоящему изобретению можно вводить в виде фармацевтической композиции в любой дозированной форме, подходящей для предназначенного пути введения, в сочетании с одним или несколькими фармацевтически приемлемыми разбавители, смачивающими агентами, эмульгаторами, диспергирующими агентами, вспомогательными агентами, консервантами, буферами, связующими веществами, стабилизаторами и тому подобное. Соединения и композиции можно вводить парентерально или перорально.
Доза соединения может быть определена подходящим образом в соответствии с физическими данными, возрастом и физическим состоянием пациента, серьезностью подвергаемого лечению заболевания, временем, прошедшим после начала заболевания и т.д. Поскольку предполагается, что соединение настоящего изобретения будет обладать существенно более высокой активностью при пероральном пути введения, его обычно используют в количестве от 0,1 до 500 мг/день при пероральном введении и в количестве от 0,1-1000 мг/день до 0,1-1000 мг/месяц при парентеральном введении (внутривенном, внутримышечном или подкожном путях введения) для взрослого пациента.
Лучший способ осуществления изобретения
Соединение общей формулы (1), в частности соединение общей формулы (2), может быть получено в соответствии с любой из следующих реакционных схем А-К и 1-19. В данных схемах реакций А-К и 1-19 (то есть способы А-К и с 1 по 19) R2, R3, R6, R7, Z1, Z2, Z3, Z4, Z5, Z6, Z7, Z8, Z9, Z10, m и n являются такими, как определено выше для общих формул (1) и (2); каждый из R11, R12, R13 и R16 представляет защитную группу; R33 представляет прямую или разветвленную алкильную группу; каждый из Y1, Y2, Y3, Y4, Y5 и Y6 независимо представляет атом водорода, алкильную группу (например, прямую или разветвленную C1-C5 алкильную группу) или ОR11; каждый из L1 и L2 представляет уходящую группу; Х представляет атом галогена; m1 равно m-2; R8 представляет прямую или разветвленную C1-C5 алкильную группу, прямую или разветвленную C2-C5 алкенильную группу или прямую или разветвленную C2-C5 алкинильную группу.
Соединение по настоящему изобретению может включать различные стереоизомеры, поскольку оно содержит один или несколько асимметрических атомов углерода. Для получения отдельного стереоизомера имеется два способа, в одном из которых используется хиральная колонка для разделения смеси стереоизомеров, а другой включает асимметрический синтез. Способ с применением хиральной колонки может быть осуществлен с использованием колонки, коммерчески доступной от DAICEL, например, под торговой маркой CHIRALPAK-OT(+), ОР(+) или AD, или CHIRALCEL-OA, OB, OJ, ОК, ОС, OD, OF или OG. Что касается асимметрического синтеза, способы 14-16 иллюстрируют асимметрический синтез соединения изобретения, касающийся асимметрического атома углерода, к которому присоединена боковая цепь карбоксильной группы.
Реакционная схема А (Способ А)
Примечание. Соединение (I) может быть синтезировано способом, описанным в J. Org. Chem., 60 (1995) 5316-5318.
Реакционная схема В (Способ В)
Примечание. Соединение (XXI) может быть синтезировано способом, описанным в патенте Германии DE4218743A1.
Реакционная схема F (Способ F)
в которой R8 представляет прямую или разветвленную C1-C5 алкильную группу, прямую или разветвленную C2-C5 алкенильную группу или прямую или разветвленную C2-C5 алкинильную группу и
М представляет металл.
в которой R8 представляет прямую или разветвленную C1-C5 алкильную группу, прямую или разветвленную C2-C5 алкенильную группу или прямую или разветвленную C2-C5 алкинильную группу и
М представляет металл.
в которой каждый из Y1, Y2 и Y3 независимо представляет атом водорода, алкильную группу (например, прямую или разветвленную C1-C5 алкильную группу) или ОR11 и каждый из Z1, Z2 и Z3 независимо представляет атом водорода, гидроксильную группу или прямую или разветвленную C1-C5 алкильную группу.
Реакционная схема 13(Способ 13)
в которой каждый из Y1, Y2, Y3, Y4, Y5 и Y6 независимо представляет атом водорода, алкильную группу (например, прямую или разветвленную C1-C5 алкильную группу) или ОR11 и каждый из Z1, Z2, Z3, Z4, Z5 и Z6 независимо представляет атом водорода, гидроксильную группу или прямую или разветвленную C1-C5 алкильную группу.
Примеры R* включают
Примеры R* включают
В указанных выше реакционных схемах 14 и 15 (способы 14 и 15) R2, R11, R12, X, m, n, X, L1 и L2 являются такими, как определено выше, R* представляет хиральный вспомогательный радикал и m и m3 представляют целые числа, которые удовлетворяют отношению m=m3+3.
Примеры R* включают
[Способ А]
Способ А иллюстрирует синтез соединения (VI) исходя из соединения (I). Соединение (I) может быть синтезировано способом, описанным в J. ORg. Chem., 60 (1995), 5316-5318.
Стадия 1: Получение соединения (III)
В присутствии катализатора, такого как бензилиденбис(трициклогексилфосфин)дихлоррутений, соединение (I) подвергают взаимодействию с соединением (II) в растворителе (например, хлористом метилене, хлороформе, бензоле, толуоле, ксилоле, диоксане, тетрагидрофуране, диметилсульфоксиде или диметилформамиде) при температуре в диапазоне от -78°С до температуры кипения реакционной смеси, предпочтительно при температуре кипения реакционной смеси, давая соединение (III).
Стадия 2: Получение соединения (IV)
С использованием катализатора (например, палладия на активированном углероде, гидроксида палладия, оксида платины или катализатора Вилкинсона (Wilkinson)) соединение (III) гидрируют в инертном растворителе (например, метаноле, этаноле, этилацетате, тетрагидрофуране, диоксане, дихлорметане, дихлорэтане, хлороформе или бензоле) при температуре в диапазоне от комнатной температуры до температуры кипения реакционной смеси, предпочтительно при температуре кипения реакционной смеси, получая соединение (IV).
Стадия 3: Получение соединения (V)
Когда R11 представляет, например, метильную группу, соединение (IV) обрабатывают кислотой (например, хлористым водородом, серной кислотой, бромистым водородом, гидрохлоридом пиридина или трехбромистым бором) при температуре в диапазоне от -78°С до температуры кипения реакционной смеси, получая соединение (V).
Стадия 4: Получение соединения (VI)
Соединение (V) обрабатывают гидроксидом натрия или гидроксидом калия в растворителе (например, воде, этаноле, метаноле или смеси вода/этанол, или смеси вода/метанол) при температуре в диапазоне от комнатной температуры до температуры кипения реакционной смеси, предпочтительно при температуре кипения реакционной смеси, получая соединение (VI).
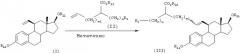
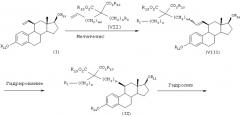
[Способ В]
Как показано ниже, соединение (VI), полученное способом А, также может быть получено исходя из соединения (I) следующим образом.
Стадия 1: Получение соединения (VIII)
В присутствии катализатора, такого как бензилиденбис(трициклогексилфосфин)дихлоррутений, соединение (I) подвергают взаимодействию с соединением (VII) в растворителе (например, хлористом метилене, хлороформе, бензоле, толуоле, ксилоле, диоксане, тетрагидрофуране, диметилсульфоксиде или диметилформамиде) при температуре в диапазоне от -78°С до температуры кипения реакционной смеси, предпочтительно при температуре кипения реакционной смеси, получая соединение (VIII).
Стадия 2: Получение соединения (IX)
С использованием катализатора (например, палладия на активированном углероде, гидроксида палладия, оксида платины или катализатора Вилкинсона (Wilkinson)) соединение (VIII) гидрируют в инертном растворителе (например, метаноле, этаноле, этилацетате, тетрагидрофуране, диоксане, дихлорметане, дихлорэтане, хлороформе или бензоле) при температуре в диапазоне от комнатной температуры до температуры кипения реакционной смеси, предпочтительно при температуре кипения реакционной смеси, получая соединение (IX).
Стадия 3: Получение соединения (X)
Соединение (IX) обрабатывают гидроксидом натрия или гидроксидом калия в растворителе (например, воде, этаноле, метаноле или смеси вода/этанол, или смеси вода/метанол) при температуре в диапазоне от комнатной температуры до температуры кипения реакционной смеси, предпочтительно при температуре кипения реакционной смеси, получая соединение (X).
Стадия 4: Получение соединения (XI)
В растворителе (например, диметилсульфоксиде, диметилформамиде, бензоле, толуоле, ксилоле, диоксане или тетрагидрофуране) и, при необходимости, в присутствии кислоты (например, хлористого водорода, серной кислоты или п-толуолсульфоновой кислоты) соединение (X) нагревают до температуры в диапазоне от 50°С до температуры кипения реакционной смеси, получая соединение (XI).
Стадия 5: Получение соединения (VI)
Когда R11 представляет, например, метильную группу, соединение (XI) обрабатывают кислотой (например, хлористым водородом, серной кислотой, бромистым водородом, гидрохлоридом пиридина или трехбромистым бором) при температуре в диапазоне от -78°С до температуры кипения реакционной смеси, получая соединение (VI).
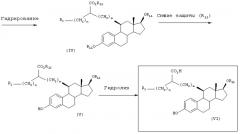
[Способ С]
Как показано ниже, соединение (VI), полученное способами А и В, также может быть получено, исходя из соединения (XII) следующим образом.
Стадия 1: Получение соединения (XIV)
В присутствии катализатора, такого как бензилиденбис(трициклогексилфосфин)дихлоррутений, соединение (XII) подвергают взаимодействию с соединением (XIII) в растворителе (например, хлористом метилене, хлороформе, бензоле, толуоле, ксилоле, диоксане, тетрагидрофуране, диметилсульфоксиде или диметилформамиде) при температуре в диапазоне от -78°С до температуры кипения реакционной смеси, предпочтительно при температуре кипения реакционной смеси, получая соединение (XIV).
Стадия 2: Получение соединения (IV)
Соединение (XIV) дегидратируют с использованием кислоты (например, хлористоводородной кислоты, бромистоводородной кислоты, смеси бромистоводородная кислота/уксусная кислота) в инертном растворителе (например, метаноле, этаноле) при температуре в диапазоне от комнатной температуры до температуры кипения реакционной смеси, предпочтительно при 50°С, и дополнительно подвергают гидрированию аналогично способу А, получая соединение (IV).
Стадия 3: Получение соединения (VI)
Соединение (IV) подвергают гидролизу и снятию защитных групп аналогично способам А или В, получая соединение (VI).
[Способ D]
Как показано ниже, соединение (VI), полученное способами А, В и С, также может быть получено исходя из соединения (XII) следующим образом.
Стадия 1: Получение соединения (XVI)
В присутствии катализатора, такого как бензилиденбис(трициклогексилфосфин)дихлоррутений, соединение (XII) подвергают взаимодействию с соединением (XV) в растворителе (например, хлористом метилене, хлороформе, бензоле, толуоле, ксилоле, диоксане, тетрагидрофуране, диметилсульфоксиде или диметилформамиде) при температуре в диапазоне от -78°С до температуры кипения реакционной смеси, предпочтительно при температуре кипения реакционной смеси, получая соединение (XVI).
Стадия 2: Получение соединения (XVII)
Соединение (XVI) дегидратируют с использованием кислоты (например, хлористоводородной кислоты, бромистоводородной кислоты, смеси бромистоводородная кислота/уксусная кислота) в инертном растворителе (например, метаноле, этаноле) при температуре в диапазоне от комнатной температуры до температуры кипения реакционной смеси, предпочтительно при 50°С, и дополнительно подвергают гидрированию аналогично способу А, получая соединение (XVII).
Стадия 3: Получение соединения (VI)
Соединение (XVII) подвергают гидролизу, декарбоксилированию и снятию защитной группы аналогично способам А или В, получая соединение (VI).
Соединение (XII), используемое в качестве исходного вещества в способах С и D, может быть получено в соответствии со способом, описанным в Tetrahedron., 30 (1977), pp.609-616.
[Способ Е]
Способ Е иллюстрирует синтез соединения (XXIX), исходя из соединения (XXI).
Стадия 1: Получение соединения (XXII)
В присутствии органического основания (например, триэтиламина или пиридина) соединение (XXI) обрабатывают хлорангидридом кислоты (например, метансульфонилхлоридом или п-толуолсульфонилхлоридом) в инертном растворителе (например, тетрагидрофуране, диоксане, дихлорметане, дихлорэтане или хлороформе, предпочтительно в дихлорметане) при температуре в диапазоне от комнатной температуры до температуры кипения реакционной смеси, предпочтительно при комнатной температуре, превращая (CH2)mOH в соединении (XXI), например (CH2)m-L1, где L1 представляет -О-SО2СН3 или -O-SO2-C6H4-п-CH3. Полученное таким образом соединение затем обрабатывают галогенидом металла (например, иодидом натрия или иодидом калия) в инертном растворителе (например, ацетоне, тетрагидрофуране, диоксане, дихлорметане, дихлорэтане или хлороформе, предпочтительно ацетоне) при температуре в диапазоне от комнатной температуры до температуры кипения реакционной смеси, предпочтительно при температуре кипения реакционной смеси, получая соединение (XXII).
Стадия 2: Получение соединения (XXIV)
В присутствии основания (например, гидрида натрия, гидроксида натрия или трет-бутоксида калия) соединение (XXII) подвергают взаимодействию с малоновым эфиром (XXIII) (например, диэтилмалонатом или диметилмалонатом) в инертном растворителе (например, тетрагидрофуране, диоксане, дихлорметане, дихлорэтане или хлороформе, предпочтительно тетрагидрофуране) при температуре в диапазоне от комнатной температуры до температуры кипения реакционной смеси, получая соединение (XXIV).
Стадия 3: Получение соединения (XXVI)
В присутствии основания (например, гидрида натрия, гидроксида натрия или трет-бутоксида калия) соединение (XXIV) подвергают взаимодействию с галоидным алкилом (XXV), в котором L2 представляет атом галогена, в инертном растворителе (например, тетрагидрофуране, диоксане, дихлорметане, дихлорэтане или хлороформе, предпочтительно тетрагидрофуране) при температуре в диапазоне от комнатной температуры до температуры кипения реакционной смеси, получая соединение (XXVI).
Стадия 4: Получение соединения (XXVII)
Соединение (XXVI) обрабатывают гидроксидом натрия или