Штамм бактерий lactobacillus plantarum p4, штамм бактерий lactobacillus buchneri p0 и препарат-пробиотик на их основе для коррекции дисбактериозов различной этиологии у людей и животных
Иллюстрации
Показать всеИзобретение относится к биотехнологии, может быть использовано в пищевой промышленности, медицине и сельском хозяйстве. Штамм Lactobacillus plantarum P4, депонированный в коллекции НИИМ МО РФ под номером 39, и штамм Lactobacillus buchneri P0, депонированный в коллекции НИИМ МО РФ под номером 38, образуют совместно симбиотическую систему, характеризующуюся синтрофным синергическим типом взаимоотношений. Пробиотический препарат "Билакт" на их основе содержит высушенную смесь штаммов Lactobacillus plantarum P4 и Lactobacillus buchneri P0 в соотношении микроорганизмов от 4:1 до 1:4, продукты их жизнедеятельности и способствует санации нестерильных полостей организма и коррекции дисбактериозов различной этиологии у больных людей и животных при содержании живых клеток не менее 1×108 живых клеток в 1 мл регидратированного препарата. Препарат показал высокую эффективность при ряде заболеваний человека - желудочно-кишечного и урогенитального трактов, разных кожных заболеваниях различной этиологии (гнойных и ожоговых поражениях кожи), и сельскохозяйственных животных и птиц. 3 н.п. ф-лы.
Реферат
Изобретение относится к биотехнологии, а именно к штаммам для приготовления лечебно-профилактических препаратов и технологии их производства в промышленных условиях. Изобретение может быть использовано в пищевой промышленности, медицине, ветеринарии и смежных областях.
Известны бактериальные препараты медицинского назначения, такие как колибактерин, лактобактерин, бифидобактерин (Руководство по вакцинному и сывороточному делу. Под ред. акад. АМН СССР И.Н.Бургасова. Москва, “Медицина”, 1978), содержащие один или два штамма микроорганизмов и подавляющие развитие патогенных бактерий.
Известны перспективные штаммы, используемые в создании препаратов и молочнокислых продуктов, способствующие регуляции микробиоценоза кишечника и неспецифической иммуностимуляции при дисбактериозах кишечника различной этиологии (В.М.Коршунов "Проблема регуляции микрофлоры кишечника". - Журнал микробиологии, эпидемиологии и иммунологии. М., 1995, N 3, с.48-52).
Известен штамм Lactobacillus acidophilus ВКМ В-2020 Д-антибиотикорезистентный антагонист возбудителей кишечных инфекций. Штамм рекомендован в качестве основы при разработке антагонистических биологических средств профилактики и лечения кишечных заболеваний, вызванных патогенной и условно-патогенной микрофлорой. Может быть использован для создания бактериальных препаратов для коррекции микрофункциональных нарушений желудочно-кишечного тракта (Патент РФ №12063436, С 12 N 1/20).
Известен штамм лактобактерий Lactobacillus acidophilus-13 (Агарац) положительно влияющий на регенеративные процессы в кишечнике при лечении желудочно-кишечных заболеваний, используемый для коррекции дисбактериозов разного вида и характера у новорожденных и взрослых. Штамм используют в производстве лечебно-диетического продукта питания, способствующего подавлению роста патогенных форм микроорганизмов и нормализации микрофлоры кишечника благодаря высокой предельной кислотности штамма, порядка 400° Т (Патент РФ №2103354, С 12 N 1/20).
Известен штамм бактерий Lactobacillus acidophilus-92 n. v. (Ани), используемый для коррекции дисбактериоза при желудочно-кишечных заболеваниях и у больных раком толстой кишки (Патент РФ №2103353, С 12 N 1/20).
Известен штамм Lactobacillus acidophilus n. v. 317/402 "Наринэ" ИНМИ-9602 (А.С. СССР №163357, С 12 N 1/20), который обладает медленной кислотообразующей способностью (максимальное образование - 360° Т). Штамм продуцирует значительное количество безвредных для детей и взрослых антибиотических веществ, подавляющих рост и развитие как грамположительных, так и грамотрицательных бактерий - возбудителей острых форм желудочно-кишечных заболеваний.
Известен препарат лактобактерин, основу которого составляет штамм 8РА-3 Lactobacillus plantarum.
Недостатком указанного препарата и соответствующего штамма является недостаточная терапевтическая эффективность. Многолетние наблюдения показали, что при высокой антагонистической активности и кислотообразующей способности клетки этого штамма имеют низкую адгезивную активность. Некоторые побочные эффекты при использовании лактобактерина вызваны способностью лактобацилл штамма 8РА-3 продуцировать перекись водорода.
Наиболее близким к заявляемому изобретению (прототипом) является препарат “Биосан” (Пат. 2102075 Россия, МКИ6 А 61 К 35/74), основу которого составляет штамм plantarum (Киров-1) и Lactobacillus buchneri (Киров-4).
Общие признаки препарата “Биосан” и заявляемого препарата заключаются в следующем:
основу препаратов составляет ассоциация микроорганизмов двух видов лактобацилл L.plantarum и L.buchneri;
лактобациллы получены из естественной среды обитания с первой степенью чистоты;
лактобациллы обладают способностью приживляться на слизистой оболочке;
лактобациллы проявляют антагонистические свойства против условно-патогенных микробов, вызывающих эндометрит у коров;
ассоциация лактобацилл используется при лечении эндометритов у крупного рогатого скота.
Сравнительное противопоставление культурально-морфологических и биохимических свойств клеток, а также антагонистической активности в отношении тест-штаммов и патогенной микрофлоры указывают на существенные различия штаммов L.buchneri P0 и L.buchneri (Киров-4):
по оптическим свойствам, цвету, поверхности и размеру колоний;
продолжительности роста в атмосфере кислорода на плотной питательной среде МРС-4 при температуре 36... 38° С;
способности ферментировать маннит (маннитол) и лактозу;
спектру антимикробного действия, в частности в отношении возбудителей дизентерии и сальмонеллеза.
Данные авторов патента (Варганов А.И. Профилактика симптоматического и искусственно приобретенного бесплодия у коров и телок: Автореферат дис... на соиск. д-ра вет. наук /ВНИИ незараз. болезней животных - Воронеж, 1988. - 31 с.; Варганов А.И., Конопельцев И.Г. Основные лекарственные препараты для лечения и профилактики акушерско-гинекологических болезней животных (Метод. указ. для студентов высших и средних учебных заведений по спец. “Ветеринария” и ветер. специалистов). - Киров, 1995 г. - 32 с.)) по видовому типированию штамма L.buchneri (Киров-4) не позволяют с уверенностью отнести его к виду L.buchneri, а наличие способности ферментировать маннит и отсутствие способности ферментировать лактозу по классификации Rogosa и Sharpe более характерны для L.brevis и L.colinoides. Таким образом, сравнительное противопоставление культурально-морфологических и биохимических свойств клеток L.buchneri Р0 и L.buchneri (Киров-4) дает основание считать их если не представителями разных видов лактобацилл, то разными штаммами L.buchneri.
Недостатками препарата “Биосан” и его технологии являются то, что:
штаммы лактобацилл, составляющие его основу, проявляют антагонистическую активность только в отношении определенной условно-патогенной микрофлоры, вызывающей эндометрит у коров;
препарат характеризуется ограниченной продолжительностью терапевтического действия;
способ его приготовления нетехнологичен как в отношении поддержания эталонных культур, так и производства конечной формы препарата;
эксплуатационные характеристики препарата “Биосан” низкие вследствие того, что готовой формой препарата является смесь культуральных жидкостей.
Эти обстоятельства сужают возможности использования препарата и не исключают накопления фенотипических и генотипических изменений клеток исходных эталонных культур в ходе хранения и вынужденных многократных пересевов, непременно приводящих к снижению или полной утрате ими требуемых полезных пробиотических свойств. Особенности доставки и хранения жидкой формы препарата в реальных условиях животноводческих хозяйств не позволяют соблюсти и проконтролировать вводимую дозу на момент применения препарата.
Поэтому задачей, стоящей перед нами, являлось создание стандартного с требуемыми эксплуатационными характеристиками препарата пробиотического действия на основе сочетания таких штаммов лактобацилл, которые находились бы в устойчивом экологическом равновесии и не только сохраняли свои свойства при совместном использовании, но и обеспечивали повышение терапевтической эффективности пробиотика.
Указанная задача решается:
отбором (селекцией) штаммов лактобацилл с требуемыми полезными пробиотическими свойствами;
установлением оптимального соотношения выбранных штаммов лактобацилл в ассоциации бактерий;
созданием на основе ассоциации симбионтных по отношению друг к другу бактерий готовой формы препарата, обеспечивающей стандартность и стабильность пробиотических свойств;
разработкой технологии, позволяющей длительное время сохранять полезные пробиотические свойства в эталонной культуре в процессе ее поддержания, накоплении биомассы микробных культур и после перевода культуральной жидкости в обезвоженное состояние.
Критериями отбора лактобацилл являлись следующие признаки:
способность активно колонизировать слизистые оболочки условно стерильных полостей человека и животных (дыхательных путей, желудочно-кишечного и урогенитального трактов) и быть способными к достаточно длительной персистенции в макроорганизме;
сохранять и/или активизировать нормальный биоценоз слизистых оболочки условно стерильных полостей человека и животных (дыхательных путей, желудочно-кишечного и урогенитального трактов);
способность активно подавлять рост и развитие грамположительных и грамотрицательных болезнетворных, а также вредных для производства микроорганизмов;
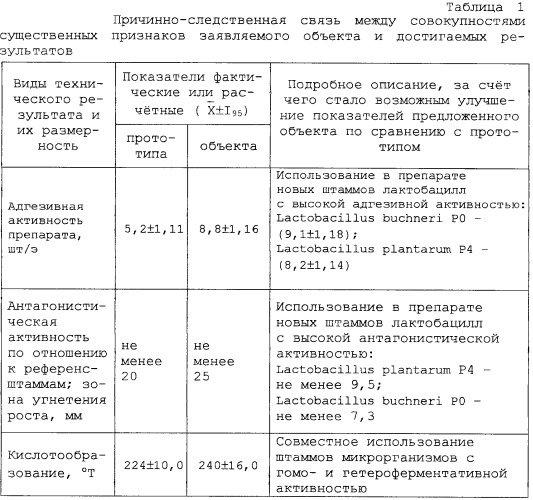
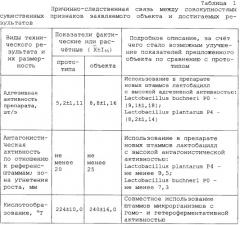
способность подавлять рост микроорганизмов, вызывающих легочные, желудочно-кишечные, гинекологические, кожные заболевания различной этиологии (таблица 1).
Штамм Lactobacillus plantarum P4 был получен в результате отбора лактобацилл из микрофлоры, выделенной из естественной среды обитания - влагалища здоровой женщины репродуктивного возраста - в 1996 году в г.Кирове. Культура выделена из моноколоний и идентифицирована по определителю Bergeys (1997 г.) и классификации Rogosa и Sharpe.
Штамм депонирован в коллекции НИИМ МО РФ под №39.
Штамм характеризуется следующими признаками.
Культурально-морфологические признаки
При выращивании в жидкой среде МРС-1 в течение 48 ч при температуре 36... 38° С лактобациллы растут в виде гомогенного белого осадка на дне пробирки, при этом питательная среда остается прозрачной.
На поверхности твердой агаризованной среды МРС-4 через 48 ч инкубирования при температуре 36... 38° С формируются колонии размером 1,0... 2,0 мм белого цвета, непрозрачные, имеющие форму полусфер с ровными четкими краями, с выпуклой, блестящей, гладкой поверхностью, профиль колоний каплевидный, консистенция мягкая, слизистая, тягучая.
Пигмента не образуют.
Морфология клеток
Грамположительные изогнутые длинные палочки с прямыми или слегка закругленными полюсами. Длина клеток составляет 1,5... 5,0 мкм, диаметр - 0,6 мкм.
Физиолого-биохимические признаки штамма
Факультативный анаэроб, каталазоотрицательный, цитохромоксидазоотрицательный. Аммиак из аргинина не образует. Нитраты не редуцирует. Желатину не разжижает.
Сахаролитическая активность.
Сбраживает: глюкозу, целлобиозу, эскулин, фруктозу, глюконат, галактозу, лактозу, мальтозу, маннит, маннозу, мелибиозу, салицин, Д-раффинозу, сорбит, сахарозу, трегалозу, Д-арабинозу, рибозу, мелизитозу.
Не ферментирует: рамнозу, ксилозу.
Конечное значение рН на ферментируемых сахарах (4,8± 0,2) ед. рН в среде МРС-1. Тип ферментации - бродильный гомоферментативный с образованием молочной кислоты без газа. Молоко свертывает с образованием сгустка, максимально титруемая кислотность которого составляет (246± 15)° Т.
Температурный оптимум 36... 38° С. Температурный предел роста в атмосфере воздуха 15... 45° С. Предельные значения рН среды, при которых наблюдается рост, - 5,0... 8,0 ед. рН. Оптимальное значение рН среды - 6,3 ед. рН.
В процессе жизнедеятельности накапливает глицин, глютамин, изолейцин и тирозин.
Чувствительность к антибиотикам
Штамм устойчив к метронидазолу, канамицину, налидиксовой кислоте, умеренно устойчив к фторхинолонам, чувствителен к амоксицилину, доксициклину, кларитромицину (таблица 2).
Адгезивные свойства
Высокоадгезивный штамм. Индекс адгезивности - среднее количество лактобацилл, прикрепившихся к одному эритроциту, при подсчете 25... 50 эритроцитов (не более 5 эритроцитов в поле зрения) - составляет 8,2± 1,14 (таблица 3).
Антагонистическая активность.
Штамм характеризуется высокой антагонистической активностью в отношении подавления роста и развития грамположительных и грамотрицательных болезнетворных, а также вредных для производства микроорганизмов (таблица 4).
Перекись водорода не продуцирует, лизоцимной, гемолитической, плазмокоагулазной и желатиназной активностью не обладает.
Плазмидный состав.
Штамм имеет четыре плазмиды с молекулярными массами 5,2 МД, 5,9 МД, 8,2 МД и 40 МД.
Способ, условия и состав сред для хранения культур штамма.
Культуры штамма хранят под маслом на среде МРС с кусочками печени в пробирках при температуре 4... 6° С с периодическим пересевом 1 раз в 6... 12 месяцев либо в сублимированном виде в запаянных ампулах (длительность хранения 2 года и более). Защитная среда при высушивании - 1,5% полиглюкин.
Способ, условия и состав сред для размножения штамма
Штамм выращивается при 36... 38° С в жидкой среде МРС-1, твердой среде МРС-4 и жидкой казеиновой посевной среде.
Состав среды МРС-1, г в 1 л:
пептон - 10,0;
дистиллированная вода - до 500,0;
ферментативный гидролизат мяса - 100,0;
MnSО4·4H2O - 0, 05;
MgSО4·4H2O - 0, 02;
цистеин солянокислый - 0,2;
глюкоза - 20,0;
лактоза - 2,0;
К2НРО4 - 2,0;
КН2РO4 - 2,0;
натрия ацетат - 5,0;
аммония ацетат - 2,0;
твин-80 - 1,0;
печеночный экстракт - 100,0;
молоко гидролизованное - до 1000,0;
концентрацию водородных ионов доводят до 6,2... 6,4 ед. рН и стерилизуют текучим паром 20 мин при 100° С.
Для получения твердой среды (МРС-4) вводят 15 г агара.
Посевная среда, г в 1 л:
пептон - 10,0;
дистиллированная вода - до 500,0;
дрожжевой экстракт - 50,0;
гидролизат казеина - 100,0;
MnSO4·4H2O - 0,05;
MgSO4·4Н2O - 0, 02;
цистеин солянокислый - 0,2;
глюкоза - 20,0;
К2НРO4 - 3,0;
КН2РO4 - 3,0;
твин-80 - 1,0;
молоко гидролизованное - до 500,0;
концентрацию водородных ионов доводят до 6,2... 6,4 ед. рН и стерилизуют текучим паром 20 мин при 100° С.
Штамм Lactobacillus buchneri P0 был получен в результате отбора лактобацилл из микрофлоры, выделенной из естественной среды обитания - влагалища здоровой женщины репродуктивного возраста - в 1996 году в г.Кирове. Культура выделена из моноколоний и идентифицирована по определителю Bergeys (1997 г.) и классификации Rogosa и Sharpe.
Штамм депонирован в коллекции НИИМ МО РФ под №38.
Штамм характеризуется следующими признаками.
Культурально-морфологические признаки
При выращивании в жидкой среде МРС-1 в течение 72 ч при температуре 36... 38° С лактобациллы растут в виде гомогенного белого осадка на дне пробирки, при этом питательная среда остается прозрачной.
На поверхности твердой агаризованной среды МРС-4 через 96...120 ч инкубирования при температуре 36... 38° С формируются колонии диаметром 0,5... 1,0 мм белого и буроватого цвета с желтым оттенком. Форма колоний круглая с фестончатыми краями - волнистые, неровные, но четкие. Структура колоний крупнозернистая. Поверхность колонии гладкая, рельефная, бугристая и блестящая. Профиль колоний изогнутый. Центр колоний конусовидный, плавно переходит в уплощенную периферическую часть. Консистенция плотная, тягучая, с трудом снимается со среды.
Пигмента не образуют.
Морфология клеток
Грамположительные короткие коккообразные палочки с четкими контурами и закругленными полюсами длиной 1,0... 1,5 мкм и диаметром 0,4... 0,6 мкм.
Физиолого-биохимические признаки штамма
Факультативный анаэроб, каталазоотрицательный, цитохромоксидазоотрицательный. Аммиак из аргинина не образует. Нитраты не редуцирует. Желатину не разжижает.
Сахаролитическая активность.
Сбраживает: глюкозу, Д-эскулин, фруктозу, Д-галактозу, Д-лактозу, мальтозу, мелибиозу, сахарозу, Д-раффинозу, Д-ксилозу, глюконат, мелибиозу, рибозу, арабинозу.
Не ферментирует: рамнозу, сорбит, маннит, салицин, маннозу, целлобиозу, трегалозу.
Конечное значение рН на ферментируемых сахарах - (4,8± 0,2) ед. рН в базовой среде МРС-1. Тип ферментации - бродильный гетероферментативный с образованием молочной и уксусной кислот, этанола и углекислого газа. Молоко свертывает с образованием сгустка, максимально титруемая кислотность которого составляет (246± 15)° Т.
Температурный оптимум 36... 38° С. Температурный предел роста в атмосфере воздуха 15... 45° С. Предельные значения рН среды, при которых наблюдается рост, - 5,0... 8,0 ед рН. Оптимальное значение рН среды - 6,3 ед. рН.
В процессе жизнедеятельности накапливает глицин, глютамин, изолейцин и тирозин.
Чувствительность к антибиотикам
Штамм устойчив к метронидазолу, канамицину, налидиксовой кислоте, умеренно устойчив к фторхинолонам; чувствителен к амоксицилину, доксициклину, кларитромицину (таблица 2).
Адгезивные свойства
Высокоадгезивный штамм. Индекс адгезивности - среднее количество лактобацилл, прикрепившихся к одному эритроциту, при подсчете 25... 50 эритроцитов (не более 5 эритроцитов в поле зрения) - составляет 9,1± 1,18 (таблица 3).
Антагонистическая активность.
Штамм характеризуется высокой антагонистической активностью в отношении подавления роста и развития грамположительных и грамотрицательных болезнетворных, а также вредных для производства микроорганизмов (таблица 4).
Перекись водорода не продуцирует, лизоцимной, гемолитической, плазмокоагулазной и желатиназной активностью не обладает.
Плазмидный состав
Штамм плазмид не имеет.
Способ, условия и состав сред для хранения культур штамма
Культуры штамма хранят под маслом на среде МРС с кусочками печени в пробирках при температуре 4... 6° С с периодическим пересевом 1 раз в 6... 12 месяцев либо в сублимированном виде в запаянных ампулах (длительность хранения 2 года и более). Защитная среда при высушивании - 1,5% полиглюкин.
Способ, условия и состав сред для размножения штамма
Штамм выращивается при 36... 38° С в жидкой среде МРС-1, плотной среде МРС-4 и жидкой казеиновой посевной среде
Состав среды МРС-1, г в 1 л:
пептон - 10,0;
дистиллированная вода - до 500,0;
ферментативный гидролизат мяса - 100,0;
MnSO4·4H2O - 0,05;
MgSO4·4H2О - 0,02;
цистеин солянокислый - 0,2;
глюкоза - 20,0;
лактоза - 2,0;
К2НРO4 - 2,0;
КН2РO4 - 2,0;
натрия ацетат - 5,0;
аммония ацетат - 2,0;
твин-80 - 1,0;
печеночный экстракт - 100,0;
молоко гидролизованное - до 1000,0;
концентрацию водородных ионов доводят до 6,2... 6,4 ед. рН и стерилизуют текучим паром 20 мин при 100° С.
Для получения твердой среды (МРС-4) вводят 15 г агара.
Посевная среда, г в 1 л:
пептон - 10,0;
дистиллированная вода - до 500,0;
дрожжевой экстракт - 50,0;
гидролизат казеина - 100,0;
MnSO4·4H2O - 0,05;
MgSO4·4Н2О - 0, 02;
цистеин солянокислый - 0,2;
глюкоза - 20,0;
К2НРO4 - 3,0;
КН2РO4 - 3,0;
твин-80 - 1,0;
молоко гидролизованное - до 500,0;
концентрацию водородных ионов доводят до 6,2... 6,4 ед. рН и стерилизуют текучим паром 20 мин при 100° С.
Lactobacillus plantarum P4 и Lactobacillus buchneri P0 схожи между собой по широкому спектру характеристик.
Основным отличием штаммов являются антагонистические свойства: штамм Lactobacillus buchneri P0 обладает средней антагонистической активностью, штамм Lactobacillus plantarum P4 обладает высокой антагонистической активностью.
Общим положительным эффектом при совместном использовании обоих штаммов является способность образовывать устойчивую симбиотическую систему, характеризующуюся синтрофным и синергетическим типом взаимоотношений и способную оказывать лечебно-профилактическое воздействие на организм человека, подвергнутого влиянию негативных внешних факторов.
Указанная система существует при соотношении в смешанной культуре клеток штаммов №39 и №38 от 1:4 до 4:1, сохраняя указанные свойства.
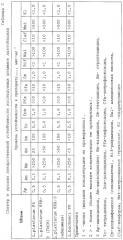
Основные свойства штаммов и их смеси в разных соотношениях микроорганизмов приведены в таблицах 5 и 6.
Проведенные эксперименты показали, что полученная симбиотическая система по эффективности выше монокультур микроорганизмов - увеличивается размер зоны угнетения роста культур E.coli 0157, Sh.flexneri 170, Sh.sonnei 5063, Pr.vulgaris 177, St.aureus 209, Pr.mirabilis (таблица 7).
На основе симбиотической смеси создан сухой препарат, содержащий наряду с клетками штаммов №39 и №38 в соотношении от 1:4 до 4:1 продукты их метаболизма. Общее содержание живых микроорганизмов не менее 1× 108 клеток в 1 мл регидратированного препарата.
Сухой препарат имеет светло-коричневый цвет с характерным кисломолочным запахом и вкусом. При растворении в воде сухой препарат образует гомогенную взвесь. При растворении в 0,85% растворе хлорида натрия рН раствора составляет не менее 4,5 ед. рН. Активность кислотообразования препарата - не менее 200° Т.
Сухой препарат не изменяет свои свойства в течение года при хранении в сухом темном месте при температуре 2... 8° С. К концу указанного срока в препарате содержание жизнеспособных бактерий составляет не менее 50% (таблица 8).
Безопасность препарата “Билакт” проверяли, изучая факторы патогенности in vitro и in vivo. Установлено, что препарат гемолитической, плазмокоагулазной и желатиназной активностями не обладает, не является токсигенным и токсичным для белых мышей. Препарат специфически безопасен для морских свинок и белых мышей как при введении через рот, так и под кожу. При обследовании внутренних органов забитых белых мышей патологоанатомических изменений брюшной и грудной полостей, желудочно-кишечного тракта и паренхиматозных органов не выявлено. При бактериальном обследовании внутренних органов (печень, селезенка, легкое, сердце) методом отпечатков на поверхности питательного агара (МРС-4) роста лактобактерий не обнаружено. Полученные результаты свидетельствуют об отсутствии “острой” и “хронической” токсичностей у исследуемых штаммов лактобацилл и препарата, приготовленного на их основе (таблицы 9, 10 и 11).
Влияния введения разрабатываемого препарата на детоксицирующую функцию печени и процессы, происходящие в ЦНС, не выявлено. Аллергизирующий эффект отсутствует.
Препарат не вызывает местной реакции, апирогенен. Не вызывает макро- и микроскопических изменений во внутренних органах экспериментальных животных. При микроскопии гистологических препаратов морфологические изменения имели локализованный характер, о чем свидетельствует интактность ретикуло-гистиоцитарного аппарата за пределами лимфатических узлов, дренирующих место введения препарата.
Результаты исследований, проведенные с использованием стандартных тестов при определении влияния изучаемого препарата на детоксицирующую функцию печени, также свидетельствовали о его безвредности.
Пример 1.
Сублимированные музейные культуры штаммов лактобацилл №39 и №38 регидратируют путем разведения содержимого ампул очищенной водой для их последующего раздельного выращивания в пробирках (МРС-1) и в матрацах (МРС-4).
Полученные регидратированные суспензии культур штаммов лактобацилл вносят по 0,5... 1,0 мл раздельно в пробирки с жидкой питательной средой МРС-1 (посевная доза - не менее 1× 106 клеток на 1 мл).
Пробирки с посевом инкубируют при температуре 36... 38° С в течение 48 ч.
В матрацы со скошенной плотной питательной средой МРС-4 раздельно вносят по 4,0... 5,0 мл посевной культуры штаммов лактобацилл из пробирок. Посевы инкубируют при температуре 36... 38° С в течение 48 ч.
Процесс получения биомассы каждого штамма включает раздельное внесение суспензии агаровых культур штаммов лактобацилл в аппараты-культиваторы, содержащие жидкую питательную среду МРС-1 из расчета 50 мл культуры на 1 л жидкой питательной среды, и культивирование при периодическом механическом перемешивании со скоростью не более 60 об./мин-1 и температуре 36... 38° С в течение 48 ч.
Культуры, выращенные в аппаратах-культиваторах, должны отвечать следующим требованиям:
концентрация лактобацилл, млрд· мл-1 - не менее 5,0;
водородный показатель, ед. рН - 3,5... 4,0;
посторонняя микрофлора - не допускается.
Раздельно выращенные в аппаратах-культиваторах культуры штаммов №39 и №38 декантируют в бутыль в требуемом соотношении, перемешивают в течение 15 мин и вводят защитную среду из расчета 80 мл на 1000 мл микробной суспензии. После перемешивания микробную взвесь разливают по 2,0 мл в стерильные пенициллиновые флаконы, которые загружают в сушильную установку.
Процесс высушивания препарата включает:
замораживание материала во флаконах до температуры минус 30... 40° С со скоростью 10... 15° С× ч-1;
двухчасовая экспозиция замороженного материала;
один час экспозиции замороженного материала под разрежением до 300 мкм рт.ст.;
сушка материала в интервале от минус 30... 40° С до 0° С со скоростью 1... 2° С× ч-1, далее в течение 4... 5 ч доводят температуру материала до 25... 30° С и досушивают его в течение 7... 10 ч.
Препарат “Билакт” должен отвечать следующим требованиям:
представлять собой пористую или кристаллическую массу в виде таблетки светло-коричневого цвета с желтоватым оттенком;
указанная таблетка должна растворяться в 5 мл дистиллированной воды при перемешивании в течение 3 мин;
иметь потерю массы при высушивании не более 3,5%;
рН после регидратации препарата в 1,8 мл 0,9% раствора хлорида натрия должна быть не менее 4,5 ед. рН;
не содержать посторонней микрофлоры;
быть безвредным;
содержать не менее 1× 108 живых лактобактерий в 1 мл регидратированного препарата;
обладать антагонистической активностью - зона угнетения роста тест-штаммов должна быть не менее 20 мм;
обладать активностью кислотообразования по Тернеру не менее 200° Т.
Препарат применяется в лечебных и профилактических целях:
при кишечных дисфункциях в результате дисбактериоза кишечника, возникающего как следствие длительной антибактериальной, гормональной, лучевой и другой терапии, при стрессовых ситуациях и пребывании в экстремальных условиях;
при острых кишечных инфекциях (в комплексном лечении острой дизентерии, сальмонеллеза, эшерихиоза, вирусных диарей и т.п.), при длительных кишечных дисфункциях стафилококковой этиологии, а также при лечении реконвалесцентов после острых кишечных инфекций при продолжающейся дисфункции кишечника;
при острых и хронических воспалительных заболеваниях толстого и тонкого кишечника (колиты, энтероколиты), протекающих на фоне нарушений микрофлоры с дефицитом или отсутствием лактобактерий;
при лечении дисбактериоза влагалища (вагиноза);
при лечении гнойных ран, трофических язв, осложненных инфекцией.
Способ применения
Внутрь. Препарат во флаконе растворяют в 5,0 мл теплой кипяченой водопроводной воды 25... 30° С. Полученную суспензию разводят в 1/2 стакана теплой воды и выпивают за 30...40 мин до приема пищи 2 раза в день. Курс лечения составляет 5 дней, затем делается перерыв на 1... 2 недели. При необходимости курс повторяется.
Интравагинально. Содержимое флакона растворяют в 5 мл кипяченой воды. Полученной взвесью препарата пропитывают стерильный тампон, который вводят интравагинально и оставляют на 2... 3 ч. Курс лечения начинают с 10... 12 дня менструального цикла.
Местно. Содержимое флакона растворяют 5 мл кипяченой воды. Полученной взвесью препарата пропитывают стерильный тампон, который наносят на поврежденную поверхность и выдерживают не менее 10 мин.
Устойчивость ассоциации штаммов лактобацилл к метронидазолу позволяет проводить комплексное лечение язвенной болезни желудка и 12-перстной кишки при положительном тесте на хеликобактер, острого и хронического трихомоноза у женщин, совмещая назначение препарата пробиотика и противомикробных и противопаразитарных средств.
Пример 2
Лечебно-профилактический препарат, содержащий в качестве основы два селекционированных штамма лактобацилл и продукты их жизнедеятельности, благодаря высокой специфической активности лактобацилл - колонизирующей способности штамма №38 и сильной антимикробной активности штамма №39 в отношении широкого спектра патогенных и условно-патогенных микроорганизмов - имеет выраженное свойство корректировать дисбактериоз различной этиологии у больных людей и животных.
Препараты были использованы при комплексном лечении язвенной болезни желудка и 12-перстной кишки, гнойных парапроктитов, хронических неспецифических колитов, обширных или глубоких гнойных и гнилостных ран с глубоким травматическим разложением мягких тканей или глубоким их повреждением в результате ожога или обморожения.
При лечении и наблюдении за указанными больными были получены следующие результаты:
при язвенной болезни желудка и 12-перстной кишки сроки выздоровления уменьшались на 30... 50%. Препарат давали 2 раза в день. Курс лечения составляет 10 дней;
парапроктиты - местное применение в виде турунд обеспечило быстрое отторжение гнойного содержимого и очищение ран к третьим - четвертым суткам, тогда как без применения препарата процесс затягивался до 8... 9 дней. Препарат использовали местно при перевязках однократно в течение 7 дней;
хронические неспецифические колиты - применение внутрь, что способствовало нормализации микрофлоры и снятию болевого синдрома. Препарат применяли внутрь 2 раза в день. Курс лечения составляет 10... 15 дней;
гнойно-некротические процессы - при ежедневном применении в виде аппликаций наблюдалось быстрое купирование воспалительных явлений. Препарат использовали местно при перевязках однократно в течение 7 дней.
После 2... 3 перевязок исчезало напряжение и боли по краю ран, воспаление отграничивалось, некротические процессы прекращались, уменьшалось гнойное отделяемое, больные отмечали улучшение самочувствия. Ранняя отмена препарата приводила к новому обострению воспалительного процесса в ране, поэтому аппликации использовали в течение всего периода лечения, что способствовало быстрому заполнению раневого канала грануляциями и ранней (уже на 12 день) эпителизацией раневого дефекта. Препарат применяли местно при перевязках однократно в течение 10... 15 дней.
Пример 3.
На базе Отдела микробиологии Всероссийского научно-исследовательского ветеринарного института птицеводства РАСХН (г.С.-Петербург) и лаборатории ветеринарной иммунологии НИИСХ Северо-Востока им. Рудницкого (г.Киров) показана высокая антагонистическая активность исследуемых штаммов лактобацилл в отношении возбудителей, выделенных от больных телят, коров, свиней и птицы разного возраста хозяйств Саратовской ("Михайловская птицефабрика"), Тульской (ЗАО АПФ “Иван-Озеро”) и Кировской ("Путь Ленина", "Ижевский") областей (E.coli штамм Р16; Salmonella dublin 12/1; Pasteurella multocida 98/4; Pseudomonos aeruginosa Л-4; Bordetella bronchiseptica Ш-97/4; Staphylococcus al-bus KB 97/2; S.enteritidis и St.aureus).
В экспериментах на базе птицеводческого комплекса ЗАО АПФ “Иван-Озеро” (Саратовская область) и ГУП “Михайловская птицефабрика” (Тульская область) показано, что выпаивание (100 мл суспензии с концентрацией клеток 4... 5 млрд. на 15000 голов) и скармливание (в ежесуточной дозе 3... 4 млн. микробных клеток на 1 голову) пробиотика Билакт молодняка кур кросса "П-46" и бройлерных цыплят в возрасте от 1 до 7 дней повышает сохранность молодняка птиц на 3%.
Подобный лечебный эффект в первые сутки жизни птицы наблюдался и в экспериментах на Костинской птицефабрике (Кировская область). Полученный лечебный эффект от применения пробиотика в первые сутки жизни молодняка был воспроизведен на цыплятах кросса “Смена-2” Яранской птицефабрики (Кировская область). Показано, что гибель цыплят в контрольной группе до 15 суток была выше по сравнению с опытной. При этом привес массы тела в опытной группе цыплят превышал таковой у цыплят контрольной группы. Увеличение разовой дозы пробиотика в два раза в период резкого увеличения падежа птицы от колибактериоза позволило снизить падеж птицы на 10%. При этом ежесуточный прирост количества выжившей птицы в опытной группе был существенно выше, чем в контрольной группе.
1. Штамм бактерий Lactobacillus plantarum P4 НИИМ МО РФ №39 симбионт штамма Lactobacillus buchneri Р0 НИИМ МО РФ №38, используемый для приготовления препарата пробиотика.
2. Штамм бактерий Lactobacillus buchneri Р0 НИИМ МО РФ №38 симбионт штамма Lactobacillus plantarum P4 НИИМ МО РФ №39, используемый для приготовления препарата пробиотика.
3. Пробиотический препарат, способствующий коррекции дисбактериозов различной этиологии у людей и животных на основе биомассы лактобацилл, отличающийся тем, что в качестве биомассы он содержит высушенную смесь бактерий штаммов Lactobacillus plantarum P4 НИИМ МО РФ №39 и Lactobacillus buchneri Р0 НИИМ МО РФ №38 в соотношении микроорганизмов от 4:1 до 1:4 при содержании живых клеток не менее 1×108 клеток на 1 г препарата.