Активаторы изоиндолин-1-он-глюкокиназы
Иллюстрации
Показать всеИзобретение относится к новым активаторам изоиндолин-1-он-глюкокиназы формулы 1
где
А означает незамещенный фенил или фенил, одно- или двузамещенный галогеном или однозамещенный группой (низш.)алкилсульфонил, нитро;
R1 означает С3-C9циклоалкил;
R2 означает незамещенный или однозамещенный пяти- или шестичленный гетероароматический цикл, связанный через атом углерода в цикле с указанной аминогруппой, причем пяти- или шестичленный гетероароматический цикл содержит от 1 или 2 гетероатома, выбранных из ряда сера, кислород или азот, один из которых является атомом азота, соседним с атомом углерода, связанным с аминогруппой, причем цикл является моноциклическим или конденсированным с фенилом по двум атомам углерода в цикле, указанный однозамещенный гетероароматический цикл является однозамещенным по атому углерода в цикле, который не является соседним с указанным атомом углерода, связанным с аминогруппой, а заместитель выбран из галогена или группы (низш.)алкил;
* означает ассиметричный атом углерода в конкретном соединении, или его фармацевтически приемлемые соли, или N-оксиды.
Соединения 1 активируют глюкокиназу, что позволяет использовать их в фармацевтической композиции при лечении диабета типа II. 8 н. и 15 з.п. ф-лы.
Реферат
Глюкокиназа (ГК) является одной из четырех гексокиназ, обнаруженных в организме млекопитающих (Colowick S.P., The Enzymes, т.9 (Р.Воуег, ed.) Academic Press, New York, NY, c.1-48 (1973)). Гексокиназы катализируют первую стадию метаболизма глюкозы, т.е. превращение глюкозы в глюкозо-6-фосфат. Глюкокиназа присутствует далеко не во всех типах клеток, а содержится главным образом в панкреатических β-клетках и в паренхимных клетках печени. Кроме того, ГК является скорость-определяющим ферментом метаболизма глюкозы в этих двух типах клеток, которые, как известно, играют решающую роль в гомеостазе глюкозы целого организма (Chipkin S.R., Kelly K.L. и Ruderman N.B., Joslin’s Diabetes, C.R. Khan и G.C.Wier, eds., Lea и Febiger, Филадельфия, PA, c.97-115 (1994)). Концентрация глюкозы, при которой ГК проявляет половину максимальной активности, составляет 8 мМ. Остальные три гексокиназы насыщаются глюкозой при существенно более низкой концентрации (<1 мМ). Следовательно, поступление глюкозы за счет глюкокиназного (ГК) пути возрастает по мере роста концентрации глюкозы в крови от “голодного” (5 мМ) до “послеобеденного” (~10-15 мМ) уровня после углеводного питания (Printz R.G., Magnuson М.А. и Granner D.K., Ann. Rev. Nutrition, т.13, R.E.Olson, D.M.Bier и D.B.McCormick, eds., Annual Review, Inc., Palo Alto, CA, c.463-496 (1993)). Десять лет назад эти данные стимулировали появление гипотезы, что в β-клетках и гепатоцитах ГК функционирует в качестве глюкозного сенсора (Meglasson M.D. и Matschinsky F.M., Amer. J. Physiol., 246, E1-E13 (1984)). В последнее время исследования на трансгенных животных подтвердили, что ГК действительно играет решающую роль в гомеостазе глюкозы всего организма. Животные, не экспрессирующие ГК, погибают через несколько дней после рождения от острого диабета, тогда как животные с гиперэкспрессией ГК хорошо переносят глюкозу (Grupe A., Hiltgren В., Ryan А. и др., Cell, 83, 69-78 (1995), Ferrie Т., Riu E., Bosch F. и др., FASEB J., 10, 1213-1218 (1996)). Рост устойчивости к глюкозе связан благодаря ГК с увеличенной секрецией инсулина в β-клетках и с увеличенным отложением гликогена в гепатоцитах и, вероятно, с пониженным продуцированном глюкозы.
Данные о том, что появление диабета совершеннолетних типа II в юности (MODY-2) вызвано потерей гена ГК из-за функциональных мутаций, свидетельствуют о том, что ГК выступает в роли глюкозного сенсора и в организме человека (Liang Y., Kesavan P., Wang L. и др, Biochem. J., 309, 167-173 (1995)). Дополнительные факты, подтверждающие участие ГК в регуляции метаболизма глюкозы в организме человека, получены при выявлении пациентов, которые экспрессируют мутантную форму ГК с более высокой ферментативной активностью. Эти пациенты проявляют гипогликемию натощак, связанную с необычно высоким уровнем инсулина в плазме (Glaser В., Kesavan Р., Heyman M. и др., New England J. Med., 338, 226-230 (1998)). Хотя мутации в гене ГК у большинства пациентов с диабетом типа II не обнаружены, соединения, которые активируют ГК и тем самым увеличивают чувствительность ГК-сенсорной системы, все же могут найти применение при лечении гипогликемии, характерной для всех вариантов диабета типа II. Активаторы глюкокиназы увеличивают метаболизм глюкозы в β-клетках и гепатоцитах, который сопряжен с повышенной секрецией инсулина. Такие агенты могут найти применение при лечении диабета типа II.
В настоящем изобретении предлагается соединение, включающее амид формулы
где
А означает незамещенный фенил или фенил, одно- или двузамещенный галогеном или однозамещенный группой (низш.)алкилсульфонил, (низш.)алкилтио или нитро,
R1 означает циклоалкил, содержащий от 3 до 9 атомов углерода, или (низш.)алкил, содержащий от 2 до 4 атомов углерода,
R2 означает незамещенный или однозамещенный пяти- или шестичленный гетероароматический цикл, связанный через атом углерода в цикле с указанной аминогруппой, причем пяти- или шестичленный гетероароматический цикл содержит от 1 до 3 гетероатомов, выбранных из ряда сера, кислород или азот, причем один гетероатом является атомом азота, соседним с атомом углерода, связанным с аминогруппой, а цикл является моноциклическим или конденсированным с фенилом по двум атомам углерода в цикле, причем указанный однозамещенный гетероароматический цикл является однозамещенным по атому углерода в цикле, который не является соседним с указанным атомом углерода, связанным с аминогруппой, а заместитель выбран из группы, включающей галоген, (низш.)алкил, нитро, циано, перфтор(низш.)алкил; гидрокси, -(CH2)n-OR3, -(CH2)n-C(O)-OR3, -(CH2)n-C(O)-NH-R3, -C(O)C(O)-OR3 и -(CH2)n-NHR3, где R3 означает водород или (низш.)алкил, а
n означает 0, 1, 2, 3 или 4, или его фармацевтически приемлемые соли, или N-оксиды.
Предпочтительно R2 означает пяти- или шестичленный гетероароматический цикл, связанный через атом углерода в цикле с аминогруппой, указанной в формуле I, причем указанный пяти- или шестичленный гетероароматический цикл содержит от 1 до 3 гетероатомов, выбранных из ряда сера, кислород и азот, причем один гетероатом является атомом азота, который является соседним с атомом углерода, связанным с аминогруппой. Этот цикл может быть моноциклическим или конденсированным с фенилом по двум атомам углерода в цикле. В одном из вариантов настоящего изобретения соседний атом азота в азотсодержащем гетероароматическом цикле может присутствовать в форме N-оксида, когда атом азота, соседний с атомом углерода в цикле, превращают в N-оксид.
С другой стороны, соединения формулы I могут существовать в форме фармацевтически приемлемых солей.
Установлено, что соединения формулы I активируют глюкиназу in vitro. Активаторы глюкокинзы применяются для увеличения уровня секреции инсулина при лечении диабета типа II.
Кроме того, настоящее изобретение относится к фармацевтической композиции, включающей соединение формулы I в смеси с фармацевтически приемлемым носителем и/или адъювантом. Кроме того, настоящее изобретение относится к применению таких соединений в качестве терапевтически активных соединений, а также к их применению при получении лекарственных средств для лечения или профилактики диабета типа II. Кроме того, настоящее изобретение относится к способу получения соединений формулы I. Настоящее изобретение относится также к способу профилактики или теравпевтического лечения диабета типа II, причем способ включает введение соединения формулы I человеку или животному.
Более подробно в изобретении предлагается соединение, включающее амид формулы I или N-оксид амида формулы I, указанной выше, а также их фармацевтически приемлемые соли.
В соединении формулы I знак "*" означает асимметрический атом углерода в конкретном соединении. Благодаря наличию асимметрического атома соединение формулы I может существовать в форме рацемата. Однако предпочтительны S-энантиомеры, где асимметрический атом углерода в амиде имеет S-конфигурацию. Если фенильный цикл А монозамещен группами (низш.)алкилсульфонил, нитро или (низш.)алкилтио, предпочтительно, чтобы он был замещен в 5 или 6 положении, как указано для формулы I. Таким образом, если А означает фенил, замещенный нитрогруппой, предпочтительно, чтобы этот заместитель находился в положении 5 или 6, т.е. если А означает 5-нитрофенил и 6-нитрофенил.
В одном варианте формулы I указанный выше цикл R2 означает одно моноциклическое (неконденсированное) кольцо. Моноциклическое кольцо R2 предпочтительно представляет собой незамещенный пиридин. В другом варианте формулы I указанный выше цикл R2 означает бициклическую систему, т.е. цикл, конденсированный с фенилом.
Термин “(низш.)алкил”, используемый в тексте заявки, означает алкильные группы с прямой и разветвленной цепью, содержащие от 1 до 10, предпочтительно от 3 до 9 атомов углерода, прежде всего от 2 до 4 атомов углерода, такие как пропил, изопропил, гептил и т.п.
Термин “циклоалкил”, используемый в тексте заявки, означает 3-9-членное циклоалкильное кольцо, предпочтительно 5-8-членное, например циклопентил, циклогексил, циклогептил или циклооктил.
Термин “перфтор(низш.)алкил”, используемый в тексте заявки, означает любую группу (низш.)алкил, где все атомы водорода в группе (низш.)алкил замещены или заменены на атом фтора. Предпочтительные перфтор(низш.)алкильные группы включают трифторметил, пентафторэтил, гептафторпропил и т.п.
Термин “(низш.)алкилтио”, используемый в тексте заявки, означает (низш.)алкил, имеющий значения, указанные выше, связанный с остатком молекулы через атом серы тиогруппы.
Термин “(низш.)алкилсульфонил”, используемый в тексте заявки, означает (низш.)алкил, имеющий значения, указанные выше, связанный с остатком молекулы через атом серы сульфонильной группы.
Термин “галоген”, используемый наряду с термином “гало”, означает, если не указано иное, все четыре галогена, т.е. фтор, хлор, бром и йод.
Термин “N-оксид”, используемый в тексте заявки, означает отрицательно заряженный атом кислорода, ковалентно связанный с заряженным положительно атомом азота в гетероароматическом цикле.
Термин “гетероароматический цикл”, используемый в тексте заявки, означает пяти- или шестичленное ненасыщенное карбациклическое кольцо, в котором один или более атомов углерода заменены на гетероатом, такой как кислород, азот или сера. Гетероароматическое кольцо может означать один цикл или оно может быть бициклическим, т.е. образованным за счет конденсации двух циклов.
Гетероароматический цикл R2 может означать незамещенный или однозамещенный пяти- или шестичленный гетероароматический цикл, содержащий от 1 до 3 гетероатомов, выбранных из группы, включающей кислород, азот и серу, и связанный по атому углерода в цикле с амином указанной амидной группы. По меньшей мере один гетероатом является атомом азота, который является соседним с атомом углерода, связанным с аминогруппой. Если присутствуют другие гетероатомы, то они могут означать серу, кислород или азот. Цикл R2 может означать одно кольцо. Такие гетероароматические циклы включают, например, пиридинил, пиримидинил, пиразинил, пиридазинил, изоксазолил, изотиазолил, пиразолил, тиазолил, оксазолил и имидазолил. Предпочтительным гетероароматическим циклом является пиридинил. Цикл R2 может быть бициклическим, т.е. конденсированным с фенилом по двум свободным атомам углерода. Примерами таких циклов являются бензимидазолил, бензотиазолил, хинолинил, бензоксазолил и т.п. Цикл R2 связан через атом углерода в цикле с амидной группой, образуя амиды формулы I. Атом углерода в гетероароматическом цикле, принимающий участие в амидной связи с образованием соединения формулы I, не может содержать никакой другой заметитель. Если R2 означает незамещенный или однозамещенный пятичленный гетероароматический цикл, предпочтительными являются такие циклы, которые содержат атом азота, соседний с атомом углерода в цикле, связанным с аминогруппой, и второй гетероатом, соседний с атомом углерода в цикле, связанным с аминогруппой.
Группа -C(O)OR3, используемая в тексте заявки, означает -C(=O)OR3 и т.п.
Термин “фармацевтически приемлемые соли”, используемый в тексте заявки, включает любую соль неорганической или органической фармацевтически приемлемой кислоты, такой как хлористоводородная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфокислота, пара-толуолсульфокислота и т.п. Кроме того, термин “фармацевтически приемлемые соли” включает любую фармацевтически приемлемую соль основания, такую как соль амина, соль триалкиламина и т.п. Специалист в данной области легко может получить такие соли по известным методикам.
Кроме того, изобретение относится к пролекарствам соединения формулы I. Пролекарство представляет собой метаболический предшественник лекарственного средства, который при введении пациенту превращается в лекарственное средство и приемлемые побочные продукты. Соединения по настоящему изобретению можно превратить в любое Пролекарство. Конкретным пролекарством по настоящему изобретению являются N-оксиды, указанные выше. В общем случае в виде пролекарства можно получить любое индивидуальное соединение по изобретению.
При проведении реакций, представленных ниже на Схеме и описанных в комментариях, различные функциональные группы, такие как свободные карбоксильные и свободные гидроксильные группы, можно защитить с использованием гидролизуемых сложных и простых эфиров. Термин “защитные группы в виде гидролизуемых сложных и простых эфиров”, используемый в тексте заявки, означает любую сложноэфирную группу или группу простого эфира, которая обычно применяется для защиты карбоновых кислот или спиртов и которая гидролизуется с образованием соответствующей карбоксильной или гидроксильной группы. Типичными сложноэфирными группами, которые используются для этих целей, являются такие группы, в которых ацильные остатки означают (низш.)алкановые, арил(низш.)алкановые или (низш.)алкандикарбоновые кислоты. Активированные производные, пригодные для получения таких групп, включают ангидриды кислот, галогенангидриды кислот, предпочтительно хлорангидриды или бромангидриды арил- или (низш.)алкановых кислот. Примерами ангидридов являются ангидриды монокарбоновых кислот, такие как ангидрид уксусной кислоты, ангидрид бензойной кислоты, и ангидриды (низш.)алкандикарбоновых кислот, например янтарный ангидрид, а также хлорформиаты, например, предпочтительны трихлор- и этилхлорформиат. Пригодной группой простого эфира для защиты спиртов являются, например, тетрагидропиранильные простые эфиры, такие как 4-метокси-5,6-дигидрокси-2Н-пиранильные простые эфиры. Другим примером простых эфиров являются ароилметиловые эфиры, такие как бензильные, бензгидрильные или тритильные простые эфиры или α-(низш.)алкокси(низш.)алкильные простые эфиры, например метоксиметильный или аллильный простой эфир или алкилсилильные простые эфиры, такие как триметилсилильный эфир.
Термин “аминозащитная группа” означает любую обычную аминозащитную группу, которая может расщепляться с образованием свободной аминогруппы. Предпочтительными защитными группами являются обычные аминозащитные группы, используемые в пептидном синтезе. Более предпочтительными являются прежде всего такие аминозащитные группы, которые расщепляются в слабокислой среде, приблизительно при рН 2-3. Более предпочтительными аминозащитными группами являются трет-бутилкарбамат (ВОС), бензилкарбамат (CBZ) и 9-флуоренилметилкарбамат (FMOC).
В предпочтительных соединениях формулы I R1 означает циклоалкил, содержащий от 5 до 8 атомов углерода, а R2 означает незамещенный или однозамещенный пяти- или шестичленный гетероароматический цикл, связанный через атом углерода в цикле с указанной аминогруппой, причем указанный пяти- или шестичленный гетероароматический цикл содержит от 1 до 2 гетероатомов, выбранных из ряда сера, кислород и азот, причем один гетероатом означает атом азота, который является соседним с атомом углерода в цикле, связанным с аминогруппой, причем цикл может содержать одно кольцо или может быть конденсирован с фенилом по двум атомам углерода в цикле, причем указанный однозамещенный гетероароматический цикл монозамещен по атому углерода, который не является соседним с указанным атомом углерода, связанным с аминогруппой, а заместитель выбран из группы, включающей галоген или (низш.)алкил (формула АВ). Как указано в формуле АВ, R2 является моноциклическим кольцом (формула А) или бициклической системой за счет конденсации с фенилом (формула В). В соединениях формулы А группа R2 более предпочтительно означает замещенный или незамещенный пиридин. Кроме того, R2 предпочтительно означает циклогексил. Фенил А предпочтительно является незамещенным.
В предпочтительном соединении формулы I группа R1 означает циклогексил, а R2 означает моноциклическое кольцо (формулы А-1). В соединении формулы А-1 фенил А предпочтительно является незамещенным. Более предпочтительно группа R2 означает замещенный или незамещенный пиридин.
В одном варианте формулы А-1 группа R2 означает незамещенный пиридин, а в другом варианте группа R2 означает однозамещенный пиридин. Предпочтительно заместитель означает галоген, такой как бром, фтор или хлор, или (низш.)алкил, такой как метил.
В другом варианте формулы А-1 группа R2 означает однозамещенный пиримидин. Предпочтительно заместитель означает (низш.)алкил, такой как метил, а фенил А является незамещенным. Кроме того, R2 может означать незамещенный пиримидин формулы А-1. Предпочтительно фенил А является незамещенным или замещенным в положении 4 или 7 группой (низш.)алкилсульфонил.
В еще одном варианте формулы А-1 группа R2 означает незамещенный тиазол. В таких предпочтительных соединениях группа А означает фенил, незамещенный или замещенный в положениях 5 и 6 хлором, или замещенный в положении 5 группой нитро, или замещенный в положении 4 или 7 группой галоген или (низш.)алкилсульфонил.
В еще одном варианте формулы А-1 группа R2 означает однозамещенный тиазол. Предпочтительно заместитель означает галоген, а группа А означает фенил, незамещенный или замещенный в положениях 5 и 6 хлором, или замещенный в положении 5 группой нитро, или замещенный в положении 4 или 7 группой галоген или (низш.)алкилсульфонил.
В еще одном варианте формулы А-1 R2 означает незамещенный пиразин. Группа А означает фенил, незамещенный или замещенный в положении 4 или 7 группой галоген или (низш.)алкилсульфонил.
В еще одном варианте А-1, где R1 означает циклогексил, а R2 означает моноциклическое кольцо, R2 означает незамещенный имидазол, а А означает предпочтительно незамещенный фенил.
В еще одном варианте формулы I или формулы А фенил А является незамещенным, R2 означает моноциклическое кольцо, предпочтительно замещенный или незамещенный тиазол (формула А-2). В одних соединениях формулы А-2 группа R1 означает циклопентил, в других группа R1 означает циклогептил, в третьих группа R1 означает циклооктил.
В предпочтительном соединении формулы I группа R2 означает бициклическое гетероароматическое кольцо, образованое при конденсации с фенилом по двум атомам углерода в цикле, а R1 означает циклогексил (формула В-1). В соединениях формулы В-1 фенил А предпочтительно является незамещенным. Кроме того, R2 предпочтительно означает бензтиазол, бензимидазол, бензоксазол или хинолин, каждый из которых предпочтительно является незамещенным.
В еще одном предпочтительном варианте настоящего изобретения А означает незамещенный фенил или фенил, который, возможно, является замещенным группой фтор, (низш.)алкилсульфонил или (низш.)алкилтио в положении 4 или 7, или хлором в положении 5 или 6 или 5 и 6, или группой бром или нитро в положении 5 или 6. В другом предпочтительном варианте А означает незмещенный фенил или фенил, который является одно- или двузамещенным галогеном или однозамещенным группой (низш.)алкилсульфонил или нитро. Наиболее предпочтительно А означает незамещенный фенил или фенил, однозамещенный галогеном, предпочтительно фтором.
В еще одном предпочтительном варианте настоящего изобретения R1 означает циклоалкил, содержащий от 3 до 9, предпочтительно от 5 до 8 атомов углерода. Наиболее предпочтительно группы R1 означают циклопентил или циклогексил.
В еще одном предпочтительном варианте настоящего изобретения R2 означает незамещенный или однозамещенный пяти- или шестичленный гетероароматический цикл, связанный через атом углерода в цикле с указанной аминогруппой, причем указанный пяти- или шестичленный гетероароматический цикл содержит 1 или 2 гетероатома, выбранных из ряда сера, кислород и азот, причем один гетероатом означает атом азота, который является соседним с атомом углерода, связанным с аминогруппой, причем цикл является моноциклическим или конденсированным с фенилом по двум атомам углерода в цикле, причем указанный однозамещенный гетероароматический цикл замещен по атому углерода, который не является соседним с указанным атомом углерода, связанным с аминогруппой, а заместитель выбран из группы, включающей галоген и (низш.)алкил. В другом предпочтительном варианте R2 означает гетероароматический цикл, выбранный из ряда тиазолил, хинолинил, пиридил, пиримидил, пиразинил, имидазолил, бензимидазолил, бензотиазолил или бензоксазолил, причем указанный гетероароматический цикл необязательно монозамещен галогеном, предпочтительно хлором или бромом, или (низш.)алкилом, предпочтительно метилом. Более предпочтительно гетероароматические циклические остатки R2 выбраны из ряда тиазолил, пиримидил, пиразинил или пиридил, причем указанный гетероароматический цикл необязательно монозамещен галогеном, предпочтительно хлором или бромом, или (низш.)алкилом, предпочтительно метилом. Наиболее предпочтительно остаток R2 означает незамещенный гетероароматический цикл, выбранный из ряда тиазолил, пиримидил, пиразинил или пиридил, или однозамещенный гетероароматический цикл, выбранный из ряда тиазолил, замещенный хлором, или пиридил, замещенный хлором, бромом или (низш.)алкилом, предпочтительно метилом.
Предпочтительными соединениями по настоящему изобретению являются соединения, выбранные из группы, включающей
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-пиридин-2-илпропионамид,
(S)-3-циклогексил-2-(4-фтор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-пиридин-2-илпропионамид,
(S)-3-циклогексил-2-(7-фтор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-пиридин-2-илпропионамид,
(S)-3-циклогексил-2-(4-хлор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-пиридин-2-илпропионамид,
(S)-3-циклогексил-2-(7-хлор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-пиридин-2-илпропионамид,
(R)-N-(5-бромпиридин-2-ил)-3-циклогексил-2-(1-оксо-1,3-
дигидроизоиндол-2-ил)пропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-
N-5-хлорпиридин-2-илпропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-
N-4-метилпиридин-2-илпропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-
N-5-метилпиридин-2-илпропионамид,
3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-пиримидин-4-илпропионамид,
(S)-3-циклогексил-2-(4-метилсульфонил-1-оксо-1,3-дигидроизоиндол-2-ил)-N-пиpимидин-4-илпpoпиoнaмид,
(S)-3-циклогексил-2-(7-метилсульфонил-1-оксо-1,3-дигидроизоиндол-2-ил)-N-пиpимидин-4-илпpoпиoнaмид,
(S)-N-3-циклогексил-N-(2-метилпиримидин-4-ил)-2-(1-оксо-
1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-тиазол-2-илпропионамид,
(R)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-тиазол-2-илпропионамид,
(S)-3-циклогексил-2-(5,6-дихлор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-тиазол-2-илпропионамид,
(S)-3-циклогексил-2-(4-хлор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-тиазол-2-илпропионамид,
(S)-3-циклогексил-2-(4-фтор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-тиазол-2-илпропионамид,
(S)-3-циклогексил-2-(7-фтор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-тиазол-2-илпропионамид,
(S)-3-циклогексил-2-(4-метилсульфонил-1-оксо-1,3-
дигидроизоиндол-2-ил)-N-тиaзoл-2-илпpoпиoнaмид,
(S)-3-циклогексил-2-(7-метилсульфонил-1-оксо-1,3-
дигидроизоиндол-2-ил)-N-тиaзoл-2-илпpoпиoнaмид,
(S)-3-циклогексил-2-(5-нитро-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-тиазол-2-илпропионамид,
(S)-3-циклогексил-2-(6-нитро-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-тиазол-2-илпропионамид,
(S)-N-(5-хлортиазол-2-ил)-3-циклогексил-2-(1-оксо-1,3-
дигидроизоиндол-2-ил)пропионамид,
(S)-N-(5-бромтиазол-2-ил)-3-циклогексил-2-(1-оксо-1,3-
дигидроизоиндол-2-ил)пропионамид,
(S)-N-(5-хлортиазол-2-ил)-3-циклогексил-2-(5,6-дихлор-
1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-N-(5-бромтиазол-2-ил)-3-циклогексил-2-(5,6-дихлор-
1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-N-(5-хлортиазол-2-ил)-3-циклогексил-2-(4-хлор-
1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-N-(5-хлортиазол-2-ил)-3-циклогексил-2-(7-хлор-
1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-N-(5-хлортиазол-2-ил)-3-циклогексил-2-(5-нитро-
1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-N-(5-хлортиазол-2-ил)-3-циклогексил-2-(6-нитро-
1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-N-(5-хлортиазол-2-ил)-3-циклогексил-2-(4-фтор-
1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-N-(5-хлортиазол-2-ил)-3-циклогексил-2-(7-фтор-
1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-3-циклогексил-2-(4-фтор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-пиразин-2-илпропионамид,
(S)-3-циклогексил-2-(7-фтор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-пиразин-2-илпропионамид,
(S)-3-циклогексил-2-(4-метилсульфонил-1-оксо-1,3-
дигидроизоиндол-2-ил)-N-пиpaзин-2-илпpoпиoнaмид,
(S)-3-циклогексил-2-(7-метилсульфонил-1-оксо-1,3-
дигидроизоиндол-2-ил)-N-пиразин-2-илпропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-пиразин-2-илпропионамид,
(S)-3-циклогексил-2-(4-хлор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-пиразин-2-илпропионамид,
(S)-3-циклогексил-N-(1Н-имидазол-2-ил)-2-(1-оксо-1,3-
дигидроизоиндол-2-ил)пропионамид,
3-циклопентил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-тиазол-2-илпропионамид,
N-(5-хлортиазол-2-ил)-3-циклопентил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
3-циклогептил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-тиазол-2-илпропионамид,
N-(5-хлортиазол-2-ил)-3-циклогептил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
3-циклооктил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-тиазол-2-илпропионамид,
(S)-N-бензотиазол-2-ил-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-N-(1Н-бензимидазол-2-ил)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-N-бензоксазол-2-ил-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-хинолин-2-илпропионамид,
(S)-3-циклогексил-2-(7-хлор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-пиразин-2-илпропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-
N-(1-оксипиридин-2-ил)пропионамид и
(S)-3-циклогексил-2-(7-хлор-1-оксо-1,3-дигидроизоиндол-
2-ил)-N-тиазол-2-илпропионамид.
Наиболее предпочтительные соединения по настоящему изобретению выбраны из группы, включающей
3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-пиримидин-4-илпропионамид,
N-(5-хлортиазол-2-ил)-3-циклопентил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)пропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-5-
хлорпиридин-2-илпропионамид,
(S)-3-циклогексил-2-(4-фтор-1-оксо-1,3-дигидроизоиндол-2-
ил)-N-пиразин-2-илпропионамид,
(S)-3-циклогексил-2-(4-фтор-1-оксо-1,3-дигидроизоиндол-2-
ил)-N-тиазол-2-илпропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-пиразин-2-илпропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-пиридин-2-илпропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-N-тиазол-2-илпропионамид,
(S)-3-циклогексил-2-(1-оксо-1,3-дигидроизоиндол-2-ил)-
N-5-метилпиридин-2-илпропионамид и
(R)-N-(5-бромпиридин-2-ил)-3-циклогексил-2-(1-оксо-1,3-
дигидроизоиндол-2-ил)пропионамид.
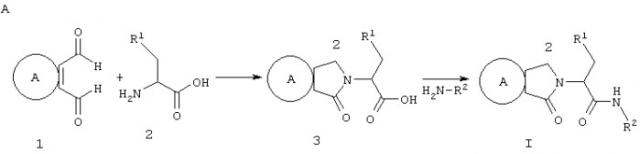
Соединения по настоящему изобретению можно получить по следующим схемам реакций, где фенил A, R1, R2 и R3 имеют значения, указанные для формулы I.
Схемы реакций
Схема 1
Схема 2
Схема 2 Ra означает галоген, Rb означает H или галоген
Ra означает нитро, Rb означает H
Ra означает (низш.)аклкилтио, (низш.)алкилсульфонил,
Rb означает H
Схема 3
Соединения по настоящему изобретению можно получить при взаимодействии замещенного орто-фенилендиальдегида 1 или 1’ с производным аминокислоты 2 или 2’ в соответствующем растворителе, таком как ацетонитрил, с образованием производного карбоновой кислоты 3 или 3’. Затем соединения 3 или 3’ можно конденсировать с соответствующим гетероароматическим амином H2N-R2 в обычных условиях образования амидной связи с образованием соединений формулы I.
Соединения формулы I, где фенил А замещен галогеном (полученным из галогенфталевой кислоты) или нитрогруппой, получают, как показано выше на схеме 2, где соединение 4 означает соответственно замещенную фталевую кислоту, которая является коммерческим препаратом. Замещенные орто-фталевые диальдегиды 1 или 1’ можно получить восстановлением фталевых кислот 4 с образованием промежуточных диодов и последующим окислением с образованием соединения 1’.
Соединения формулы I, где фенил А замещен группой (низш.)алкилсульфонил, можно получить из фталевой кислоты 4, где Ra означает фтор, a Rb означает водород, по следующей последовательности реакций:
а) превращение в соответствующий диметиловый эфир в метаноле в присутствии серной кислоты,
б) нуклеофильное замещение фтора тиометоксидом натрия в соответствующем растворителе, таком как диметилсульфоксид, с образованием соединения 4, где Ra означает (низш.)алкилтио,
в) восстановление полученной фталевой кислоты 4, где Ra означает (низш.)алкилтио, с образованием диола с последующим окислением в соответствующий орто-фенилендиальдегид 1, где Ra означает (низш.)алкилтио,
г) взаимодействие орто-фенилендиальдегида 1, где Ra означает (низш.)алкилтио, с аминокислотой 2 при кипячении с обратным холодильником в ацетонитриле с образованием смеси изомеров (низш.)алкилтиокарбоновой кислоты 3, и
д) конденсация с H2N-R2 с образованием соединений формулы I, где Ra означает (низш.)алкилтио.
Соединения формулы I, где Ra означает (низш.)алкилсульфонил, a Rb означает водород, получают сначала окислением (низш.)алкилтио-изомеров, полученных на стадии (г), пероксидом водорода с образованием (низш.)алкилсульфонилкарбоновой кислоты формулы 3 (где Ra означает (низш.)алкилсульфонил, а Rb означает водород), а затем конденсацией полученной карбоновой кислоты формулы 3 с H2N-R2 с образованием соединения формулы I, где Ra означает (низш.)алкилсульфонил.
Соединения формулы I, где R1 означает С3-С9циклоалкил или С2-С4алкил (в R, S или рацемической форме) получают, как описано выше, причем соединение 2 или 2’ означает соответствующую аминокислоту, которая является коммерческим препаратом. Аминокислоту 2 или 2’ можно получить по схеме 3 из соединения 5. Соединение 5 получают по методике, описанной в литературе (см. O’Donnell M.J., Polt R.L., J. Org. Chem., 47, 2663-2666 (1982)), а затем вводят в реакцию с соответствующим алкилгалогенидом, замещенным необходимым R1, в присутствии основания и после кислотного гидролиза получают любую аминокислоту 2. Алкилгалогениды являются коммерческими препаратами, или их можно получить известными методами.
Соединения формулы I, где R2 имеет значения, указанные в формуле I, можно получить конденсацией необходимого гетероароматического амина (который является коммерческим препаратом, или его можно получить известными методами) с производным карбоновой кислоты 3 или 3’ в обычных условиях взаимодейстия амина с кислотой. N-Оксид гетероароматического амина (например, 2-аминопиридин-N-оксид) можно конденсировать с соединением 3 или 3’, или соответствующее соединение формулы I можно окислить известными способами по незамещенному циклу R2 с получением N-оксида.
Если необходимо получить R или S изомер соединения формулы I, изомеры разделяют обычными физическими и химическими методами. Физические методы означают разделение энантиомерных пар соединений формулы I с использованием хроматографа для жидкостной хроматографии высокого разрешения на колонке, заполненной хиральным агентом. Предпочтительные химические способы включают взаимодейстие промежуточной карбоновой кислоты 3 или 3’ с оптически активным основанием. Для проведения разделения можно использовать любое обычное оптически активное основание. Предпочтительными оптически активными основаниями являются оптически активные амины, такие как альфа-метилбензиламин, хинин, дегидроабиетиламин и альфа-метилнафтиламин. При проведении этой реакции применяют обычные методики, используемые для разделения органических кислот в присутствии оптически активных органических оснований, содержащих аминогруппу.
При разделении изомеров соединение 3 или 3’ взаимодействует с оптически активным основанием в инертном органическом растворителе с образованием солей оптически активного амина с R и S изомерами соединения 3 или 3’. При получении таких солей температура и давление не имеют решающего значения, соль образуется при комнатной температуре и атмосферном давлении. Соли R и S изомеров можно разделить обычным способом, таким как фракционная кристаллизация. После кристаллизации каждую из солей превращают в соответствующее соединение 3 или 3’, имеющее R и S конфигурацию, кислотным гидролизом. Предпочтительными кислотами являются разбавленные водные растворы кислот, например, с концентрацией от приблизительно 0,001н. до 2н. растворов кислот, таких как серная или хлористоводородная кислоты. Конфигурация соединения 3 или 3’, которое получают эти методом разделения изомеров, сохраняется в ходе проведения всей последовательности реакций, а в результате получают требуемый R или S изомер формулы I или II. Разделение R и S изомеров можно проводить ферментативным гидролизом любых гидрокси(низш.)алкильных сложных эфиров соединений 3 или 3’ (см., например, Ahmar М., Girard С., Bloch R., Tetrahedron Lett., 7053 (1989)), который приводит к получению смеси соответствующей хиральной кислоты и хирального сложного эфира. Сложный эфир и кислоту можно разделить любым известным методом отделения кислоты от сложного эфира. Другим предпочтительным методом разделения рацематов соединений 3 или 3’ является получение соответствующих диастереомерных сложных эфиров или амидов. Эти диастереомерные сложные эфиры или амиды можно получить конденсацией карбоновых кислот 3 или 3’ с хиральным спиртом или хиральным амином. Реакцию проводят обычным методом конденсации карбоновой кислоты со спиртом или амином. Соответствующие диастереомеры производных карбоновых кислот 3 или 3’ можно разделить любым обычным методом разделения, например, ЖХВР. Полученные чистые диастереомерные сложные эфиры или амиды можно затем гидролизовать с получением соответствующих чистых R или S изомеров. Гидролиз проводят любыми обычными методами гидролиза сложных эфиров или амидов, исключающими рацемизацию.
Благодаря способности активировать глюкокиназу соединения формулы I можно использовать в качестве лекарственных средств для лечения диабета типа II. Следовательно, как указано выше, объектом настоящего изобретения являются также лекарственные препараты, содержащие соединение формулы I, и способ получения таких лекарственных препаратов, причем указанный способ включает переработку одного или более соединений формулы I и, при необходимости, одного или более других терапевтически ценных соединений в готовую галеновую форму, например, смешивание соединения формулы I с фармацевтически приемлемым носителем и/или адъювантом.
Фармацевтические композиции можно вводить пероральным способом, например, в форме таблеток, таблеток в оболочке, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Ввведение можно также проводить ректальным способом, например, используя суппозитории, местным и чрескожным способом, например, используя мази, кремы, гели или растворы, или парентеральным способом, например внутривенным, внутримышечным, подкожным, подоболочечным или чрескожным способами, с использованием, например, инъекционных растворов. Кроме того, введение можно проводить подъязычным способом или в виде аэрозоля, например, в форме спрея. При получении таблеток, таблеток в оболочке, драже или твердых желатиновых капсул соединения по настоящему изобретению смешивают с фармацевтически инертными неограническими или органическими эксципипентами. Например, пригодные эксципиенты для таблеток, драже или твердых желатиновых капсул включают лактозу, кукурузный крахмал или его производные, тальк или стеариновую кисилоту или ее соли. Пригодные эксципиенты для мягких желатиновых капсул включают, например, растительные масла, воски, жиры, полутвердые или жидкие полиолы и т.п., однако в зависимости от свойств активных ингредиентов в случае мягких желатиновых капсул эксципиент может оказаться ненужным. Эксципиенты для получения растворов и сир