Производные цианоарил (или цианогетероарил)-карбонилпиперазинил-пиримидинов, способ их получения (варианты), фармацевтическая композиция и применение
Иллюстрации
Показать всеИзобретение относится к новым производным цианоарил(или цианогетероарил)-карбонилпиперазинил-пиримидинов общей формулы (I) и их физиологически приемлемым солям, которые обладают широким спектром биологической активности, превосходящей активность близких по структуре известных соединений. Соединения могут найти применение для получения лекарственных средств полезных для терапии человека и/или для терапевтического использования в ветеринарии, например, в качестве агентов антиконвульсивного, снотворного действия или для общей анестезии. В общей формуле (I) R1 представляет собой собой OR3 радикал, в котором R3 представляет собой насыщенный углеводородный радикал с линейной или разветвленной цепью, имеющий от 1 до 4 атомов углерода, и R2 представляет собой фенильный радикал, замещенный цианорадикалом (-C≡N) или радикалом 5- или 6-членного гетероароматического кольца, в котором гетероатом выбирается из O,N или S и замещенного циано- радикалом (-C≡N);
Изобретение также относится к способам получения соединений общей формулы (I), введением группы
в пиперазинил-пиримидиновое соединение, или конденсацией соответствующего пиримидина с пиперазином, содержащим группу . Изобретение также относится к фармацевтической композиции и применению соединений. 12 з.п. ф-лы, 7 схем, 7 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым цианоарил (или цианогетероарил)-карбонилпиперазинил-пиримидинам общей формулы (I), а также к их физиологически приемлемым солям, к способам их получения, их применению в качестве лекарственного средства для терапии человека и/или для терапевтического использования в ветеринарии и к содержащим их фармацевтическим композициям
Новые соединения, которые являются объектом настоящего изобретения, могут использоваться в фармацевтической промышленности в качестве промежуточных соединений и для изготовления лекарственных средств.
Уровень техники
В публикации WO 99/05121 описаны некоторые производные ацил-пиперазинил-пиримидинов, среди которых встречаются соединения общей формулы (I) в качестве агентов с седативной, антиконвульсивной, гипнотической и общей анестезирующей активностью. В указанной публикации описаны производные общей формулы (I), где R2 представляет собой, в частности, арильный радикал и гетероарильный радикал. Термин "арил" представляет собой фенильный радикал, незамещенный или замещенный 1, 2 или 3 одинаковыми или различными заместителями, такими как фтор, хлор, бром, амин, ацетамид, нитро, метил, трифторметил или метокси. Термин "гетероарил" представляет собой замещенное или незамещенное 5- или 6-членное гетероароматическое кольцо или замещенные или незамещенные, конденсированные 9- или 10-членные гетероароматические системы, содержащие 1 или 2 гетероатома, такие как азот, кислород или сера, где заместителями могут быть группы, такие как фтор, хлор, бром, амин, ацетамид, нитро, метил, трифторметил или метокси.
Было обнаружено, что введение цианогруппы (-C=N) в арильный или гетероарильный радикалы приводит к получению новых соединений общей формулы (I), которые являются более эффективными по сравнению с ранее описанными соединениями, обладающими интересными биологическими свойствами, которые делают их особенно полезными при использовании для терапии человека и/или при терапевтическом использовании в ветеринарии. Соединения, являющиеся объектом настоящего изобретения, являются полезными в качестве агентов, действующих на центральную нервную систему млекопитающих, включая человека. В частности, новые соединения полезны в качестве седативных, антиконвульсивных, гипнотических и общих анестезирующих средств.
Подробное описание изобретения
Настоящее изобретение относится к новым соединениям, обладающим следующими свойствами: седативным, антиконвульсивным, анальгезирующим, миорелаксантным, противокашлевым, анксиолитическим, антипсихотическим, антидепрессивным, против церебральной ишемии, антимигреневым, при расстройствах сна, при нейродегенеративных заболеваниях, при расстройствах восприятия и болезни Альцгеймера, гипнотическим или общим анестезирующим для млекопитающих, включая человека. В частности, новые соединения по изобретению способны вызывать сознательный седативный эффект, действовать в качестве гипнотических средств и средств, способных вызывать или поддерживать общую анестезию, в зависимости от дозы и способа введения.
Соединения, являющиеся объектом настоящего изобретения, имеют общую структурную формулу (I)
где R1 представляет собой алкокси радикал и R2 представляет собой цианоарильный или цианогетероарильный радикал.
В настоящем изобретении термин "алкокси" представляет собой радикал OR3, где R3 представляет собой алкил C1-C4 (т.е. алкильный радикал насыщенного углеводорода с линейной или разветвленной цепью с 1-4 атомами углерода), такой как метокси, этокси, пропокси, изопропокси, бутокси, втор-бутокси или трет-бутокси.
Термин "цианоарил" обозначает фенильный радикал, замещенный, по крайней мере, одним радикалом циано (-C=N).
Термин "цианогетероарил" обозначает радикал 5- или 6-членного гетероароматического кольца или радикал замещенных или незамещенных конденсированных 9 или 10-членных гетероароматических систем, содержащих 1 или 2 гетероатома, таких как азот, кислород или сера, которые замещены, по крайней мере, циано радикалом (-C=N), такие как, например, 3-циано-2-фурил, 3-циано-2-тиенил, 5-циано-2-тиенил, 3-циано-2-пирролил, 3-циано-2-пиридил, 2-циано-3-пиридил, 2-циано-4-пиридил, 3-циано-2-индолил, 2-циано-3-индолил, 3-циано-2-бензо[b]тиенил или 2-циано-3-бензо[b]тиенил.
Настоящее изобретение также относится к физиологически приемлемым солям соединений общей формулы (I), особенно к аддитивным солям минеральных кислот, таких как соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота, азотная кислота, и органических кислот, таких как n-толуолсульфоновая или метансульфоновая кислота.
Новые производные общей формулы (I) могут быть получены способами A-G, приведенными ниже:
СПОСОБ А:
Соединения общей формулы (I) могут быть получены в результате реакции амина общей формулы (II), в которой R1 является таким, как определено выше, с карбоновой кислотой общей формулы R2COOH (III), в которой R2 имеет вышеуказанное значение, или с солью этой кислоты или реакционным производным R2COX (IV), (Схема 1 ).
Примеры таких солей включают соли щелочных металлов, такие как соли натрия и калия, щелочноземельных металлов, такие как соли кальция и магния, аммониевую соль и соли органических оснований, таких как триэтиламин, триметиламин, пиридин и пиколин.
Примеры реакционных производных общей формулы R2СОХ (IV) включают производные, в которых Х представляет собой атом галогена, предпочтительно атом хлора или брома, азидную группу (-N3), 1-имидазолильную группу, О-СО-R4 группу, где R4 может быть алкильным радикалом с 1-6 атомами углерода или арильным радикалом, необязательно замещенным одним или более атомами галогена, или OR5 группу, где R5 представляет собой ароматическую группу с одним или двумя кольцами, замещенную одним или более атомами галогена или нитрорадикалами, предпочтительно группами 4-нитрофенил, 2,4-динитрофенил, пентахлорфенил, пентафторфенил, 1-бензотриазолил или N-сукцинимид. Подобным образом, вместо использования вышеуказанных реакционоспособных производных, соединения общей формулы (I) могут быть получены при непосредственном взаимодействии амина (II) с карбоновой кислотой общей формулы R2COOH (III), в этом случае является предпочтительным, чтобы реакция протекала в присутствии активирующих реагентов для карбонильной группы, таких как N,N'-дициклогексилкарбодиимид, N,N'-диизопропилкарбодиимид или 3-(3-диметиламино)пропил-1-этилкарбодиимид. Эта реакция может также проводиться с использованием указанных выше карбодиимидов в присутствии 1-бензотриазола или N-гидроксисукцинимида. Кислоты общей формулы (III) и амин общей формулы (II) также реагируют непосредственно в присутствии N,N'-карбонилдиимидазола или ангидрида пропанфосфорной кислоты.
Реакция протекает в органическом растворителе, например в органическом хлорированном углеводороде, таком как дихлорметан или хлороформ, линейном или циклическом эфире, таком как 1,2-диметоксиэтан, тетрагидрофуран или диоксан, полярном апротонном растворителе, таком как пиридин, диметилсульфоксид, ацетонитрил или диметилформамид или любом другом подходящем растворителе. Реакция может протекать в присутствии минерального или органического основания, такого как алифатический амин, предпочтительно триэтиламин или N-метилморфолин, при перемешивании и температуре, находящейся в интервале между комнатной температурой и температурой кипения растворителя в течение периода времени, составляющего от десяти минут до двадцати четырех часов, предпочтительно от тридцати минут до пяти часов.
СПОСОБ В:
Новые производные общей формулы (I), где R1 является таким, как определено выше, и R2 представляет собой цианоарильный радикал, могут быть получены в соответствии со способом, приведенным на Схеме 2.
Реакция амина общей формулы (II), где R1 является таким, как определено выше, с 3-бромфталидом (V) приводит к получению альдегида общей формулы (VI), где R1 является таким, как определено выше (Alonso, R., Castedo, L., Dominguez, D., J. Org. Chem. 1989, 54 (2), 424).
Реакцию проводят в органическом растворителе, например в органическом хлорированном углеводороде, таком как дихлорметан или хлороформ, линейном или циклическом эфире, таком как 1,2-диметоксиэтан, тетрагидрофуран или диоксан, полярном апротонном растворителе, таком как пиридин, диметилсульфоксид, ацетонитрил или диметилформамид или любом другом подходящем растворителе. Реакция может протекать в присутствии минерального или органического основания, такого как алифатический амин, предпочтительно триэтиламин или N-метилморфолин, при перемешивании и температуре, находящейся в интервале между комнатной температурой и температурой кипения растворителя в течение периода времени, составляющего от десяти минут до двадцати четырех часов, предпочтительно от тридцати минут до пяти часов.
Оксим общей формулы (VII), где R1 является таким, как определено выше, получают реакцией альдегида общей формулы (VI) с гидроксиламином или солью гидроксиламина. Реакцию проводят в органическом растворителе, таком как этанол или смесь этанола с водой или в любом другом подходящем растворителе. Реакция протекает в присутствии основания, такого как гидроксид натрия, карбонат натрия или ацетат натрия, или алифатического амина, предпочтительно пиридина, триэтиламина или N-метилморфолина, при перемешивании и температуре, находящейся в интервале между комнатной температурой и температурой кипения растворителя, в течение периода времени, составляющего от одного часа до двадцати четырех часов.
Превращение оксима общей формулы (VII), где R1 является таким, как определено выше, в циановое производное общей формулы (I), где R1 является таким, как определено выше, осуществляют реакцией оксима (VII) с некоторыми дегидрирующими реагентами, такими как (PhO)2РНО, n-ClC6Н4OС(=S)Cl, N,N'-карбонилдиимидазол, а также в присутствии ионов Cu(II), таких как Cu(АсО)2, или ацилированием альдоксима уксусным ангидридом или трифторуксусным ангидридом, и последующим образованием цианового радикала с помощью основания, такого как гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, пиридин или триэтиламин. Реакцию проводят при температуре между комнатной температурой и температурой кипения растворителя в течение периода времени, составляющего от одного часа до 4 дней.
СПОСОБ С:
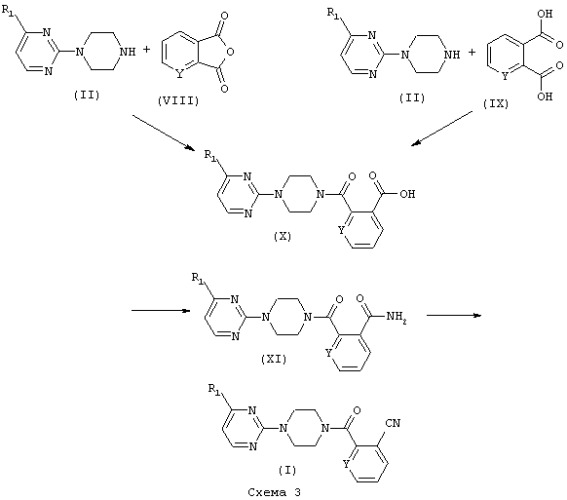
Новые производные общей формулы (I), где R1 является таким, как определено выше, и R2 представляет собой цианоарильный или цианопиридильный радикал, могут быть получены в соответствии со способом, представленным на Схеме 3:
Реакция амина общей формулы (II), где R1 является таким, как определено выше, с ангидридом общей формулы (VIII), где Y представляет собой атом азота (N) или ароматический атом углерода, связанный с атомом водорода (СН), или реакция амина общей формулы (II), в которой R1 является таким, как определено выше, с кислотой общей формулы (IX), где Y представляет собой атом азота (N) или ароматический атом углерода, связанный с атомом водорода (СН), приводит к получению кислоты общей формулы (X), где R1 и Y являются такими, как указано выше.
Реакцию с ангидридом (VIII) проводят в органическом растворителе, например в органическом хлорированном углеводороде, таком как дихлорметан или хлороформ, линейном или циклическом эфире, таком как 1,2-диметоксиэтан, тетрагидрофуран или диоксан, полярном апротонном растворителе, таком как пиридин, диметилсульфоксид, диметилформамид или ацетонитрил или любом другом подходящем растворителе. Реакция может протекать в присутствии минерального или органического основания, такого как алифатический амин, предпочтительно триэтиламин или N-метилморфолин, при перемешивании и температуре, находящейся в интервале между комнатной температурой и температурой кипения растворителя в течение периода времени, составляющего от десяти минут до двадцати четырех часов, предпочтительно от тридцати минут до пяти часов.
Реакцию кислоты общей формулы (IX) проводят в присутствии активирующих реагентов для карбонильной группы, таких как N,N'-дициклогексилкарбодиимид, N,N'-диизопропилкарбодиимид или 3-(3-диметиламино)пропил-1-этилкарбодиимид. Эта реакция может также протекать при использовании указанных карбодиимидов в присутствии 1-бензотриазола или N-гидроксисукцинимида или путем взаимодействия кислоты общей формулы (IX) с реагентами, такими как тионилхлорид, оксалилхлорид, этилхлорформиат, пивалоилхлорформиат или метансульфонилхлорид. Кислота общей формулы (IX) и амин общей формулы (II) также реагируют непосредственно в присутствии N,N'-карбонилдиимидазола или ангидрида пропанфосфорной кислоты. Реакция протекает в органическом растворителе, таком как хлористый метилен, хлороформ, пиридин или любом другом подходящем растворителе. Реакция протекает в присутствии основания, такого как гидроксид натрия, карбонат натрия или ацетат натрия, или алифатический амин, предпочтительно пиридин, триэтиламин или N-метилморфолин, при перемешивании и температуре, находящейся в интервале между комнатной температурой и температурой кипения растворителя, в течение периода времени, составляющего от одного часа до двадцати четырех часов.
Амид общей формулы (XI), в которой R1 и Y являются такими, как указано выше, получают в результате реакции кислоты общей формулы (X) с активирующими реагентами для карбонильной группы и последующей обработкой аммиаком. Активацию карбонильной группы кислоты общей формулы (X) проводят реакцией (X) с реагентами, такими как тионилхлорид, оксалилхлорид, этилхлорформиат, пивалоилхлорформиат или метансульфонилхлорид. Реакция кислоты (X) с аммиаком может также протекать в присутствии активирующих реагентов для карбонильной группы, таких как N,N'-дициклогексилкарбодиимид, N,N'-диизопропилкарбодиимид или 3-(3-диметиламино)пропил-1-этилкарбодиимид. Эта реакция может также протекать с помощью указанных выше карбодиимидов в присутствии 1-бензотриазола или N-гидроксисукцинимида. Кислота общей формулы (X) и аммиак также реагируют непосредственно в присутствии N,N'-карбонилдиимидазола. Реакцию осуществляют в органическом растворителе, таком как хлористый метилен, хлороформ, пиридин или любом другом подходящем растворителе. Реакция протекает в присутствии основания, такого как гидроксид натрия, карбонат натрия или ацетат натрия, алифатический амин, предпочтительно пиридин, триэтиламин или N-метилморфолин, при перемешивании и температуре, находящейся в интервале между комнатной температурой и температурой кипения растворителя, в течение периода времени, составляющего от одного до двадцати четырех часов.
Превращение амида общей формулы (XI), где R1 и Y являются такими, как описано выше, в циановое производное общей формулы (I), где R1 и Y являются такими, как указано выше, достигается дегидрированием амида (XI) некоторыми реагентами, такими как тионилхлорид, оксалилхлорид, трифторуксусный ангидрид, каталитический Bu2SnO или, предпочтительно, метансульфонилхлорид (A.D. Dunn, M.J. Mills и W. Henry, Org. Prep. Proced. Int., 1982 Vol. 14(6) 396-399) или другими дегидрирующими реагентами. Реакция протекает в органическом растворителе, таком как диметилформамид, хлористый метилен, толуол, в присутствии основания, такого как триэтиламин или пиридин, при температуре, находящейся в интервале между 0°С и температурой кипения растворителя, в течение периода времени, составляющего от одного часа до двадцати четырех часов.
СПОСОБ D:
Новые производные общей формулы (I), где R1 является таким, как определено выше, и R2 представляет собой цианоарильный или цианопиридильный радикал, могут быть получены в соответствии со способом, представленным на Схеме 4.
По реакции амина общей формулы (II), где R1 является таким, как определено выше, с карбоновой кислотой общей формулы (XII), где R6 представляет собой алкильный радикал, такой как метил или этил, и Y представляет собой атом азота (N) или ароматический атом углерода, связанный с атомом водорода (СН), получают амид общей формулы (XIII), где R1, R6 и Y являются такими, как указано выше.
Реакцию осуществляют обработкой кислоты общей формулы (XII) активирующими реагентами для карбонильной группы с последующей обработкой амина общей формулы (II). Активация карбонильной группы кислоты общей формулы (XII) достигается обработкой реагентами, такими как тионилхлорид, оксалилхлорид, этилхлорформиат, пивалоилхлорформиат или метансульфонилхлорид. Реакция кислоты (XII) и амина общей формулы (II) может также протекать в присутствии активирующих реагентов для карбонильной группы, таких как N,N'-дициклогексилкарбодиимид, N,N'-диизопропилкарбодиимид или 3-(3-диметиламино)пропил-1-этилкарбодиимид. Эта реакция может также осуществляться с указанными выше карбодиимидами в присутствии 1-бензотриазола или N-гидроксисукцинимида. Кислота общей формулы (XII) и амин (II) также реагируют непосредственно в присутствии N,N'-карбонилдиимидазола или ангидрида пропанфосфорной кислоты. Реакцию проводят в органическом растворителе, таком как хлористый метилен, хлороформ, пиримидин или любом другом подходящем растворителе. Реакция протекает в присутствии основания, такого как гидроксид натрия, карбонат натрия, ацетат натрия или алифатический амин, предпочтительно пиримидин, триэтиламин или N-метилморфолин, при перемешивании и температуре, находящейся в интервале между комнатной температурой и температурой кипения растворителя, в течение периода времени, составляющего от одного часа до двадцати четырех часов.
Гидролиз эфирной группы амида общей формулы (XIII), в которой R1, R6 и Y являются такими, как указано выше, приводит к получению кислоты общей формулы (XIV), где R1 и Y являются такими, как определено выше. Гидролиз осуществляется обычными способами, такими как омыление гидроксидом натрия, гидроксидом калия, гидроксидом лития, карбонатом натрия или карбонатом калия или гидролиз в кислотной среде, такой как соляная кислота. Реакция протекает в растворителе, таком как метанол, этанол, вода, тетрагидрофуран или в их смеси при температуре, находящейся в интервале между комнатной температурой и температурой кипения раствора, в течение периода времени, составляющего от одного часа до двадцати четырех часов.
Амид общей формулы (XV), где R1 и Y являются такими, как указано выше, получают реакцией кислоты общей формулы (XIV) с активирующими реагентами для карбонильной группы и последующей обработкой аммиаком. Активация карбонильной группы кислоты общей формулы (XIV) осуществляется с помощью реагентов, таких как тионилхлорид, оксалилхлорид, этилхлорформиат, пивалоилхлорформиат или метансульфонилхлорид. Реакция кислоты (XIV) с аммиаком может также протекать в присутствии активирующих реагентов для карбонильной группы, таких как N,N'-дициклогексилкарбодиимид, N,N'-диизопропилкарбодиимид или 3-(3-диметиламино)пропил-1-этилкарбодиимид. Эта реакция может также протекать с указанными выше карбодиимидами в присутствии 1-бензотриазола или N-гидроксисукцинимида. Кислота общей формулы (XIV) и аммиак также реагируют непосредственно в присутствии N,N'-карбонилдиимидазола. Реакция протекает в органическом растворителе, таком как хлористый метилен, хлороформ или пиридин, или любом другом подходящем растворителе. Реакция протекает в присутствии основания, такого как гидроксид натрия, карбонат натрия, ацетат натрия или алифатический амин, предпочтительно пиридин, триэтиламин или N-метилморфолин, при перемешивании и температуре, находящейся в интервале между комнатной температурой и температурой кипения растворителя, в течение периода времени, составляющего от одного часа до двадцати четырех часов.
Превращение амида общей формулы (XV), где R1 и Y являются такими, как указано выше, в циановое производное общей формулы (I), где R1 и Y являются такими, как определено выше, достигается дегидрированием амида (XV) некоторыми реагентами, такими как тионилхлорид, оксалилхлорид, трифторуксусный ангидрид, каталитический Bu2SnO или, предпочтительно, метансульфонилхлорид (A.D. Dunn, M.J. Mills и W. Henry, Org. Prep. Proced. Int., 1982 Vol. 14(6) 396-399) или другими дегидрирующими реагентами. Реакцию проводят в органическом растворителе, таком как ДМФА, хлористый метилен или толуол, в присутствии основания, такого как триэтиламин или пиридин, при температуре, находящейся в интервале между 0°С и температурой кипения растворителя в течение периода времени, составляющего от одного часа до двадцати четырех часов.
СПОСОБ Е:
Новые производные общей формулы (I), где R1 является таким, как указано выше, и R2 представляет собой цианотиенильный или цианофурильный радикал, могут быть получены способом, представленным на Схеме 5:
Реакция амина общей формулы (II), где R1 является таким, как указано выше, с N,N'-карбонилдиимидазолом приводит к получению соединения общей формулы (XVI). Реакцию проводят в безводном органическом растворителе, таком как тетрагидрофуран или диметилформамид, при температуре, находящейся в интервале от 0°С до комнатной в течение периода времени, составляющего от одного до двадцати четырех часов.
Введение атома металла в соединение общей формулы (XVII), где Z представляет собой атом серы (S) или атом кислорода (О) с помощью n-BuLi, втор-BuLi или трет-BuLi в безводном растворителе, таком как тетрагидрофуран, при температуре -78°С и последующее добавление соединения (XVI) приводит к получению цианового производного общей формулы (I), где R1 и Z являются такими, как указано выше.
СПОСОБ F:
Новые производные общей формулы (I), где R1 и R3 являются такими, как указано выше, могут быть получены реакцией хлорпиримидинового производного общей формулы (XVIII), где R1 является таким, как определено выше, с пиперазиновым производным общей формулы (XIX), где R2 является таким, как указано выше, в соответствии со способом, представленным на Схеме 6:
Реакцию проводят в органическом растворителе, таком как хлорированный органический углеводород, такой как дихлорметан или хлороформ, линейный или циклический эфир, такой как 1,2-диметоксиэтан, тетрагидрофуран или диоксан, апротонный полярный растворитель, такой как пиридин, диметилсульфоксид, диметилформамид или ацетонитрил, протонный полярный растворитель, такой как метанол, этанол, изопропанол или н-бутанол или любой другой подходящий растворитель для осуществления реакции ароматического нуклеофильного замещения. Реакция может протекать в присутствии минерального основания, такого как карбонат натрия или карбонат калия, или органического основания, такого как алифатический амин, предпочтительно триэтиламин или N-метилморфолин, при перемешивании и температуре, находящейся в интервале между комнатной температурой и температурой кипения растворителя в течение периода времени, составляющего от десяти минут до двадцати четырех часов, предпочтительно в течение периода от тридцати минут до пяти часов.
СПОСОБ G:
Соли соединений общей формулы (I) получают реакцией с минеральной кислотой, такой как соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота, азотная кислота или с органической кислотой, такой как n-толуолсульфоновая кислота или метансульфоновая кислота, в подходящем растворителе, таком как метанол, этанол, этиловый эфир, этилацетат или ацетон, с получением соответствующей соли обычным осаждением или кристаллизацией.
Карбоновые кислоты, использующиеся для получения циановых производных общей формулы (I), где R1 и R2 являются такими, как указано выше, в соответствии со способами, описанными в настоящем изобретении, являются коммерчески доступными или их получают обычными способами, описанными в научной литературе (Kenneth A. Hold и Phillip Shadbolt, Br. Polym. J., 1983, 15 (4), 201-207; Carol K. Sauers и Robert J. Cotter, J. Org. Chem., 1961, 26, 6-10; Louis A. Carpino, J. Am. Chem. Soc., 1962, 84, 2196-2201; A.D. Dunn, M.J. Mills и W. Henry, Org. Prep. Proced. Int., 1982, 14(6), 396-399; Pierre Dubus, Bernard Decroix, Jean Morel et Paul Pastour, Bull. Soc. Chim. Fr., 1976. (3-4. Pt. 2), 628-634; William M. Murray и J. Edward Semple, Synthesis, 1996, 1180-1182; Luc I. M. Spiessens и Marc J. OR. Anteunis, Bull. Soc. Chim. Belg., 1980, 89 (3), 205-231; I. Thunus et M. Dejardin-Duchene, J. Pharm. Belg., 1969, 51, 3-21; S. Fallab und H. Erlenmeyer, Helv. Chim. Acta, 1951, 34, 488-496).
Следующие примеры описывают получение новых соединений в соответствии с изобретением. Также описаны некоторые типичные пути использования в различных областях применения, а также галеновые составы, пригодные для соединений, являющихся объектом изобретения.
Описанные ниже способы приведены только с целью иллюстрации и не должны рассматриваться как ограничение объема изобретения.
СПОСОБ А:
Пример 1. Получение 2-[4-(2-цианобензоил)-1-пиперазинил]-4-метоксипиримидина.
К суспензии 2.0 г (14 ммоль) 2-цианобензойной кислоты в 100 мл CH2CI2 добавляют 1.5 мл (17.5 ммоль) оксалилхлорида и каталитическое количество пиридина. Суспензию оставляют перемешиваться при комнатной температуре в течение 3 часов. Растворитель упаривают при пониженном давлении, получая сырой продукт, который суспендируют в 100 мл CH2Cl2 и медленно добавляют в раствор 2.45 г (12.6 ммоль) 4-метокси-2-(1-пиперазинил)пиримидина и 4 мл (28 ммоль) триэтиламина в 50 мл CH2Cl2 охлажденного до 0°С на ледяной бане. Раствор выдерживают при 0°С в течение часа, а затем дают ему возможность нагреться до комнатной температуры. Реакционную смесь промывают Н2О, сушат над Na2SO4, после чего растворитель удаляют при пониженном давлении. Полученный сырой продукт очищают с помощью хроматографии на силикагеле, используя этилацетат в качестве элюента, получая 2.06 г (6.4 ммоль) 2-[4-(2-цианобензоил)-1-пиперазинил]-4-метоксипиримидина с температурой плавления =166-168°С,
СПОСОБ В:
Пример 3. Получение 2-[4-(2-цианобензоил)-1-пиперазинил]-4-этоксипиримидина.
К раствору 2.08 г (10 ммоль) 4-этокси-2-(1-пиперазинил)пиримидина и 5 мл триэтиламина в 60 мл сухого ТГФ добавляют 2.15 г (10 ммоль) 3-бромфталида и оставляют перемешиваться при комнатной температуре в течение 4 часов. Триэтиламин гидробромид отфильтровывают, после чего промывают ТГФ и растворитель удаляют при пониженном давлении, получая сырой продукт, который очищают с помощью хроматографии на силикагеле, используя этилацетат в качестве элюента. Получют 2.45 г (7,20 ммоль) 4-этокси-2-[4-(2-формилбензоил)-1-пиперазинил]пиримидин с температурой плавления=134-136°С.
К раствору 2.45 г (7.2 ммоль) 4-этокси-2-[4-(2-формилбензоил)-1-пиперазинил]пиримидина в этаноле - Н2О (80:20) добавляют 2.5 г (18.4 ммоль) AcONa·3Н2О и 0.75 г (8.6 ммоль) гидрохлорида гидроксиламина. Реакционную смесь нагревают при кипении с обратным холодильником, контролируя процесс с помощью ТСХ. Растворитель удаляют при пониженном давлении, остаток растворяют в СН2Cl2 и промывают Н2О. Органический растворитель выпаривают при пониженном давлении, получая масло, которое кристаллизуют в этиловом эфире, получая 0.5 г (1.40 ммоль) 4-этокси-2-{4-[2-(гидроксииминометил)бензоил]-1-пиперазинил) пиримидина с температурой плавления =136-140 С.
К раствору 0.5 г (1.40 ммоль) 4-этокси-2-(4-[2-(гидроксииминометил)бензоил]-1-пиперазинил} пиримидина в 30 мл этилацетата добавляют 0.15 мл уксусного ангидрида и нагревают при кипении с обратным холодильником в течение 2 часов. Растворитель выпаривают при низком давлении, получая ацетилированный оксим.
Ацетилированный оксим растворяют в 20 мл ацетонитрила и добавляют избыток К2СО3, после чего оставляют перемешиваться при комнатной температуре в течение 78 часов. Твердое вещество фильтруют, растворитель удаляют при пониженном давлении, растворяют в CH2Cl2 и промывают Н2О. Растворитель выпаривают при пониженном давлении, получая сырой продукт, который кристаллизуют из этилового эфира, получая 0.2 г (0.60 ммоль) 2-[4-(2-цианобензоил)-1-пиперазинил]-4-этоксипиримидина с температурой плавления =151-154 С.
СПОСОБ С:
Пример 15. Получение 2-[4-(3-циано-2-пиридилкарбонил)-1-пиперазинил]-4-этоксипиримидина.
К суспензии 0.75 г (5.04 ммоль) хинолинового ангидрида в 25 мл ацетонитрила добавляют 1.05 г (5.04 ммоль) 4-этокси-2-(1-пиперазинил)пиримидина и 0.8 мл (5.07 ммоль) триэтиламина и нагревают при кипении с обратным холодильником в течение 18 часов. Растворитель упаривают при пониженном давлении и полученный сырой продукт очищают с помощью хроматографии на силикагеле, используя в качестве элюентов CHCl3:МеОН 3:2, получая 0.6 г (1.68 ммоль) 2-[4-(3-карбокси-2-пиридилкарбонил)-1-пиперазинил]-4-этоксипиримидина с температурой плавления=186-189°С.
К суспензии 0.3 г (0.8 ммоль) 2-[4-(3-карбокси-2-пиридилкарбонил)-1-пиперазинил]-4-этоксипиримидина в 20 мл хлористого метилена добавляют 0.5 мл (3.6 ммоль) триэтиламина, охлаждают до 0°С и добавляют 0.1 г (0,92 ммоль) этилхлорформиата, оставляя раствор при этой температуре на 30 минут. Через полученную смесь пропускают МН3 (газ) в течение 1 минуты и температуру поддерживают на уровне 0°С в течение 2 часов. Раствору дают нагреться до комнатной температуры, затем его промывают Н2О, хлористый метилен удаляют при пониженном давлении, получая пасту, которая после затвердевания дает 184 мг (0.51 ммоль) 2-[4-(3-карбамоил-2-пиридилкарбонил)-1-пиперазинил]-4-этоксипиримидина с температурой плавления =161-163°С.
К раствору 84 мг (0.23 ммоль) 2-[4-(3-карбамоил-2-пиридилкарбонил)-1-пиперазинил]-4-этоксипиримидина в 15 мл хлористого метилена добавляют 0.2 мл триэтиламина и 0.1 мл метансульфонилхлорида. Полученную смесь оставляют перемешиваться в течение 18 часов при комнатной температуре. Органический раствор промывают раствором Na2CO3, растворитель удаляют при пониженном давлении, получая сырой продукт, который очищают с помощью хроматографии на силикагеле, используя этилацетат в качестве элюента, получая 42 мг (0.12 ммоль) 2-[4-(3-циано-2-пиридилкарбонил)-1-пиперазинил]-4-этоксипиримидина с температурой плавления =137-140°С.
СПОСОБ D:
Пример 19. Получение 2-[4-(2-циано-3-пиридилкарбонил)-1-пиперазинил]-4-этоксипиримидина.
К раствору 1.33 г (7.45 ммоль) 2-метоксикарбонилникотиновой кислоты в 15 мл ДМФА, охлажденного на ледяной бане, добавляют 1.20 г (7.45 ммоль) N,N'-карбонилдиимидазола и перемешивают в течение 40 минут. К реакционной смеси добавляют 1.53 г (7.45 ммоль) 4-этокси-2-(1-пиперазинил)пиримидина и оставляют при комнатной температуре в течение двух часов. Затем раствор разбавляют этилацетатом и промывают Н2О, сушат над Na2SO4 и растворитель удаляют при пониженном давлении, получая масло, которое кристаллизуется в этиловом эфире, получая 1.5 г (4.04 ммоль) 4-этокси-2-[4-(2-метоксикарбонил-3-пиридилкарбонил)-1-пиперазинил]пиримидина с температурой плавления =126-128°С.
К раствору 1.4 г (3.77 ммоль) 4-этокси-2-[4-(2-метоксикарбонил-3-пиридилкарбонил)-1-пиперазинил]пиримидина в 25 мл ТГФ и 10 мл МеОН добавляют 0.158 г (3.77 ммоль) LiOH×Н2О и оставляют перемешиваться при комнатной температуре в течение двух часов. Через раствор пропускают SO2 и растворитель удаляют при пониженном давлении. Полученный сырой продукт суспендируют в 30 мл хлористого метилена и добавляют 0.45 мл (3.3 ммоль) триэтиламина, после чего охлаждают до 0°С и затем добавляют 0.3 г (2.76 ммоль) этилхлорформиата, оставляя раствор при этой температуре на 30 минут. Через полученную смесь пропускают NH3 (газ) в течение 1 минуты и температуру поддерживают на уровне 0°С в течение 2 часов. Раствору дают возможность достичь комнатной температуры, после чего промывают Н3О. Хлористый метилен удаляют при пониженном давлении и получают пасту, которая затвердевает с образованием сырого продукта, который кристаллизуется в этилацетате. Получают 0.12 г (0.34 ммоль) 2-[4-(2-карбамоил-3-пиридилкарбонил)-1-пиперазинил]-4-этоксипиримидина с температурой плавления =152-156°С.
К раствору 100 мг (0.28 ммоль) 2-[4-(2-карбамоил-3-пиридилкарбонил)-1-пиперазинил]-4-этоксипиримидина в 5 мл пиридина добавляют 1.0 мл метансульфонилхлорида. Полученную смесь перемешивают в течение 24 часов при комнатной температуре. Растворитель упаривают досуха и продукт распределяют между хлористым метиленом и водой, после чего промывают NaHCO3 и растворитель удаляют при пониженном давлении, получая сырой продукт, который очищают с помощью хроматографии на силикагеле, используя в качестве элюента этилацетат. Получают 60 мг (0.18 ммоль) 2-[4-(2-циано-3-пиридилкарбонил)-1 -пиперазинил]-4-этоксипиримидина с температурой плавления =177-178 С.
СПОСОБ Е:
Пример 9. Получение 2-[4-(3-циано-2-тиенилкарбонил)-1-пиперазинил]-4-метоксипиримидина.
К раствору 1.5 г (7.7 ммоль) 4-метокси-2-(1-пиперазинил)пиримидина в 20 мл ТГФ, охлажденного до 0°С, добавляют 1.25 г (7.7 ммоль) N,N'-карбонилдиимидазола. Смесь оставляют перемешиваться при комнатной температуре в течение 3 часов. Растворитель удаляют при пониженном давлении и добавляют Н2О, образующая осадок, отфильтровывают и получают 1.8 г (6.24 ммоль) 2-[4-(1-имидазолилкарбонил)-1-пиперазинил]-4-метоксипиримидина с температурой плавления =125-126°С.
К раствору 0.62 мл (6.8 ммоль) 3-цианотиофена в 25 мл безводного ТГФ, охлажденного до -78°С, в атмосфере аргона медленно добавляют 4.26 мл (6.8 ммоль) н-BuLi 1.6M в гексане. Смесь оставляют при -78°С в течение 30 минут и затем медленно добавляют раствор 1.8 г (6.2 ммоль) 2-[4-(1-имидазолилкарбонил)-1-пиперазинил]-4-метоксипиримидина в 25 мл безводного ТГФ. Смеси дают возможность медленно нагреться до комнатной температуры, после чего ее оставляют при той же температуре на 2 часа. Раствор выливают в воду и экстрагируют этилацетатом, получая сырой продукт, который очищают с помощью хроматографии на силикагеле, используя в качестве элюента смесь этилацетата:гексана 7:3. Получают 1.0 г (3.0 ммоль) 2-[4-(3-циано-2-тиенилкарбонил)-1-пиперазинил]-4-метоксипиримидина с температурой плавления =140-142°С.
СПОСОБ F:
Пример 1. Получение 2-[4-(2-цианобензоил)-1-пиперазинил]-4-метоксипиримидина.
К раствору 1.0 г (6.8 ммоль) 2-цианобензойной кислоты в 20 мл безводного ДМФА, охлаженного до 0°С, добавляют 1.1 г (6.8 ммоль) N,N'-карбонилдиимидазола и оставляют перемешиваться в течение 40 минут. Затем добавляют 1.26 г (6.8 ммоль) 1-(трет-бутоксикарбонил)пиперазина и оставляют при комнатной температуре на 2 часа. Затем выливают в воду и экстрагируют этиловым эфиром. Органическую фазу сушат и упаривают при пониженном давлении, получая сырой продукт, который затвердевает в петролейном эфире. Получают 1.24 г (3.94 ммоль) 4-(трет-бутоксикарбонил)-1-(2-цианобензоил)пиперазина с температурой плавления =126-128°С.
К раствору 1.2 г (3.81 ммоль) 4-(трет-бутоксикарбонил)-1-(2-цианобензоил)пиперазина в 10 мл хлористого метилена, охлажденного до 0°С, добавляют 10 мл трифторуксусной кислоты и оставляют перемешиваться при комнатной температуре на 2 часа. Реакционную смесь упаривают досуха и полученный сырой продукт кристаллизуют из хлористого метилена:этилового эфира с образованием 1.04 г (3.16 ммоль) 1-(2-цианобензоил)пиперазинтрифторацетата с температурой плавления =136-141°С.
Смесь 1.0 г (3.04 ммоль) 1-(2-цианобензоил)пиперазинтрифторацетата, 0.5 г (3.35 ммоль) 2-хлор-4-метоксипиримидина и 1.0 г (6.68 ммоль) карбоната калия в 20 мл ДМФА нагревают до 100°С в течение часа. Растворитель удаляют при пониженном давлении и добавляют воду. Полученное твердое вещество фильтруют, промывают водой и очищают с помощью хроматографии на силикагеле, используя в качестве элюента этилацетат. Получают 0.51 г (1.58 ммоль) 2-[4-(2-цианобензоил)-1-пиперазинил]-4-метоксипиримидина.
СПОСОБ G:
Пример 4. Получение 2-[4-(2-цианобензоил)-1-пиперазинил]-4-этоксипиримидина гидрохлорида.
4.76 г (14.12 ммоль) 2-[4-(2-цианобензоил)-1-пиперазинил]-4-этоксипиримидина растворяют в ацетоне и добавляют несколько капель этилового эфира/HCl и этилового эфира, образующийся осадок отфильтровывают и сушат, получая 3.