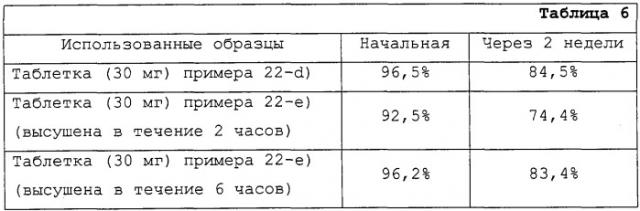
Арипипразоловое лекарственное средство с низкой гигроскопичностью и способы его получения
Иллюстрации
Показать всеИзобретение относится к области медицины и фармакологии и касается кристаллов В безводного арипипразола, имеющего характеристические пики порошковой дифракции рентгеновских лучей при 2θ=11,0°, 16,6°, 19,3°, 20,3°, 22,1°; характерные инфракрасные полосы поглощения при 2945, 2812, 1678, 1627, 1448, 1377, 1173, 960 и 779 см-1 на ИК-спектре; эндотермический пик при 141,5°С в термогравиметрическом /дифференциальном термическом анализе и эндотермический пик при 140,7°С в дифференциальной сканирующей калориметрии, гидрата А арипипразола, способов их получения, фармкомпозиций, содержащих кристаллы В арипипразола, и способов их получения. Изобретение обеспечивает пониженную гигроскопичность кристаллов В арипипразола. 36 н. и 21 з.п. ф-лы, 31 ил., 14 табл.
Реферат
Область изобретения
Настоящее изобретение относится к улучшенной форме арипипразола, имеющей пониженную гигроскопичность, и способам получения этой улучшенной формы.
Предпосылки создания изобретения
Арипипразол, 7-{4-[4-(2,3-дихлорфенил)-1-пиперазинил]бутокси}-3,4-дигидрокарбостирил или 7-{4-[4-(2,3-дихлорфенил)-1-пиперазинил]бутокси}-3,4-дигидро-2(1Н)-хинолинон, представляет собой нетипичный антипсихотический агент, пригодный для лечения шизофрении (патент США 4734416 и патент США 5006528). Шизофрения является обычным типом психоза, характеризующимся бредом, галлюцинациями и явно выраженным избеганием общения с другими людьми. Начало шизофрении обычно имеет место в возрасте между 16 и 25 годами, и шизофрения обычно поражает 1 из 100 индивидуумов во всем мире. Она более широко распространена, чем болезнь Альцгеймера, рассеянный склероз, инсулин-зависимый диабет и мышечная дистрофия. Ранний диагноз и лечение могут привести к выздоровлению со значительно улучшенным состоянием и результатом. Кроме того, раннее терапевтическое вмешательство может предотвратить дорогую госпитализацию.
В соответствии с примером 1 японской патентной выкладки №191256/1990, кристаллы безводного арипипразола получают, например, взаимодействием 7-(4-бромбутокси)-3,4-дигидрокарбостирила с 1-(2,3-дихлорфенилпиперазином) и перекристаллизацией образовавшегося неочищенного безводного арипипразола с этанолом. Кроме того, в соответствии с трудами 4-го японско-корейского симпозиума по технологии разделения (6-8 октября, 1996), кристаллы безводного арипипразола получают нагреванием гидрата арипипразола при 80°С. Однако кристаллы безводного арипипразола, полученные вышеуказанными способами, имеют недостаток, заключающийся в значительной гигроскопичности.
Гигроскопичность этих кристаллов делает трудной ручную работу с ними, так как должны быть предприняты дорогие и обременительные измерения, чтобы быть уверенными, что они не подвергаются действию влаги во время их получения и приготовления из них готовой препаративной формы. Подвергнутая действию влаги безводная форма может поглощать воду и превращаться в водную форму. Это создает несколько затруднений. Во-первых, водные формы арипипразола имеют недостаток, заключающийся в меньшей биологической доступности и меньшей растворимости, чем безводные формы арипипразола. Во-вторых, изменение в количестве водного арипипразола по сравнению с безводным арипипразоловым лекарственным веществом от партии к партии может не удовлетворить спецификациям, установленным организациями, регулирующими дозы лекарственных средств. В-третьих, размалывание может вызвать прилипание лекарственного вещества, обычного безводного арипипразола, к производственному оборудованию, что может в дальнейшем привести к замедлению процесса, более частому вовлечению оператора в процесс, повышенной стоимости, повышенному обслуживанию и более низкому выходу продукта. В-четвертых, кроме проблем, вызванных введением влаги во время обработки этих гигроскопичных безводных форм, возможность поглощения влаги во время хранения и манипулирования с этими формами может оказывать неблагоприятное влияние на растворимость арипипразолового лекарственного вещества. Таким образом, срок годности продукта может значительно снизиться и/или может значительно повыситься стоимость упаковки. Было бы весьма желательно найти форму арипипразола, которая обладает низкой гигроскопичностью, чтобы тем самым облегчить операции фармацевтической обработки и приготовления готовой препаративной формы, требуемые для получения унифицированных лекарственных форм арипипразолового лекарственного продукта, имеющего повышенный срок годности, подходящую растворимость и подходящую биологическую доступность.
Кроме того, в трудах 4-го японско-корейского симпозиума по технологии разделения (6-8 октября, 1996) указывается, что кристаллы безводного арипипразола существуют как кристаллы типа I и кристаллы типа II; кристаллы типа I безводного арипипразола можно получить перекристаллизацией арипипразола из раствора в этаноле или нагреванием гидрата арипипразола при 80°С; и кристаллы типа II безводного арипипразола можно получить нагреванием кристаллов типа I безводного арипипразола при температуре от 130 до 140°С в течение 15 часов.
Вышеуказанными способами кристаллы типа II безводного арипипразола, имеющие высокую чистоту, невозможно легко получить в промышленном масштабе с хорошей воспроизводимостью.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Таким образом, в соответствии с настоящим изобретением обеспечивается форма арипипразола, которая имеет пониженную гигроскопичность и которая легко поддается фармацевтической обработке и приготовлению из нее готовой препаративной формы. Было обнаружено, что эта форма арипипразола с пониженной гигроскопичностью является кристаллическим веществом, определенным здесь как кристаллы В безводного арипипразола. Был также открыт конкретный способ получения этого безводного кристаллического вещества, он составляет еще один аспект настоящего изобретения. В частности, как часть настоящего изобретения, было обнаружено, что для получения кристаллов В безводного арипипразола, который имеет требуемые фармацевтические свойства и для получения которого используют наиболее эффективный способ, промежуточным продуктом может служить гидрат А, как определено здесь выше. Обнаружено также, что конкретная последовательность технологического процесса должна осуществляться так, чтобы образовался гидрат А. Было обнаружено, что получение гидрата А, требующее размалывания, определяется здесь как получение обычного гидрата. Затем гидрат А можно превратить в кристаллы В безводного арипипразола посредством подходящего нагревания, как здесь определено. Как ни странно, если обычный гидрат сначала нагревают и затем размалывают, это приводит к серьезной агломерации, делающей технологический процесс коммерчески неподходящим.
Целью настоящего изобретения является обеспечение новых кристаллов безводного арипипразола.
Кроме того, другой целью настоящего изобретения является обеспечение кристаллов безводного арипипразола, которые не превращаются легко в гидраты, не снижают существенно первоначальную растворимость, даже когда фармацевтическую композицию, включающую безводный арипипразол, сохраняют в течение продолжительного периода времени.
Следующей целью настоящего изобретения является обеспечение способов получения кристаллов безводного арипипразола, имеющих высокую чистоту в промышленном масштабе с хорошей воспроизводимостью.
Были проведены исследовательские работы, предназначенные для достижения вышеуказанных целей. В ходе проведения исследований обнаружено, что требуемые кристаллы безводного арипипразола можно получить, когда хорошо известный безводный арипипразол нагревают при определенной температуре. Кроме того, обнаружено, что требуемые кристаллы безводного арипипразола можно получить перекристаллизацией хорошо известного безводного арипипразола с использованием определенных растворителей. Кроме того, обнаружено, что требуемые кристаллы безводного арипипразола можно получить суспендированием хорошо известного безводного арипипразола в определенном растворителе и нагреванием таким образом полученной суспензии.
Настоящее изобретение, таким образом, создано на основе этих открытий и знания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
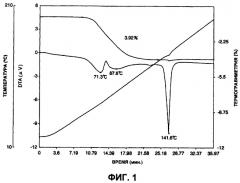
Фигура 1 представляет термогравиметрическую/дифференциальную термограмму гидрата А арипипразола, полученного в примере 1.
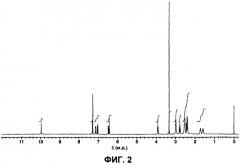
На фигуре 2 показан 1Н ЯМР-спектр (DMSO-d6, TMC) гидрата А арипипразола, полученного в примере 1.
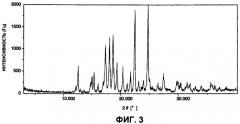
На фигуре 3 показана диаграмма порошковой дифракции рентгеновских лучей гидрата А арипипразола, полученного в примере 1.
На фигуре 4 показан 1Н ЯМР-спектр (DMSO-d6, TMC) кристаллов В безводного арипипразола, полученных в примере 2.
На фигуре 5 показана диаграмма порошковой дифракции рентгеновских лучей кристаллов В безводного арипипразола, полученных в примере 2.
Фигура 6 представляет термогравиметрическую/дифференциальную термограмму гидрата арипипразола, полученного в ссылочном примере 3.
На фигуре 7 показана диаграмма порошковой дифракции рентгеновских лучей гидрата арипипразола, полученного в ссылочном примере 3.
На фигуре 8 показана эндотермическая кривая термогравиметрического/дифференциального термического анализа кристаллов типа С безводного арипипразола, полученных в примере 11.
На фигуре 9 показан 1Н ЯМР-спектр (DMSO-d6, TMC) кристаллов типа С безводного арипипразола, полученных в примере 11.
На фигуре 10 показан спектр порошковой дифракции рентгеновских лучей кристаллов типа С безводного арипипразола, полученных в примере 11.
На фигуре 11 показан ИК-спектр кристаллов типа С безводного арипипразола, полученных в примере 11.
На фигуре 12 показан 13С ЯМР-спектр кристаллов типа С безводного арипипразола (спектр арипипразола снят в твердом состоянии), полученных в примере 11.
На фигуре 13 показана эндотермическая кривая термогравиметрического/дифференциального термического анализа кристаллов типа D безводного арипипразола, полученных в примере 12 или примере 13.
На фигуре 14 показан 1Н ЯМР-спектр (DMSO-d6, TMC) кристаллов типа D безводного арипипразола, полученных в примере 12 или примере 13.
На фигуре 15 показан спектр порошковой дифракции рентгеновских лучей кристаллов типа D безводного арипипразола, полученных в примере 12 или примере 13.
На фигуре 16 показан ИК-спектр кристаллов типа D безводного арипипразола, полученных в примере 12 или примере 13.
На фигуре 17 показан 13С ЯМР-спектр кристаллов типа D безводного арипипразола (спектры арипипразола сняты в твердом состоянии), полученных в примере 12 или примере 13.
На фигуре 18 показана эндотермическая кривая термогравиметрического/дифференциального термического анализа кристаллов типа Е безводного арипипразола, полученных в примере 14.
На фигуре 19 показан 1H ЯМР-спектр (ДМСО-d6, TMC) кристаллов типа Е безводного арипипразола, полученных в примере 14.
На фигуре 20 показан спектр порошковой дифракции рентгеновских лучей кристаллов типа Е безводного арипипразола, полученных в примере 14.
На фигуре 21 показан ИК-спектр кристаллов типа Е безводного арипипразола, полученных в примере 14.
На фигуре 22 показана эндотермическая кривая термогравиметрического/дифференциального термического анализа кристаллов типа F безводного арипипразола, полученных в примере 15.
На фигуре 23 показан 1Н ЯМР-спектр (ДМСО-d6, ТМС) кристаллов типа F безводного арипипразола, полученных в примере 15.
На фигуре 24 показан спектр порошковой дифракции рентгеновских лучей кристаллов типа F безводного арипипразола, полученных в примере 15.
На фигуре 25 показан ИК-спектр кристаллов типа F безводного арипипразола, полученных в примере 15.
На фигуре 26 показана эндотермическая кривая термогравиметрического/дифференциального термического анализа кристаллов типа G безводного арипипразола, полученных в примере 16-b).
На фигуре 27 показан 1H ЯМР-спектр (ДМСО-d6, ТМС) кристаллов типа G безводного арипипразола, полученных в примере 16-b).
На фигуре 28 показан спектр порошковой дифракции рентгеновских лучей кристаллов типа G безводного арипипразола, полученных в примере 16-b).
На фигуре 29 показан ИК-спектр кристаллов типа G безводного арипипразола, полученных в примере 16-b).
На фигуре 30 показана эндотермическая кривая термогравиметрического/дифференциального термического анализа стекловидной формы безводного арипипразола, полученного в примере 16-а).
На фигуре 31 показан спектр порошковой дифракции рентгеновских лучей стекловидной формы безводного арипипразола, полученного в примере 16-а).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с первым вариантом осуществления первого аспекта настоящего изобретения обеспечивается гидрат А арипипразола, где указанный гидрат имеет спектр порошковой дифракции рентгеновских лучей, который по существу такой же, как спектр порошковой дифракции рентгеновских лучей, показанный на фигуре 3.
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет характеристические пики порошковой дифракции рентгеновских лучей при 2θ=12,6°, 15,4°, 17,3°, 18,0°, 18,6°, 22,5° и 24,8°.
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет характерные инфракрасные полосы поглощения при 2951, 2822, 1692, 1577, 1447, 1378, 1187, 963 и 784 см-1 на ИК-спектре (КВr).
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет 1H ЯМР-спектр, который по существу такой же, как 1H ЯМР-спектр (ДМСО-d6, ТМС), показанный на фигуре 2.
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет 1H ЯМР-спектр (ДМСО-d6, ТМС), имеющий характеристические пики при 1,55-1,63 м.д. (м, 2Н), 1,68-1,78 м.д. (м, 2Н), 2,35-2,46 м.д. (м, 4Н), 2,48-2,56 м.д. (м, 4Н+ДМСО), 2,78 м.д. (т, J=7,4 Гц, 2Н), 2,97 м.д. (шир.т, J=4,6 Гц, 4Н), 3,92 м.д. (т, J=6, 3 Гц, 2Н), 6,43 м.д. (д, J=2,4 Гц, 1Н), 6,49 м.д. (дд, J=8,4 Гц, J=2,4 Гц, 1Н), 7,04 м.д. (д, J=8,1 Гц, 1Н), 7,11-7,17 м.д. (м, 1Н), 7,28-7,32 м.д. (м, 2Н) и 10,00 м.д. (с, 1Н).
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет эндотермическую кривую, которая по существу такая же, как эндотермическая кривая термогравиметрического/дифференциального термического анализа (скорость нагревания 5°С/мин), показанная на фигуре 1.
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет средний размер частиц 50 мкм или меньше.
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет средний размер частиц 40 мкм или меньше.
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет средний размер частиц 35 мкм или меньше.
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет средний размер частиц 30 мкм или меньше.
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет средний размер частиц 25 мкм или меньше.
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет средний размер частиц 20 мкм или меньше.
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет средний размер частиц в диапазоне от 40 до 10 мкм.
В соответствии с другим вариантом осуществления первого аспекта настоящего изобретения предложен гидрат А арипипразола, где указанный гидрат имеет средний размер частиц в диапазоне от 36 до 14 мкм.
В соответствии со вторым аспектом настоящего изобретения обеспечивается способ получения гидрата А, где указанный способ включает стадии размалывания обычного гидрата.
В соответствии с первым вариантом осуществления второго аспекта настоящего изобретения предложен способ получения гидрата А, включающий стадии размалывания обычного гидрата, где указанное размалывание проводят машиной для размалывания.
В соответствии с другим вариантом осуществления второго аспекта настоящего изобретения предложен способ получения гидрата А, включающий стадии размалывания обычного гидрата, где указанной машиной для размалывания является установка для тончайшего измельчения (аэрозольный аппарат) шпиндельная мельница, струйная мельница или шаровая мельница.
В соответствии с другим вариантом осуществления второго аспекта настоящего изобретения предложен способ получения гидрата А, включающий стадии размалывания обычного гидрата, где указанной машиной для размалывания является установка для тончайшего измельчения.
В соответствии с другим вариантом осуществления второго аспекта настоящего изобретения предложен способ получения гидрата А, включающий стадии размалывания обычного гидрата, где указанной машиной для размалывания является установка для тончайшего измельчения, использующая скорость вращения 5000-15000 об./мин для основной оси, вращение исходного материала 10-30 об./мин и размер отверстия сита 1-5 мм.
В соответствии с различными вариантами осуществления третьего аспекта настоящего изобретения предложен гидрат А, определенный в соответствии с одним или несколькими вариантами осуществления, описанными здесь, где указанный гидрат получают описанным здесь способом.
В соответствии с четвертым аспектом настоящего изобретения предложено арипипразоловое лекарственное вещество с низкой гигроскопичностью.
В соответствии с первым вариантом осуществления четвертого аспекта настоящего изобретения предложено арипипразоловое лекарственное вещество с низкой гигроскопичностью, где указанная низкая гигроскопичность представляет собой содержание влаги 0,5% или меньше после помещения указанного лекарственного вещества на 24 часа в эксикатор, который выдерживают при температуре 60°С и уровне влажности 100%.
В соответствии с первым вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное вещество с низкой гигроскопичностью, где указанная низкая гигроскопичность представляет собой содержание влаги 0,4% или меньше после помещения указанного лекарственного вещества на 24 часа в эксикатор, который выдерживают при температуре 60°С и уровне влажности 100%.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное вещество с низкой гигроскопичностью, где указанная низкая гигроскопичность представляет собой содержание влаги 0,25% или меньше после помещения указанного лекарственного вещества на 24 часа в эксикатор, который выдерживают при температуре 60°С и уровне влажности 100%.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное вещество с низкой гигроскопичностью, где указанная низкая гигроскопичность представляет собой содержание влаги 0,15% или меньше после помещения указанного лекарственного вещества на 24 часа в эксикатор, который выдерживают при температуре 60°С и уровне влажности 100%.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное вещество с низкой гигроскопичностью, где указанная низкая гигроскопичность представляет собой содержание влаги 0,10% или меньше после помещения указанного лекарственного вещества на 24 часа в эксикатор, который выдерживают при температуре 60°С и уровне влажности 100%.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное вещество с низкой гигроскопичностью, где указанная низкая гигроскопичность представляет собой содержание влаги 0,05% или меньше после помещения указанного лекарственного вещества на 24 часа в эксикатор, который выдерживают при температуре 60°С и уровне влажности 100%.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное вещество с низкой гигроскопичностью, где указанная низкая гигроскопичность представляет собой содержание влаги 0,04% или меньше после помещения указанного лекарственного вещества на 24 часа в эксикатор, который выдерживают при температуре 60°С и уровне влажности 100%.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное вещество с низкой гигроскопичностью, где указанным лекарственным веществом являются кристаллы В безводного арипипразола, как определено здесь.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения предложено арипипразоловое лекарственное вещество с низкой гигроскопичностью, где указанное лекарственное вещество имеет спектр порошковой дифракции рентгеновских лучей, который по существу такой же, как спектр порошковой дифракции рентгеновских лучей, показанный на фигуре 5.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество имеет характеристические пики порошковой дифракции рентгеновских лучей при 2θ=11,0°, 16,6°, 19,3°, 20,3° и 22,1°.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество имеет характерные инфракрасные полосы поглощения при 2945, 2812, 1678, 1627, 1448, 1377, 1173, 960 и 779 см-1 на ИК-спектре (КВr).
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество имеет 1H ЯМР-спектр, который по существу такой же, как 1H ЯМР-спектр (ДМСО-d6, ТМС), показанный на фигуре 4.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество имеет 1Н ЯМР-спектр (ДМСО-d6, ТМС), имеющий характеристические пики при 1,55-1,63 м.д. (м, 2Н), 1,68-1,78 м.д. (м, 2Н), 2,35-2,46 м.д. (м, 4Н), 2,48-2,56 м.д. (м, 4Н + ДМСО), 2,78 м.д. (т, J=7, 4 Гц, 2Н), 2,97 м.д. (шир.т, J=4,6 Гц, 4Н), 3,92 м.д. (т, J=6,3 Гц, 2Н), 6,43 м.д. (д, J=2,4 Гц, 1Н), 6,49 м.д. (дд, J=8,4 Гц, J=2,4 Гц, 1Н), 7,04 м.д. (д, J=8,1 Гц, 1Н), 7,11-7,17 м.д. (м, 1Н), 7,28-7,32 м.д. (м, 2Н) и 10,00 м.д. (с, 1Н).
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество имеет эндотермический пик около 141,5°С в термогравиметрическом/дифференциальном термическом анализе (скорость нагрева 5°С/мин).
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество имеет эндотермический пик около 140,7°С в дифференциальной сканирующей калориметрии (скорость нагрева 5°С/мин).
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество является кристаллами В безводного арипипразола и по существу не превращается в водную форму арипипразола при сохранении должным образом даже в течение продолжительного периода. Например, указанные кристаллы В безводного арипипразола можно сохранять при относительной влажности (RH) 60% и при температуре 25°С, даже в течение периода не меньше чем 1 год.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество является кристаллами В безводного арипипразола и по существу не превращается в водную форму арипипразола при сохранении должным образом даже в течение продолжительного периода. Например, указанные кристаллы В безводного арипипразола можно сохранять при относительной влажности (RH) 60% и при температуре 25°С, даже в течение периода не меньше чем 4 года.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество является кристаллами В безводного арипипразола и по существу не превращается в водную форму арипипразола при сохранении должным образом даже в течение периода не меньше чем 0,5 года, при относительной влажности (RH) 75% и при температуре 40°С.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество имеет средний размер частиц 50 мкм или меньше, когда для готовой препаративной формы, такой как таблетка или другие твердые дозированные готовые препаративные формы, в том числе, например, быстро плавящиеся готовые препаративные формы, требуются частицы небольшого размера.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество имеет средний размер частиц 40 мкм или меньше, если для готовой препаративной формы, такой как таблетка или другие твердые дозированные готовые препаративные формы, в том числе, например, быстро плавящиеся готовые препаративные формы, требуются частицы небольшого размера.
В соответствии с другим вариантом осуществления четвертого аспекта настоящего изобретения обеспечивается арипипразоловое лекарственное средство с низкой гигроскопичностью, где указанное лекарственное вещество имеет средний размер частиц 30 мкм или меньше, если для готовой препаративной формы, такой как таблетка или другие твердые дозированные готовые препаративные формы, в том числе, например, быстро плавящиеся готовые препаративные формы, требуются частицы небольшого размера.
В соответствии с пятым аспектом настоящего изобретения обеспечивается способ получения кристаллов В безводного арипипразола.
В соответствии с первым вариантом осуществления пятого аспекта настоящего изобретения обеспечивается способ получения кристаллов В безводного арипипразола, где указанный способ включает нагревание гидрата А арипипразола.
В соответствии с первым вариантом осуществления пятого аспекта настоящего изобретения обеспечивается способ получения кристаллов В безводного арипипразола, где указанный способ включает нагревание гидрата А арипипразола при 90-125°С в течение приблизительно 3-50 часов.
В соответствии с другим вариантом осуществления пятого аспекта настоящего изобретения обеспечивается способ получения кристаллов В безводного арипипразола, где указанный способ включает нагревание гидрата А арипипразола при 100°С в течение приблизительно 18 часов.
В соответствии с другим вариантом осуществления пятого аспекта настоящего изобретения обеспечивается способ получения кристаллов В безводного арипипразола, где указанный способ включает нагревание гидрата А арипипразола при 100°С в течение приблизительно 24 часов.
В соответствии с другим вариантом осуществления пятого аспекта настоящего изобретения обеспечивается способ получения кристаллов В безводного арипипразола, где указанный способ включает нагревание гидрата А арипипразола при 120°С в течение приблизительно 3 часов.
В соответствии с другим вариантом осуществления пятого аспекта настоящего изобретения обеспечивается способ получения кристаллов В безводного арипипразола, где указанный способ включает нагревание гидрата А арипипразола в течение приблизительно 18 часов при 100°С с последующим дополнительным нагреванием в течение около 3 часов при 120°С.
В соответствии с шестым аспектом настоящего изобретения обеспечиваются кристаллы В безводного арипипразола, определенные в соответствии с одним или несколькими описанными здесь вариантами осуществления и полученные предложенным здесь способом.
В соответствии с седьмым аспектом настоящего изобретения обеспечиваются кристаллы В безводного арипипразола, изготовленные с одним или несколькими фармацевтически приемлемыми носителями.
Другие варианты осуществления настоящего изобретения могут включать подходящие комбинации двух или более описанных здесь вариантов осуществления и/или аспектов.
Другие варианты осуществления и аспекты изобретения будут очевидны из приведенного ниже описания.
Еще один аспект настоящего изобретения включает открытие, что когда гидрат арипипразола (обычный гидрат, как определено здесь) размалывают, он превращается в гидрат арипипразола (гидрат А, как определено здесь) с другим спектром порошковой дифракции рентгеновских лучей вследствие других интенсивностей пиков. Кроме того, было обнаружено, что гидрат А теряет резкий эндотермический пик дегидратации 123,5°С, который характеризует неразмолотый обычный гидрат при термогравиметрическом/дифференциальном термическом анализе. Таким образом, обычный гидрат превращается в гидрат А после размалывания обычного гидрата и имеет нерезкий эндотермический пик дегидратации между приблизительно 60°С и 120°С со слабым пиком приблизительно у 71°С.
Еще один аспект изобретения включает открытие, что при нагревании до определенной температуры 90-125°С в течение 3-50 час этот новый гидрат арипипразола постепенно дегидратируется без феномена агрегации, которая, как считается, вызывается в обычном гидрате арипипразола быстрой дегидратацией, и что кристаллы безводного арипипразола, полученные нагреванием нового гидрата арипипразола до определенной температуры, являются кристаллами безводного арипипразола с нужными свойствами.
Характеристика гидрата А
Частицы используемого здесь "гидрата А" имеют физико-химические свойства, приведенные ниже в (1)-(5):
(1) Они имеют эндотермическую кривую, которая по существу такая же, как эндотермическая кривая в термогравиметрическом/дифференциальном термическом анализе (скорость нагрева 5°С/мин), показанная на фигуре 1. Конкретно, она характеризуется появлением небольшого пика приблизительно при 71°С и нерезкого эндотермического пика в интервале приблизительно от 60°С до 120°С.
(2) Они имеют 1H ЯМР-спектр, который по существу такой же, как 1H ЯМР-спектр (ДМСО-d6, ТМС), показанный на фигуре 2. Конкретно, он имеет характеристичные пики при 1,55-1,63 м.д. (м, 2Н), 1,68-1,78 м.д. (м, 2Н), 2,35-2,46 м.д. (м, 4Н), 2,48-2,56 м.д. (м, 4Н + ДМСО), 2,78 м.д. (т, J=7,4 Гц, 2Н), 2,97 м.д. (шир.т, J=4,6 Гц, 4Н), 3,92 м.д. (т, J=6,3 Гц, 2Н), 6,43 м.д. (д, J=2,4 Гц, 1Н), 6,49 м.д. (дд, J=8,4 Гц, J=2,4 Гц, 1Н), 7,04 м.д. (д, J=8,1 Гц, 1Н), 7,11-7,17 м.д. (м, 1Н), 7,28-7,32 м.д. (м, 2Н) и 10,00 м.д. (с, 1Н).
(3) Они имеют спектр порошковой дифракции рентгеновских лучей, который по существу такой же, как спектр порошковой дифракции рентгеновских лучей, показанный на фигуре 3. Конкретно, он имеет характеристичные пики при 2θ=12,6°, 15,4°, 17,3°, 18,0°, 18,6°, 22,5° и 24,8°.
(4) Они имеют четкие инфракрасные полосы поглощения при 2951, 2822, 1692, 1577, 1447, 1378, 1187, 963 и 784 см-1 на ИК-спектре (КВr).
(5) Они имеют средний размер частиц 50 мкм или меньше.
Способ изготовления гидрата А
Гидрат А изготовляют размалыванием обычного гидрата. Для размалывания обычного гидрата можно использовать общепринятые способы размалывания. Например, обычный гидрат можно размалывать в машине для размалывания. Можно использовать широко используемую машину для размалывания, такую как установка для тончайшего измельчения, шпиндельная мельница, струйная мельница или шаровая мельница. Из них предпочтительной является установка для тончайшего измельчения.
Что касается определенных условий размалывания, при использовании установки для тончайшего измельчения для основной оси можно использовать скорость вращения 5000-15000 об./мин, например, с вращением исходного материала 10-30 об./мин и размером отверстий сита 1-5 мм.
Средний размер частиц гидрата А арипипразола, полученных размалыванием, должен быть обычно 50 мкм или меньше, предпочтительно 30 мкм или меньше. Средний размер частиц можно установить описанным ниже способом измерения размера частиц.
Характеристика кристаллов В безводного арипипразола
"Кристаллы В безводного арипипразола" настоящего изобретения, используемого здесь, имеют физико-химические свойства, приведенные ниже в (6)-(12).
(6) Они имеют 1H ЯМР-спектр, который по существу такой же, как 1H ЯМР-спектр (ДМСО-d6, ТМС), показанный на фигуре 4. Конкретно, они имеет характеристичные пики при 1,55-1,63 м.д. (м, 2Н), 1,68-1,78 м.д. (м, 2Н), 2,35-2,46 м.д. (м, 4Н), 2,48-2,56 м.д. (м, 4Н + ДМСО), 2,78 м.д. (т, J=7,4 Гц, 2Н), 2,97 м.д. (шир.т, J=4,6 Гц, 4Н), 3,92 м.д. (т, J=6,3 Гц, 2Н), 6,43 м.д. (д, J=2,4 Гц, 1Н), 6,49 м.д. (дд, J=8,4 Гц, J=2,4 Гц, 1Н), 7,04 м.д. (д, J=8,1 Гц, 1Н), 7,11-7,17 м.д. (м, 1Н), 7,28-7,32 м.д. (м, 2Н) и 10,00 м.д. (с, 1Н).
(7) Они имеют спектр порошковой дифракции рентгеновских лучей, который по существу такой же, как спектр порошковой дифракции рентгеновских лучей, показанный на фигуре 5. Конкретно, они имеют характеристичные пики при 2θ=11,0°, 16,6°, 19,3°, 20,3° и 22,1°.
(8) Они имеют четкие инфракрасные полосы поглощения при 2945, 2812, 1678, 1627, 1448, 1377, 1173, 960 и 779 см-1 на ИК-спектре (КВr).
(9) Они имеют эндотермический пик приблизительно около 141,5°С в термогравиметрическом/дифференциальном термическом анализе (скорость нагрева 5°С/мин).
(10) Они имеют эндотермический пик приблизительно около 140,7°С в дифференциальной сканирующей калориметрии (скорость нагрева 5°С/мин).
(11) Кристаллы В безводного арипипразола настоящего изобретения имеют низкую гигроскопичность. Например, кристаллы В безводного арипипразола настоящего изобретения сохраняют содержание воды 0,4% или меньше после 24 часов выдерживания внутри эксикатора, в котором установлена температура 60°С и влажность 100%. Можно использовать хорошо известные способы измерения содержания воды, поскольку они являются способами, обычно используемыми для измерения содержания воды кристаллов. Например, можно использовать такой способ, как способ Карла Фишера.
(12) Когда для готовой препаративной формы, такой как таблетка и другие твердые дозированные готовые препаративные формы, в том числе, например, быстро плавящиеся препаративные формы, требуются частицы небольшого размера, средний размер частиц предпочтительно составляет 50 мкм или меньше.
Способ приготовления безводного В
В случае готовой препаративной формы, для которой требуются частицы небольшого размера (меньше, чем 50 мкм), для получения необходимо размалывание. Однако, когда размалывают большое количество обычного безводного арипипразола или кристаллов В безводного арипипразола, имеющих большой размер частиц, размолотые вещества прилипают друг к другу в машине для размалывания. В соответствии с этим появляется недостаток, состоящий в том, что в промышленном масштабе трудно получить кристаллы В безводного арипипразола, имеющие небольшой размер частиц.
При таких обстоятельствах было обнаружено, что обычный гидрат можно легко размолоть и можно получить кристаллы В безводного арипипразола, имеющие небольшой размер частиц, с высоким выходом и хорошей пригодностью нагреванием таким образом полученного размолотого гидрата А.
Кристаллы В безводного арипипразола настоящего изобретения получают, например, нагреванием вышеуказанного гидрата А арипипразола при 90-125°С. Время нагревания обычно составляет 3-50 часов, но оно не может быть указано точно, поскольку оно изменяется в зависимости от температуры нагревания. Время нагревания и температура нагревания обратно пропорциональны, так что, например, время нагревания будет тем дольше, чем ниже температура нагревания, и тем короче, чем выше температура нагревания. В частности, если температура нагревания гидрата А арипип