Замещенные 6-сульфо-2-оксо-1,2-дигидрохинолин 4-карбоновые кислоты и их производные (варианты) и фокусированная библиотека
Иллюстрации
Показать всеИзобретение относится к новым замещенным 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновым кислотам и их производным общей формулы (1), обладающим физиологической активностью, в частности способностью ингибировать протеинкиназу, к промежуточным соединениям для их получения и фокусированной библиотеке, для поиска соединений-лидеров и лекарственных кандидатов (drug-candidates), получаемых на основании скрининга комбинаторных библиотек. В соединениях общей формулы (1)
R1 представляет: атом водорода или электрофильный заместитель; R2 представляет: атом водорода или инертный заместитель; R3 представляет: необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу и необязательно замещенный азагетероцикл; R4 представляет: необязательно замещенную аминогруппу и необязательно замещенный азагетероцикл. Изобретение также относится к соединениям общей формулы (1.1)
(1.1)
в которой R1, R2 и R3 имеют вышеуказанное значение, R5 представляет гидроксил или атом хлора, и их применению для получения соединений общей формулы (1.2) и (1.3)
R1, R2 и R4 имеют вышеуказанное значение. 4 н. и 2 з.п. ф-лы, 4 табл.
Реферат
Данное изобретение относится к новым химическим веществам и поиску новых физиологически активных веществ, соединений-лидеров и лекарственных кандидатов (drug-candidates), получаемых на основании скрининга комбинаторных библиотек, а также к способам получения новых веществ и комбинаторным библиотекам.
Более конкретно, настоящее изобретение относится к новым замещенным 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновым кислотам и фокусированной библиотеке соединений этого ряда.
Существует большое количество физиологически активных веществ класса, хинолин-4-карбоновых кислот, обладающих антибактериальными, противовоспалительными, иммуномодулирующими и пр. свойствами, Например, амиды хинолин-4-карбоновых кислот следующего строения:
являются антагонистами тахикининовых (Tachykinin NK2 and/or NK3) рецепторов и обладают широким спектром физиологической активности, позволяющей рассматривать их как потенциальные анальгетические, противовоспалительные, противоартритные, иммуномодулирующие препараты (GlaxoSmithKline SpA; Laboratoire GlaxoSmithKline SAS. WO 0238547, 2002).
2-Оксо-1,2-дигидрохинолин-4-карбоновые кислоты и их производные также обладают биологической активностью, например, являются 5-НТ3, NMDA и AT1 антагонистами. Например, 1-алкил-2-оксо-1,2-дигидрохинолин-4-карбоксилаты, один из которых представлен ниже, являются 5-НТ3 антагонистами (Kyowa Hakko Kogyo Co., Ltd. Jap. Pat. 1992226980,1992; Pat. EP 0458636).
Известно лишь несколько представителей замещенных 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновых кислот, в том числе: 6-диэтилсульафмоил-2-оксо-1,2-дигидрохинолин-4-карбоновая кислота [База данных Chemcats of STN, (AN) 2003, 2884896, №438029-22-2, опубл. 15.11.2001] и 6-(2-метоксифенилсульафмоил)-2-оксо-1,2-дигидрохинолин-4-карбоновая кислота [База данных Chemcats of STN, (AN) 2002, 288889, №379730-31-1, опубл. 15.11.2001]. В патенте DE 19613591 A1 (1997) среди заявленных производных хинолина и способа их получения упоминаются и производные 2-оксо-6-сульафмоил-1,2-дигидрохинолин-4-карбоновой кислоты, однако в описании отсутствует хотя бы один пример конкретного соединения, отвечающего указанной общей формуле
В этой связи дизайн новых 6-сульфамоилхинолин-4-карбоновых кислот и их производных, синтез новых физиологически активных веществ этого ряда, разработка способов их получения и создание комбинаторной библиотеки этих соединений представляется перспективным подходом к открытию новых соединений-лидеров, обладающих высоким сродством к тахикининовым рецепторам и лишенных побочных свойств.
Данное изобретение относится к новым замещенным 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновых кислот и фокусированной библиотеке соединений этого ряда, обладающих физиологической активностью, в том числе специфической физиологической активностью, позволяющей использовать их в качестве ингибиторов сериновых протеаз и киназ, а также позволяющей использовать их в качестве полупродуктов синтеза замещенных 6-сульфамоил- и 6-оксисульфонил-2-оксо-1,2-дигидрохинолин-4-карбоновых кислот и их производных. Ниже приведены определения терминов, использованных в описании изобретения.
«Комбинаторная библиотека» означает коллекцию соединений, полученных параллельным синтезом и предназначенную для поиска лидера или оптимизации биологической активности лид-соединения, причем каждое соединение библиотеки соответствует общему скэффолду и библиотека является коллекцией родственных гомологов или аналогов.
«Фокусированная библиотека» означает комбинаторную библиотеку, или совокупность нескольких комбинаторных библиотек, или совокупность библиотек и веществ, специальным образом организованную с целью увеличения вероятности нахождения хитов и лидеров или с целью повышения эффективности их оптимизации. Дизайн фокусированных библиотек, как правило, связан с направленным поиском эффекторов (ингибиторов, активаторов, агонистов, антагонистов и т.п.) определенных биомишеней (ферментов, рецепторов, ионных каналов и т.п.).
«Лид-соединение» означает соединение с выдающейся активностью, относящейся к определенной болезни.
«Скэффолд» означает общую структурную формулу или молекулярный каркас или инвариантную область соединений, характерную для всех соединений, входящих в комбинаторную библиотеку.
«Хемотип» означает серию соединений, объединенную общей структурной формулой, и обладающую определенным общим свойством, например каким-то видом физиологичекой активности. Можно сказать, например, "новый хемотип активаторов калиевых каналов", или "известный хемотип киназных ингибиторов", и т.д. Как правило, наличие общего структурного фрагмента у соединений в рамках одного хемотипа является необходимым и достаточным условием для наличия у них общего свойства.
«Нуклеофильный» означает электроноизбыточный реагент.
«Электрофильный» означает электронодефицитный реагент.
«Заместитель» означает химический радикал или группу, которые присоединяются к другому радикалу, группе или к скэффолду, включая, но не ограничивая атом галогена, «инертный заместитель», нитрогруппу, сульфогруппу, сульфамидную группу, гидроксильную группу, аминогруппу, карбоксиалкильную группу, алкоксикарбонильную группу, карбамоильную группу и др.
«Инертный заместитель» ("Non-interfering substituent") означает низко- или нереакционоспособный радикал, инертный к дальнейшим превращениям и к среде включая, но не ограничивая C1-С7алкил, С2-С7алкенил, С2-С7алкинил, C1-С7алкокси, С7-C12аралкил, замещенный аралкил, С7-C12гетероциклилалкил, замещенный гетероциклилалкил, С7-С12алкарил, С3-С10циклоалкил, С3-С10циклоалкенил, фенил, замещенный фенил, толуил, ксиленил, бифенил, C2-С12алкоксиалкил, C2-С10алкилсульфинил, C2-С10алкилсульфонил, (CH2)m-O-(C1-С7алкил), -(CH2)m-N(C1-С7алкил)n, арил, замещенный арил, замещенный алкокси, фторалкил, арилоксиалкил, гетероциклил, замещенный гетероциклил и нитроалкил; где m и n имеют значение от 1 до 7. Предпочтительными «инертными заместителями» являются C1-C7алкил, С2-С7алкенил, С2-С7алкинил, C1-С7алкокси, С7-С12аралкил, С7-C12алкарил, С3-С10циклоалкил, С3-С10циклоалкенил, фенил, замещенный фенил, (СН2)m-O-(C1-С7алкил), -(CH2)m-N(C1-С7алкил)m, арил, замещенный арил, гетероциклил и замещенный гетероциклил.
«Нуклеофильный заместитель» означает химический радикал, который присоединяется к скэффолду в результате реакции с нуклеофильным реагентом, например, выбранным из группы первичных или вторичных аминов, спиртов, фенолов, меркаптанов и тиофенолов.
«Электрофильный заместитель» означает химический радикал, который присоединяется к скэффолду в результате реакции с электрофильным реагентом, например, выбранным из группы органических галогенидов (необязательно замещенных C1-C7алкил галогенидов, необязательно замещенных арилС1-С7алкил галогенидов, необязательно замещенных гетероциклилС1-С7алкил галогенидов, необязательно замещенных арил галогенидов, необязательно замещенных гетероциклил галогенидов), органических кислот или их производных (ангидридов, имидазолидов, галогенангидридов), эфиров органических сульфокислот или органических сульфохлоридов, органических галогенформиатов, органических изоцианатов и органических изотиоцианатов.
«Замещенная группа, замещенный радикал или скэффолд» означают, соответственно, группу, радикал или скэффолд, у которых имеется заместитель, включая но не ограничивая: инертный заместитель, атом галогена, нитрогруппу, цианогруппу, сульфогруппу, гидроксильную группу, аминогруппу, карбоксиалкильную группу, карбоксильную группу, карбамоильную группу. Например, замещенный алкил означает алкил, у которого один или несколько заместителей, например гидроксиалкил или метилоксикарбонилалкил, амино-метоксикарбонил-метил, диметиламиноалкил, 2-гидрокси-2-метоксикарбонил-этил и др.; замещенная аминогруппа означает аминогруппу, у которой имеется один или два заместителя, например ациламиногруппа, N,N-диалкиламиногруппа, N-ацил-N-арил-аминогруппа, ацетил-метоксикарбонилметил-аминогруппа и др.; замещенный фенил означает фенил, у которого имеется один или несколько заместителей, например 2-метоксикарбонилфенил, 4-амино-3-метоксикарбонилфенил, 3,4-диаминофенил и др.
«Необязательно замещенная группа, необязательно замещенный радикал или скэффолд» означают, соответственно группу, радикал или скэффолд, включающие группы, радикалы или скэффолды с заместителями и без заместителей. Например, понятие необязательно замещенная аминогруппа включает: незамещенную аминогруппу и аминогруппы, содержащие любые, не противоречащие химии заместители, включая, но не ограничивая ациламиногруппы, N,N-диалкиламиногруппы, N-ацил-N-арил-аминогруппы, ацил-метоксикарбонилметил-аминогруппы и др.
«Арил» означает один или более ароматических циклов, каждый из которых включает 5 или 6 атомов углерода. «Арил» может быть конденсированным полициклом, например, как нафталин, или неконденсированным, например, как бифенил.
«Замещенный арил» имеет один или несколько «не мешающих» заместителей.
«Галоген» означает атом фтора, хлора, брома или иода.
«Гетероцикл» означает один или несколько насыщенных или ароматических циклов с 5, 6 или 7 атомами, по крайней мере, один из которых является гетероатомом. Преимущественными гетероатомами являются сера, кислород и азот. «Гетероцикл» может быть конденсированным полициклом, например, как бензимидазол, бензоксазол, бензтиазол, хинолин, или неконденсированным, например, как бипиридил.
«Азогетероцикл» означает гетероцикл, включающий, по крайней мере, один атом азота, например, как бензимидазол, бензоксазол, бензтиазол, хинолин.
«Замещенный гетероцикл» означает гетероцикл, имеющий один или несколько «не мешающих» заместителей.
«Параллельный синтез» означает метод проведения химического синтеза комбинаторной библиотеки индивидуальных соединений.
Целью настоящего изобретения является новые замещенные 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновые кислоты.
Поставленная цель достигается замещенными 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновыми кислотами и их производными общей формулы (1):
в которой:
R1 представляет: атом водорода, инертный заместитель или электрофильный заместитель;
R2 представляет: атом водорода или инертный заместитель;
R3 представляет: необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу или необязательно замещенный азогетероцикл;
R4 представляет: необязательно замещенную аминогруппу или необязательно замещенный азогетероцикл, исключая 6-диэтилсульфамоил-1-метил-2-оксо-1,2-дигидрохинолин-4-карбоновую кислоту, 6-(3-метоксифенилсульфамоил)-1-метил-2-оксо-1,2-дигидрохинолин-4-карбоновую кислоту и соединения общей формулы 1 для которых R4 означает NH2.
Поставленная цель достигается замещенными 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновыми кислотами и их производными общей формулы (1.1)
которой R1, R2 и R3 имеют вышеуказанное значение, а R5 представляет гидроксил или атом хлора.
Согласно изобретению предпочтительными новыми соединениями являются замещенные 6-хлорсульфонил-2-оксо-1,2-дигидрохинолин-4-карбоновые кислоты и их производные общей формулы (1.1.1)
в которой R1, R2 и R3 имеют вышеуказанное значение.
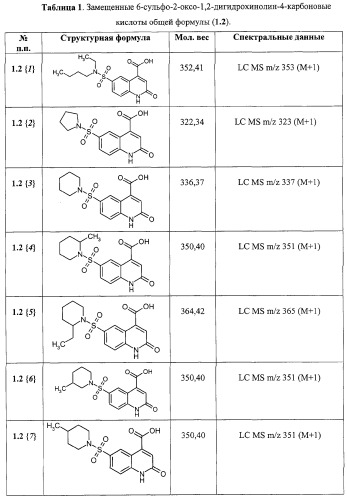
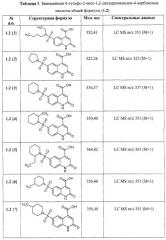
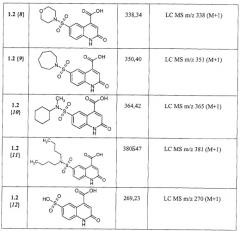
Согласно изобретению предпочтительными новыми соединениями являются замещенные 6-сульфамоил-2-оксо-1,2-дигидрохинолин-4-карбоновые кислоты общей формулы (1.2)
в которой R1, R2 и R4 имеют вышеуказанное значение.
Согласно изобретению предпочтительными новыми соединениями являются замещенные 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновые кислоты и их производные общей формулы (1.3)
которой R1, R3 и R4 имеют вышеуказанное значение.
Согласно изобретению соединения общей формулы (1.1 и 1.1.1) используют в качестве полупродуктов синтеза замещенных 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновых кислот и их производных общей формулы (1.2) и (1.3).
Целью настоящего изобретения является также новая фокусированная библиотека соединений для поиска биологически активных лидов.
Поставленная цель достигается фокусированной библиотекой соединений для поиска биологически активных лидов, включающей, по крайней мере, одно соединение общей формулы (1), в которой R1, R2, R3 и R4 имеют вышеуказанное значение.
Ниже изобретение описывается с помощью конкретных примеров получения конкретных соединений и комбинаторной библиотеки. Структуры полученных соединений подтверждались данными химического, хроматографического и спектрального анализа. Жидкофазный паралельный ситез новых соединений и комбинаторной библиотеки осуществлялись с использованием специальных синтезаторов "CombiSyn-012-3000" [M. Бару, А. Иващенко, Патент России 2180609, 2002; РСТ WO 02/087740 A1, 2002] и оборудования [Technology Platform. In Custom Chemistry; Chemical Diversity Labs, Inc.; San Diego, CA, 2002; p.5, http://www.chemdiv.com.]. Приведенные ниже примеры иллюстрируют, но не ограничивают данное изобретение.
Общая информация. Все растворители и реагенты были получены из коммерческих источников, таких как Акрос (Бельгия), Сигма-Олдрич (США), Ланкастер (Англия) и КемДив (США). Точки плавления (т.пл.) были получены на приборе фирмы Бюхи (Швейцария) модель В-520. 13С ЯМР спектры были получены на спектрометрах фирмы Брукер модель АМ-300 и модель DRX-500 в диметилсульфоксиде-d6, химические сдвиги приведены в шкале δ (ppm). Внутренний стандарт тетраметилсилан. Масс-спектры были измерены на приборе Kratos Model MS-890.
Аналитическую ТСХ проводили на силикагеле на алюминевых пластинках Silufol UV254 (5 см × 15 см) (Kavalier, Czech Republic) или на стеклянных пластинках с 0.25 - мм слоем силикагеля 60 F254 (Merck, Germany). Визуализация осуществлялась с помощью УФ света на длине волны 254 нм. Для хроматографической очистки использовали силикагель 5-40 μm (Chemapol, Czech Republic). В соответствии с данными LC/MS все синтезированные соединения имели содержание основного вещества выше 95%.
Примеры 1. Этил 6-хлорсульфонил-2-оксо-1,2-дигидро-4-хинолин-карбоксилат (1.1: R1=R2=H, R3=OC2H5). Постепенно прибавляют 54 г (0,25 моль) этил 2-оксо-1,2-дигидро-4-хинолинкарбоксилата (полученного по методике: Org. Synthesis, 1947, 28, стр.70) в 100 мл хлорсульфоновой кислоты. Реакционную массу перемешивают 1 ч при комнатной температуре, а затем еще 5 ч при 50-60°С. Реакционную массу постепенно выливают в лед, осадок отфильтровывают, дважды промывают на фильтре ледяной водой и сушат в вакууме. Полученный продукт перекристаллизовывают из ледяной уксусной кислоты и получают этил 6-хлорсульфонил-2-оксо-1,2-дигидро-4-хинолинкарбоксилат (1.1: R1=R2=H, R3=OC2H5) в виде белых призм.
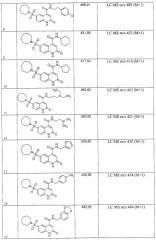
Примеры 2. Комбинаторная библиотека 6-сульфамоил-2-оксо-1,2-дигидро-4-хинолинкарбоновых кислот (1.2 {1-11}). Параллельный синтез комбинаторной библиотеки проводят в синтезаторе "CombiSyn-012-3000". В каждый из 11 реакторов синтезатора загружают по 25 мл воды, 0,24 г NaOH, 0,006 моль соответствующего амина и 1,58 г (0,005 моль) 6-хлорсульфонил-2-оксо-1,2-дигидро-4-хинолинкарбоксилат (1.1: R1=R2=H, R3=ОС2Н5). Реакционную массу перемешивают 3 ч при комнатной температуре, после чего прибавляют еще 0,48 г (0,012 моль) NaOH и 25 мл этанола и кипятят 1 ч. Реакционные массы упаривают в вакууме досуха, а остаток растворяют в 15 мл воды и при перемешивании прибавляют 20% H2SO4 до pH=5. Осадки отфильтровывают, промывают на фильтре водой и сушат в вакууме над Р2О5. Полученные осадки промывают в кипящем этилацетате, отфильтровывают и сушат. Получают 6-сульфамоил-2-оксо-1,2-дигидро-4-хинолинкарбоновые кислоты 1.2{1-11}, с выходом 65-78%, представленные в Таблице 1.
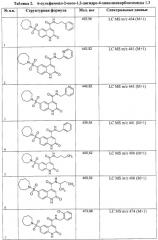
Примеры 3. Комбинаторная библиотека 6-сульфамоил-2-оксо-1,2-дигидро-4-хинолинкарбоксамидов 1.3 {1-480}. Растворяют 300 моль 6-сульфамоил-2-оксо-1,2-дигидрохинолин-4-карбоновой кислоты 1.2 в 100 мл ДМФ. К полученному раствору постепенно прибавляют 49,4 г (305 моль) карбонилдиимидазола, выдерживают при перемешивании и комнатной температуре 10 мин, после чего выдерживают 3 ч при 80-90°С. Полученный раствор разбавляют сухим ДМФ до 500 мл и загружают по 5 мл в 100 реакционных пробирок. В каждую реакционную пробирку добавляют 3,2 моль соответствующего первичного или вторичного амина, растворенного в 3 мл сухого ДМФ. Реакционные массы выдерживают 8 ч при перемешивании и 75-80°С, после чего разбавляют 50 мл холодной воды. Осадки отфильтровывают и перекристаллизовывают из смеси этанол-ДМФ. Получают 6-сульфамоил-2-оксо-1,2-дигидро-4-хинолинкарбоксамиды 1.3, с выходом 60-80%, представленные в Таблице 2.
Примеры 4. Составляют фокусированную библиотеку, включающую 538 6-сульфонилхинолинов, в том числе 491 синтезированных 6-сульфонилхинолин-4-карбоновых кислот и их производных общей формулы (1.2 и 1.3), и испытывают ее на антипротеазную активность. Антипротеазную активность определяют на сериновой протеазе (Каспаза 3), которая вовлечена в регуляцию программированной клеточной смерти (апоптозис). Активность Каспазы 3 определяют по скорости расщепления пептидного субстрата, содержащего флуоресцентную молекулу (метилкумарин). Отщепление метилкумарина от пептидной молекулы в результате протеолитической реакции фермента сопровождается усилением интенсивности флуоресценции, измерения которой производят с помощью флуоресцентного параллельного считывателя VICTOR2V (PerkinElmer, USA) при длине волны возбуждения 355 nm и длине волны эмиссии 460 nm. Для проведения реакций используют оптические 96-луночные микроплаты. В экспериментах используют каспаза 3 и флуоресцентный субстрат фирмы Sigma (USA). Реакционные условия и состав среды используют в соответствии с рекомендацией фирмы производителя. Исходные растворы тестируемых соединений готовят их растворением в ДМСО (диметилсульфоксид) до концентрации 10 мМ. Исходные растворы соединений добавляют к раствору фермента в таком объеме, что бы получить окончательную концентрацию соединения 10 мкМ. После 10-минутной инкубации фермента с тестируемым соединением, к раствору добавляют энзимный субстрат и измерения флуоресценции проводят спустя 1 час после добавления субстрата (Fi e). Для коррекции на собственную флуоресценцию тестируемых соединений флуоресцентные измерения (Fi 0) проводят в отдельных платах, не содержащих энзимные реагенты (фермент плюс субстрат). Полную активность фермента измеряют по флуоресценции в реакционных лунках, содержащих все реакционные компоненты, кроме тестируемых соединений (F100), а нулевую активность определяют по флуоресценции лунок, содержащих соответствующие тестируемые соединения и все реакционные реагенты за исключением фермента (F0).
Расчет ингибирования производился по следующей формуле:
где Fi=Fi e-Fi 0, подстрочный индекс соответствует тестируемому соединению, в присутствии которого измеряется флуоресценция, а надстрочные индексы (е) и (0) означают присутствие или отсутствие энзимных реагентов соответственно.
Некоторые примеры испытанных соединений, проявивших при скрининге фокусированной библиотеки умеренную или малую активность, приведены в Таблице 3.
Примеры 5. Составляют фокусированную библиотеку, включающую 538 6-сульфонилхинолинов, в том числе 491 синтезированных 6-сульфонилхинолин-4-карбоновых кислот и их производных общей формулы (1.2) и (1.3), и испытывают ее на способность ингибировать активность протеинкиназы, которую определяют следующим образом. Раствор полипептида (Calbiochem, USA), состоящего из случайной последовательности глутаминовой кислоты и тирозина в количественном соотношении 4:1 соответственно, выдерживают в лунках 96-луночных тарелок с оптически прозрачным дном в течение ночи. За это время полипептид прочно сорбируется на поверхности лунок. Сорбированный полипептид служит субстратом для киназы, которая фосфориллировала тирозин в этом полипептиде.
100 микролитров 1U киназы (Calbiochem, USA, 1U определялась как концентрация этого фермента, способная присоединить к субстрату 1 пикомоль фосфата за 1 минуту) добавляют в лунки с адсорбированным полипептидом без тестируемых соединений (контрольная активность) или в присутствии разных концентраций этих соединений. После 30-минутной инкубации эти растворы удаляют путем вытряхивания из лунок и лунки дважды промывают физиологическим раствором. В лунки заливают 100 микролитров раствора антифосфотирозиновых моноклональных IGg антител с конъюгированной пероксидазой из хрена (Sigma, USA). Количество связавшихся антител определяют по соответствующей активности пероксидазы, которую, в свою очередь, определяют по скорости преобразования пероксидазного субстрата (OPD, о-phenolenediamine dihydrochloride, Sigma) в окрашенный продукт. Концентрацию этого продукта, образовавшегося за 30 минут реакции, определяют по оптической плотности при 490 nm, измеренной с помощью параллельного 96-луночного считывателя VICTOR2V (PerkinElmer, USA).
Для расчета процента ингибирования киназной активности каждая 96-луночная тарелка содержала следующие контрольные лунки: 1) реакционный раствор, содержащий все компоненты кроме киназы и 2) реакционный раствор вместе с киназой. Оптическую плотность, измеренную в контрольных лунках (1), принимают за нулевую активность (OD0), а оптическую плотность, измеренную в контрольных лунках (2) - за 100% (OD100). Оптические плотности, измеренные в присутствии тестируемых соединений (ODi), выражают в процентах от максимальной активности, и процент ингибирования киназной активности рассчитывают по следующей формуле:
В Таблице 2 приведены величины ингибирования ABL-киназы, подтверждающие биологическую активность 6-сульфонилхинолин-4-карбоновых кислот и их производных.
1.Замещенные 6-сульфонилхинолин-4-карбоновые кислоты и их производные общей формулы (1)
в которой R1 представляет атом водорода или электрофильный заместитель;
R2 представляет атом водорода или инертный заместитель;
R3 представляет необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу и необязательно замещенный азагетероцикл;
R4 представляет необязательно замещенную аминогруппу и необязательно замещенный азагетероцикл, исключая 6-диэтилсульфамоил-1-метил-2-оксо-1,2-дигидрохинолин-4-карбоновую кислоту, 6-(3-метоксифенилсульфамоил)-1-метил-2-оксо-1,2-дигидрохинолин-4-карбоновую кислоту, и соединения общей формулы (1), для которых R4 означает NH2.
2. Замещенные 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновые кислоты и их производные общей формулы (1.1)
(1.1)
в которой R1, R2 и R3 имеют вышеуказанное значение,
R5 представляет гидроксил или атом хлора.
3. Соединения по п.1, представляющие замещенные 6-сульфамоил-2-оксо-1,2-дигидрохинолин-4-карбоновые кислоты общей формулы (1.2)
в которой R1, R2 и R4 имеют вышеуказанное значение.
4. Соединения по любому из пп.1 и 3, представляющие замещенные 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновые кислоты и их производные общей формулы (1.3)
(1.3)
в которой R1, R2 и R4 имеют вышеуказанное значение.
5. Применение замещенных 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновых кислот и их производных общей формулы (1.1) в качестве полупродуктов для синтеза замещенных 6-сульфо-2-оксо-1,2-дигидрохинолин-4-карбоновых кислот и их производных общей формулы (1.2) или (1.3) по п.3 или 4.
6. Фокусированная библиотека соединений для поиска биологически активных соединений-лидеров, включающая, по крайней мере, одно соединение общей формулы (1), в которой R1, R2, R3 и R4 имеют вышеуказанное значение.