Амикомицин, способ его получения и его применение в качестве фармацевтического средства
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может найти применение в медицине. Новое соединение амикомицин имеет молекулярную формулу С65Н115NO18 (структурная ф-ла приведена в формуле изобретения) и обладает противомикробной активностью. Амикомицин, его фармацевтически приемлемые соли и производные во всех их стереоизомерных и таутомерных формах могут быть получены культивированием микроорганизма Amycolatopsis sp., ST101170 (DSM 12216) в аэробных условиях в питательной среде, содержащей необходимые питательные компоненты, с последующим выделением и очисткой целевого продукта и, при необходимости, превращением его в фармакологически приемлемую соль, сложный эфир, простой эфир и другие химические эквиваленты, обладающие тем же спектром противомикробной активности. Амикомицин входит в качестве активного компонента в фармацевтическую композицию, обладающую противомикробной активностью. Амикомицин выполняет функцию антибиотика. Использование изобретения позволит ингибировать микроорганизмы, резистентные к ванкомицину и тейкопланину, используемые для лечения инфекций, вызываемых Staphylococcus aureus (MRSA). 4 н. и 3 з.п. ф-лы, 2 табл.
Реферат
Данное изобретение относится к соединению под названием "амикомицин", которое может быть получено путем культивирования микроорганизма Amycolatopsis sp., ST 101170 (DSM 12216), и к его фармацевтически приемлемым солям и производным. Данное изобретение также относится к способу получения амикомицина, к применению амикомицина и его фармацевтически приемлемых солей и производных в качестве фармацевтических средств, в частности к их применению в качестве антибиотиков, а также фармацевтических композиций, включающих амикомицин, или его фармацевтически приемлемую соль, или производное.
Известно, что резистентные к метициллину инфекции Staphylococcus aureus (MRSA) преобладают при некоторых инфекционных состояниях, таких как раны и ожоги. Ванкомицин и тейкопланин, принадлежащие к классу гликопептидов, являются единственными двумя антибиотиками, применяемыми в клинике для лечения инфекций MRSA. Однако вследствие недавнего появления ванкомицин- и тейкопланин-резистентных штаммов сообщается, что данные инфекции стали угрожающими и смертельными. Поэтому был начат интенсивный поиск структурно иного класса соединений, активных против указанных ванкомицин- и тейкопланин-резистентных штаммов. Например, в качестве антибиотика, активного против ванкомицин- и тейкопланин-резистентных штаммов, ранее был описан (ЕР-А-0818539, поданная 11 июля, 1996 г.) метилсульфомицин I, циклический тиопептид.
Было обнаружено, что новое соединение под названием "амикомицин" обладает активностью антибиотика. Таким образом, настоящее изобретение относится к соединению формулы:
а также к его фармацевтически приемлемым солям и производным, таким как сложные эфиры, простые эфиры и другие очевидные химические эквиваленты, включая все стереоизомерные формы и все таутомерные формы.
Амикомицин имеет характерный остаток тетрамовой кислоты с высокоокисленной боковой цепью С45. Он имеет молекулярную формулу C65H115NO18 и может быть получен путем культивирования микроорганизма Amycolatopsis species ST101170 (DSM 12216) в аэробных условиях и питательной среде, содержащей источники углерода и азота, с последующим выделением и очисткой обычным образом. Микроорганизм ST101170 принадлежит к отряду Actinomycetales, род Amycolatopsis, и 4 июня 1998 г. он был депонирован в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH), Braunschweig, Deutschland, и ему был присвоен порядковый номер DSM №12216.
Настоящее изобретение также предоставляет способ получения соединения под названием "амикомицин" из Amycolatopsis species ST101170, его мутантов и вариантов в аэробных условиях в питательной среде, содержащей один или несколько источников углерода и один или несколько источников азота и необязательно питательные неорганические соли и/или следовые элементы, с последующим выделением указанного соединения и очисткой обычным образом.
Мутанты и варианты микроорганизма ST101170 могут быть также способны синтезировать соединение в соответствии с настоящим изобретением. Такие мутанты могут быть получены известным образом с помощью физических средств, например облучением, таким как ультрафиолетовыми или рентгеновскими лучами, или с помощью химических мутагенов, таких как этилметилансульфонат (EMS), 2-гидрокси-4-метоксибензофенон (MOB) или N-метил-N'-нитро-N-нитрозогуанидин (MNNG).
Скрининг подходящих мутантов и вариантов, которые могут продуцировать соединение в соответствии с изобретением, может быть подтвержден определением биологической активности активных соединений, накопленных в культуральном бульоне, например испытанием антибактериального действия, в частности против ванкомицин-резистентных штаммов (см. таблицу 2 ниже).
Предпочтительными источниками углерода, подходящими для аэробной ферментации, являются ассимилируемые углеводные и сахарные спирты, такие как глюкоза, лактоза или D-маннит, а также углеводсодержащие природные продукты, такие как солодовый экстракт. Подходящие источники азота включают, например, аминокислоты, пептиды и белки, включая продукты их распада, такие как пептоны или триптоны, мясной экстракт, измельченные семена, например, кукурузы, белых бобов, сои или хлопковых растений, остатки дистилляции от получения спирта, мясную муку и дрожжевые экстракты, а также соли аммония и нитраты. Подходящими неорганическими солями, которые может содержать питательный раствор, являются, например, хлориды, карбонаты, сульфаты или фосфаты щелочных или щелочноземельных металлов, ионов цинка, кобальта или марганца.
Образование амикомицина происходит особенно хорошо, например, в питательной среде, включающей около 0,5-5% крахмала (растворимого), предпочтительно 1-2%, около 0,5-5% глюкозы, предпочтительно 1-3%, около 0,5-5% глицерина, предпочтительно 1-2%, около 0,1-0,5% кукурузного экстракта, предпочтительно 0,2-0,3%, около 0,2-1% пептона, предпочтительно 0,4-0,6%, около 0,1-0,5% дрожжевого экстракта, предпочтительно 0,2-0,4%, около 0,05-0,2% хлорида натрия, предпочтительно 0,1-0,2%, и около 0,1-0,5% СаСО3, предпочтительно 0,2-0,3%. Указанные количества приведены в расчете на массу всей питательной среды.
Культивирование ST101170 осуществляют аэробно, например, погружением с встряхиванием или перемешиванием в качалочных колбах или лабораторных ферментерах, необязательно с введением воздуха или кислорода. Культивирование ферментацией может осуществляться, например, в стерильных широкогорлых бутылях или круглодонных колбах различных объемов, в стеклянных ферментерах или емкостях из V2A-стали.
Культивирование ST101170 может осуществляться при температуре между примерно 20 и 35°С, предпочтительно примерно между 25 и 30°С, и рН между 4 и 10, предпочтительно между 6 и 8. При данных условиях микроорганизм культивируется в общем на протяжении периода времени 20-200 часов, предпочтительно 24-150 часов.
Культивирование преимущественно осуществляется в несколько стадий. Сначала в жидкой питательной среде могут быть получены одна или несколько предкультур. Основную культуру, фактическую производственную среду, затем инокулируют предкультурой, например, при объемном соотношении, составляющем 1:10. Предкультуру получают, например, инокулированием питательной среды мицелием со спорами и оставлением ее для роста в течение примерно от 20 до примерно 120 часов, предпочтительно 24-90 часов. Мицелий со спорами может быть получен, например, в результате роста микроорганизма в течение около 1 - около 40 дней, предпочтительно 5-12 дней, на твердой или жидкой питательной среде, такой как солодово-дрожжевой агар или картофельно-декстрозный агар.
Ход ферментации и образования амикомицина можно контролировать способами, известными специалистам, такими как измерение биологической активности культурального бульона с помощью биологических анализов, или хроматографическими методами, такими как тонкослойная хроматография (ТСХ) или высокоэффективная жидкостная хроматография (ВЭЖХ).
Соединение амикомицин присутствует в фильтрате культуры, а также в мицелии. Однако обычно основное количество присутствует в мицелии. Соединение может быть выделено с применением известных приемов разделения. Так, оно может быть выделено из фильтрата культуры, например, фильтрованием или центрифугированием. Фильтрат может экстрагироваться несмешиваемым с водой растворителем, таким как 1-бутанол, этилацетат, хлороформ, дихлорметан или аналогичный, предпочтительно бутанол или этилацетат.
Активный материал также может выделяться из мицелия экстрагированием смешиваемым с водой растворителем, таким как метанол, ацетон, ацетонитрил, н-пропанол или изопропанол, предпочтительно метанол или ацетон, или несмешиваемым с водой растворителем, таким как трет-бутанол, этилацетат, хлороформ, дихлорметанол или аналогичный, предпочтительно бутанол или этилацетат.
Экстрагирование фильтрата культуры может осуществляться в широком интервале рН. Однако предпочтительно проводить экстрагирование в нейтральной или слабокислой среде, предпочтительно при рН между 4 и 9. Органический экстракт может концентрироваться в вакууме и сушиться, давая активный сырой материал.
Выделение или очистка амикомицина может осуществляться известным способом с учетом химических, физических и биологических характеристик природного соединения.
Одним из методов выделения амикомицина в соответствии с изобретением является распределение раствора известным per se образом.
Еще одним способом очистки амикомицина является хроматография на абсорбционных смолах, таких как Diaion® HP-20 (Mitsubishi Casei Corp., Tokyo), на Amberlite® XAD 7 (Rohm and Haas, USA), на Amberchrom® CG (Toso Haas, Philadelphia, USA), или на аналогичных смолах. Разделение может осуществляться в широком интервале рН. Интервал рН предпочтительно составляет от 1 до 9, более предпочтительно от 2 до 8. Подходящими являются также многочисленные подложки с обращенной фазой, например RP8 и RP18, такие как описаны в общем в контексте высокоэффективной жидкостной хроматографии (ВЭЖХ). Следующая возможность очистки соединения в соответствии с изобретением состоит в использовании так называемых "хроматографических подложек с нормальной фазой", таких как силикагель или Al2O3 (окись алюминия), или другие, способом, известным per se. Для этого подходящими являются многие элюенты, такие как дихлорметан, хлороформ, метанол, этилацетат, ацетон, петролейный эфир, или их сочетания. рН можно варьировать, например, добавлением триэтиламина. Альтернативный способ выделения амикомицина заключается в использовании молекулярных сит, таких как Fractogel® TSK HW-40, Sephadex® LH-20 и другие, способом, известным per se. Кроме того, амикомицин можно также выделить из сырого материала с помощью кристаллизации. Для этого подходящими являются, например, органические растворители и их смеси, безводные или с добавлением воды.
Дополнительный способ выделения и очистки соединения в соответствии с изобретением включает применение анионообменников, предпочтительно в интервале рН от 7 до 10, и катионообменников, предпочтительно в интервале рН от 3 до 7. Особенно подходящим для данной цели является использование буферных растворов, к которым добавлены некоторые количества органических растворителей.
Возможным способом очистки дополнительно является противоточная хроматография с использованием двухфазной системы элюента, состоящей из двух и более растворителей, таких как вода, метанол, этанол, бутанол, изопропанол, ацетон, дихлорметан, этилацетат или петролейный эфир.
Амикомицин или его химические производные могут быть превращены в соответствующие фармакологически приемлемые соли способами, известными специалистам в данной области.
Фармакологически приемлемыми солями соединений согласно изобретению являются неорганические или органические соли, такие как описаны в Remington's Pharmaceutical Sciences (17. Edition, page 1418 (1985)). Возможными солями являются соли щелочных металлов, соли аммония, соли щелочноземельных металлов, соли с физиологически приемлемыми аминами и соли с неорганическими или органическими кислотами, такими как HCl, HBr, H2SO4, малеиновая кислота и фумаровая кислота.
Очевидными химическими эквивалентами соединений изобретения являются соединения с небольшими химическими различиями, но имеющие такую же или сходную активность, или которые могут превращаться в мягких условиях в соединения согласно изобретению. Примерами очевидных химических эквивалентов являются сложные эфиры, простые эфиры, аминопроизводные, комплексы или аддукты соединений или с соединениями согласно изобретению.
Сложные эфиры могут быть получены, например, взаимодействием амикомицина с карбоновыми кислотами в присутствии реагентов, таких как дициклогексилкарбодиимид (DCC), или обработкой соединения ацилирующим агентом, таким как хлорангидрид кислоты.
Простые эфиры могут быть получены, например, из амикомицина взаимодействием с алкилирующими агентами в основных условиях.
Другие способы получения сложных и простых эфиров описаны в литературе, например, в Advanced Organic Synthesis, 4th Edition, J. March, John Wiley & Sons., 1992.
Химические эквиваленты могут представлять собой стабильные комплексы с ионами металлов, например переходных металлов, таких как La3+, Sm3+, Eu3+, Gd3+, которые являются типичными для производных тетрамовой кислоты и могут быть получены способами, описанными в литературе (К. Tanaka et al., Chem. Pham. Bull. 1979, 27, 1901. К. Matsuo, Chem. Pharm. Bull. 1980, 28, 2494).
Двойные связи алкильной боковой цепи могут восстанавливаться способами, описанными в литературе, например, в Р. N. Rylander, "Hydrogenation Methods", Academic Press, New York (1985), Chpt. 2, или гидрогалогенироваться способами, описанными Н. О. House в "Modern Synthetic Reactions", W. A. Benjymin, Inc., New York (1972), pp.446-452. Гидроксилированные производные могут быть получены взаимодействием двойных связей с такими реагентами, как OsO4, как описано в литературе, например в Chem. Rev. 1980, 80, 187.
Производные могут также получаться с помощью превращения двойных связей в эпоксидные окислением, например, с применением МСРВА, как описано в Advanced Organic Synthesis, 4th Edition, J. March, John Wiley & Sons., 1992.
Амикомицин согласно изобретению имеет следующие физико-химические, а также спектроскопические характеристики:
Внешний вид: бесцветное твердое вещество, растворимое в метаноле, ДМСО, пиридине.
Молекулярная формула: C65H115NO18.
ВЭЖХ (высокоэффективная жидкостная хроматография):
Колонка: Purospher Star RP.18e (Merck), 55×4 мм, 3 мкм
Элюент: CH3CN/0,01% Н3PO4 (85%)
| Градиент: | Время (мин) | % СН3CN |
| 0,00 | 5,0 | |
| 3,00 | 95,0 | |
| 5,00 | 95,0 | |
| 6,00 | 5,0 | |
| 10,00 | 5,0 |
Скорость: 2 мл/мин
Температура: 40°С
Детектирование: 210 нм, 254, 280, 320, 380
tR: 2,67 мин
Молекулярная масса: 1198,64 Da
HR-FAB-MS: 1220,801187 [M+Na]+
1H и 13С-ЯМР: см. таблицу 1
УФ/VIS: МеОН, max(log)=229 нм (3,29), 281 (3,16)
| Таблица 1Химический сдвиг амикомицина в MeOD при 300 К | ||
| 1H | 13С | |
| 1 | 0,86 | 14,76 |
| 2 | 0,97 | 20,83 |
| 3 | 1,89 | 31,20 |
| 4 | 3,41 | 82,20 |
| 5 | 1,70 | 39,55 |
| 6 | 0,77 | 13,63 |
| 7 | 3,54 | 80,19 |
| 8 | 1,65 | 36,32 |
| 9 | 0,86 | 12,71 |
| 10 | 1,43 | 31,20 |
| 11 | 1,44 | 36,46 |
| 12 | 3,75 | 71,98 |
| 13 | 1,62/1,54 | 44,79 |
| 14 | 3,74 | 72,22 |
| 15 | 1,58/1,37 | 36,46 |
| 16 | 1,63/1,14 | 29,27 |
| 17 | 1,51 | 40,69 |
| 18 | 0,90 | 15,70 |
| 19 | 3,70 | 72,90 |
| 27 | 1,51/1,46 | 42,12 |
| 28 | 4,07 | 66,31 |
| 29 | 1,52 | 42,12 |
| 30 | 3,80 | 72,54 |
| 31 | 4,33 | 73,26 |
| 32 | 6,62 | 142,18 |
| 33 | - | 138,47 |
| 34 | 1,83 | 12,75 |
| 35 | - | 206,04 |
| 36 | 4,21 | 41,00 |
| 37 | 1,14 | 17,77 |
| 38 | 5,36 | 128,37 |
| 39 | - | 138,72 |
| 40 | 1,69 | 12,75 |
| 41 | 3,98 | 80,54 |
| 42 | 1,64 | 41,25 |
| 43 | 0,88 | 8,02 |
| 44 | 3,59 | 73,88 |
| 45 | 1,49 | 36,46 |
| 46 | 1,62/1,32 | 23,50 |
| 47 | 1,55/1,32 | 33,34 |
| 48 | 3,80 | 75,09 |
| 49 | 1,74 | 42,71 |
| 50 | 0,77 | 11,92 |
| 51 | 3,41 | 77,87 |
| 52 | 1,61 | 36,46 |
| 53 | 0,86 | 12,75 |
| 54 | 1,55/1,32 | 31,37 |
| 55 | 1,61/1,44 | 36,46 |
| 56 | 3,77 | 71,83 |
| 57 | 1,67 | 44,53 |
| 58 | 3,92 | 71,12 |
| 59 | 2,30 | 37,54 |
| 60 | 5,84 (b) | ˜131,7 (с) |
| 61 | - | (с) |
| 62 | 1,82 | 13,81 |
| 63 | - | (с) |
| 64 | - | (с) |
| 65 | 3,24 (b) | 27,91 |
| 66 | - | (с) |
| 67 | - | (с) |
| 68 | - | (с) |
| 69 | 5,50 (b) | ˜119,3 (с) |
| 70 | 3,09 | 26,52 |
| 71 | 1,10 | 24,31 |
| 72 | 1,10 | 24,31 |
| b) Широкие сигналыc) Данные сигналы невидимы. С60 и С69 могут быть получены только с помощью спектра HMQC. |
Амикомицин имеет чрезвычайно высокую антибактериальную активность, особенно против грам-положительных бактерий, таких как, например, Staphylo- и Enterococcen. Минимальные ингибирующие концентрации Амикомицина против широкого ряда бактерий указаны ниже в таблице 2. В частности, данные штаммы в последнее время становятся все более проблемными, т.е. микроорганизмами, которые становятся устойчивыми к существующим антибиотикам. Превосходство данного соединения по сравнению с другими антибиотиками показано, например, при ингибировании ванкомицин- и тейкопланин-резистентных штаммов, таких как, например, Е.faecalis, E.faecium или Е.gallinarium.
| Таблица 2Минимальная ингибирующая концентрация (мг/л) (испытания с микроразбавлениями) | ||||
| Грам-положительный штамм | Код | Амикомицин | Ванкомицин | |
| S.aureus | 011HT3 | oxa S ery S | 0,08 | 0,3 |
| S.aureus | 011HT18 | ATCC 13709 Smith | 0,08 | 0,3 |
| S.epidermidis | 012G020 | oxa S ery S tet R | 0,3 | 0,6 |
| S.aureus | 011HT1 | nov R | <=0,04 | 0,08 |
| S.aureus | 011DU5 | nov R tet R | 0,08 | 0,15 |
| S.aureus | 011CB20 | oxa R ery Rc tet R | 0,08 | 0,15 |
| S.aureus | 011G071 | ofl S oxa R ery S tet R | 0,15 | 0,6 |
| S.aureus | 011G064 | ofl R oxa R ery Re tet R | 0,3 | 1,2 |
| S. epidermidis | 012G042 | oxa R | 0,3 | 1,2 |
| Staph. coag. Negative | 012HT5 | ofl R oxa R tet R | 0,15 | 0,6 |
| S.aureus | 011GR91 | pri R oxa R ery R nov R | 1,2 | 1,2 |
| S.pyogenes | O2A1SJ1 | van S ery Rc | 0,3 | 0,15 |
| S.pyogenes | O2A1UC1 | van S ery Rc | 0,6 | 0,15 |
| S.pyogenes | O2A1F16 | ery R | 0,6 | 0,08 |
| Strepto gr.G | O2GOCB2 | tet R rif R nov R | 0,6 | 0,15 |
| S.pneumoniae | 030B12 | ery R | 0,15 | 0,15 |
| S.milleri | 02milGR12 | ery S van S | 1,2 | 0,3 |
| S.mitis | 02mitGR16 | ery Ri van S | 1,2 | 0,3 |
| E.faecium | 02D3AP9 | nov S van R ery S tei R | 0,6 | >40 |
| E.faecium | 02D3HT12 | tei R van R ery R tet R | 0,6 | >40 |
| Е.faecium. | O2D31P2 | tei R van R ery R tet R | не опр. | >40 |
| E.faecium | O2D3HM3 | nov S van A ery R tei R | 1,2 | >40 |
| E.gallinarium | O2DOHM8 | van С tet R ery S | 1,2 | >40 |
| E.faecalis | O2D2HM9 | nov R van В ery R tei S | 2,5 | >40 |
| E.faecalis | O2D2UC5 | ATCC 29212 nov R | 2,5 | 2,5 |
| E.faecalis | O2D2DU18 | tet R nov R | 1,2 | 0,3 |
| E.faecalis | O2D2HT10 | nov R van S tet R | 1,2 | 0,6 |
| Грам-отрицательный штамм | Код | |||
| E.coli | DB102501P5 | ery S fuc S nov S | не опр. | >40 |
| P.aeruginosa | 1771391НТ2 | >40 | >40 | |
| P.aeruginosa | 1771m391HT3 | мутант пермессивный | >40 | >40 |
Амикомицин и его фармацевтически приемлемые соли и производные могут быть введены животным, предпочтительно млекопитающим, в частности людям, в виде фармацевтических средств самих по себе, в смеси друг с другом и в виде фармацевтических композиций, позволяющих вводить их парентерально или иными способами. Соответственно, настоящее изобретение также относится к амикомицину и его фармацевтически приемлемым солям и производным для применения их в качестве фармацевтических средств, и к применению амикомицина и его фармацевтически приемлемых солей и производных для получения лекарственных средств, обладающих антибактериальной активностью. Настоящее изобретение также относится к фармацевтическим композициям, содержащим эффективное количество амикомицина и/или одну или несколько его фармацевтически приемлемых солей, и/или производных вместе с фармацевтически приемлемым носителем.
Амикомицин может вводиться энтерально (перорально), парентерально (внутривенно или внутримышечно), ректально или локально (местное введение). Фармацевтические композиции, содержащие амикомицин или его фармацевтически приемлемую соль или производное с другими фармацевтически активными веществами, могут быть получены смешением активных соединений с одним или несколькими фармакологически переносимыми вспомогательными средствами и/или эксципиентами и превращением смеси в подходящую фармацевтическую форму, такую как растворы, порошки (таблетки, капсулы, включая микрокапсулы), мази (кремы или гели), липосомные препараты, липидные комплексы, коллоидальные дисперсии или суппозитории, подходящие для введения.
Возможными вспомогательными средствами и/или эксципиентами для готовых форм данного типа являются обычные фармацевтические жидкие или твердые наполнители и экстендеры, растворители, эмульгаторы, смазывающие агенты, вкусовые корригенты, красители и/или буферные вещества.
Как принято, галеновые готовые формы и способ введения, а также интервал доз, подходящих для конкретного случая, зависят от вида, против которого направлено лечение, и от тяжести соответствующего состояния или заболевания, и могут оптимизироваться с применением способов, известных в данной области. В качестве примера подходящей может быть доза 0,001-10 мг, предпочтительно 0,1-5 мг, более предпочтительно 1,0 мг, для массы тела приблизительно 75 кг. Доза должна быть, по крайней мере, достаточной для достижения желаемого эффекта.
Следующие примеры иллюстрируют настоящее изобретение, но не ограничивают его объем.
Пример 1
Получение посевного материала
100 мл питательного раствора (4 г/л дрожжевого экстракта, 15 г/л растворимого крахмала, 1 г/л К2HPO4, 0,5 г/л MgSO4×7Н2О, дополненные водой до 1000 мл, рН 7,0 до стерилизации) в стерильной колбе Эрленмейера инокулируют штаммом Amycolatopsis sp.(DSM 12216) и инкубируют в течение 5 дней при 28°С и 180 об./мин на роторной качалке. 1,5 мл данной культуры впоследствии разбавляют 1,5 мл 99% глицерина и хранят при 20°С.
Пример 2
Получение культуры или предкультуры Amycolatopsis sp., ST101170 (DSM 12216) в колбах Эрленмейера
Стерильную колбу Эрленмейера, содержащую 100 мл следующей питательной среды: 10 г/л раствора крахмала, 10 г/л глюкозы, 10 г/л глицерина 99%, 2,5 г/л кукурузного экстракта или жидкости, 5 г/л пептона, 2 г/л дрожжевого экстракта, 1 г/л NaCl и 3 г/л СаСО3, инокулируют полной петлей выращенной культуры (такой же питательный раствор, но с 2% агара) или 1 мл глицериновой культуры (см. пример 1) и инкубируют в шейкере при 180 об./мин и 28°C. Максимальное продуцирование соединения амикомицин достигается через 72 часа.
72-Часовой погруженной культуры (полученной в соответствии с описанным способом для шейкерной культуры, пример 1, но со следующей средой: 15 г/л глюкозы, 15 г/л соевой муки, 3 г/л СаСО3 и 5 г/л NaCl, pH 7,5) достаточно для инокуляции 10 и 200-л ферментеров с инокуляционным количеством 10%.
Пример 3
Получение соединения амикомицин
200-л ферментер эксплуатировался со следующими параметрами:
| Питательная среда: | 10 г/л крахмала |
| 10 г/л глюкозы | |
| 10 г/л глицерина 99% | |
| 2,5 г/л кукурузного экстракта | |
| 5 г/л пептона | |
| 2 г/л дрожжевого экстракта | |
| 7 г/л NaCl | |
| 3 г/л СаСО3 | |
| pH 7,2 (перед стерилизацией) | |
| Инокулюм: | 10% объема ферментера |
| Время инкубации: | 60-80 часов |
| Температура инкубации: | 28°С |
| Перемешивание: | 50 об./мин |
| Аэрация: | 150 л/мин |
Добавлением 1-2 мл этанольного раствора полиола можно ограничить образование пены. Максимальное продуцирование достигается через 69 часов.
Пример 4
Выделение соединения амикомицин
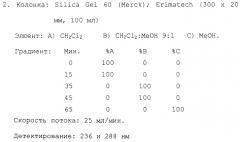
200 л раствора культуры, полученного в примере 3, центрифугируют и мицелий полностью экстрагируют метанолом. Метанольный экстракт концентрируют до соотношения приблизительно 1:10, получая бесцветный осадок, который отфильтровывают. Данную процедуру повторяют до тех пор, пока в фильтрате больше не будет обнаруживаться амикомицин (ВЭЖХ). Остаток лиофилизуют, а затем очищают с помощью ВЭЖХ:
1. Колонка: ®Fractogel TSK-HW 40 (4 л, 500×100 мм)
Элюент: МеОН
Скорость потока: 20 мл/мин
Детектирование: 204 и 236 нм
Фракции, обогащенные амикомицином, элюируются через 125 минут. Фракции сливают вместе на основании ВЭЖХ (указанные выше условия). Активные объединенные фракции с желаемым соединением концентрируют в вакууме и лиофилизуют.
Активное соединение амикомицин элюируется через 42 минуты. Фракции объединяют на основании ВЭЖХ (указанные выше условия). Активные объединенные фракции с желаемым соединением концентрируют в вакууме и лиофилизуют.
3. Колонка: ®Fractogel TSK-HW 40 (1 л, 500×50 мм)
Элюент: МеОН
Скорость потока: 5 мл/мин
Детектирование: 204 и 236 нм
Активный компонент амикомицин элюируется через 112 минут.
В соответствии с описанным выше процессом из 200 л ферментационного бульона может быть выделено 110 мг амикомицина.
1. Амикомицин формулы
и его фармацевтически приемлемые соли, сложные эфиры, простые эфиры и другие очевидные химические эквиваленты во всех их стереоизомерных и таутомерных формах.
2. Соединение по п.1, отличающееся тем, что используется в качестве фармацевтического средства.
3. Соединение по п.1, отличающееся тем, что используется в качестве антибиотика.
4. Амикомицин молекулярной формулы C65H115NO18, обладающий противомикробной активностью, полученный культивированием микроорганизма Amycolatopsis species, ST101170 (DSM 12216) в аэробных условиях в питательной среде, содержащей источники углерода и азота, с последующим выделением и очисткой обычным способом, и его фармацевтически приемлемые соли и производные во всех их стереоизомерных и таутомерных формах.
5. Способ получения соединения по п.1 или 2, включающий культивирование микроорганизма Amycolatopsis species, ST 101170 (DSM 12216) в аэробных условиях в питательной среде, содержащей источники углерода и азота, с последующим выделением и очисткой соединения.
6. Способ по п.5, отличающийся тем, что он включает дополнительную стадию превращения полученного целевого продукта в фармакологически приемлемую соль, сложный эфир, простой эфир и другие очевидные химические эквиваленты, обладающие противомикробной активностью.
7. Фармацевтическая композиция, обладающая противомикробной активностью, включающая эффективное количество соединения по п.1 или 2, и/или его фармацевтически приемлемой соли, сложного эфира, простого эфира или другого очевидного химического эквивалента, и фармацевтически приемлемый носитель.