Низкомолекулярные производные пептидов как ингибиторы взаимодействия ламинина/нидогена
Иллюстрации
Показать всеОбъектом настоящего изобретения являются низкомолекулярные производные пептидов, которые способны действовать как ингибиторы взаимодействия между ламинином и нидогеном (взаимодействия ламинин/нидоген), способ их получения, приготовленные на их основе фармацевтические композиции и их использование для получения фармацевтических средств и для идентификации ингибиторов взаимодействия ламинин/нидоген. 3 н. и 2 з.п.ф-лы, 12 ил.
Реферат
Объектом настоящего изобретения являются низкомолекулярные производные пептидов, которые способны действовать как ингибиторы взаимодействия между ламинином и нидогеном (ламинин/нидоген взаимодействие), способ их получения, приготовленные на их основе фармацевтические композиции и их использование для изготовления фармацевтических препаратов и для идентификации ингибиторов взаимодействия ламинина/нидогена.
Ассоциация ламинина (гликопротеин размером 80 кДа) и нидогена (гликопротеин размером 1-60 кДа) рассматривается как важнейший биомолекулярный механизм, участвующий в синтезе и стабилизации базальных мембран (Mayer, U. и Timpl, R., 1994, Extracellular Matrix Assembly and Structure (P.D. Yurchenco, D. Birk и R.P. Mecham, Ed.), 389-416, Academic Press, Orlando, FL). Способность нидогена образовывать трехкомпонентные комплексы со всеми основными ингредиентами базальной мембраны, такими как, например, изоформы, содержащие γ1-ламинин (информацию по номенклатуре см.: Burgeson, R.E., Chiquet, M., Deutzmann, R., Ekblom, P., Engel, J., Kleinmann, H., Martin, G.R., Meneguzzi, G., Paulsson, M., Sanes, J., Timpl, R., Tryggvasson, K., Yamada, Y., Yurchenco, P.D., 1994, Matrix Biology, 14, 209-211), коллаген IV, перлекан и фибулин, а также ассоциированные структуры, образованные на основе каждой из них, означает, что он выполняет функции линкера, который соединяет, пространственно организует и стабилизирует независимо действующие макромолекулы (Fox, J.W., Mayer, U., Nischt, R., Aumailley, M., Reinhardt, D., Wiedemann, H., Mann, K., Timpl, R., Krieg, Т., Engel, J. и Chu, M.-L., 1991, EMBO J., 10, 3137-3146).
Базальные мембраны представляют собой высокоспециализированные внеклеточные структуры, с которыми связывают реализацию важных функций в контроле клеточной и тканевой активности, структуры тканей, клеточного роста, клеточной трансформации, миграции клеток и тканеспецифичной экспрессии генов (Adams, J.C. и Watt, F.M., 1993, Development, 117, 1183-1198). Эксперименты, проведенные с использованием моноклональных антител против ламинина, предоставили очевидные доказательства центральной роли взаимодействия ламинина/нидогена в процессе синтеза функционирующей базальной мембраны. Указанные антитела получают при иммунизации кроликов ламинином Р1 или полученными рекомбинантными методами нидогенсвязывающим доменом ламинина (γ1 III 3-5). После концентрирования антител с помощью аффинной хроматографии на ламинине Р1 или ламинине γ1 III 3-5 матрицы демонстрируют в тестах на ингибирование полное ингибирование ассоциации типа ламинин/нидоген. Такой эффект основан на стерической блокаде антителами доступа нидогена к ламинину, регионы связывания которых находятся в непосредственной близости от нидоген-связывающей последовательности ламинина (Mayer, U., Nischt, R., Е., Mann, К., Fukuda, К., Gerl, M., Yamada, Y., Timpl, R., 1993, EMBO J., 12, 1879-1885).
В культурах эмбриональных органов указанные антитела ингибируют развитие почечных канальцев, образование легочных альвеол, а также морфогенез слюнных желез у эмбрионов. Все три указанные модели относятся к тем программам онтогенеза, для которых имеет существенное значение беспрепятственный синтез базальной мембраны (Ekblom, P., Ekblom, M., Fecker, L., Klein, G., Zhang, H.-Y., Kadoya, Y., Chu, M.-L., Mayer, U., Timpl, R., 1994, Development, 120, 2003-2014).
Антитела, действующие против γ1 цепи последовательности ламинина в регионе, ответственном за связывание с нидогеном, также способны ингибировать ассоциацию ламинин/нидоген. Однако указанное ингибирование носит конкурентный характер в отличие от действия указанных выше антител против ламинина, поскольку в данном случае они конкурируют непосредственно с нидогеном за сайт связывания на ламинине (WO 98/31709).
Моноклональное антитело из подкласса IgM (против ламинина P1 A6/2/4 - DSM ACC2327, см. WO 98/31709) ингибирует in vitro взаимодействие ламинина/нидогена со значением ИК50, равным 30 нМ. Как и описанный выше препарат поликлональных антител против ламинина, оно препятствует морфогенезу эмбриональных слюнных желез в культуре органов. Этот факт подчеркивает специфичность взаимодействия ламинина/нидогена и важность LE-4 модуля, а также идентифицированной последовательности региона в домене ламинина γ1 III 4 в осуществлении указанного взаимодействия.
Нидоген-связывающий домен ламинина был вполне определенно идентифицирован и охарактеризован с точки зрения его локализации, первичной последовательности и пространственной структуры (проведен рентгеноструктурный анализ кристаллической решетки и ЯМР анализ первичной структуры) (Gerl, M., Mann, К., Aumailley, M., Timpl, R., 1991, Eur. J. Biochem., 202, 167-174; Mayer, U., Nischt, R., Pöschl, E., Mann, K., Fukuda, K., Gerl, M., Yamada, Y., Timpl, R., 1993, EMBO J., 12, 1879-1885; Baumgartner, R., Czisch, M., Mayer, U., Pöschl, E., Huber, R., Timpl, R., Holak, T.A., 1996, J. Mol. Biol., 257, 658-668; Stetefeld, J., Mayer, U., Timpl, R., Huber, R., 1996, J. Mol. Biol., 257, 644-657). Указанный домен расположен в LE-модуле (эпидермальном ростоподобном факторе ламининового типа) короткого плеча γ1 цепи ламинина в домене γ1 III 4. LE-модули представляют собой структурный мотив, состоящий из 50-60 аминокислот с характерной сложной складчатой структурой, аналогичной ЭФР (эпидермального фактора роста), с 4 дисульфидными мостиками (Bairoch, A., 1995, Nomenclature of extracellular domains. The SWISS-PROT Protein sequence data bank release, 310; Engel, J., 1989, FEBS Letters, 251, 1-7).
Высокая аффиность по связыванию нидогена с комплементарным ламининовым доменом была обнаружена для ламинина Р1 из EHS опухоли мыши, для ламинина 2 и ламинина 4 из человеческой плаценты и для ламинина дрозофилы. Причина такого межвидового перекрывания специфичности связывания кроется в чрезвычайно высокой идентичности последовательностей γ1 III 4 домена в отношении исследованных видов. Она составляет 97% для последовательностей человека и мыши, 61% - для мыши и дрозофилы и, как ни странно, 51% - между мышью и Caenorhabditis elegans, относительно всего домена (Pikkarinen, Т., Kallunki, Т., Tryggvasson, К., 1987, J. Biol. Chem., 263, 6751-6758; Chi, H.-C., Hui, C.-F., 1989, J. Biol. Chem., 264, 1543-1550; Wilson, R. et al., 1994, Nature, 368, 32-38; Pöschl, E., Mayer, U., Stetefeld, J., Baumgartner, R., Holak, T.A., Huber, R., Timpl, R., 1996, EMBO J., 15, 5154-5159).
Исследования выявили не только наличие зависимости процесса связывания нидогена от интактной трехмерной структуры, но также привели к идентификации четко установленных последовательностей регионов, расположенных в стабилизированных с помощью S-S связей петлях а и с домена γ1 III 4. При этом были определены пять незаменимых аминокислот, четыре из которых расположены внутри участка петли а, состоящего из 7 аминокислот, и одна из них - тирозин - в боковой цепи петли с (Mann, К., Deutzmann, R., Timpl, R., 1988, Eur. J. Biochem., 178, 71-80). Синтетические пептиды, которые могут быть получены на основе соответствующих регионов γ1 III 4 домена и которые способны ингибировать связывание ламинина/нидогена в специфических тестах на связывание, раскрыты в патенте Фокса и Тимпла (J.W. Fox and R. Timpl, патент США No. 5493008).
По всей видимости, для достижения высокой аффиности связывания с сайтом связывания нидогена на молекуле ламинина требуется взаимодействие с тирозином или гистидином на петле (петле с), соседней с действующей связывающей последовательностью. Указанное взаимодействие с ароматическими аминокислотами рассматривается как предварительное условие ингибирования в диапазоне значений ИК50<500 нМ, с учетом размера γ1 III 3-5, равного 3 Да, и на основе известного характера связи структура-функция, который описан в патенте США No. 5493008. Однако до сих пор остается неясным вопрос, взаимодействует ли петля с непосредственно с нидогеном или она лишь участвует в стабилизации подходящей пространственной структуры NIDPNAV последовательности соответствующего региона (Pöschl, Е., Fox, J.W., Block, D., Mayer, U., Timpl, R., 1994, EMBO J., 13, 3741-3747; Baumgartner. R., Czisch, M., Mayer, U., Pöschl, E., Huber, R., Timpl, R., Holak, T.A., 1996, J. Mol. Biol., 257, 658-668; Stetefeld, J., Mayer, U., Timpl, R., Huber, R., 1996, J. Mol. Biol., 257, 644-657).
На взаимодействие типа ламинин/нидоген оказывает сильное воздействие конформационный компонент (Mayer, U., Nischt, R., Pöschl, E., Mann, К., Fukuda, К., Gerl, M., Yamada, Y., Timpl, R., 1993, EMBO J., 12, 1879-1885; Mann, К., Deutzmann, R., Timpl, R., 1988, Eur. J. Biochem., 178, 71-80). Синтетические пептиды, которые могут быть получены на основе нидоген-связывающего сайта ламинина, не способны образовывать дисульфидную связку, такую как присутствует в LE-модулях, но они демонстрируют активность в тестах на ингибирование, которая примерно в 400-10000 раз слабее, чем активность интактного ламинина Р1 или ламинина γ1 III 3-5 (Pöschl, Е., Fox, J.W., Block, D., Mayer, U., Timpl, R., 1994, EMBO J., 13, 3741-3747; J.W. Fox и R. Timpl, патент США No. 5493008). Такое снижение активности выглядит достаточно необычно, поскольку известно, что в водном растворе пептиды могут принимать большое множество различных конформаций и лишь небольшой процент пептидов находится в биологически активной конформации. Наиболее активный пептид из числа описанных к настоящему времени (со значением ИК50, равным 22 нМ) имеет молекулярный вес примерно 2700 Да (т.е. примерно 50% соответствуют LE-модулю). Его структура включает интактную S-S петлю, которая предположительно стабилизирует структуру последовательности из незаменимых аминокислот NIDPNAV в соответствующем регионе (Poschl, E., Fox, J.W., Block, D., Mayer, U., Timpl, R., 1994, EMBO J., 13, 3741-3747; J.W. Fox и R. Timpl, патент США No. 5493008).
Химическая формула последовательности NIDPNAV (Asn-Ile-Asp-Pro-Asn-Ala-Val) имеет следующий вид:
Ингибиторы взаимодействия ламинин/нидоген могут найти применение для изготовления фармацевтических средств, употребляемых при заболеваниях, связанных с повышенным или нежелательным синтезом базальных мембран.
Такие заболевания включают, в частности, все типы диабета, которые сопровождаются утолщением базальных мембран (особенно в почках, глазах, сосудистой системе), фиброз печени, особенно фиброз печени, вызванный алкогольной интоксикацией, который характеризуется синтезом непрерывной базальной мембраны в синусоидах и соответствующей капилляризацией, все фиброзы (хронические или ятрогенные), при которых наблюдается повышенный синтез базальной мембраны или ее компонентов (фиброз почки, легкого, кожи), атеросклероз, при котором имеет место ограничение регуляции липидного метаболизма и которое может быть вызвано в числе других также нарушенной фильтрацией липопротеинов через частично капилляризованные синусоиды печени (патологические изменения в сосудистой системе, наблюдаемые при атеросклерозе, также могут вносить определенный вклад в модификацию состава и структуры базальных мембран сосудов), заболевания, при которых ангиогенез усугубляет тяжесть клинической картины, например при раке, когда для роста опухоли требуется неоваскуляризация, а также диабетическая ретинопатия, ретролентальная фиброплазия, болезни с выраженным воспалительным компонентом (например, ревматоидный артрит, остеоартрит, васкулит), гемангиома, псориаз и многие другие.
Однако использование пептидов, описанных в патенте США 5493008, в качестве лекарственных препаратов ограничено в значительной мере их конформационной гибкостью, нестабильностью в отношении протеаз, плохой биодоступностью и низкой фармакодинамикой (Milner-White, E.J., 1989, Trends Pharmacol, Sci., 10, 70-74; Verber, D.F., Freidinger, R.M., 1985, Trends. Neurosci., 8, 392-396; Hruby, V.J,, 1994, Peptides, Proc. Thirteenth American Symposium (Hodges, R.S., Smith, J.A., Ed.), 3-17, ESCOM, Leiden, Netherlands).
3адачей настоящего изобретения является выявление низкомолекулярных пептидных производных, которые способны специфически взаимодействовать с нидоген-связывающим сайтом на ламинине и таким образом конкурентно ингибировать в низких концентрациях ассоциацию между ламинином и нидогеном.
В этой связи объектом настоящего изобретения является соединение формулы I:
в которой
R1 обозначает группу формулы
или или или
или или
или или
где R4 обозначает -A, -NH2, -NHR, -NR2, А2, -NHR1,
или или
и R5 обозначает -(CH2)1COOA, - (СН2)1CONH2, -(CH2)1NH2 или -(СН2)1-SO3Н,
или
Х обозначает группу, описываемую одной из следующих формул
или или или
или или или
или
где Y обозначает О, S, -N(A)-CO- или -(СН2)r-,
D обозначает (СН2)r, О, S, NH, NR, (CH2)r-O, (CH2)r-S, (CH2)r-NH или (CH2)r-NR и
R2 обозначает -А, -Е-ОН, -Е-СООН или -E-CONH2,
где Е обозначает линейную или разветвленную C1-С10-алкильную цепь, которая может быть не замещена или замещена группами -А, -(СН2)2mОН, -(CH2)m-СООН, -(СН2)m-С(О)NA2 или С5-С10-циклоалкильной группой,
или Е обозначает C5-C10-циклоалкил, который может быть не замещен или замещен группами -А, -(СН2)m-ОН, -(СН2)m-СООН, - (CH2)m-C(О)NA2 или C5-C10-циклоалкильной группой,
и R3 представляет собой группу одной из нижеприведенных формул:
или
или
где R6 обозначает -Н, -СООН, -CONH2, -CONHR, -CONR2, -CH2OH или
или
или
и где R7 обозначает линейную или разветвленную C1-С10-алкильную группу, которая может быть не замещена или замещена группами -А, -(СН2)m-ОН, -(СН2)m-СООН, -(СН2)m-С(О)NA2 или C5-С10-циклоалкильной группой,
или R7 обозначает С5-С10-циклоалкильную группу, которая может быть не замещена или замещена группами -А, -(СН2)m-ОН, -(СН2)m-СООН, -(CH2)m-C(O)NA2 или С5-С10-циклоалкильной группой,
и R обозначает разветвленный или неразветвленный C1-C6-алкил, С2-С6-алкенил, С2-С6-алкинил, С5-С10-циклоалкил, Het или Ar, которые необязательно могут быть замещены одним или более атомами галогена, C1-C6-алкилокси, разветвленной или неразветвленной C1-С6-алкильной, С2-С6-алкенильной, С2-С6-алкинильной или С5-С10-циклоалкильной группами, или -C1-C6-алкил-Het, -C1-C6-алкил-Ar, -О-С1-С6-алкил-Het, -O-C1-С6-алкил-Ar, Het или Ar,
где Het обозначает моноциклическое или бициклическое, 5-10-членное ароматическое или неароматическое кольцо, содержащее 1 или 2 одинаковых или разных гетероатома в качестве членов указанного кольца, выбранных из группы, состоящей из азота, кислорода и серы, которое может быть незамещенным или замещенным одной или более гидрокси- или карбоксигруппами, и где
Ar обозначает моноциклическое или бициклическое 5-10-членное ароматическое кольцо, которое может быть незамещенным или замещенным одной или более гидрокси- или карбоксигруппами, и
Z обозначает (СН2)m, О, S, NH, NR, N-C(O)-R или NSO2R,
А обозначает Н или С1-С4-алкил и
l, m и r обозначают целые числа от 0 до 3,
n и k обозначают целые числа от 1 до 2,
р обозначает целое число от 0 до 1 и
q обозначает целое число от 1 до 3
и все их стереоизомерные формы и их смеси во всех соотношениях, включая все физиологически толерантные соли.
Физиологически толерантные соли включают, например, соли неорганических и органических кислот, например соляной кислоты, серной кислоты, уксусной кислоты, лимонной кислоты или п-толуолсульфоновой кислоты, или соли неорганических и органических оснований, таких как NH4OH, NaOH, KOH, Са(ОН)2, Mg(ОН)2, диэтаноламин или этилендиамин, или соли аминокислот, таких как аргинин, лизин, лизил-лизин или глютаминовая кислота.
В одном предпочтительном варианте реализации настоящее изобретение относится к соединению формулы I, в которой n равно 1.
Еще один предпочтительный вариант реализации относится к соединению формулы I, в которой R в группе Х обозначает Het или Ar, которые могут быть необязательно замещены -C1-C6-алкил-Het, -C1-C6-алкил-Ar, -O-C1-C6-алкил-Het, -O-C1-С6-алкил-Ar, Het или Ar. Более предпочтительно R в группе Х обозначает Het. Например, Het может обозначать:
или
или
или
или
Предпочтительный вариант осуществления настоящего изобретения включает также соединение формулы I, в которой R в группе Х обозначает Ar, который может быть необязательно замещен -C1-С6-алкил-Ar, -O-C1-C6-алкил-Ar или Ar. Предпочтительно R в группе Х обозначает Ar.
Например, Ar может обозначать:
или
или
или
Предпочтительный вариант осуществления настоящего изобретения включает также соединение формулы I, в которой R в группе Х обозначает:
или
В соединении формулы I X предпочтительно обозначает группу следующей формулы:
Предпочтительно Y обозначает -(СН2)r, где r предпочтительно имеет значение 0 или 1 и k предпочтительно имеет значение 1 или 2.
Еще один предпочтительный вариант осуществления настоящего изобретения относится к соединению формулы 1, в которой группа Х имеет следующую формулу:
причем D предпочтительно обозначает -(СН2)r-, где r принимает значение 0 или 1.
Также предпочтительным является вариант осуществления настоящего изобретения, относящийся к соединению формулы I, в которой R1 обозначает группу следующей формулы:
где Z обозначает предпочтительно (СН2)m и m имеет значение 0 или 1. Предпочтительно R5 обозначает -(CH2)1-COOA, где А обозначает предпочтительно Н, или R5 обозначает -(CH2)1-COONH2, где 1 имеет значение 0. Предпочтительно R4 обозначает -NH2 или -А, где А предпочтительно обозначает Н, или предпочтительно R4 обозначает -NHR1, где -NHR1 предпочтительно обозначает:
и где R5 в группе -NHR1 предпочтительно обозначает
и 1 предпочтительно имеет значение 0, или R5 в группе -NHR1 предпочтительно обозначает
и 1 предпочтительно имеет значение 0, или R5 в группе -NHR1 предпочтительно обозначает (CH2)1-NH2, и 1 предпочтительно обозначает 0.
Еще один предпочтительный вариант реализации настоящего изобретения относится к соединению А формулы I, где R1 обозначает группу следующей формулы:
где Z обозначает предпочтительно -(CH2)m- и m предпочтительно имеет значение 1, R4 предпочтительно обозначает -NH2 и R5 предпочтительно обозначает -(CH2)1-COOA, где 1 предпочтительно имеет значение 0, и А обозначает предпочтительно Н.
Еще один предпочтительный вариант реализации настоящего изобретения относится к соединению А формулы I, где R1 обозначает группу следующей формулы:
где R5 предпочтительно обозначает -(СН2)1-COOA, где 1 предпочтительно имеет значение 0, и А обозначает предпочтительно Н.
Еще один предпочтительный вариант реализации настоящего изобретения относится к соединению формулы I, где R2 обозначает А, причем А предпочтительно обозначает группу -СН3, или R2 обозначает группу -Е-СООН, предпочтительно -СН2-СООН, или R2 обозначает группу -Е-ОН, предпочтительно -СН2-ОН.
Еще один предпочтительный вариант реализации настоящего изобретения относится к соединению формулы I, где R3 обозначает группу следующей формулы:
где k предпочтительно обозначает 2.
Еще один предпочтительный вариант реализации настоящего изобретения относится к соединению формулы I, где R3 обозначает группу следующей формулы:
Еще один предпочтительный вариант реализации настоящего изобретения относится к соединению формулы I, где R3 обозначает группу следующей формулы:
где R7 предпочтительно обозначает разветвленную C1-С10-алкильную группу, предпочтительно -СН(СН3)2, -С(СН3)3, -СН(СН3)СН2-СН3 или -СН2-СН(СН3)2 и где R6 предпочтительно обозначает -Н, -СООН, -CONH2, -СН2OH, -CON(СН3)2, или более предпочтительно R6 обозначает:
где q обозначает предпочтительно 2.
Еще один предпочтительный вариант реализации настоящего изобретения относится к соединению формулы I, где R3 обозначает группу следующей формулы:
где R7 предпочтительно обозначает -СН(СН(СН3)2)2 или -СН2С(СН3)3.
Соединения согласно настоящему изобретению являются неприродными (т.е. они не встречаются в природе) низкомолекулярными производными пептидов, которые способны ингибировать взаимодействие ламинин/нидоген в нМ диапазоне концентраций. Неожиданно было обнаружено, что низкомолекулярные структуры оказались способными осуществлять высокоаффинное связывание с сайтами связывания нидогена на молекуле ламинина, обходясь без взаимодействия с тирозином или гистидином из петли (петли с), соседней с действующей связывающей последовательностью.
Еще более неожиданным стало обнаружение того факта, что рассматриваемые в настоящем изобретении низкомолекулярные производные пептидов со значениями молекулярного веса от 550 до 800 Да демонстрируют ингбирование того же порядка, что и наиболее активные из числа известных на настоящий момент пептидов (ИК50 примерно 22 нМ), которые имеют молекулярный вес примерно 2700 Да (т.е. примерно 50% от значения, характерного для LE-модуля) и включают интактную S-S петлю, которая преимущественно стабилизирует структуру необходимого региона с последовательностью NIDPNAV (J.W. Fox и R. Timpl, патент США 5493008).
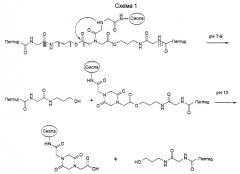
Целевое соединение было получено путем специфического синтеза, на основе знания природы взаимодействия структура/функция и известной по литературным данным трехмерной структуры связывающего нидоген сайта, в виде пептидных производных на смоле, использованной в качестве подложки. Строительные блоки, применявшиеся для пептидного синтеза, варьировали в соответствии с заданными критериями для достижения нужных структурных различий и интеграции неприродных блоков. Для тестирования наличия у получаемых пептидных производных ингибирующей активности и последующего сравнения их между собой был использован чувствительный метод скрининг-анализа, который применялся после отщепления производных от смолы-подложки.
Соединения согласно настоящему изобретению могут использоваться для получения фармацевтических препаратов, применяемых при лечении заболеваний, связанных с повышенным или нежелательным синтезом базальных мембран.
В соответствии с вышесказанным, возможными областями терапевтического применения настоящих пептидных производных и/или их физиологически толерантных солей являются:
1. Все типы поздних осложнений диабета, связанные с утолщением базальных мембран (особенно в почках, глазах, сосудистой системе).
2. Цирроз печени, особенно алкогольный цирроз печени, характеризующийся синтезом непрерывной мембраны в синусоидах и вызванной этим процессом капилляризацией.
3. Все фиброзы (хронические или ятрогенные), при которых может наблюдаться повышенный синтез базальных мембран или их компонентов (почка, легкое, кожа).
4. Атеросклероз, который характеризуется ограниченной регуляцией липидного метаболизма, что может быть вызвано в том числе нарушенной фильтрацией липопротеинов через частично капилляризованные синусоиды печени. К тому же патологические изменения в сосудистой системе, которые могут иметь место при атеросклерозе, также вносят определенный вклад в модификацию состава и структуры базальных мембран сосудов.
5. 3аболевания, при которых ангиогенез способствует ухудшению клинической картины, например в случае рака, когда для роста опухоли требуется неоваскуляризация, в случае диабетической ретинопатии, ретролентальной фиброплазии, болезней с выраженным воспалительным компонентом (например, ревматоидный артрит, остеоартрит, васкулит), гемангиома, псориаз и многие другие.
Таким образом, соединения согласно настоящему изобретению и/или их физиологически толерантные соли могут применяться в качестве фармацевтических средств. В этой связи еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая, по меньшей мере, одно соединение согласно настоящему изобретению и/или его физиологически толерантные соли.
Соединения формулы I и их физиологически толерантные соли и производные могут вводиться согласно настоящему изобретению животным, предпочтительно млекопитающим, в частности людям, для лечения или профилактики. Они могут вводиться per se, в виде смесей друг с другом или в виде фармацевтических препаратов, пригодных для энтерального или парентерального введения, и, будучи активными составляющими, содержат эффективную дозу, по меньшей мере, одного соединения формулы I и/или его физиологически толерантных солей и производных, а также могут объединяться с традиционными фармацевтически безвредными наполнителями и/или добавками.
Указанные фармацевтические препараты могут вводиться системно или местно. Так, например, они могут употребляться в виде пилюль, таблеток, таблеток, покрытых оболочкой, таблеток, покрытых сахарной пленкой, гранул, твердых и мягких желатиновых капсул, порошков, растворов, сиропов, эмульсий, суспензий или других фармацевтических форм. Кроме того, введение может осуществляться внутривагинально или ректально, например, в виде суппозиторий, или парентерально или путем имплантирования, например, в виде растворов для инъекций или для инфузии, микрокапсул или стержневидных форм, и кроме того, введение может быть местным или чрескожным, например, в виде мазей, растворов или настоек, или с использованием любого другого способа, например в виде назального распылителя или аэрозольных смесей, или в виде вдыхаемых препаратов сухих порошков. В случае парентерального введения растворов может быть выбран, например, внутривенный, внутримышечный, подкожный, интраартикулярный, внутрисуставной или другой способ, например путем ингаляции влажных аэрозолей или сухих порошковых препаратов.
Фармацевтические препараты согласно настоящему изобретению получают с помощью известных в технике способов, позволяющих использовать фармацевтически инертные неорганические и/или органические носители в сочетании с соединением(ями) формулы I и/или его/их физиологически толерантными солями и производными. Для получения пилюль, таблеток, таблеток, покрытых сахарной пленкой, и твердых желатиновых капсул могут использоваться, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и др. Функции носителей в случае мягких желатиновых капсул и суппозиториев могут выполнять, например, жиры, воски, полутвердые и жидкие полиолы, полиэтиленгликоли, натуральные или отвержденные масла и др. Приемлемыми наполнителями при изготовлении растворов, например растворов для инъекций, или эмульсий или сиропов могут быть, например, вода, спирты, глицерин, диолы, полиолы, сахароза, инвертный сахар, глюкоза, растительные масла и др. Приемлемые носители для получения микрокапсул, имплантатов или стержневидных форм включают, например, сополимеры гликолевой кислоты и молочной кислоты. В норме фармацевтические препараты содержат примерно от 0,5 до 90 вес.% соединений формулы I и/или их физиологически толерантных солей и производных.
Кроме активных соединений и носителей фармацевтические препараты могут также включать вспомогательные средства или добавки, такие как, например, наполнители, средства, способствующие разложению, связующие вещества, замасливатели, увлажняющие средства, стабилизаторы, эмульгаторы, консерванты, подсластители, красители, вкусовые вещества или ароматизаторы, загустители, разбавители, забуферивающие вещества, растворители или солюбилизирующие агенты, средства для достижения депо-эффекта, соли, воздействующие на осмотическое давление, средства, применяемые для нанесения покрывающей оболочки, или антиоксиданты. Они также могут содержать два или более соединений формулы I и/или их физиологически толерантных солей и производных. Кроме того, указанные препараты могут включать один или более терапевтически или профилактически активных веществ в дополнение, по меньшей мере, к одному соединению формулы I и/или его физиологически толерантным солям и производным. В норме фармацевтические препараты могут содержать от 0,2 до 500 мг, предпочтительно от 1 до 100 мг активного соединения формулы I и/или его физиологически толерантных солей и производных в расчете на дозу.
Если соединения формулы I или содержащие их фармацевтические препараты применяются в виде аэрозолей, например в виде назальных аэрозолей или влажных аэрозолей, или при ингаляции сухого порошка, то указанное введение может осуществляться с помощью распылителя, атомайзера, насосного атомайзера, устройства для ингаляции, ингалятора с отмеряемой дозой или ингалятора для сухого порошка соответственно. Фармацевтические формы, используемые для введения соединений формулы I в виде аэрозоля, могут быть приготовлены с помощью способа, известного на достигнутом уровне техники любому специалисту в данной области. Так, для получения растворов или дисперсий соединений формулы I в воде могут использоваться в смесях вода-спирт или подходящих солевых растворах обычные добавки, например бензиловый спирт или другие подходящие консерванты, усилители абсорбции с целью повышения биодоступности, солюбилизирующие агенты, средства, способствующие диспергированию, и другие, а в случае соответствующих форм - традиционные пропелленты, например хлорфторуглеводороды и/или фторуглеводороды, тогда как порошковые формы препаратов на основе соединений формулы I и/или их физиологически толерантных солей могут быть получены при лиофильной сушке или предпочтительно при распылительном высушивании водных растворов соединений формулы I и/или их физиологически толерантных солей и приемлемых водорастворимых добавок, таких как сахара или производные сахаров и аминокислоты.
Доза соединений формулы I в фармацевтических композициях может варьировать в широких пределах и как обычно определяется лечащим врачом в каждом конкретном случае при учете специфических индивидуальных условий. Так, например, она зависит от природы и тяжести заболевания, которое предстоит лечить, от конкретного используемого соединения, от того, в острой или хронической форме предстоит лечить заболевание или применять препарат с профилактической целью, а также от того, вводятся ли в сочетании с соединением формулы I в составе композиции другие активные соединения. В целом в случае перорального введения подходящей для достижения эффективных результатов у взрослых людей является дневная доза, составляющая примерно от 0,01 до 100 мг/кг, предпочтительно от 0,1 до 10 мг/кг, в частности от 0,3 до 2 мг/кг (в каждом случае имеется в виду доза на кг веса тела). В случае внутривенного введения дневная доза составляет в основном примерно от 0,01 до 50 мг/кг, предпочтительно от 0,01 до 10 мг/кг веса тела. В частности, при введении относительно больших количеств дневная доза может быть разделена на несколько приемов, например на 2, 3 или 4 отдельных введения. В ряде случаев при наличии соответствующих условий может возникнуть потребность повысить или снизить указанную дозировку.
Кроме того, соединения формулы I и их соли согласно настоящему изобретению могут использоваться в качестве промежуточных продуктов для изготовления других соединений, в частности других фармацевтически активных соединений, получаемых из соединений формулы I, например, при соответствующей модификации радикалов или при введении в них нужных групп, например в ходе реакций этерификации, восстановления, окисления или других видов превращения функциональных групп.
Пептидные производные согласно настоящему изобретению могут, с одной стороны, непосредственно использоваться как терапевтическое средство, но могут также представлять собой и основу для создания родственных структур, которые также могут применяться в качестве лекарственного средства при лечении заболеваний, связанных с повышенным или нежелательным синтезом базальных мембран.
Другим объектом настоящего изобретения является способ идентификации соединения, которое способно ингибировать взаимодействие нидогена и ламинина, заключающийся в том, что указанное соединение согласно настоящему изобретению используется как конкурентный ингибитор. Указанный способ может также включать композицию идентифицированного соединения в фармацевтически приемлемой форме.
Объектом настоящего изобретения является также способ получения фармацевтической композиции, предназначенной для идентификации соединения, ингибирующего взаимодействие нидогена и ламинина, заключающийся в том, что соединение согласно настоящему изобретению, используемое как конкурентный ингибитор, и/или его физиологически толерантные соли, смешивают с фармацевтически приемлемым носителем.
Объектом настоящего изобретения является также способ получения соединения формулы I согласно настоящему изобретению.
Соединение формулы I:
согласно настоящему изобретению получают посредством фрагментарной конденсации соединения формулы II:
с соединением формулы III
где переменные R1, X, n, R2 и R3 имеют указанные выше значения, и в этой связи соединения формул II и III могут быть защищены на определенных выше функциональных группах с использованием методов, известных в пептидной химии (см., например, Houben-Weyl, Methoden der Organischen Chemie, vol. 15/1 и 15/2, Georg Thieme Verlag, Stuttgart, 1974). Подходящие методы конденсации хорошо известны в технике (Houben-Weyl, Methoden der Organischen Chemie, vol. 15/1 и 15/2, Georg Thieme Verlag, Stuttgart, 1974). Приемлемые конденсирующие или связывающие реагенты представляют собой, например, карбонилдиимидазолы, карбодиимиды, такие как дициклогексилкарбодиимид или диизопропилкарбодиимид, или О-((циано(этоксикарбонил)-метилен)амино)-N,N,N',N'-тетра-метил-урония тетрафторборат (TOTU) или ангидрид пирофосфорной кислоты (РРА). Реакции конденсации проводят в стандартных условиях. Как правило, при пептидной конденсации возникает, необходимость в защите аминогрупп, которые не участвуют в реакции связывания, с помощью защитных групп, которые затем легко удаляются в условиях, отличных от тех, что применяют для реа