Способ прессования для получения лекарственной формы фенитоина натрия
Иллюстрации
Показать всеИзобретение относится к медицине, конкретно - к способу прессования для получения лекарственной формы фенитоина натрия. Способ прессования в валках и получения фармацевтического состава включает стадии добавления фенитоина натрия в резервуар смесителя и добавление по крайней мере одного эксципиента в указанный резервуар. Смесь смешивают и переносят в валковый уплотнитель, где к смеси фенитоина натрия и эксципиента прикладывают давление. Полученный компакт (брикет) измельчают, получая гранулят, который смешивают второй раз и который является подходящим для дальнейшей переработки в лекарственную форму. Эксципиенты включают стеарат магния, сахар, моногидрат лактозы и тальк, или тальк добавляют непосредственно перед смешением гранулята во второй раз. 3 н. и 12 з.п. ф-лы, 10 табл., 2 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу получения лекарственной формы фенитоина натрия. В частности, настоящее изобретение относится к способу получения перорально вводимых капсул фенитоина натрия с пролонгированным действием.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В области разработки фармацевтических технологий лекарственная форма с пролонгированным действием может быть определена как препарат, который высвобождает лекарственное средство, in vivo, при значительно более медленной скорости, чем это имеет место в случае обычной (непролонгированного действия) лекарственной формы с эквивалентной дозой. Цель использования продукта с пролонгированным действием состоит в том, чтобы получить удовлетворительную реакцию на лекарственное средство, при снижении, в то же самое время, частоты введения и сохранении биоэквивалентности по отношению к существующим составам фенитоина натрия. Примером лекарственного средства, которое широко используют в форме с пролонгированным действием, является хлорфенираминмалеат. В обычной форме лекарственное средство можно назначать в виде 4-мг доз каждые 4 часа или в форме с пролонгированным действием в виде одной дозы 12 мг каждые 12 часов.
Композиции с пролонгированным действием для последовательного или разнесенного по времени высвобождения лекарственных средств известны в данной области. Как правило, такие композиции содержат частицы лекарственного средства, обычно вводимые в разделенных дозах 2 или 3 раза в день, смешанные с или покрытые веществом, которое устойчиво к деградации или дезинтеграции в желудке и/или в кишечнике на протяжении выбранного периода времени. Высвобождение лекарственного средства может происходить путем дренажа, эрозии, разрушения, диффузии или подобных действий, в зависимости от применения вышеупомянутого вещества. В некоторых случаях высвобождение гидрофильного вещества из состава можно замедлить путем применения гидрофобного вещества.
Известно, что различные фармацевтические препараты одного и того же активного компонента могут обладать различной биодоступностью активного компонента в отношении к млекопитающему. Биодоступность или биологическая доступность может быть определена как доля (процент) лекарственного средства, высвобожденного из введенной лекарственной формы, которая становится доступной для проявления биологического действия в организме. Различные составы одного и того же лекарственного средства могут различаться по биодоступности в клинически значимых пределах, и это отклонение может иметь место даже между партиями одного и того же продукта из-за едва уловимых изменений условий процесса производства.
Многие лекарственные средства, которые обычно вводят в форме таблетки или капсулы, имеют низкую растворимость в биологических жидкостях. В отношении многих лекарственных средств с низкой растворимостью имеются очевидные данные, свидетельствующие о том, что скорость растворения частично или полностью влияет на скорость абсорбции. Кроме того, на биодоступность может оказывать влияние ряд факторов, таких как количества и типы используемых адъювантов, способ грануляции, силы сжатия (при получении таблеток), площадь поверхности, доступная для растворения и факторы окружающей среды, такие как движение (содержимого) в желудочно-кишечном тракте и присутствие пищи. Вследствие вышеприведенных многочисленных факторов конкретный состав играет важную роль при получении твердых лекарственных форм с пролонгированным действием. Твердые лекарственные формы с пролонгированным действием могут представлять большой интерес для лечения заболеваний, таких как эпилепсия.
Эпилепсия - древняя болезнь, которая поражает приблизительно 1% населения мира. Несмотря на прогресс, достигнутый в терапии противоэпилептическими лекарственными средствами, все еще имеется много пациентов, которые продолжают страдать от неконтролируемых приступов и токсичности лекарственной терапии. Примерами основных противоэпилептических лекарственных средств, используемых в настоящее время, являются: натриевая соль дивальпроевой кислоты, этосукцимид, натрий фенитоин, карбамазепин и вальпроевая кислота.
Фармакологическая активность в целом и противоэлептическая активность в частности лучше коррелируют с концентрацией лекарственного средства в крови (или в другой биофазе), чем с вводимой дозой. Это явление обусловлено, частично, изменчивостью в абсорбции и распределении лекарственного средства между различными людьми и внутри их организмов, в частности, когда лекарственное средство вводят перорально. Оптимизация лекарственной терапии стремится к достижению и поддержанию терапевтических и безопасных концентраций лекарственного средства в плазме пациента.
Фенитоин, 5,5-дифенил-2,4-имидазолидиндион, представляет собой известное фармацевтическое средство, имеющее противосудорожную и противоэпилептическую активность. Из-за недостаточной растворимости фенитоина в воде для получения инъецируемых растворов лекарственного средства и в твердых лекарственных формах используют фенитоин натрия, который намного лучше растворим в воде.
Фенитоин натрия имеет нижеследующую формулу:
Хотя фенитоин является предпочтительным противоэпилептическим средством для многих типов эпилептических приступов, требуется терапевтический лекарственный мониторинг из-за трудности поддержания эффективного терапевтического уровня лекарственного средства в плазме между 10 мкг/мл и 20 мкг/мл. Помимо проблем, связанных с узкими терапевтическими плазменными уровнями, фенитоин демонстрирует значительные колебания в биодоступности после его перорального введения пациентам из-за своей недостаточной растворимости в воде.
Даже в случае новых подходов к доставке фенитоина (т.е. лекарственные формы Dilantin® Kapseals®, предложенные Parke-Davis, которые представляют собой 100-мг капсулы фенитоина натрия с пролонгированным действием), для пациентов все же остается необходимость принимать лекарственное средство несколько раз в день, чтобы поддерживать эффективный терапевтический плазменный уровень без проявления побочных эффектов. В случае Kapseals® действие in vivo продукта характеризуется медленной и растянутой во времени скоростью абсорбции с пиковыми концентрациями в крови, наблюдаемыми через 4-12 часов.
Несмотря на то что были опробованы многочисленные методики и способы с целью получения надежной лекарственной формы фенитоина, сопоставимой с Dilantin® Kapseals®, не было найдено ни одного, который был бы полностью удовлетворительным. Karakasa et al., Biol. Pharm. Bull., 1994; 17(3):432-436 в статье, озаглавленной "Sustained Release of Phenytoin Following the Oral Administration of Sodium Phenytoin/Ethylcellulose Microcapsules in Human Subjects and Rabbits," описано исследовалние картины (профиля) высвобождения фенитоина в виде натриевой соли в комбинации с этилцеллюлозой. Микрокапсулы с фенитоином натрия получали путем смешения 80 масс.% фенитоина натрия в 10 масс.% растворе этилцеллюлозы в этилацетате. Суспензию перемешивали и в нее по каплям добавляли н-пентан до тех пор, пока не происходило фазовое разделение, и получали микрокапсулы. Микрокапсулы собирали на фильтровальной бумаге, сушили и сохраняли. Karakasa и др. обращают внимание на то, что после перорального введения фенитоина натрия указанная соль могла бы легко трансформироваться в кислых жидкостях желудка в свободный фенитоин. Так как свободный фенитоин практически нерастворим в воде, его абсорбция в желудочно-кишечном тракте могла быть неполной. С другой стороны, при прохождении через желудок объем воды, проникающей в этилцеллюлозные микрокапсулы, мог быть минимальным. Таким образом, бульшая часть фенитоина натрия в микрокапсулах не могла превратиться в свободный фенитоин.
В обзорной статье Boxenbaum в Drug Development & Industrial Pharmacy, 1982; 8(v):1-25, озаглавленной "Physiological and Phamacokinetic Factors Affecting Performance of Sustained Release Dosage Forms", фактически утверждается, что составы с пролонгированным высвобождением для таких лекарственных средств, как фенитоин, не являются необходимыми. Boxenbaum отмечает, что схемы приема лекарственного средства один раз в день по сравнению со схемой приема 3 раза ежедневно дают аналогичные плазменные кривые. Это является результатом как медленной абсорбции, так и низкой растворимости лекарственного средства.
Желательная цель - фенитоин с медленным высвобождением, замедленным (отсроченным) высвобождением, продленным (пролонгированным) высвобождением или продолжительным (непрерывным) высвобождением. Пероральные лекарственные формы с контролируемым высвобождением лекарственных средств с длительным полупериодом существования, таких как фенитоин, для состава с пролонгированным действием игнорировались, поскольку они дают небольшое изменение концентрации в крови после введения многократных доз. Существование вышеупомянутых продуктов может быть, однако, оправдано, исходя из их способности минимизировать токсичность и проявление побочных реакций, а также того, что они обеспечивают большее удобство для пациентов и, тем самым, пользуются большим предпочтением у пациентов.
В публикации Bourgeois, озаглавленной "Important Pharmacokinetic Properties of Antiepileptic Drugs" in Epilepsia, 1995;36 (Supp.5), обсуждаются важные фармакокинетические свойства противоэпилептических лекарственных средств. Автор утверждает, что профиль степени абсорбции лекарственного средства описывается константой его абсорбции (Кабс). Высокое значение константы абсорбции приводит к ранним и высоким пикам сывороточных концентраций. Высокое значение (Кабс) также приводит к более сильным флуктуациям уровня лекарственного средства по сравнению с более устойчивыми концентрациями, являющимися следствием более низких значений (Кабс). Более низкое значение константы абсорбции может часто получаться при формулировании иным путем быстро абсорбируемого лекарственного средства в препарат с медленным высвобождением. Однако использование препаратов с энтеросолюбильным покрытием как части способа получения лекарственной формы не изменяет значение (Кабс) лекарственного средства, они лишь замедляют абсорбцию. Энтеросолюбильное покрытие предназначено для того, чтобы предотвратить абсорбцию в кислой среде желудка. Рассмотрим, например, пациента, который получил разовую дозу вальпроата, покрытого энтеросолюбильной оболочкой. В течение первых нескольких часов после приема дозы сывороточные измерения не обнаружат лекарственного средства в крови. Только когда таблетка достигнет щелочной среды двенадцатиперстной кишки, сывороточная концентрация начнет быстро увеличиваться, в конечном счете достигая профиля, аналогичного профилю препарата вальпроата без покрытия. Следовательно, энтеросолюбильное покрытие лишь сдвигает профиль (кривой) концентрация-время вправо.
Из обзора предшествующего уровня техники очевидно, что все еще остается потребность в разработке способа, который мог бы легко и надежно обеспечить получение лекарственной формы с пролонгированным действием для лекарственных средств с растворимостями, зависимыми от рН, таких как фенитоин натрия, такую форму, которая обеспечивает начальные терапевтические уровни лекарственного средства и замедляет высвобождение другой части лекарственного средства, чтобы исключить избыточные концентрации на протяжении периода времени приблизительно от 1 до 5 часов. Способы согласно настоящему изобретению являются полезными для получения лекарственной формы фенитоина натрия, которая имеет, по существу, подходящий профиль растворения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение реализует неудовлетворенные потребности, изложенные выше, путем обеспечения способа легкого получения состава, который имеет заданное соотношение требуемой дозы. В тех случаях, когда фенитоин натрия представляет собой активный фармацевтический компонент, состав демонстрирует биоэквивалентность по отношению к лекарственным формам Dilantin® Kapseals®. Конкретно, настоящее изобретение включает использование способа прессования в валках для получения твердых гранул, которые после инкапсулирования дают предсказуемый профиль растворения. В частности, настоящее изобретение включает использование способа прессования в валках, чтобы получить твердые гранулы, которые после инкапсулирования дают в основном постоянный профиль растворения среди разных лотов смесей дозированного состава, включающих исходный шипучий фенитоин натрия. Кроме того, способ обеспечивает надежный и стойкий продукт фенитоина натрия. Следовательно, обычное применение такого способа обеспечивает надежный способ получения лекарственных форм фенитоина натрия, а также гарантирует подходящие эксплуатационные характеристики продукта.
В общем настоящее изобретение обеспечивает способ получения фармацевтического продукта. Способ включает стадии добавления фенитоина натрия в емкость или резервуар смесителя и добавление по крайней мере одного эксципиента в резервуар. Затем смесь перемешивают с получением смеси. Полученную смесь переносят в валковый уплотнитель и прессуют между по крайней мере двумя валками, получая брикет с эксципиентом. Давление, прикладываемое к смеси, улучшает физическую адгезию между фенитоином и эксципиентом. Затем брикет измельчают с образованием гранулята. Затем полученный гранулят подвергают формованию в желаемую лекарственную форму, такую как капсулы.
В одном варианте осуществления изобретения способ включает стадии добавления фенитоина натрия в резервуар смесителя; добавления эксципиента в резервуар; смешения фенитоина натрия и наполнителя с получением первой смеси; прессования первой смеси между по крайней мере двумя валками силой, достаточной для того, чтобы вызвать дробление части фенитоина натрия и образование брикета, где первая смесь подвергается обработке валками с усилием от 1 и 20 килоньютонов (кН, kN), валки вращаются при этом со скоростью между 1 и 20 об/мин, и где наружные поверхности (кромки) вышеупомянутых валков фиксированы в положении их максимального сближения на расстоянии между 0,5 мм и 5 мм друг от друга; измельчения брикета с образованием гранулята; смешения гранулята с получением второй смеси.
В другом варианте осуществления изобретения усилие валков, прикладываемое к первой смеси, составляет 2,5 кН, валки при этом вращаются со скоростью 10 об/мин, и рабочий зазор между валками составляет 3 мм.
В другом варианте осуществления эксципиенты включают стеарат магния, сахар и моногидрат лактозы, и способ включает стадию смешения талька с гранулятом фенитоина натрия. Альтернативно, тальк может быть включен в качестве одного из эксципиентов, первоначально смешиваемых с фенитоином натрия в резервуаре.
Далее, пациенты извлекут пользу от такого состава, поскольку многие лекарственные средства, подобные фенитоину натрия, имеют узкие терапевтические окна, которые обычно требуют многократных (три или больше) ежедневных приемов.
Необходимо иметь в виду, что как предшествующее описание, так и нижеследующее подробное описание являются иллюстративными, но не являются ограничительными для объема изобретения.
Изобретение наилучшим образом понимается при рассмотрении нижеследующего подробного описания в сочетании с прилагаемыми ниже чертежами, в которых:
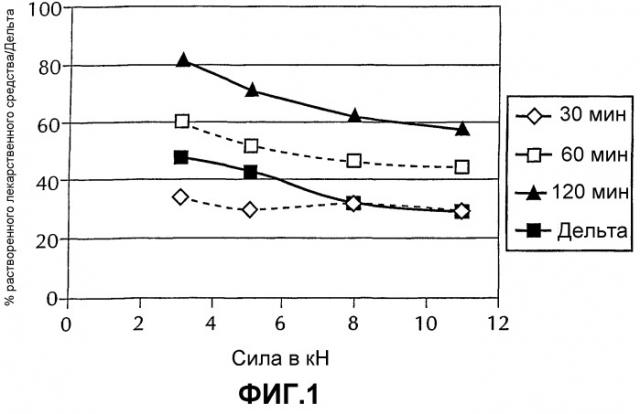
Фиг.1 представляет графическое изображение, демонстрирующее растворение смеси, полученной по способу согласно настоящему изобретению при различных силах сжатия, с использованием одних и тех же значений величины зазора между валками и частоты вращения валков.
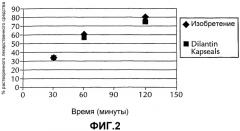
Фиг.2 представляет графическое изображение, демонстрирующее профиль растворения двух составов фенитоина натрия, полученных по способу согласно настоящему изобретению, по сравнению с профилем растворения лекарственной формы Dilantin® Kapseals®.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение включает способ валкового прессования, который применяют к смеси активного фармацевтического компонента и одного или нескольких эксципиентов, для получения гранул с соответствующими характеристиками. В частности, настоящее изобретение представляет способ получения гранул активного фармацевтического компонента - фенитоина натрия.
Способ согласно настоящему изобретению включает использование устройства для прессования в валках, имеющее возможность регулирования частоты вращения валков, величины усилия валков и рабочего зазора между валками. Система прессования сухих материалов в валках типа Gerteis Polygran, имеющая 100-мм рифленые (накатанные) валки, выпускаемая Gerteis (Германия), является предпочтительным устройством для прессования в валках, поскольку программируемые логические системы управления вышеупомянутого валкового уплотнителя относительно просты в эксплуатации.
Валковый уплотнитель функционирует путем равномерного приложения давления к смешанной порошковой смеси, пропуская смесь между двумя вращающимися в противоположном направлении валками. Давление, передаваемое на смесь валками, прессует порошок в брикет, такой как лист или лента, который обычно измельчают, получая гранулы.
Способ согласно настоящему изобретению относится к открытию, согласно которому некоторые терапевтические средства, такие как фенитоин натрия, могут быть сформулированы и переработаны с получением лекарственной формы, обеспечивающей пролонгированные концентрации активного фармацевтического средства в плазме крови. Специалистам в данной области очевидно, что эффективные количества высвобождаются на протяжении заданного времени, обеспечивая желаемую концентрацию в плазме крови.
Было установлено, что регулируемое приложение давления к смеси активного фармацевтического компонента и по крайней мере одного эксципиента при прессовании в валках дает продукт, который, помимо того, что его относительно легко получить, демонстрирует свойства пролонгированного высвобождения воспроизводимым способом. Кроме того, в случае фенитоина натрия, продукт оказывается биоэквивалентным коммерческому Dilantin® Kapseals®. В частности, можно считать, что при прессовании в валках смеси, получаемой в соответствии с настоящим изобретением, компоненты входят в состояние тесного контакта, принудительного перемешивания и адгезии. Частицы претерпевают перегруппировку, и, предположительно, дробление частиц порождает многочисленные участки поверхности, точки контакта и участки связывания между активным фармацевтическим компонентом и эксципиентом. Повышение контакта между активным фармацевтическим компонентом и эксципиентом непосредственно оказывает влияние на характеристики растворения активного фармацевтического компонента. Другими словами, можно считать, что один или несколько эксципиентов образуют покрытие, ингибирующее растворение лекарственного средства, вокруг активного фармацевтического компонента после воздействия давления, сообщаемого валковым уплотнителем. Этот подход обеспечивает возможность разработки воспроизводимого способа получения лекарственных форм фенитоина натрия.
В частности, настоящее изобретение включает использование способа прессования в валках для получения твердых гранул, которые после инкапсулирования дают в основном одинаковый профиль растворения для различных лотов смесей дозированного состава, включающих один и тот же исходный сыпучий фенитоин натрия.
Подразумевается, что термин "в основном одинаковый" профиль растворения означает, что различие в растворении, выраженном в процентах, любых двух партий состава одного и того же сыпучего фенитоина натрия составляет не более 15% при измерении в одинаковых условиях (например, температура и время) известными методами в данной области, включая методы, иллюстрируемые здесь. Более предпочтительно, это различие составляет от 10% до 15%, еще более предпочтительно от 5 до 10%, и еще более предпочтительно от 2 до 5%; наиболее предпочтительно от 0% до 2%.
Для достижения цели настоящего изобретения активный фармацевтический компонент помещают в резервуар смесителя, такого как смеситель с двойным корпусом типа Patterson-Kelley®. Предпочтительно, активным фармацевтическим компонентом является фенитоин натрия. Если не оговорено особо, процентные содержания компонентов будут выражены в масс.%. Как правило, активный фармацевтический компонент присутствует в количестве приблизительно от 25% до 75% от общей массы конечной дозированной формы. Предпочтительно, в резервуар добавляют от 35% до 50%.
Затем эксципиенты, такие как наполнители и смазывающие вещества, помещают в резервуар смесителя с активным фармацевтическим компонентом, хотя порядок добавления не является важным и может быть обратным. К смеси могут быть добавлены разнообразные смазывающие вещества, общеизвестные в данной области, такие как стеариновая кислота и стеарат магния. Смазывающее вещество может быть добавлено в количествах от около 1% до около 10% от общей массы смеси, предпочтительно от 2% до 5%.
Кроме того, настоящее изобретение может содержать по крайней мере один наполнитель в качестве эксципиента. Подходящие наполнители известны в данной области и обычно включают микрокристаллическую целлюлозу, сорбит, маннит, сахарную глазурь, прессуемый сахар, глюкозу, моногидрат лактозы и тальк. Предпочтительно, сахарную глазурь, моногидрат глюкозы, прессуемый сахар или их комбинацию добавляют в количестве приблизительно от 25% до 75% от общей массы смеси. Тальк может быть добавлен в количестве приблизительно от 0,5% до 5% от общей массы смеси. Несмотря на то что тальк может быть добавлен в резервуар смесителя с другими наполнителями, альтернативно тальк может быть добавлен к смеси непосредственно перед дополнительной стадией смешения, как описано ниже. Предпочтительно, один или несколько компонентов, перед их добавлением в резервуар, сначала очищают, например, пропуская компоненты через сито. В тех случаях когда смеситель, используемый в способах изобретения, представляет собой смеситель с двойным корпусом, вышеуказанный смеситель необязательно включает интенсифицирующий стержень. Под "интенсифицирующим стержнем" подразумевается стержень, содержащий лопасти, которые вращаются в направлении, противоположном направлению вращения двойного корпуса. Использование таких стержней для улучшения перемешивания в слое порошка, общеизвестно в данной области.
После добавления всех компонентов в резервуар, смеситель приводят в действие и смесь перемешивают в резервуаре смесителя. Один такой смеситель вышеописанного типа, который может быть использован в настоящем изобретении, представляет собой смеситель Patterson-Kelley®. Порошковую смесь помещают в смеситель и перемешивают в течение от около 10 до 60 минут при частоте вращения от около 5 до 30 об/мин.
Затем полученную смесь переносят в валковый уплотнитель известным способом. Затем устанавливают скорость вращения валков, величину зазора между валками и силу сжатия и смесь подают сквозь валковый уплотнитель известным способом. В частности, в способе согласно настоящему изобретению прессуют смесь фенитоина натрия и эксципиентов в брикеты, прилагая оптимальное усилие для того, чтобы получить брикет. Можно подобрать предпочтительную силу сжатия и другие условия, чтобы обеспечить достаточную адгезию между компонентами, которая позволит реализовать подходящий профиль растворения. Специалист в данной области может установить вышеуказанные факторы эмпирически. Что касается валкового уплотнителя Gerteis, оптимальная величина усилия обычно находится между 1 и 20 кН. Для такого типа уплотнителя оптимальная величина усилия находится предпочтительно между 2 и 6 кН, еще более предпочтительно составляет 2,5 кН.
Для поддержания постоянного выхода вещества из валкового уплотнителя валки вращают со скоростью от 1 до 20 об/мин. Предпочтительно валки вращают со скоростью от 5 до 15 об/мин. Кроме того, наружные поверхности валков фиксируют на расстоянии между 0,5 мм и 5 мм друг от друга, причем наружные поверхности валков предпочтительно фиксируют в положении их максимального сближения на расстоянии между 2 мм и 4 мм друг от друга. Хотя вариации частоты вращения валков и величины зазора между валками оказывают влияние на профиль растворения фенитоина натрия, усилие валков является наиболее существенным параметром, как описано выше и подробно изложено в Примере 3.
После контакта с противоположно вращающимися валками валкового уплотнителя сжимающая сила, прилагаемая к смеси валками, превращает порошкообразную смесь в ленту или спрессованный лист. Затем полученный брикет подают на мельницу, обычно вибрационную мельницу, снабженную ситом. Предпочтительно, сито имеет диаметр отверстий между 0,2 мм и 2 мм, наиболее предпочтительно около 1,0 мм. После прохождения через мельницу и сито брикет превращается в гранулят.
После измельчения гранулят переносят в смеситель и перемешивают аналогичным образом, как описано выше, получая вторую смесь. Однако, если тальк не добавлен до операции прессования вместе с другими наполнителями, его можно, в случае необходимости, добавить перед вышеуказанной второй стадией смешения. После того как проведено смешение во второй раз, полученная смесь может быть инкапсулирована известным способом, как, например, с помощью машины для инкапсулирования Hofliger and Karg. Гранулы могут быть заполнены в тело лекарственной формы-капсулы путем утрамбовывания или дозирования, и затем капсула может быть герметизирована с помощью крышечки-колпачка.
Как показано на Фиг.1, усилие играет важную роль в растворении фенитоина натрия. В частности, было установлено, что чем больше по величине усилие, прикладываемое к смеси, подаваемой в валковый уплотнитель, тем ниже степень растворения при постоянных значениях частоты вращения валков и величины зазора между валками. В соответствии с этим, регулируя давление, прикладываемое к смеси активного компонента и эксципиента, подаваемой в валковый уплотнитель, можно воспроизводимо регулировать профиль растворения фенитоина натрия в лекарственной форме. Кроме того, как показано на Фиг.2, лекарственная форма, полученная способом согласно настоящему изобретению, имеет профиль высвобождения, аналогичный профилю высвобождения лекарственных форм Dilantin® Kapseals®.
ПРИМЕР 1
Получают смесь фенитоина натрия и эксципиентов в количествах, представленных в Таблице 1. Смесь перемешивают в течение 10 минут в смесителе Patterson-Kelly®.
| Таблица 1Состав смеси | |
| Компоненты | % от общей массы |
| Натрий фенитоин, USP | 43,5% |
| Стеарат магния, NF | 3,9% |
| Прессуемый сахар, NF | 24,9% |
| Тальк, USP | 2,7% |
| Моногидрат лактозы, NF | 25,0% |
ПРИМЕР 2
Чтобы определить диапазон, при котором усилие играет роль в растворении гранул, полученных способом согласно настоящему изобретению, параметры способа - зазор между валками и частота вращения валков, поддерживают постоянными, как подробно изложено ниже. В Таблица 2 представлены данные растворения порции смеси, описанной в Примере 1, спрессованной при различных усилиях валков. Процент растворенного лекарственного средства определяют, используя стандартные протоколы, известные в данной области. В частности, используют тест на растворение USP для каждого из составов фенитоина натрия. В частности, этот тест включает помещение каждой капсулы в 900 мл воды, которую поддерживают при 37°C±0,5°C и перемешивают при 50 об/мин. Пробы отбирают на 30, 60 и 120 минутах и исследуют на количество содержащегося в них растворенного фенитоина натрия.
| Таблица 2Влияние силы сжатия на растворение | |||
| Параметры способа:зазор между валками = 2 мм, скорость вращения валков = 3 об/мин,усилие валков (кН) | Растворение (%)(sd)n=12 | ||
| 30 мин | 60 мин | 120 мин | |
| 5 кН | 32 (1,5) | 55 (3,4) | 74 (3,7) |
| 8 кН | 29 (1,4) | 46 (2,1) | 62 (3,6) |
| 11 кН | 31 (2,2) | 46 (3,1) | 61 (4,4) |
| 14 кН | 29 (2,9) | 43 (4,1) | 57 (5,4) |
| 17 кН | 32 (2,4) | 47 (3,0) | 62 (3,4) |
| (sd) - среднее квадратичное отклонение |
Данные, представленные в Таблице 2, указывают на то, что по мере того как сила валка увеличивается, вплоть до 14 кН, количество фенитоина натрия, которое растворяется к 120 минутам, уменьшается.
ПРИМЕР 3
Чтобы определить диапазон, на протяжении которого усилие сжатия, как таковое, воздействует на растворение, все из параметров способа поддерживали постоянными, за исключением усилия валков, как подробно изложено выше в Таблице 2. Однако в Таблице 3 приводятся данные растворения различных образцов смеси, описанной в Примере 1, при различных значениях величины усилия валков, величины рабочего зазора между валками (расстояние между наружными поверхностями валков в положении их максимального сближения) и различных скоростях вращения валков. Аналогично Примеру 2, процент растворенного лекарственного средства определяют, используя стандартные протоколы, известные в данной области.
| Таблица 3Влияние параметров способа | ||||||
| Параметры способа | Растворение (%)(sd)n=12 | |||||
| Партия Опыт № | Зазор между валками (мм) | Скорость вращения валков (об/мин) | Усилие валков (кН) | 30 мин | 60 мин | 120 мин |
| 1 | 2,5 | 6,0 | 7,0 | 29 (2,0) | 49 (3,2) | 66 (4,4) |
| 2 | 2,0 | 3,0 | 3,0 | 33 (2,9) | 62 (5,7) | 81 (4,7) |
| 3 | 2,5 | 6,0 | 11,0 | 27 (2,3) | 43 (2,6) | 59 (3,8) |
| 4 | 3,0 | 3,0 | 11,0 | 27 (1,9) | 44 (2,3) | 60 (3,8) |
| 5 | 2,0 | 6,0 | 11,0 | 28 (1,2) | 44 (2,9) | 59 (4,4) |
| 6 | 2,0 | 6,0 | 11,0 | 29 (2,1) | 45 (2,8) | 60 (3,8) |
| 7 | 2,5 | 6,0 | 7,0 | 28 (1,9) | 46 (5,1) | 65 (6,4) |
| 8 | 3,0 | 9,0 | 11,0 | 27 (2,1) | 43 (2,7) | 60 (4,0) |
Из Таблицы 3 можно видеть, что усилие валков, несомненно, играет превалирующую роль в определении профиля растворения продукта, лекарственного средства, полученного в настоящем изобретении. Например, сравнение данных растворения из опытов 1, 3 и 7 свидетельствуют о том, что увеличение усилия валков снижает степень растворения (%). С другой стороны, статистический анализ обнаружил, что величина зазора между валками и скорость вращения валков не оказывают в такой же степени воздействия на степень растворения.
ПРИМЕР 4
В дальнейшем были испытаны параметры способа, используя различные препараты сыпучего вещества-фенитоина натрия. Если не оговорено особо, все методики и параметры были такими же, как описано выше. Использовались те же компоненты и массовые отношения, которые представлены в Таблице 1, с необязательной заменой прессуемого сахара на сахарную глазурь. Данные суммированы ниже в Таблицах 4-10 и показывают, что для заданного сыпучего лекарственного вещества фенитоина натрия достигаются в основном одинаковые профили растворения.
В случае настоящего изобретения были подвергнуты оценке три сыпучих лекарственных веществ (I, II и III) фенитоина натрия. Для сыпучего лекарственного вещества I фенитоина натрия 80% частиц типично имели размер между 3-126 микронами; с медианой (50я процентиль) размера частиц около 15-23 микрон (оценено Coulter counting). Профили растворения для сыпучего лекарственного вещества I фенитоина натрия изображены в Таблицах 2, 4, 5, 6, 8 и 9.
Для сыпучего лекарственного вещества II фенитоина натрия 45-70% частиц типично имели размер больше, чем или равный 179 микронам и 5-30% частиц имели размер больше, чем или равный 44 микронам (оценено ситовым анализом). Профили растворения для сыпучего лекарственного вещества I фенитоина натрия приведены в Таблице 10.
Сыпучее лекарственное вещество III фенитоина натрия, вероятно, преимущественно имеет очень мелкий размер частиц; с установленной медианой меньше, чем 15 микрон.
| Таблица 4Профили растворения капсул фенитоина натрия, содержащих сыпучее лекарственное вещество I фенитоина натрия | ||||||
| Партия № | Параметры способа: Сила (кН), Скорость (об/мин), Зазор (мм) | Используемые лоты фенитоина Na | % каждого используемого лота | % Растворенный (sd) | ||
| 30 мин | 60 мин | 120 мин | ||||
| A | 3,2 кН, 7,0 об/мин, 2,6 мм | 1 | 91,8 | 31 | 52 | 71 |
| 2 | 8,2 | (0,8) | (1,7) | (2,6) | ||
| B | 3,4 кН, 6,5 об/мин, 2,4 мм | 2 | 100 | 25 | 45 | 65 |
| (1,4) | (2,2) | (1,8) | ||||
| C | 3,0 кН, 7,5 об/мин, 2,8 мм | 3 | 70,8 | 28 | 49 | 69 |
| 4 | 29,2 | (1,4) | (2,2) | (3,3) | ||
| D | 3, 2 кН, 7,0 об/мин, 2,6 мм | 5 | 48,5 | 29 | 49 | 70 |
| 6 | 51,5 | (2,8) | (3,5) | (3,2) | ||
| E | 3,3 кН, 6,8 об/мин, 2,5 мм | 5 | 48,5 | 27 | 46 | 67 |
| 6 | 51,5 | (2,2) | (3,3) | (3,2) | ||
| F | 3,1 кН, 7,3 об/мин, 2,7 мм | 7 | 48,5 | 30 | 50 | 70 |
| 8 | 51,5 | (1,5) | (2,4) | (3,2) | ||
| Диапазон параметров способа: Усилие валков от 3,0 до 3,4 кНСкорость вращения валков 6,5 до 7,5 об/минЗазор между валками 2,4 до 2,8 мм |
| Таблица 5Партии, сделанные по полной шкале (900 кг) для демонстрации воспроизводимости способа | |||
| Прессование в валкахПартия № | % Растворенный | ||
| 30 мин | 60 мин | 120 мин | |
| G1 | 30 | 52 | 73 |
| H1 | 30 | 52 | 73 |
| I1 | 31 | 54 | 75 |
| J1 | 32 | 55 | 75 |
| K1 | 34 | 59 | 78 |
| L1 | 34 | 62 | 81 |
| M1 | 35 | 61 | 82 |
| N1 | 38 | 63 | 82 |
| O1 | 35 | 58 | 78 |
| P1 | 31 | 53 | 74 |
| Q1 | 31 | 54 | 75 |
| (Партия A, Таблица 4) | 31 | 52 | 71 |
| (Партия D, Таблица 4) | 29 | 49 | 70 |
| Среднее | 32 | 56 | 76 |
| Средняя квадратичная ошибка (SE) | 0,72 | 1,2 | 1,1 |
| Медиана | 31 | 54 | 75 |
| Мода (Mode) | 31 | 52 | 75 |
| Среднее квадратичное отклонение (SD) | 2,6 | 4,4 | 4,0 |
| Параметры: Сила = 3,2 кН, Частота вращения = 7,0 об/мин,Зазор = 2,6 мм |
| Таблица 6Оптимизация параметров способа, в котором использован валковый уплотнитель Gerteis | ||||
| Уплотнение в валках Партия № | Описание параметров способа | % растворенного лекарственного средства (SD) | ||
| 30 мин | 60 мин | 120 мин | ||
| Q1 | Сила=2,0 кНПостоянные частота вращения и зазор | 36 (2,6) | 61 (2,9) | 82 (2,3) |
| Q2 | Сила=2,5 кН *Постоянные частота вращения и зазор | 33 (2,0) | 58 (3,3) | 80 (2,5) |
| Q3 | Сила=3,0 кН *Постоянные частота вращения и зазор | 33 (1,5) | 56 (2,8) | 76 (2,1) |
| Q4 | Зазор=2,5 ммПостоянные частота вращения и сила | 34 (1,5) | 56 (2,5) | 76 (2,3) |
| Q5 | Сила=2,5 кН *Постоянные частота вращения и зазор | 33 (2,0) | 57 (3,4) | 77 (2,8) |
| Q6 | Зазор=3,5 ммПостоянные частота вращения и сила | 33 (1,2) | 56 (3,0) | 76 (3,1) |
| Постоянная частота вращения = 10 об/мин; Постоянная сила = 2,5 кН; и постоянный зазор = 3,0 мм.* Дублированные параметры |
| Таблица 7Данные растворения для различных партий, полученных c использованием сыпучего лекарственного средства III фенитоина натрия | ||||
| Прессование в валках Партия № | Параметры | % растворенного лекарственного средства (SD) | ||
| 30 мин | 60 мин | 120 мин | ||
| R1 | Сила=6,0 кН, Зазор=2,0 мм, Частота вращения=8,0 об/мин | 38 (3,2) | 71 (2,7) | 86 (1,2) |
| S1 | Сила=10 кН, Зазор=2,0 мм, Частота вращения=8,0 об/мин | 31 (2,9) | 58 (2,9) | 78 (1,8) |
| R2 | Сила=6,0 кН, Зазор=2,0 мм, Частота вращения=12,0 об/мин | 40 (4,3) | 74 (5,5) | 88 (2,7) |
| S2 | Сила=10,0 кН, Зазор=2,0 мм, Частота вращения=12,0 об/мин | 34 (2,2) | 65 (2,5) | 86 (2,1) |
| R3 | Сила=6,0 кН, Зазор=4,0 мм, Частота вращения=8,0 об/мин | 45 (3,9) | 71 (3,9) | 87 (3,1) |
| S3 | Сила=10,0 кН, Зазор=4,0 мм, Частота вращения=8,0 об/мин | 32 (4,0) | 61 (4,5) | 80 (3,1) |
| U1 | Сила=6,0 кН, Зазор=4,0 мм, Частота вращения=12,0 об/мин | 39 (4,0) | 78 (2,3) | 90 (0,6) |
| U2 | Сила=10,0 кН, Зазор=4,0 мм, Частота вращения=12,0 об/мин | 35 (2,1) | 69 (3,9) | 87 (2,1) |
| S4 | Сила=8,0 кН, * Зазор=3,0 мм, Частота вращения=10,0 об/мин | 34 (2,9) | 65 (3,1) | 85 (2,6) |
| R4 | Сила=8,0 кН, * Зазор=3,0 мм, Частота вращения=10,0 |