Производные пирролпиримидинона, способ получения и их применение
Иллюстрации
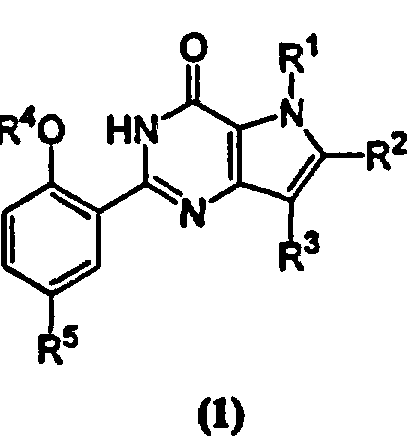
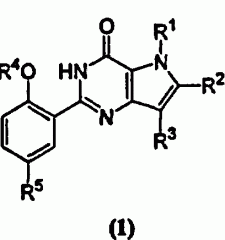
Показать всеИзобретение относится к новым производным пирролпиримидинона формулы (1) и их фармацевтически приемлемым солям, обладающим свойствами селективного ингибитора специфической фосфодиэстеразы циклического гуанозин-3',5'-монофосфата (специфического ФДЭ цГМФ(ФДЭ V), которые могут найти применение при лечении импотенции, половой дисфункции женщин, стойкой, нестойкой и вариантной (Prinzmetal) стенокардии и др. заболеваний. В формуле (1)
R1 представляет Н; C1-С3-алкил, необязательно замещенный одним или несколькими атомами фтора; R2 представляет Н; атом галогена; C1-С6-алкил, необязательно замещенный ОН, C1-С3-алкокси, C3-С6-циклоалкилом или одним или несколькими атомами фтора; C3-С6-циклоалкил; R3 представляет C1-С6-алкил, необязательно замещенный C3-С6-циклоалкилом или одним или несколькими атомами фтора; R4 представляет C1-С6-алкил, необязательно замещенный одним или несколькими атомами фтора; R5 представляет SO2NR6R7, NHSO2R8 или гетероциклил, такой как тетразолил; каждый R6 и R7 независимо представляет Н или C1-С6-алкил, необязательно замещенный CO2H, или одним или несколькими атомами фтора; или вместе с атомом азота, к которому они присоединены, образуют или моноциклическое кольцо, такое как имидазол, пирролидин, пиперидин, морфолин, пиперазин и гомопиперазин, где указанная группа необязательно замещена R9; R8 представляет C1-С6-алкил; R9 представляет C1-С6-алкил, необязательно замещенный одним или несколькими атомами галогена, ОН, C1-С3-алкокси, который необязательно замещен одним или несколькими атомами фтора, NR11R12, C=NR13(NR14R15), или тетразольной группой, 6-членную азотсодержащую гетероарильную группу;каждый R11 и R12 независимо представляет Н или C1-С4-алкил; R13 представляет Н; каждый R14 и R15 независимо представляет Н. Изобретение также относится к промежуточным продуктам, способам получения соединений и к фармацевтическим композициям. 10 н. и 5 з.п. ф-лы, 1 табл.
Реферат
Предпосылки создания изобретения
Область изобретения
Изобретение относится к ряду производных пирролпиримидинона формулы (1), к способам их получения, промежуточным продуктам, для их получения, к их применению в качестве лечебных средств и к содержащим их фармацевтическим композициям,
где R1 представляет Н; C1-С3-алкил, необязательно замещенный одним или несколькими атомами фтора, или C3-С6-циклоалкил;
R2 представляет Н; атом галогена; C1-С6-алкил, необязательно замещенный ОН, C1-С3-алкокси, C3-С6-циклоалкилом или одним или несколькими атомами фтора; C3-С6-циклоалкил;
C2-С6-алкенил; или C2-С6-алкинил;
R3 представляет Н; C1-С6-алкил, необязательно замещенный ОН, C1-С3-алкокси, C3-С6-циклоалкилом или одним или несколькими атомами фтора; C3-С6-циклоалкил; C2-С6-алкенил; или C2-С6-алкинил; R4 представляет C1-С6-алкил, необязательно замещенный C3-С6-циклоалкилом или одним или несколькими атомами фтора;
C2-С6-алкенил; C2-С6-алкинил; или C3-С6-циклоалкил;
R5 представляет SO2NRбR7; NHSO2NR6R7; NHCOCONR6R7; NHSO2R8;
NHCOR8; или фенил или гетероциклил, каждый из которых необязательно замещен одним или несколькими атомами фтора или C1-С3-алкилом;
каждый R6 и R7 независимо представляет Н или C1-С6-алкил, необязательно замещенный ОН, CO2Н, C1-С3-алкокси, C3-С6-циклоалкилом или одним или несколькими атомами фтора; или вместе с атомом азота, к которому они присоединены, образуют или моноциклическое кольцо, такое как имидазол, азириден (азиридин), азеридин (азетидин), пирролидин, пиперидин, морфолин, пиперазин и гомопиперазин, или бициклическое кольцо, такое как 2,5-диазабицикло[2.2.1]гептан и 3,7-диазабицикло [3.3.0]октан, где указанная группа необязательно замещена R9;
R8 представляет C1-С6-алкил, необязательно замещенный одним или несколькими атомами фтора; или C3-С7-циклоалкил;
R9 представляет C1-С6-алкил, необязательно замещенный одним или несколькими атомами галогена, ОН, C1-С3-алкокси, который необязательно замещен одним или несколькими атомами фтора, CO2R10, NR11R12, C=NR13 (NR14R15), или тетразольной группой, которая необязательно замещена C1-С3-алкилом; или одну или несколько азотосодержащих гетероарильных групп, которые необязательно замещены одним или несколькими атомами фтора;
R10 представляет Н; или С1-С4-алкил, необязательно замещенный ОН, NR11R12, одним или несколькими атомами фтора или азотосодержащим гетероциклическим кольцом, таким как пирролидин, пиперидин, пиперазин, морфолин, пиррол и имидазол, где атом азота непосредственно связан с С1-С4-алкилом;
каждый R11 и R12 независимо представляет Н или С1-С4-алкил;
R13 представляет Н; С1-С4-алкил, необязательно замещенный одним или несколькими атомами фтора; или C3-С6-циклоалкил;
каждый R14 и R15 независимо представляет Н или С1-С4-алкил, необязательно замещенный одним или несколькими атомами фтора;
C3-С6-циклоалкил; или вместе с атомом азота, к которому они присоединены, образуют пирролидинил, пиперидино, морфолино, пиперазинильную или гомопиперазинильную группу, где указанная группа необязательно замещена C1-С3-алкилом.
Описание предшествующего уровня
В заявках на Европейский патент ЕР-А-0463756 и ЕР-А-0526004 раскрыты в качестве ингибиторов цГМФ ФДЭ некоторые пиразол[4,3-d]пиримидин-7-оны, полезные при лечении сердечно-сосудистых расстройств, таких как стенокардия, гипертония и сердечная недостаточность. В международной заявке WO 94/28902 раскрыто их использование для лечения импотенции.
Авторы данного изобретения недавно открыли ряд производных пиразол[4,3-d]пиримидин-7-она в качестве ингибиторов ФДЭ V (заявки №KR 98-60436 и KR 99-7580). В данном изобретении получен новый ряд производных пиррол[3,2-d]пиримидин-4-она в качестве ингибиторов ФДЭ V. Однако ни одно из соединений данного изобретения нигде конкретно не раскрыто.
Сущность изобретения
Соединения формулы (1) данного изобретения являются сильнодействующими и селективными ингибиторами специфической фосфодиэстеразы циклического гуанозин 3',5'-монофосфата (специфической ФДЭ цГМФ; ФДЭ V), являющимися полезными во множестве терапевтических областей, в которых, как предполагается, указанное ингибирование будет полезным, включая лечение импотенции (эректальной дисфункции мужчин), половой дисфункции женщин и различных сердечно-сосудистых расстройств, таких как стенокардия, гипертензия, сердечная недостаточность и атеросклероз.
Вследствие селективного ингибирования ФДЭ V, проявляемого соединениями данного изобретения, уровни цГМФ снижаются, что в свою очередь может вызвать увеличение полезной сосудорасширяющей, анти-вазоспастической, противотромбоцитной, противонейтрофильной, натриуретической и диуретической активности, а также потенцирование действий образованного из эндотелия расслабляющего фактора (EDRF), нитровазодилататоров, предсердного натриуретического фактора (ANF), мозгового натриуретического пептида (BNP), натриуретического пептида С-типа (CNP) и эндотелийзависимых расслабляющих средств, таких как брадикинин, ацетилхолин и 5-HT1.
Следовательно, соединения данного изобретения полезны при лечении ряда заболеваний, включающих импотенцию, половую дисфункцию женщин, стойкую, нестойкую и вариантную (Prinzmetal) стенокардию, гипертензию, легочную гипертензию, застойную сердечную недостаточность, почечную недостаточность, атеросклероз, состояния с пониженной активностью кровеносных сосудов (например, после чрескожной транслюминальной пластической операции на коронарных сосудах), заболевание периферических сосудов, сосудистые расстройства, такие как болезнь Рейно, воспалительные заболевания, удар, бронхит, хроническую астму, аллергическую астму, аллергический ринит, глаукому и заболевания, характеризующиеся расстройствами сократительной способности кишки (например, синдром раздраженной толстой кишки).
Подробное описание изобретения
Таким образом, данное изобретение в соответствии с первым аспектом включает соединения формулы (1),
где R1, R2, R3, R4 и R5 являются такими, как они определены выше, и их фармацевтически приемлемые соли и сольваты (например, гидраты).
В вышеуказанном определении, если не указано иным образом, алкильные группы имеют три или более атомов углерода и могут иметь прямую или разветвленную цепь. Кроме того, алкенильные или алкинильные группы, имеющие четыре или более атомов углерода, или алкоксильные группы, имеющие три атома углерода, могут также иметь прямую или разветвленную цепь.
Соединения формулы (1) могут содержать один или несколько асимметрических центров и поэтому могут существовать в виде энантиомеров или диастереоизомеров. Понятно, что изобретение включает как смеси, так и отдельные изомеры соединений формулы (1). Кроме того, некоторые соединения формулы (1), которые содержат алкенильные группы, могут существовать в виде цис-или транс-изомеров. В любом случае изобретение включает как смеси, так и отдельные изомеры.
Соединения формулы (1) могут также существовать в таутомерных формах и изобретение включает как смеси, так и их отдельные таутомеры.
В изобретение также включены меченные радиоактивным изотопом производные соединений формулы (1), которые являются подходящими для биологических исследований.
Соединения формулы (1), в которых присутствуют один или более основных атомов азота, могут образовывать фармацевтически приемлемые соли с кислотами, такими как хлористоводородная, бромистоводородная, серная, фосфорная, метансульфоновая, уксусная, лимонная, фумаровая, молочная, малеиновая, янтарная и винная кислоты.
Соединения формулы (1) могут образовывать фармацевтически приемлемые соли с ионами металлов, таких как щелочные металлы, например натрий и калий, или с ионом аммония.
Предпочтительная группа соединений формулы (1) представляет собой группу, где R1 представляет Н; метил или этил;
R2 представляет Н; метил или атом галогена;
R3 представляет С1-С4-алкил, необязательно замещенный одним или несколькими атомами фтора;
R4 представляет этил, н-пропил или аллил;
R5 представляет SO2NR6R7 или NHSO2R8;
R6 и R7, взятые вместе с атомом азота, к которому они присоединены, образуют пиперидино, пиперазинильную или гомопиперазинильную группу, где данная группа замещена R9;
R8 представляет метил;
R9 представляет C1-С4-алкил, необязательно замещенный одним или несколькими атомами галогена, ОН, CO2R10 или тетразольной группой, которая необязательно замещена C1-С3-алкилом; R10 представляет Н.
Особенно предпочтительная группа соединений формулы (1) представляет собой группу, где
R1 представляет метил или этил;
R2 представляет Н;
R3 представляет этил; н-пропил; 3-фторпропил или циклопропилметил;
R4 представляет этил или н-пропил;
R5 представляет SO2NR6R7 или NHSO2R8;
R6 и R7, взятые вместе с атомом азота, к которому они присоединены, образуют пиперидино или пиперазинильную группу, где данная группа замещена R9;
R8 представляет метил; R9 представляет С1-С4-алкил, необязательно замещенный одним или несколькими атомами фтора или хлора, ОН, CO2R10 или тетразольной группой.
R10 представляет Н.
Особенно предпочтительные конкретные соединения изобретения включают:
2-(2-этокси-5-(4-метилпиперазин-1-илсульфонил)фенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он;
2-(5-(4-метилпиперазин-1-илсульфонил)-2-н-пропоксифенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-н-пропилпиперазин-1-илсульфонил)фенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-изопропилпиперазин-1-илсульфонил)фенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-(2-фторэтил)пиперазин-1-илсульфонил) фенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(5-(4-(2-фторэтил)пиперазин-1-илсульфонил)-2-н-пропоксифенил) -5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(2-этокси-5-(4-(3-фторпропил)пиперазин-1-илсульфонил) фенил) -5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(2-этокси-5-(4-(3-фторпропил)пиперазин-1-илсульфонил) фенил)-7-этил-5-метил-3,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-(3-фторпропил)пиперазин-1-илсульфонил) фенил)-7- (3-фторпропил) -5-метил-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
7-циклопропилметил-2-(2-этокси-5-(4-(3-фторпропил) пиперазин-1-илсульфонил)фенил)-5-метил-3,5-дигидро-4Н-пиррол [3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-(3-фторпропил)пиперазин-1-илсульфонил) фенил)-5-этил-7-этил-3,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-(3-фторпропил)пиперазин-1-илсульфонил) фенил)-5-этил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(2-этокси-5-(4-изопропилпиперазин-1-илсульфонил)фенил)-5-этил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-(3-фторпропил)пиперазин-1-илсульфонил) фенил)-5-этил-7-н-пропил-3,5-дигидро-4H-пиррол[3,2-d] пиримидин-4-он;
2-(2-этокси-5-(4-(2-гидроксиэтил)пиперазин-1-илсульфонил) фенил)-5-этил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(2-этокси-5-(4-этилпиперазин-1-илсульфонил)фенил)-5-этил-7-(3-фторпропил)-3,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он;
2-(5-(4-этилпиперазин-1-илсульфонил)-2-н-пропоксифенил)-5-этил-7-(3-фторпропил)-3,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-изопропилпиперазин-1-илсульфонил)фенил)-5-этил-7-(3-фторпропил)-3,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-(3-фторпропил)пиперазин-1-илсульфонил) фенил)-5-этил-7-(3-фторпропил)-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(5-(4-(3-фторпропил)пиперазин-1-илсульфонил)-2-н-пропоксифенил)-5-этил-7-(3-фторпропил)-3,5-дигидро-4Н-пиррол [3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-(2-гидроксиэтил)пиперазин-1-илсульфонил) фенил)-5-этил-7-(3-фторпропил)-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(5-(4-(2-гидроксиэтил)пиперазин-1-илсульфонил)-2-н-пропоксифенил)-5-этил-7-(3-фторпропил)-3,5-дигидро-4Н-пиррол [3,2-d]пиримидин-4-он;
2-(5-(4-(3-гидроксипропил)пиперазин-1-илсульфонил)-2-н-пропоксифенил)-5-этил-7-(3-фторпропил)-3,5-дигидро-4Н-пиррол [3,2-d]пиримидин-4-он;
2-(5-(4-(2-гидроксиэтил)пиперазин-1-илсульфонил)-2-н-пропоксифенил-5-этил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(5-(4-(3-фторпропил)пиперазин-1-илсульфонил)-2-н-пропоксифенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(2-этокси-5-(4-(2-гидроксиэтил)пиперазин-1-илсульфонил) фенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(5-(4-(2-гидроксиэтил)пиперазин-1-илсульфонил)-2-н-пропоксифенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(5-(2-этокси-4-(3-гидроксипропил)пиперазин-1-илсульфонил)фенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол [3,2-d]пиримидин-4-он;
2-(5-(4-(3-гидроксипропил)пиперазин-1-илсульфонил)-2-н-пропоксифенил-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d] пиримидин-4-он;
2-(2-этокси-5-(4-(гидроксикарбонилметил)пиперидин-1-илсульфонил)фенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол [3,2-d]пиримидин-4-он;
2-(5-(4-(гидроксикарбонилметил)пиперидин-1-илсульфонил)-2-н-пропоксифенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол [3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-(2-гидроксикарбонилэтил)пиперидин-1-илсульфонил)фенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол [3,2-d]пиримидин-4-он;
2-(5-(4-(2-гидроксикарбонилэтил)пиперидин-1-илсульфонил)-2-н-пропоксифенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол [3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-(1Н-тетразол-5-илметил)пиперазин-1-илсульфонил)фенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол [3,2-d]пиримидин-4-он;
5-метил-2-(2-н-пропокси-5-(4-(2-(1Н-тетразол-5-ил)этил) пиперазин-1-илсульфонил)фенил)-7-н-пропил-З,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он;
2-(2-этокси-5-(4-(1Н-тетразол-5-илметил)пиперидин-1-илсульфонил)фенил)-5-метил-7-н-пропил-3,5-дигидро-4Н-пиррол [3,2-d]пиримидин-4-он;
5-метил-2-(2-н-пропокси-5-(4-(1Н-тетразол-5-илметил) пиперидин-1-илсульфонил)фенил)-7-н-пропил-3,5-дигидро-4Н-пиррол[3,2-d]пиримидин-4-он и их физиологически приемлемые соли и сольваты (например, гидраты).
В соответствии с другим аспектом данное изобретение включает способы получения соединений формулы (1) или их фармацевтически приемлемых солей. Соединения формулы (1) могут быть получены из соединений формулы (2), (3) или (4):
где R1, R2, R3 и R4 являются такими, как они определены выше, и Х представляет собой сульфонилгалогенид, циано- или аминогруппу, и Y представляет атом галогена, предпочтительно атом хлора. Реакцию связывания соединений формулы (2) с соединением формулы (5) (где R6 и R7 являются такими, как они определены выше) обычно осуществляют при температуре от 0°С до комнатной температуры в течение 1-24 часов в подходящем растворителе, таком как C1-С3-алканол, дихлорметан, ДМФ или вода, с использованием избыточного количества соединения (5) или в присутствии органического третичного амина, предпочтительно триэтиламина, для удаления кислотного полупродукта. У соединений формулы (1), где R9 представляет C1-С6-алкил, замещенный C=NR13 (NR14R15), цианогруппа в предшествующем соединении может быть превращена в амидиновую функциональную группу. Реакцию можно осуществлять обработкой цианосоединения насыщенным HCl газом в безводном спирте, таком как метанол и этанол, при температуре от ˜20°С до 0°С и последующей реакцией полученного промежуточного алкилимидата с соответствующим амином при температуре от 0°С до комнатной температуры.
Реакцию аминовых соединений формулы (3) с соединением формулы (6), (7) или (8):
(где R8 является таким, как он определен выше и Y представляет атом галогена, предпочтительно атом хлора) обычно осуществляют при температуре от 0°С до комнатной температуры в течение 1-24 часов в инертном безводном растворителе, таком как дихлорметан или ТГФ, с использованием избыточного количества соединения формулы (6), (7) или (8) в присутствии органического третичного амина, предпочтительно триэтиламина, для удаления кислотного полупродукта. Сульфонилгалогенид формулы (6), ангидрид карбоновой кислоты формулы (7) и ацилгалогенид формулы (8) являются или коммерчески доступными или могут быть легко получены общепринятыми способами синтеза.
Цианосоединения формулы (4) могут быть эффективно превращены в соответствующие производные тетразола взаимодействием с NaN3 в присутствии н-Bu3SnCl в качестве кислоты Льюиса при температуре кипения в безводном углеводородном растворителе, таком как толуол.
Соединения формул (2), (3) и (4) могут быть получены из соединений формулы (9), (10) и (11) соответственно:
(где R1, R2, R3 и R4 являются такими, как они определены выше, и Х представляет водород, нитро или бромидную группу) с использованием предшествующих методик.
Соединения формулы (2) могут быть получены из соединений формулы (9) с использованием известных способов введения сульфонилгалогенидной группы в ароматическое кольцо, например, когда галогенид представляет атом хлора, действием хлорсульфоновой кислоты при температуре от 0°С до комнатной температуры в течение 3-24 часов без растворителя.
Амины формулы (3) могут быть легко получены восстановлением соответствующих нитросоединений формулы (10) с использованием хорошо известных способов, таких как каталитическое гидрирование в спиртовом растворителе или восстановление хлоридом олова (II) и т.д.
Цианосоединения формулы (4) могут быть легко получены из бромидных соединений формулы (11) замещением бромида CuCN при 150-200°С в высококипящем растворителе, таком как 1-метил-2-пирролидинон.
Соединения формулы (9), (10) и (11) могут быть получены из соединений формулы (12), (13) и (14) соответственно:
(где R1, R2, R3 и R4 являются такими, как они определены выше, и Х представляет водород, нитро или бромидную группу) с использованием известных способов циклизации для образования пиримидинонового кольца.
Реакцию циклизации обычно осуществляют нагреванием при повышенной температуре, например 50-150°С, в присутствии кислоты или основания в подходящем растворителе, таком как водный C1-C4-алканол, вода, галогенированный углеводород или ацетонитрил. Так, например, циклизацию можно осуществить обработкой соединения формул (12)-(14) неорганическим или органическим основанием, таким как гидроксид натрия, карбонат калия или трет-бутоксид калия, в водно-спиртовой среде, предпочтительно трет-бутоксидом калия в трет-бутаноле при температуре от 60°С до температуры кипения.
Для получения соединений формулы (9) (где R1, R3 и R4 являются такими, как они определены выше, и R2 представляет галоген) введение атома галогена в соединения формулы (12) осуществляют до последующей циклизации. Галогенирование можно осуществлять с использованием соответствующих условий для каждого галогенида, например N-хлорсукцинимида (NCS) в галогенированном растворителе, таком как CH2Cl2, при температуре от -10°С до комнатной температуры для осуществления хлорирования, брома в уксусной кислоте в присутствии ацетата натрия при комнатной температуре для осуществления бромирования и иода с оксидом ртути (HgO) в углеводородном растворителе, таком как бензол, при температуре от 0°С до комнатной температуры для осуществления иодирования.
Соединения формул (12)-(14) могут быть получены из соединений формулы (15) и (16), (17) или (18) соответственно:
где R1, R2, R3 и R4 являются такими, как они определены выше, Х представляет водород, нитро или бромидную группу и Y представляет гидроксильную группу или атом галогена, предпочтительно атом хлора.
Реакцию обычно осуществляют сначала превращением карбоновой кислоты формул (16)-(18) (Y=ОН) в соответствующий ацилхлорид с использованием избыточных количеств реагентов, хорошо известных из литературы, предпочтительно тионилхлорида или оксалилхлорида, в присутствии инертного растворителя, такого как дихлорметан или бензол, при температуре от комнатной до температуры кипения. Реакцию связывания с соединением формулы (15) обычно осуществляют с использованием избытка полученного ацилхлорида формул (16)-(18) (Y=Cl) в присутствии избытка органического третичного амина, такого как триэтиламин, действующего в качестве поглотителя кислотного полупродукта (HY), необязательно в присутствии катализатора, такого как 4-диметиламинопиридин (DMAP), в инертном безводном растворителе, таком как дихлорметан, при температуре от 0°С до комнатной температуры в течение 2-6 часов. Исходные соединения формул (16)-(18) (Y=OH) являются или коммерчески доступными или могут быть легко получены из соединения формулы (16) способами, известными в литературе. Так, например, нитросоединения формулы (17) могут быть эффективно получены из соединений формулы (16) с использованием способов, известных для нитрования ароматического кольца, и реакцию обычно осуществляют с использованием нитрата натрия или дымящей азотной кислоты в сильнокислой среде, такой как концентрированная серная кислота или трифторуксусная кислота, предпочтительно в трифторуксусной кислоте, при температуре от -10°С до комнатной температуры в течение 1-24 часов.
Соединения формулы (15) могут быть получены из соединений формулы (20) в две стадии:
(где R1, R2 и R3 являются такими, как они определены выше) превращением соединений формулы (20) в соответствующие амидные соединения формулы (19) и последующей циклизацией соединений формулы (19) для образования пирролового кольца. Образование амида можно осуществлять с использованием аммиака или в спиртовом растворителе, или в воде, предпочтительно в воде, при температуре от комнатной до 100°С, в присутствии цианида натрия в качестве катализатора или при его отсутствии.
Реакцию циклизации эффективно осуществляют нагреванием при повышенной температуре, например, при 50-150°С, в присутствии основания в подходящем растворителе, таком как водный C1-C4-алканол или ацетонитрил. Так, например, циклизацию можно осуществить обработкой соединения формулы (20) алкоксидным основанием, таким как этоксид натрия или трет-бутоксид калия, в спиртовой среде, предпочтительно этоксидом натрия в этаноле при 60°С.
Соединения формулы (20) могут быть получены из соединений формулы (21) и (22):
где R1, R2 и R3 являются такими, как они определены выше. Реакцию конденсации между соединениями формулы (21) и (22) обычно осуществляют в смеси спирта и воды, предпочтительно в среде только метанола, в присутствии слабого основания, такого как ацетат натрия, при комнатной температуре в течение 1-3 дней. Соединения формулы (21) или коммерчески доступны, или могут быть легко получены из глицина с использованием хорошо известных из документов методов синтеза.
Соединения формулы (22) могут быть получены из соединений формулы (23) и (24):
где R2 и R3 являются такими, как они определены выше, и R представляет C1-C3-алкил.
Реакцию ацилирования соединений формулы (23) эффективно осуществляют захватом анионных частей соединений формулы (23) соединениями формулы (24) при температуре от -78°С до комнатной температуры. Образование анионного промежуточного продукта из соединений формулы (23) осуществляют действием сильного амидного основания, такого как амид натрия, гексаметилдисилазид щелочного металла (Li, Na или KHMDS), или диизопропиламид лития (LDA), предпочтительно LDA, в безводном эфирном растворителе, таком как тетрагидрофуран, при низкой температуре в диапазоне от -78°С до 0°С.
Соединения формулы (I) могут быть также получены циклизацией соединений формулы (25):
где R1, R2, R3 и R4 являются такими, как они определены выше, и R16 представляет группу R5, которая определена выше, или предшественник группы R5.
Реакцию циклизации обычно осуществляют нагреванием при повышенной температуре, например, при 50-150°С, в присутствии кислоты или основания в подходящем растворителе, таком как водный C1-C4-алканол, вода, галогенированный углеводород или ацетонитрил. Таким образом, циклизацию можно осуществлять, например, обработкой соединения формулы (25) неорганическим или органическим основанием, таким как гидроксид натрия, карбонат калия или трет-бутоксид калия, в водно-спиртовой среде. Примерами R16, являющегося предшественником группы R5, являются такие, когда R5 содержит карбоновую кислоту, так как сложноэфирная группа формулы (25) может быть превращена в соответствующую карбоновую кислоту в щелочной среде, используемой при циклизации.
Соединения формулы (25) могут быть получены из соединений формулы (15) и (26):
где R1, R2, R3, R4 и R16 являются такими, как они определены выше, и Y представляет гидроксильную группу или атом галогена, предпочтительно атом хлора.
Реакцию обычно осуществляют сначала превращением карбоновой кислоты формулы (26) (Y=OH) в соответствующей ацилхлорид с использованием избыточных количеств реагентов, хорошо известных из литературы, предпочтительно тионилхлорида или оксалилхлорида, в присутствии инертного растворителя, такого как дихлорметан или бензол, или в его отсутствие при температуре от комнатной до температуры кипения. Реакцию связывания с соединением формулы (15) обычно осуществляют с использованием избытка полученного ацилхлорида (26) (Y=Cl) в присутствии избытка органического третичного амина, такого как триэтиламин, для осуществления поглощения кислотного полупродукта (HY), необязательно в присутствии катализатора, такого как 4-диметиламинопиридин (DMAP), в инертном безводном растворителе, таком как дихлорметан, при температуре от 0°С до комнатной температуры в течение 2-6 часов. Исходные соединения формулы (26) (Y=OH) могут быть легко получены из соединения формулы (16) (Х=Н, Y=OH) способами, известными в литературе.
Коммерчески недоступные амины формулы (5) могут быть получены общепринятыми методами синтеза в соответствии со способами, представленными в литературе, из легкодоступных исходных материалов с использованием стандартных реагентов и условий реакций.
Некоторые соединения формулы (5), (5а), где R6 и R7, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или гомопиперазинильную группу, замещенную R9 (R9 является таким, как он определен выше), могут быть легко синтезированы из соединений формулы (27):
где Z представляет группу CF3, гидроксил или галоген, предпочтительно атом фтора, и Р представляет соответствующую защитную группу, например бензил, бензилоксикарбонил (Cbz) или трет-бутоксикарбонил (Boc).
Удаление бензильной или бензилоксикарбонильной (Cbz) группы у соединений формулы (27) можно осуществить в условиях гидрирования с использованием каталитического количества палладия-на-угле в спиртовом растворителе, таком как метанол или этанол, при комнатной температуре с получением соответствующего соединения формулы (5а). Отщепление трет-бутоксикарбонильной группы (Boc) у соединений формулы (27) можно осуществить в кислой среде с использованием водного раствора HCl или трифторуксусной кислоты в апротонном растворителе, таком как тетрагидрофуран или дихлорметан, при комнатной температуре, с получением соответствующей соли формулы (5а). Исходные соединения формулы (27) могут быть получены из 1-бензилпиперазина или из 1-трет-бутоксикарбонилгомопиперазина формулы (28) прямым N-алкилированием с использованием соответствующего алкилгалогенида, содержащего CF3, гидроксильную или галогеновую группу.
Другие соединения формулы (5), (5b), где R6 и R7, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пиперидиногруппу, замещенную R9, (R9 является таким, как он определен выше, и замещен 1Н-(тетразол-5-ильной) группой) могут быть легко синтезированы из соединений формулы (29):
где Х представляет метиновую группу или атом азота и Р представляет соответствующую защитную группу, например, предпочтительно трет-бутоксикарбонил (Boc).
Удаление трет-бутоксикарбонильной (Boc) и трифенилметильной (тритильной) групп у соединений формулы (29) можно осуществить одновременно в кислой среде с использованием водного раствора HCl или трифторуксусной кислоты в апротонном растворителе, таком как тетрагидрофуран, при комнатной температуре в присутствии избытка 1H-тетразола в качестве поглотителя карбокатиона с получением соответствующей соли формулы (5b).
Соединения формулы (29) могут быть получены из соединений формулы (30):
где X и Р являются такими, как они определены выше.
Превращение цианогруппы у соединения формулы (30) обычно осуществляют с использованием хлорида трибутилолова и азида натрия в углеводородном растворителе, предпочтительно толуоле, при температуре кипения с получением соответствующих тетразольных соединений формулы (29). Соединения формулы (30) легко получаются или из 1-трет-бутоксикарбонилпиперазина формулы (31) прямым N-алкилированием соответствующим алкилгалогенидом, содержащим цианогруппу, или превращением гидроксильной функциональной группы соединения формулы (32) в цианогруппу с использованием хорошо описанных методик. Исходные соединения формулы (31) и (32) или коммерчески доступны или могут быть легко получены общепринятыми методами синтеза в соответствии со способами, представленными в литературе.
Полученные соединения данного изобретения, представленные формулами (1)-(5), (9)-(15) и (19)-(22) могут быть выделены и очищены соответствующими общепринятыми методами, такими как колоночная хроматография и перекристаллизация.
Соединения изобретения могут быть введены любым подходящим методом введения, например пероральным, трансбуккальным, подъязычным, ректальным, вагинальным, назальным, локальным или парентеральным введением, (включая внутривенное, внутримышечное, подкожное и внутрикоронарное).
Для введения человеку с целью лечения или профилактики вышеуказанных расстройств дозы соединения формулы (1) для перорального, трансбуккального или подъязычного введения обычно находятся в интервале 0,1-400 мг в день для взрослого пациента. со средним весом (70 кг). Таким образом, для типичного взрослого пациента отдельные таблетки или капсулы содержат 0,05-200 мг активного соединения в подходящем фармацевтически приемлемом наполнителе или носителе и предназначены для введения в виде одной или многократных доз один или несколько раз в день. Дозы для парентерального введения обычно находятся в интервале 0,01-100 мг на единичную дозу. На практике точную схему приема лекарственного средства, которая будет наиболее подходящей для отдельного пациента, определяет лечащий врач, и она будет изменяться в зависимости от возраста, веса и реакции конкретного пациента. Вышеуказанные дозы являются примерными для среднего случая, но могут быть индивидуальные случаи, в которых могут быть необходимы более высокие или более низкие интервалы доз, которые также входят в объем данного изобретения.
Соединения формулы (1) могут быть введены человеку как таковые, но обычно их вводят в смеси с фармацевтическим носителем, выбранным в зависимости от способа введения и общепринятой фармацевтической практики. Так, например, соединение может быть введено перорально, трансбуккально или подъязычно в форме таблеток, содержащих эксипиенты, такие как крахмал или лактоза, или в форме капсул, или в форме шариков или как таковое или в смеси с эксипиентами, или в форме эликсиров или суспензий, содержащих корригенты или красители. Такие жидкие препараты могут быть получены с фармацевтически приемлемыми добавками, такими как суспендирующий агент (например, метилцеллюлоза, полусинтетический глицерид, такой как витепсол, или смеси глицеридов, такие как смесь персикового масла и сложных эфиров ПЭГ-6 или смеси ПЭГ-8 и каприлового/капринового глицеридов). Соединение может быть также введено парентерально инъекцией, например внутривенно, внутримышечно, подкожно или внутрикоронарно. Для парентерального введения соединение лучше всего использовать в форме стерильного водного раствора, который может содержать другие вещества, например соли или моносахариды, такие как маннит или глюкоза, для того, чтобы сделать раствор изотоническим по отношению к крови.
Таким образом, в соответствии с еще одним аспектом изобретение включает фармацевтическую композицию, содержащую соединение формулы (1) или его фармацевтически приемлемую соль вместе с его фармацевтически приемлемым разбавителем или носителем.
Изобретение также включает соединение формулы (1) или его фармацевтически приемлемую соль или фармацевтическую композицию, содержащую их для использования для лечения импотенции, половой дисфункции женщин, стойкой, нестойкой и вариантной (Prinzmetal) стенокардии, гипертензии, легочной гипертензии, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояний с пониженной активностью кровеносных сосудов (например, после чрескожной транслюминальной пластической операции на коронарных сосудах), заболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, воспалительных заболеваний, удара, бронхита, хронической астмы, аллергической астмы, аллергического ринита, глаукомы и заболеваний, характеризующихся расстройствами сократительной способности кишки (например, синдрома раздраженной толстой кишки).
Изобретение также включает применение соединения формулы (1) или его фармацевтически приемлемой соли или фармацевтической композиции, содержащей их, для производства лекарственного препарата для лечения импотенции, половой дисфункции женщин, стойкой, нестойкой и вариантной (Prinzmetal) стенокардии, гипертензии, легочной гипертензии, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояний с пониженной активностью кровеносных сосудов (например, после чрескожной транслюминальной пластической операции на коронарных сосудах), заболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, воспалительных заболеваний, удара, бронхита, хронической астмы, аллергической астмы, аллергического ринита, глаукомы и заболеваний, характеризующихся расстройствами сократительной способности кишки (например, синдрома раздраженной толстой кишки). В соответствии с еще одним аспектом изобретение относится к способу лечения или профилактики импотенции, половой дисфункции, женщин, стойкой, нестойкой, вариантной (Prinzmetal) стенокардии, гипертензии, легочной гипертензии, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояний с пониженной активностью кровеносных сосудов (например, после чрескожной транслюминальной пластической операции на коронарных сосудах) заболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, воспалительных заболеваний, удара, бронхита, хронической астмы, аллергической астмы, аллергического ринита, гл