Фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к гранулированной фармацевтической композиции, содержащей гранулированный материал и эритрит. Гранулированный материал включает лекарственное вещество, имеющее неприятный вкус, и воск. Также изобретение относится к фармацевтическому продукту для перорального применения, содержащему указанную гранулированную композицию. Композиция маскирует неприятный вкус, присущий лекарственному средству, и обеспечивает хорошее ощущение при пероральном применении. Гранулированная композиция легко проглатывается пожилыми людьми, детьми и пациентами, страдающими дисфагией. Кроме того, продукт по изобретению пригоден для введения с применением трубки. 2 н. и 13 з.п. ф-лы, 5 табл.
Реферат
Область изобретения
Данное изобретение относится к гранулированной фармацевтической композиции, которая маскирует неприятный вкус лекарственного средства и которая обеспечивает приятное ощущение при пероральном применении, и к готовым фармацевтическим формам, полученным из нее.
Предпосылки изобретения
Пероральное применение лекарственного средства, имеющего неприятный вкус, предрасполагает к снижению соблюдения больным режима и схемы лечения и во многих случаях приводит к плохим результатам ожидаемого терапевтического эффекта.
Известные способы маскировки неприятного вкуса тонко гранулированных лекарственных средств предусматривают способ покрытия распылением с применением нерастворимых в воде полимеров и способы с применением микроинкапсулирования или добавки подслащивающих агентов. Пример способа покрытия распылением с применением нерастворимых в воде полимеров использован для приготовления постепенно высвобождающегося лекарственного средства, представлен в японской патентной выложенной заявке (kokai) №30709/1987, в которой содержащее лекарственное средство ядро покрыто этилцеллюлозой, и скорость высвобождения лекарственного средства может контролироваться варьированием толщины этилцеллюлозного покрытия. Однако предложенная для этого технология направлена к постепенно высвобождающимся лекарственным средствам и не обеспечивает технологию, применимую для быстро высвобождающихся лекарственных средств, которая способна маскировать неприятный вкус. Покрытые лекарственные средства с нерастворимым в воде полимером придают песочный вкус во рту пациента при оральном применении и вызывают боль при попадании между зубами пациента; такие создаваемые проблемы относятся к легкости введения. Способ микроинкапсулирования имеет те недостатки, что он делает процедуру приготовления сложной из-за применения органических растворителей и сопровождается низким выходом и высокой стоимостью производства. Способ, использующий добавку подслащивающих агентов, дает слабый маскирующий эффект для лекарственных средств, имеющих сильный неприятный вкус.
В японской патентной выложенной заявке (kokai) №242568/1995 предложены гранулированные лекарственные средства, полученные сплавлением при нагревании гидрофобного вещества с температурой плавления 45-90°С и поверхностно-активного вещества, растворения или суспендирования лекарственного средства, имеющего неприятный вкус, и передающего агента с гранулированием полученной смеси распылительной грануляцией. В указанной публикации поверхностно-активное вещество и передающий агент введены с целью повышения скорости элюирования лекарственного средства, и они содержатся в композиции соответственно в количествах 5-35%. Однако поверхностно-активные вещества предпочтительно используют в уменьшенных количествах с точки зрения обеспечения сохранности. Таким образом, принимая во внимание процесс образования фармацевтических готовых препаративных форм, желательно, чтобы распылительно гранулированные препараты содержали меньшие количества добавок, так чтобы позволить введение других добавок в увеличенных количествах. Таким образом, поверхностно-активные вещества и передающие агенты предпочтительно применяют в возможно меньших количествах. В японской патентной выложенной заявке (kokai) №267850/1995 предложена фармацевтическая композиция, полученная смешиванием одного или более видов лекарственных средств, имеющих неприятный вкус, одного или нескольких видов водорастворимых полимеров и одного или нескольких видов восков; нагреванием и гранулированием расплавленного воска вместе с лекарством(вами) и водорастворимым(ми) полимером(ами). В данной публикации водорастворимые полимеры добавляют с той же целью, что и выше, то есть для повышения скорости растворения лекарственного средства. Водорастворимые полимеры вводят в фармацевтическую композицию в количестве 5-60%. По причинам, указанным выше, водорастворимые полимеры предпочтительно вообще не используют или используют в возможно меньших количествах.
Твердые гранулы, между прочим, порошкообразные продукты, предпочтительно имеют хорошую приспосабливаемость к введению с применением трубки, в добавление к вышеуказанной способности маскирования неприятного вкуса. «Введение с применением трубки» относится к способу введения, который подходит для применения пациенту, который имеет затруднения при глотании фармацевтических готовых препаративных форм. Согласно введению с помощью трубки порошковый препарат диспергируют в воде, и затем дисперсию переносят в шприц для введения дисперсии пациенту через трубку, вставленную в нос или пищеварительный тракт. Во многих случаях дисперсию готовят непосредственно перед применением. Поэтому необходимо, чтобы порошкообразный препарат был однородно диспергирован за короткий период времени и чтобы он не закупоривал шприц или трубку. Порошковые готовые препаративные формы покрыты зависимым от рН полимером, таким как сополимер метакриловой кислоты, в неэлектролитной жидкости, такой как очищенная вода или раствор глюкозы, засоряя шприц или трубку. Поэтому такие порошковые препараты, которые получают с применением сахара в качестве наполнителя, такого как лактоза, также вызывают засорение в шприце или трубке и таким образом не применимы для введения с применением трубки.
В виду вышеизложенного предметом данного изобретения является представление гранулированной фармацевтической композиции, имеющей отличную способность маскировать неприятный вкус лекарственного средства и обеспечивать приятное ощущение при пероральном применении. Другим предметом данного изобретения является обеспечение фармацевтической готовой препаративной формы, содержащей ее.
Описание изобретения
Данное изобретение представляет гранулированный продукт, содержащий лекарственное средство, имеющее неприятный вкус, и охватывает обширное исследование свойств продукта. Неожиданно изобретатели обнаружили, что введение сахарного спирта в комбинацию лекарственного средства, имеющего неприятный вкус, и воскообразного вещества может давать гранулированный фармацевтический продукт, имеющий отличную способность маскировать неприятный вкус и обеспечивающий приятное ощущение при оральном применении, ведущее к выполнению изобретения. Изобретатели обнаружили также, что фармацевтический продукт пригоден для введения с применением трубки.
Соответственно, в первом аспекте данного изобретения предложена гранулированная фармацевтическая композиция, содержащая лекарственное средство, имеющее неприятный вкус, воскообразное вещество и сахарный спирт. Во втором аспекте данного изобретения предложен способ приготовления гранулированной фармацевтической композиции. В третьем аспекте данного изобретения предложен фармацевтический продукт для перорального применения, содержащий гранулированную фармацевтическую композицию.
Наилучшие способы осуществления изобретения
В данном изобретении термин «неприятный вкус» относится к любому горькому вкусу, вяжущему эффекту, едкому вкусу, неприятному раздражению и неприятному запаху.
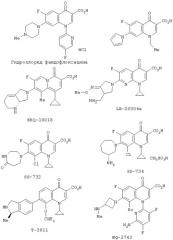
Не наложены частные ограничения на лекарственные средства, имеющие непрятный вкус, если лекарственное средство имеет описанный выше вкус и применимо как фармацевтическое средство. Примерами лекарственных средств являются гидрохлорид цетраксата, экапапид, нефирацетам, гидрохлорид талампициллина, гидрохлорид инденолола, гидрохлорид гидралазина, гидрохлорид хлорпромазина, гидрохлорид тиарамида, хлорид берберина, дигитоксин, сульпирин, гидрохлорид азеластина, гидрохлорид этилефрина, гидрохлорид дилтиазема, гидрохлорид пропранолола, хлорамфеникол, аминофиллин, эритромицин, кларитромицин, фенобарбитал, пантотенат кальция, гидрохлорид инделоксазина, гидрохлорид аминогуанидина, гидрохлорид бифемелана, гидрохлорид 1-(изопропоксикарбонилокси)-этилового эфира 7β-[2-(2-аминотиазол-4-ил)-2-(Z)-гидроксииминоацетамидо]-3-N,N-диметилкарбамоилоксиметил-3-цефем-карбоновой кислоты, (Е)-3-(2-метокси-3,6-диметил-1,4-бензохинон-5-ил)-2-[5-(3-пиридил)пентил]-2-пропеновая кислота, аминофиллин, теофиллин, дифенгидрамин, метоклопрамид, фенилбутазон, фенобарбитал, ампициллин, циметидин, фамотидин, низатидин, ацетоаминофен, эпиризол, пиразинамид, кофеин, этионамид, карведилол, гидрохлорид ранитидина, гидрохлорид ацетата роксатидина, гидрохлорид имипрамина, гидрохлорид эфедрина, гидрохлорид дифенгидрамина, гидрохлорид тетрациклина, гидрохлорид доксициклина, гидрохлорид нафазолина, гидрохлорид носкапина, гидрохлорид папаверина, гидробромид декстрометорфана, бромид тимепидия, малеат хлорфениламмония, тартрат алимемазина, гидрохлорид пилсикаинида, метилсульфат N-метилскополамина, малеат цинепазида, гидрохлорид аргинина, гидрохлорид гистидина, гидрохлорид лизина, ацетат лизина, неочищенные лекарственные вещества или экстракты из Corydalis Tuber, Phellodendron Bark, Coptis Rhizome, Nux vomica, Ephedra Herb, Ipecac, Scopolia Rhizome, Belladonna или Sophora Root; соединения пиридонкарбоновой кислоты, представленные формулами с (1) по (4), и их соли:
(где каждый из R1a, R1b и R1c означает С1-С6 линейную или разветвленную алкильную группу, которая может иметь заместитель, С3-С6 циклическую алкильную группу, которая может иметь заместитель, арильную группу, которая может иметь заместитель, или гетероарильную группу, которая может иметь заместитель;
каждый из R2a, R2b, R2c и R2d означает атом водорода или С1-С6 линейную или разветвленную алкильную группу, которая может иметь заместитель, или аминогруппу;
каждый из R3a, R3b, R3c и R3d означает атом водорода или атом галогена;
R4a или R4c означают атом водорода, атом галогена, С1-С6 линейную или разветвленную алкильную группу, которая может иметь заместитель; или С1-С6 линейную или разветвленную алкоксильную группу, которая может иметь заместитель;
R5d означает атом водорода или С1-С6 линейную или разветвленную алкильную группу, которая может иметь заместитель; и
каждый из Ya, Yb, Yc и Yd означает азотсодержащую группу); и 4,5,6,7-тетрагидротиено[3,2-с]пиридины или их соли, представленные формулой (5):
[где R1 означает фенильную группу, которая может иметь от 1 до 3 заместителей, выбранных из С1-С4-алкильной группы, атома галогена, фторзамещенной С1-С4 алкильной группы, С1-С4 алкоксильной группы, фторзамещенной С1-С4 алкоксильной группы, цианогруппы и нитрогруппы;
R2 означает атом водорода, карбоксильную группу, С1-С6 алкоксикарбонильную группу или С1-С7 алифатическую ацильную группу, которая может иметь заместитель, выбранный из атома галогена, гидроксильной группы, С1-С4 алкоксильной группы и цианогруппы; и
R3 означает 4,5,6,7-тетрагидротиено[3,2-с]пиридин-5-ильную группу, которая может иметь заместитель, выбранный из гидроксильной группы, С1-С4 алкоксильной группы, С1-С4 алкоксильной группы, которая может быть замещена С1-С4 алкоксилом или С1-С6 алканоилокси, С7-С14 аралкилоксигруппы, С1-С18-алканоилоксигруппы, С3-С7-циклоалкилкарбонилоксигруппы, С6-С10 арилкарбонилоксигруппы, С1-С4 алкоксикарбонилоксигруппы и С7-С14 аралкилоксикарбонилоксигруппы].
Вышеуказанные производные пиридонкарбоновой кислоты, представленные формулами (1), (2), (3) или (4), и их соли и способ их получения описаны в следующих ссылках: японские выложенные патетные заявки (kokai) №№53-141286, 55-31042, 57-46986, 57-77683, 60-36482, 60-64979, 60-228479, 62-252772, 62-252790, 62-277362, 1-230558, 1-258666, 1-294680, 2-28178, 2-124873, 2-231475, 5-271229, 7-309864, 8-41050 и WO 91/02526, WO 94/14794, WO 94/15933, WO 95/5373, WO 96/37475, WO 96/39407, WO 97/29102, WO 97/19072, WO 97/40037, WO 98/02431, WO 98/13370, WO 98/18783, WO 98/24781, WO98/52939, WO 98/54169 или WO 98/58923. Указанные публикации раскрывают также способы получения соединений и солей. Соединения, представленные формулой (5), и их соли могут быть получены по способу, описанному в японских патентных выложенных заявках (kokai) №№50-46688, 58-10583, 59-27895 и 6-41139.
Любые из вышеописанных соединений, представленных формулами (1), (2), (3), (4) или (5), могут иметь асимметрический атом углерода и могут существовать как оптические изомеры или диастереомеры. Такие изомеры per se, их произвольные смеси, рацемические смеси и т.д. охватываются рамками данного изобретения. Вышеописанные соединения, представленные формулами с (1) по (5), могут существовать в виде их солей, их гидратов или их сольватов, которые также входят в рамки данного изобретения.
В отношении маскирующего эффекта лекарственные средства, имеющие неприятный вкус, предпочтительно слабо растворимы в воске; более предпочтительно растворимы в воде и слабо растворимы в воске.
Среди вышеописанных соединений, представленных формулами с (1) по (4), и их солей примерами предпочтительных соединений являются следующие:
Кроме того, среди соединений, представленных формулой (5), и их солей примерами предпочтительных соединений являются следующие:
2-гидрокси-5-(α-циклопропилкарбонил-2-хлорбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
2-гидрокси-5-(α-пропионил-2-фторбензил-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
2-гидрокси-5-(α-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
2-ацетокси-5-(α-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
2-пропионилокси-5-(α-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
2-бутирилокси-5-(α-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
2-пивалоилокси-5-(α-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
2-валерилокси-5-(α-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
2-гексаноилокси-5-(α-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
2-трет-бутоксикарбонилокси-5-(α-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
2-пивалоилоксиметокси-5-(α-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
5-(α-циклопропилкарбонил-2-хлорбензил)-2-оксо-2,4,5,6,7,7а-гексагидротиено[3,2-с]пиридин,
5-(α-пропионил-2-фторбензил)-2-оксо-2,4,5,6,7,7а-гексагидротиено[3,2-с]пиридин,
5-(α-циклопропилкарбонил-2-фторбензил)-2-оксо-2,4,5,6,7,7а-гексагидротиено[3,2-с]пиридин,
2-ацетокси-5-(α-циклопропилкарбонил-2-хлорбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
2-гидрокси-5-(α-2-фторциклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
5-(α-2-фторциклопропилкарбонил-2-фторбензил)-2-оксо-2,4,5,6,7,7а-гексагидротиено[3,2-с]пиридин,
2-ацетокси-5-(α-2-фторциклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
5-(α-метоксикарбонил-2-хлорбензил)-2-оксо-2,4,5,6,7,7а-гексагидротиено[3,2-с]пиридин,
2-ацетокси-5-(α-метоксикарбонил-2-хлорбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
5-(α-метоксикарбонил-2-фторбензил)-2-оксо-2,4,5,6,7,7а-гексагидротиено[3,2-с]пиридин,
2-ацетокси-5-(α-метоксикарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
5-(2-хлорбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин (непатентованное название: тиклопидин; доступен в виде гидрохлорида тиклопидина),
5-(α-метоксикарбонил-2-хлорбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин (непатентованное название: клопидогрель; доступен в виде сульфата клопидогреля),
5-(α-метоксикарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено-[3,2-с]пиридин,
5-(α-циклопропилкарбонил-2-хлорбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
5-(α-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин,
5-(α-пропионил-2-хлорбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин и
5-(α-пропионил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-с]пиридин; и их соли.
В данном изобретении лекарственным средством, имеющим неприятный вкус, является предпочтительно офлоксацин, левофлоксацин, гидрат ситафлоксацина, гидрохлорид цетраксата, нефирацетам, гидрохлорид тиклопидина или сульфат клопидогреля.
Примерами воска (в частности, воска, имеющего температуру плавления 40-150°С), который применим в данном изобретении, являются жиры и масла, такие как гидрогенизированные масла (например, гидрогенизированное касторовое масло, гидрогенизированное соевое масло, гидрогенизированное рапсовое масло, гидрогенизированное хлопковое масло), и жиры и масла растительного или животного происхождения (например, карнаубский воск, белый пчелиный воск, говяжье сало); спирты и многоатомные спирты, такие как высшие спирты (например, стеариловый спирт, цетанол) и полиэтиленгликоли (например, макроголь 4000, макроголь 6000); жирные кислоты и их производные, такие как высшие жирные кислоты (например, стеариновая кислота, пальмитиновая кислота) и глицериды жирных кислот и эфиры жирных кислот с сахарозой (например, моноглицерид жирной кислоты, триглицерид жирной кислоты); и смеси двух или более указанных веществ. Из них гидрогенизированные масла, жирные кислоты и производные жирных кислот являются предпочтительными; гидрогенизированные масла, высшие жирные кислоты и эфиры жирных кислот более предпочтительны; и, в частности, предпочтительны гидрогенизированные масла, моноглицериды жирных кислот, триглицериды жирных кислот и стеариновая кислота. С точки зрения эффекта маскирования неприятного вкуса лекарственного средства воск предпочтительно имеет температуру плавления ниже, чем лекарственное средство.
В данном изобретении может быть предпочтительно применение сахарных спиртов, имеющих низкую теплоту растворения; например эритрит, ксилит, сорбит, мальтит или смесь двух или более указанных соединений. С точки зрения ощущения при пероральном применении предпочтителен сахарный спирт, имеющий теплоту растворения - 30 кал/г или меньше, в частности предпочтительны эритрит и ксилит.
В данном изобретении с точки зрения растворимости и эффекта маскирования неприятного вкуса весовое отношение лекарственного средства, имеющего неприятный вкус, к воску предпочтительно находится в пределах между 1:1 и 1:5, более предпочтительно между 1:2 и 1:3. Процентное содержание сахарного спирта в смеси предпочтительно составляет 10 мас.% или более, более конкретно 10-99,9 мас.%, более предпочтительно 20-80 мас.%, наиболее предпочтительно 30-70 мас.%.
Гранулированная композиция данного изобретения может быть приготовлена следующим образом. Воск расплавляют нагреванием и лекарственное средство, имеющее неприятный вкус, диспергируют или растворяют в нем. Затем полученную дисперсию или раствор подвергают первичной грануляции с образованием гранул. Гранулы смешивают с сахарным спиртом или гранулы подвергают вторичной грануляции.
Первичная грануляция может быть осуществлена путем распылительной грануляции или грануляцией из расплава. В качестве альтернативы раствор может быть охлажден до отверждения с последующим раздроблением. Предпочтительна распылительная грануляция. В частности, предпочтительны распыление с охлаждением и сушка распылением, поскольку указанные способы могут легко давать тонкие частицы, не вызывающие неприятного постороннего ощущения во рту. Величина гранул предпочтительно находится в интервале 50-200 мкм, в частности 80-120 мкм.
Если распылительное гранулирование осуществляют для первичной грануляции, может быть добавлено небольшое количество поверхностно-активного вещества для уменьшения прилипания гранул к внутренним стенкам обрабатывающего аппарата во время процесса распыления с охлаждением. Количество поверхностно-активного вещества предпочтительно может находиться в интервале 0,5-5 мас.%, в частности, предпочтительно 1-4 мас.% или около того.
Вторичная грануляция сахарного спирта и гранул, полученных первичной грануляцией, может быть осуществлена влажной грануляцией в псевдоожиженном слое с применением раствора связующего, такого как раствор гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы или поливинилпирролидона. В качестве альтернативы вторичную грануляцию можно выполнять гранулированием в горячем расплаве, где в качестве связующего использованы вещества с низкой температурой плавления, такие как полиэтиленгликоль или моностеарат глицерина.
Гранулированную фармацевтическую композицию данного изобретения предпочтительно получают одним из вышеуказанных способов. Короче говоря, первичной грануляцией могут быть образованы гранулы, в которых лекарственное средство однородно диспергировано в воске, чем достигают успешного маскирования неприятного вкуса из-за очень низкой растворимости воска во рту. Во рту сахарный спирт растворяется в слюне приблизительно за десять секунд, оставляя воск, содержащий лекарство в форме дисперсии. Однако, поскольку частицы воскообразного вещества являются микросферами, они не вызывают неприятного песочного вкуса во рту. Сахарные спирты, в частности эритрит и ксилит, имеют сладкий вкус и придают ощущение свежести и прохлады во рту, обеспечивая эффект максирования неприятного вкуса лекарственного средства. После проглатывания воск высвобождает лекарство в пищеварительном тракте, обеспечивая абсорбцию лекарственного средства в организме.
Гранулированная фармацевтическая композиция данного изобретения может быть получена - с добавлением или без других добавок по необходимости - в виде фармацевтических готовых препаративных форм для перорального применения, таких как порошки, гранулы, сухие сиропы, таблетки и капсулы. В частности, предпочтительны порошки, гранулы и сухие сиропы.
Примерами добавок, применимых для вышеуказанных готовых препаративных форм, могут являться связующее, такое как поливинилпирролидон, поливиниловый спирт, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза, полиэтиленгликоль или моностеарат глицерина; и подсластитель, такой как аспартам, сахаринат натрия, сахарин, тауматин или стевия; ароматизаторы, такие как d1-ментол и 1-ментол; разжижающие агенты, такие как светлая безводная кремневая кислота, алюмометасиликат магния, тальк, синтетический силикат алюминия и этилцеллюлоза; дезинтегранты, такие как кросс-кармелоза-кальций, крахмал-глюконат кальция и низкозамещенная гидроксипропилцеллюлоза; и регуляторы рН, такие как цитрат натрия и бикарбонат натрия. Добавки содержат водорастворимые полимеры. В данном изобретении такие добавки, содержащие водорастворимые полимеры, предпочтительно используют в малых количествах, то есть они составляют 0,1-5% по весу, в частности, предпочтительно 1-4% по весу фармацевтической композиции.
Примеры
Данное изобретение далее описано более детально при помощи примеров, которые не должны рассматриваться как ограничивающие изобретение.
Пример 1
Моностеарат глицерина (200 частей по весу) расплавляли при 90°С и в нем равномерно диспергировали левофлоксацин (100 частей по весу). Дисперсию распыляли с охлаждением, используя распылительную сушилку для получения таким образом мелких гранул. К гранулам (300 частей по весу) прибавляли эритрит (630 частей по весу), и смесь перемешивали с применением гранулятора с псевдоожиженным слоем. Затем впрыскивали в смесь водный раствор поливинилового спирта (10% вес/об.) в количестве, эквивалентном 10 частям по весу поливинилового спирта перед грануляцией в псевдоожиженном слое. После впрыскивания гранулы сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали с применением сита №30 (размер отверстий сита: 500 мкм), получив при этом порошок.
Пример 2
Моностеарат глицерина (197 частей по весу) расплавляли при 90°С и прибавляли моноолеат полиоксиэтилен(20)сорбита (полисорбат 80) (3 части по весу). В полученной смеси равномерно диспергировали левофлоксацин (100 частей по весу). Дисперсию распыляли с охлаждением, используя распылительную сушилку для получения таким образом мелких гранул. К гранулам (300 частей по весу) прибавляли эритрит (630 частей по весу), и смесь перемешивали с применением гранулятора с псевдоожиженным слоем. Затем впрыскивали в смесь водный раствор поливинилового спирта (10% вес/об.) в количестве, эквивалентном 20 частям по весу поливинилового спирта перед грануляцией в псевдоожиженном слое. После впрыскивания гранулы сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали с применением сита №30 (размер отверстий сита: 500 мкм), получив при этом порошок.
Аналогичным описанному в примерах 1 и 2 способу получали порошкообразные готовые препаративные формы из офлоксацина, гидрата ситафлоксацина, гидрохлорида цетраксата или нефирацетама.
Тестовый пример 1 (оценка эффекта маскирования неприятного вкуса: сенсорная проба 1)
Порошок (940 мг), полученный в примере 1, и порошок (950 мг), полученный в примере 2, были подвергнуты сенсорной пробе. Каждый из порошков действительно помещали в рот в количестве, эквивалентном 100 мг левофлоксацина, и оценивали вкус и ощущение. Было обнаружено, что два порошка маскируют очень неприятный вкус лекарственного средства в течение более чем 30 секунд. Через 10 секунд после проглатывания во рту не оставалось посторонних ощущений.
Тестовый пример 2 (оценка эффекта маскирования неприятного вкуса: проба растворимости 1)
Порошок (940 мг), полученный в примере 1, и порошок (950 мг), полученный в примере 2, подвергали испытанию для оценки эффекта демаскирования неприятного вкуса, которое осуществляли с применением аппарата для пробы на растворимость (тестовая жидкость: 500 мл очищенной воды; температура тестовой жидкости 37°С; способ лопастной мешалки; скорость вращения: 100 об./мин). Использование одного лекарственного средства служило контролем. Результаты показаны в таблице 1. Растворимость лекарственного средства на начальной стадии заметно уменьшена по сравнению с случаем применения одного лекарственного средства.
| Таблица 1Результаты пробы на вымывание | ||||
| Время (секунды) | 10 | 20 | 30 | 60 |
| Только лекарственное средство | 58 | 83 | 93 | 103 |
| Пример 1 | 2 | 6 | 12 | 29 |
| Пример 2 | 5 | 12 | 19 | 40 |
Тестовый пример 3 (оценка возможности введения с применением трубки-1)
Порошки, полученные в примерах 1 и 2, оценивали по их способности применения при введении через трубку. Каждый из порошков (950 мг) диспергировали в очищенной воде (20 мл). Дисперсию помещали в одноразовый шприц, который был соединен с энтеральной питательной трубкой (торговое название ARGAIL, производство Japan Sharwood; новая энтеральная питательная трубка; внутренний диаметр 1,0 мм). Дисперсию экструдировали из шприца, и верхний конец шприца и верхний конец трубки проверяли на закупоривание. Результаты показаны в таблице 2.
| Таблица 2Результаты оценки приспосабливаемости к введению с применением трубки | |
| Результаты | |
| Пример 1 | Не наблюдалось закупоривания у верхнего конца шприца или верхнего конца трубки |
| Пример 2 | Не наблюдалось закупоривания у верхнего конца шприца или верхнего конца трубки |
В примерах 1 и 2 не наблюдали закупоривания, и, таким образом, было обнаружено, что возможно плавное введение.
Тестовый пример 4 (проба растворимости 1)
Порошок (940 мг), полученный в примере 1, и порошок (950 мг), полученный в примере 2, были подвергнуты пробе на растворимость, которая была проведена в аппарате для пробы на растворимость (тестовая жидкость: 900 мл первой жидкости, описанной в Pharmacopoeia of Japan, дезинтеграционная проба; температура тестовой жидкости: 37°С; способ лопастной мешалки; скорость вращения: 50 об./мин). Как очевидно из таблицы 3, обнаружено, что указанные порошки проявляют отличную растворимость.
| Таблица 3Результаты испытаний растворимости (отношение средней растворимости (%)) | ||||||
| Время | через 5 мин | через 10 мин | через 20 мин | через 30 мин | через 45 мин | через 60 мин |
| Пример 1 | 100 | 100 | 100 | 100 | 100 | 100 |
| Пример 2 | 98 | 98 | 98 | 98 | 98 | 98 |
Пример 3
Триглицерид жирной кислоты (216 частей по весу) расплавляли при 80°С, и добавляли моноолеат полиоксиэтилен(20)сорбита (полисорбат 80) (11,2 частей по весу). В полученной смеси равномерно диспергировали сульфат клопидогреля (97,8 частей по весу). Дисперсию охлаждали распылением с применением распылительной сушилки с образованием мелких гранул. К гранулам (325 частей по весу) прибавляли эритрит (169 частей по весу) и аспартам (5 частей по весу) с образованием порошка.
Пример 4
Триглицерид жирной кислоты (216 частей по весу) расплавляли при 80°С, и добавляли моноолеат полиоксиэтилен(20)сорбита (полисорбат 80) (11,2 частей по весу). В полученной смеси равномерно диспергировали сульфат клопидогреля (97,8 частей по весу). Дисперсию распыляли с охлаждением, используя распылительную сушилку, с образованием мелких гранул. К гранулам (325 частей по весу) прибавляли эритрит (169 частей по весу) с последующим перемешиванием с применением гранулятора с псевдоожиженным слоем. Затем в смесь впрыскивали водный раствор поливинилового спирта (10% вес/об.) в количестве, эквивалентном 20 частям по весу поливинилового спирта перед грануляцией в псевдоожиженном слое. После впрыскивания гранулы сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы (514 частей по весу) смешивали с аспартамом (5 частей по весу), получая порошок.
Пример 5
Триглицерид жирной кислоты (216 частей по весу) растворяли в дихлорметане. В полученной смеси равномерно диспергировали сульфат клопидогреля (97,8 частей по весу) и этилцеллюлозу (32,6 частей по весу). Дисперсию охлаждали распылением с применением распылительной сушилки, получая при этом мелкие гранулы. К гранулам (346,4 частей по весу) прибавляли эритрит (147,6 частей по весу) и аспартам (5 частей по весу), получая при этом порошок.
Пример 6
Триглицерид жирной кислоты (216 частей по весу) растворяли в дихлорметане. В полученной смеси равномерно диспергировали сульфат клопидогреля (97,8 частей по весу) и этилцеллюлозу (32,6 частей по весу). Дисперсию распыляли с охлаждением, используя распылительную сушилку, получая при этом мелкие гранулы. К гранулам (346,4 частей по весу) прибавляли эритрит (147,6 частей по весу) с последующим перемешиванием с применением гранулятора с псевдоожиженным слоем. Затем в смесь впрыскивали водный раствор поливинилового спирта (10% вес/об.) в количестве, эквивалентном 20 частям по весу поливинилового спирта перед грануляцией в псевдоожиженном слое. После впрыскивания гранулы сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы (514 частей по весу) смешивали с аспартамом (5 частей по весу), получая порошок.
Сравнительный пример 1
Триглицерид жирной кислоты (135 частей по весу) расплавляли при 80°С, и прибавляли моноолеат полиоксиэтилен(20)сорбита (полисорбат 80) (7 частей по весу). В полученной смеси равномерно диспергировали сульфат клопидогреля (61 часть по весу). Дисперсию распыляли с охлаждением, используя распылительную сушилку, получая при этом мелкие гранулы. К гранулам (346,4 частей по весу) добавляли лактозу (147,6 частей по весу) и аспартам (5 частей по весу), получая при этом порошок.
Тестовый пример 5 (оценка эффекта маскирования неприятного вкуса: сенсорная проба 2)
Каждый из порошков, полученных в примерах с 3 по 6, подвергали сенсорной пробе. Каждый из порошков действительно помещали в рот в количестве, эквивалентном 100 мг сульфата клопидогреля, и оценивали вкус и ощущение. Было обнаружено, что все эти порошки маскировали очень неприятный вкус лекарственного средства в течение более чем 30 секунд. Через 10 секунд после прогатывания во рту не оставалось постороннего ощущения.
Тестовый пример 6 (оценка эффекта маскирования неприятного вкуса: проба растворимости 2)
Порошки (500 мг), полученные в примерах с 3 по 6, подвергали испытанию для оценки эффекта демаскирования неприятного вкуса, которое проводили с применением аппарата для испытания растворимости (тестовая жидкость: 300 мл очищенной воды; температура тестовой жидкости 37°С; способ лопастной мешалки; скорость вращения: 100 об./мин). В качестве результата было подтверждено, что каждый порошок способен значительно уменьшать растворимость лекарственного средства на начальной стадии по сравнению со случаем, в котором использовано одно лекарственное средство.
Тестовый пример 7(оценка возможности введения с применением трубки - 2)
Порошки, полученные в сравнительном примере 1 и примере 5, были оценены по их способности к введению с применением трубки. Каждый из порошков (500 мг) диспергировали в очищенной воде (20 мл). Дисперсию помещали в одноразовый шприц, который был соединен с энтеральной питательной трубкой (торговое название ARGAIL, производство Japan Sharwood; новая энтеральная питательная трубка; внутренний диаметр 1,0 мм). Дисперсию экструдировали из шприца, и верхний конец шприца и верхний конец трубки проверяли на закупоривание. Результаты показаны в таблице 4.
| Таблица 4Результаты оценки приспосабливаемости к введению с применением трубки | |
| Результаты | |
| Сравнительный пример 1 | Наблюдали закупоривание у верхнего конца трубки непосредственно после подачи порошка, и дисперсия с трудом выталкивалась из трубки |
| Пример 5 | Не наблюдалось закупоривания у верхнего конца шприца или верхнего конца трубки |
Результаты сравнительного примера 1 показывают, что данный сравнительный продукт является слишком сложным для эффективного введения и поэтому не подходит для введения через трубку. Напротив, продукт примера 5 не вызывает нежелательного закупоривания, что делает возможным его плавное введение.
Тестовый пример 8 (проба на растворимость 2)
Порошок (326,5 мг), полученный в примере 3, подвергали испытанию на вымывание, которое проводили с применением тестового аппарата на вымывание (тестовая жидкость: 900 мл первой жидкости, как описано в Pharmacopoeia of Japan (содержащая около 1% лаурилсульфата), дезинтеграционная проба; температура тестовой жидкости: 37°С; способ лопастной мешалки; скорость вращения: 50 об./мин). Как показано в таблице 5, было обнаружено, что порошок примера 3 проявляет отличную растворимость.
| Таблица 5Результаты пробы на вымывание | ||||||
| Время | через 10 мин | через 15 мин | через 20 мин | через 30 мин | через 45 мин | через 60 мин |
| Средний уровень вымывания (%) | 75,7 | 83,4 | 88,5 | 94,0 | 99,7 | 100,9 |
Промышленное применение изобретения
Данное изобретение обеспечивает готовую препаративную форму, которая отлично маскирует неприятный вкус лекарственного средства и которая дает приятное ощущение при пероральном введении и поэтому легко проглатывается даже пожилыми, детьми и пациентами, страдающими дисфагией. Указанная фармацевтическая готовая препаративная форма применима также для введения с применением трубки.
1. Гранулированная фармацевтическая композиция, содержащая гранулированный материал, включающий лекарственное вещество, имеющее неприятный вкус, и воск; и эритрит.
2. Гранулированная фармацевтическая композиция по п.1, где лекарственное средство, имеющее неприятный вкус, слабо растворимо в воске.
3. Гранулированная фармацевтическая композиция по п.1, где лекарственное средство, имеющее неприятный вкус, растворимо в воде и слабо растворимо в воске.
4. Гранулированная фармацевтическая композиция по любому из пп.1-3, где воск имеет температуру плавления 40-150°С.
5. Гранулированная фармацевтическая композиция по любому из пп.1-4, где воск является веществом, выбранным из группы, состоящей из гидрогенизированных масел, жиров и масел растительного или животного происхождения, высших спиртов, полиэтиленгликолей, высших жирных кислот, глицеридов жирных кислот, эфиров жирных кислот с сахарозой, и комбинаций из двух или более указанных компонентов.
6. Гранулированная фармацевтическая композиция по любому из пп.1-5, где лекарственное средство, имеющее неприятный вкус, выбрано из группы, состоящей из гидрохлорида цетраксата, экапапида, нефирацетама, гидрохло