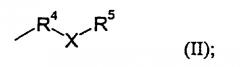Производные адамантана, способы их получения, фармацевтическая композиция на их основе и способ ее получения, способы лечения ревматоидного артрита и хронического обструктивного заболевания легких
Иллюстрации
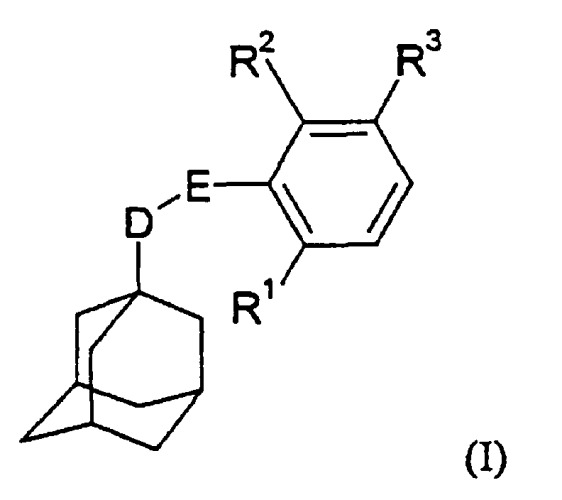
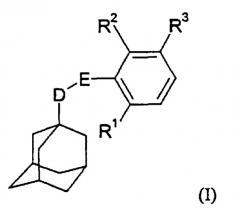
Показать всеИзобретение относится к производным адамантана формулы (I)
где D представляет собой СН2 или СН2СН2; Е представляет собой С(О)NH или NHC(O); R1 и R2, каждый, независимо, представляют собой водород или галоген, но R1 и R2 не могут одновременно означать водород; R3 представляет собой группу формулы -R4-X-R5 (II), где R4 представляет собой С1-С6 алкильную группу; Х представляет собой атом кислорода или серы, либо группу NR13; R5 представляет собой С1-С6 алкил или С2-С6 алкенил, каждый из которых может быть необязательно замещен по крайней мере одним заместителем, выбранным из галогена, гдроксила, (ди)-С1-С6-алкиламино, -Y-R6,
и 5- или 6-членное гетероароматическое кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, причем гетероароматическое кольцо может быть необязательно замещено по крайней мере одним С1-С6 алкилом; Y представляет собой атом кислорода или серы или группу NH; R6 представляет собой группу -R7Z, где R7 представляет собой С2-С6 алкильную группу и Z представляет собой -ОН, и в том случае, когда Y представляет собой атом кислорода или серы или группу NH, R6 дополнительно представляет собой водород, С1-С6 алкил, С1-С6 алкилкарбонил; R13 представляет собой водород, С3-С8 циклоалкил, С3-С8 циклоалкилметил, или R13 представляет собой С1-С6 алкильную группу, необязательно замещенную по крайней мере одним гидроксилом, или его фармацевтически приемлемым солям или сольватам, которые являются эффективными антагонистами рецептора P2X7, и могут быть использованы для лечения ревматоидного артрита или хронического обструктивного заболевания легких. Также описаны способы их получения, фармацевтическая композиция, содержащая указанные соединения, способ получения фармацевтической композиции и их применение в терапии. 7 н. и 12 з. п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к производным адамантана, способу их получения, фармацевтическим композициям, содержащим указанные вещества, способу получения фармацевтических композиций и их применению в терапии.
Рецептор Р2Х7 (ранее известный как рецептор P2Z), который представляет собой блокируемый лигандом ионный канал, присутствует на клетках разных типов, преимущественно участвующих в воспалительных/иммунных процессах, в частности на макрофагах, мастоцитах и лимфоцитах (Т и В). Активация рецептора Р2Х7 внеклеточными нуклеотидами, в частности аденозинтрифосфатом, вызывает высвобождение интерлейкина-1β (IL-1β) и образование гигантских клеток (макрофагов/микроглиальных клеток), дегрануляцию (мастоцитов) и выделение L-селектина (лимфоцитов). Рецепторы Р2Х7 расположены также на антиген-представляющих клетках (АРС), кератиноцитах, ацинарных клетках слюны (клетки околоушной железы), гепатоцитах, эритроцитах, эритролейкозных клетках, моноцитах, фибробластах, клетках костного мозга, нейронах и мезангиальных клетках почек.
Была бы желательна разработка соединений, эффективных в качестве антагонистов рецептора Р2Х7, необходимых для лечения воспалительных, иммунных или сердечно-сосудистых заболеваний, в этиологии которых может играть роль рецептор Р2Х7.
В соответствии с настоящим изобретением предложено соединение общей формулы
где D представляет собой СН2 или СН2СН2;
Е представляет собой C(O)NH или NHC(O);
R1 и R2, каждый, независимо, представляют собой водород или галоген, но R1 и R2 не могут одновременно означать водород;
R3 представляет собой группу формулы
R4 представляет собой C1-C6 алкильную группу;
Х представляет собой атом кислорода или серы, либо группу NR13;
R5 представляет собой C1-С6 алкил или С2-С6 алкенил, каждый из которых может быть необязательно замещен по крайней мере одним заместителем, выбранным из галогена, гидроксила, (ди)-C1-С6-алкиламино, -Y-R6,
и 5- или 6-членное гетероароматическое кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, причем гетероароматическое кольцо может быть необязательно замещено по крайней мере одним C1-C6 алкилом;
Y представляет собой атом кислорода или серы или группу NH;
R6 представляет собой группу -R7Z, где R7 представляет собой С2-С6 алкильную группу и Z представляет собой -ОН, и в том случае, когда Y представляет собой атом кислорода или серы или группу NH, R6 дополнительно представляет собой водород, C1-С6 алкил, C1-C6 алкилкарбонил;
R13 представляет собой водород, С3-C8 циклоалкил, С3-С8 циклоалкилметил, или R13 представляет собой C1-C6 алкильную группу, необязательно замещенную по крайней мере одним гидроксилом;
при условии, что, когда Е представляет собой C(O)NH, X представляет собой О, NH или N(C1-C6 алкил), тогда R5 не является незамещенной C1-C6 алкильной группой;
или его фармацевтически приемлемая соль или сольват.
В настоящем описании изобретения, за исключением особо оговоренных случаев, алкильный заместитель или алкильная часть в замещающей группе может быть прямым или разветвленным. В настоящем изобретении алкильная группа или часть может содержать до 6 атомов углерода, примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил и н-гексил. С2-С6 алкенильная группа может быть прямой или разветвленной. В ди-С1-С6-алкиламиногруппе алкильные части могут быть одинаковыми или различными.
Предпочтительно, D представляет собой СН2.
Предпочтительно, Е представляет собой NHC(О).
Предпочтительно, R1 и R2, каждый, независимо, представляют собой атом водорода, хлора или брома.
Предпочтительно, Х представляет собой атом кислорода или группу NR13.
Предпочтительно, R13 представляет собой водород, (СН2)2OH, метил, этил, н-пропил, изопропил, н-бутил, н-пентил, н-гексил, циклопропил, циклопентил, циклогексил или циклогексилметил.
Предпочтительно, R5 представляет собой C1-С6 алкильную группу, замещенную одним заместителем -Y-R6.
Предпочтительно, Y представляет собой атом кислорода или серы или группу NH.
Предпочтительно, R6 представляет собой -(СН2)2OH, -(СН2)3ОН, водород, метил, изопропил, метилкарбонил или трет-бутилкарбонил.
Предпочтительными соединениями по данному изобретению являются:
дигидрохлорид 2-хлор-5-[[2-(2-гидроксиэтиламино) этиламино] метил] -N- (трицикло [3.3.1.13,7] дец-1-илметил)бензамида;
2-хлор-5-[[2-(2-гидроксиэтокси)этиламино]метил]-N-(трицикло [3.3.1.13,7]дец-1-илметил) бензамид;
2-хлор-5-[(3-гидрокси-2,2-диметилпропиламино)метил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[(5-гидроксипентиламино)метил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[[2-[(2-гидроксиэтилтио)этиламино]метил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
ацетат 2-хлор-5-[3-[(2-гидроксиэтил)амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида;
гидрохлорид 2-хлор-5-[3-[(3-гидроксипропил)амино]пропил]-N-(трицикло [3.3. 1.13,7] дец-1-илметил) бензамида;
ацетат 2-хлор-5-[3-(метиламино)пропил]-N-(трицикло[3.3. 1.13'7] дец-1-илметил) бензамида;
гидрохлорид 2-хлор-5-[3-[(1-метилэтил)амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида;
дигидрохлорид 5-[3-[(2-амино-2-метилпропил)амино]пропил]2-хлор-N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамида;
2-хлор-5-[3-[(4-гидроксибутил)амино]пропил]-N-(трицикло [ 3.3. 1.13,7] дец-1-илметил) бензамид;
ацетат 2-хлор-5-[3-[(2-гидрокси-2-метилпропил)амино]пропил]-N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамида;
дигидрохлорид 2-хлор-5- [3- [ [2- (метиламино) этил] амино] пропил] -N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамида;
гидрохлорид (S)-2-хлор-5-[3-[(2-гидроксипропил)амино]пропил]-N- (трицикло [3.3.1.13,7]дец-1-илметил) бензамида;
гидрохлорид (R) -2-хлор-5- [3- [ (2-гидроксипропил) амино] пропил] -N- (трицикло [3.3.1.13,7]дец-1-илметил)бензамида;
гидрохлорид (R) -2-хлор-5-[3-[(2-гидрокси-1-метилэтил)амино]-пропил] -N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамида;
2-хлор-5-[3-[[2-гидрокси-1-(гидроксиметил)-1-метилэтил] амино] пропил] -N- (трицикло [3.3.1.13,7] дец-1-илметил)бензамид;
гидрохлорид 5-[3-[[2-(ацетиламино)этил]амино]пропил]-2-хлор-N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамида;
дигидрохлорид 2-хлор-5-[3-[[2-(диэтиламино)этил]амино]пропил]-N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамида;
гидрохлорид 2-хлор-5-[3-[(3-метоксипропил)амино]пропил] -N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамида;
гидрохлорид 2-хлор-5-[3-[(3-гидрокси-3-метилбутил) амино] пропил] -N- (трицикло [3.3.1.13,7] дец-1-илметил)бензамида;
гидрохлорид 2-хлор-5-[3-[(2-метоксиэтил)амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида;
2-хлор-5-[[3-(метиламино)пропокси]метил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
соль уксусной кислоты 2-хлор-5-[[2-[(2-гидроксиэтил)амино]этокси]метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида;
соль уксусной кислоты 2-хлор-5-[[2-[ (3-гидроксипропил)амино]этокси]метил]-N-(трицикло[3.3.1.I3,7]дец-1-илметил)бензамида;
2-хлор-5-[[[3-[(1-метилэтил)амино]пропил]амино]метил]-N-(трицикло [3.3.1.13,7]дец-1-илметил) бензамид;
5-[[(3-аминопропил)амино]метил]-2-хлор-N-(трицикло [3.3.1.13,7] дец- 1-илметил) бензамид;
2-хлор-5-[[[2-[(1-метилэтил)амино]этил]амино]метил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
соль трифторуксусной кислоты 2,2-диметилпропилового эфира 3- [ [3- [4-хлор-3- [ [ (трицикло[3. 3.1. 13,7]дец,-1-илметил)амино]карбонил]фенил]пропил]амино]пропановой кислоты;
2-хлор-5-[3-[(2 -гидроксиэтил)пентиламино]пропил]-N-(трицикло[ 3.3. 1.13,7] дец- 1-илметил) бензамид;
2-хлор-5-[3-(метил-2-пропениламино)пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[[2-(диметиламино)этил]метиламино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
5-[3-(бутилэтиламино)пропил]-2-хлор-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-(метилпентиламино)пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[[2-(диэтиламино)этил]этиламино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[(2-гидроксиэтил)метиламино]пропил]-N-(трицикло [3. 3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-(дипропиламино)пропил]-N-(трицикло[ 3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[(2-гидроксиэтил)(1-метилэтил)амино]пропил]-N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
5-[3-[бутил(2-гидроксиэтил)амино]пропил]-2-хлор-N-(трицикло [3. 3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-(диэтиламино)пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-(диметиламино)пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
5-[3-(бутилметиламино)пропил]-2-xnop-N-(трицикло [3.3. 1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[(2-гидроксиэтил)пропиламино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[этил(2-гидроксиэтил)амино]пропил]-N-(трицикло [3.3. 1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-(дибутиламино)пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-(этилпропиламино)пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[метил(1-метилэтил)амино]пропил]-N-(трицикло [3.3. 1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[[3-(диметиламино)пропил]метиламино]пропил]-N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[циклогексил(2-гидроксиэтил)амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-(циклогексилметиламино)пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[[1-(гидроксиметил)-2,2-диметилпропил] амино] пропил] -N- (трицикло [3.3.1.13,7] дец-1-илметил)бензамид;
2-хлор-5-[3-[[2-(диметиламино)этил]амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[(3-гидрокси-2,2-диметилпропил)амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[(1,1-диметилэтил)амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[[3-(диметиламино)пропил]амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-N- (трицикло [3.3.1.13,7] дец-1-илметил) -5- [3-[(1,2,2-триметилпропил)амино]пропил]бензамид;
5- [3- (бутиламино) пропил] -2-хлор-N- (трицикло [3.3.1.13,7] дец-1-илметил) -бензамид;
2-хлор-5-[3-[[1-(гидроксиметил)-2-метилпропил]амино]пропил]-N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[(1-метилпропил)амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[[2-(метилтио)этил]амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[(2-гидрокси-1,1-диметилэтил)амино]пропил]-N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-(2-пропениламино)пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[(2-фторэтил)амино]пропил]-N-(трицикло [3.3.1. 13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[(2-метокси-1-метилэтил)амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
дигидрохлорид 2-хлор-5-[3-[3-(метиламино)пропокси]пропил]-N- (трицикло [3.3.1.13,7] дец-1-илметил)бензамида;
5-[[[(1-аминоциклопропил) метил] (2-гидроксиэтил) амино] метил] -2-хлор-N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
5-[[(2-гидроксиэтил)[2-(метиламино)этил]амино]метил]-2-метил-N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5- [3-[[2-(1-метил-1Н-имидазол-4-ил) этил] амино] пропил] -N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамид;
2-хлор-5-[3-[[2-(1Н-имидазол-4-ил)этил]амино]пропил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид; и
2-хлор-5-[3-[[3-(1Н-имидазол-1-ил)пропил]амино]пропил]-N- (трицикло [3.3.1.13,7] дец-1-илметил) бензамид и
их фармацевтически приемлемые соли и сольваты.
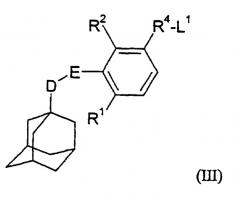
В настоящем изобретении далее предложен способ получения описанного выше соединения формулы (I), когда Х представляет собой атом кислорода или серы или группу NR13, который заключается в том, что:
соединение общей формулы
где L1 представляет собой удаляемую группу (например, атом галогена или трифторметансульфонатную группу) и D, Е, R1, R2 и R4 имеют значения, указанные в формуле (I), подвергают взаимодействию с соединением общей формулы
где Х' представляет собой атом кислорода или серы или группу NR13 и R5 имеет значения, указанные в формуле (I), необязательно в присутствии приемлемой соли серебра, и полученное соединение формулы (I) необязательно преобразуют в его фармацевтически приемлемую соль или сольват.
Предложен также способ получения соединения формулы (I), когда Х представляет собой атом кислорода или серы или группу NR13, который заключается в том, что:
соединение общей формулы
где R20 представляет собой связь или C1-С5 алкильную группу и D, Е, R1 и R2 имеют значения, указанные в формуле (I), подвергают взаимодействию с соединением общей формулы
где R5 и R13 имеют значения, указанные в формуле (I), в присутствии восстановителя; и полученное соединение формулы (I) необязательно преобразуют в его фармацевтически приемлемую соль или сольват.
Способы по данному изобретению можно удобно осуществлять в растворителе, например, органическом растворителе, таком как дихлорметан, 1,2-дихлорэтан или тетрагидрофуран, при температуре в интервале от 0 до 200°С, предпочтительно от 0 до 150°С.
Соединения формулы (V), в которых R20 представляет собой связь, могут быть получены путем взаимодействия соединения общей формулы
где Hal представляет собой атом галогена, такой как бром, и D, Е, R1 и R2 имеют значения, указанные в формуле (I), с основанием, таким как трет-бутиллитий, и далее с формилирующим агентом, таким как диметилформамид.
Соединения формулы (VII) могут быть удобно получены путем взаимодействия соединения общей формулы
где R25 представляет собой NH2 или CO2Н и D имеет значения, указанные в формуле (I), с соединением общей формулы
где R30 представляет собой СО2Н или NH2, и R1, R2 и Hal имеют значения, указанные выше в формуле (VII).
Соединения формулы (V), в которых R20 представляет собой C1-C5 алкильную группу, могут быть получены путем взаимодействия соответствующего соединения формулы (V), в котором R20 представляет собой связь, с (метоксиметил)дифенилфосфиноксидом в присутствии основания или с соединением общей формулы
где n равно 0, 1, 2 или 3 и R и R', каждый, независимо, представляют собой C1-C6 алкильные группы, с последующим гидрированием.
Альтернативно, соединения формулы (V), в которой R20 представляет собой С2-С5 алкильную группу, могут быть получены путем взаимодействия соединения формулы (VII) с алкенолом (например, 2-пропен-1-ол (аллиловый спирт), бут-3-енол, пент-4-енол или гекс-5-енол) в присутствии палладиевого катализатора, с последующим гидрированием и оксилением, при использовании, например, реактива перйодинана Десса-Мартина (две последние стадии могут не потребоваться, когда алкенол представляет собой аллиловый спирт).
В качестве другой альтернативы, соединения формулы (V), в которых R20 представляет собой C2-C5 алкильную группу, могут быть получены путем взаимодействия соединения формулы (VII) со сложным эфиром алкеновой кислоты (например, метилакрилат или этилакрилат) в присутствии палладиевого катализатора, такого как ацетат палладия, с последующим восстановлением сложноэфирной группы в гидроксильную группу и окислением в альдегид при помощи окислителя (например, реактив перйодинана Десса-Мартина).
Соединения формулы (I), в которых R5 представляет собой C2-С6 алкильную группу, замещенную группой -Y-R6, где Y представляет собой О, S или NH и R6 представляет собой указанную выше группу -R7Z, могут быть получены путем взаимодействия соответствующего соединения формулы (I), в которой R5 представляет собой С2-С6 алкильную группу, замещенную гидроксильной группой, с активирующим гидроксил агентом (таким как метансульфонилхлорид) в присутствии основания (такого как триэтиламин) с последующим взаимодействием с соединением формулы HO-R7Z, HS-R7Z или H2N-R7Z.
Соединения формулы (I), где Е представляет собой группу NHC(О), могут быть получены из соединения общей формулы
где R1, R2 и R3 имеют значения, указанные в формуле (I), и Х представляет собой О, S или NR13, путем взаимодействия с адамантилметиламином или адамантилэтиламином в присутствии связующего вещества, такого как 1,1'-карбонилдиимидазол.
Соединения формулы (I), где Е представляет собой группу C(O)NH, могут быть получены из соединения общей формулы
где R1, R2 и R3 имеют значения, указанные в формуле (I), и Х представляет собой О, S или NR13, путем взаимодействия с адамантилацетилхлоридом или адамантилпропаноилхлоридом в присутствии основания, такого как триэтиламин.
Соединения формулы (XI) могут быть получены из соединения общей формулы
где L2 представляет собой удаляемую группу (такую как атом галогена или трифторметансульфонатная группа), и R1, R2 и R4 имеют значения, указанные в формуле (I), путем взаимодействия с указанным выше соединением формулы (IV), необязательно, в присутствии соли серебра, такой как трифторметансульфонат серебра.
Соединения формулы (XII) могут быть получены из соединения общей формулы
где L3 представляет собой удаляемую группу (такую как атом галогена или трифторметансульфонатная группа) и R1, R2 и R4 имеют значения, указанные в формуле (I), путем взаимодействия с указанным выше соединением формулы (IV) необязательно в присутствии соли серебра, такой как трифторметансульфонат серебра.
Следует отметить, что некоторые соединения формулы (I) можно преобразовать в другие соединения формулы (I). Например, соединения формулы (I), в которой -Y-R6 представляет собой -ОН, можно преобразовать в соединения, в которых Y представляет собой О и R6 представляет собой C1-C6 алкоксикарбонил, путем взаимодействия с ацилирующим агентом. Кроме того, соединения формулы (I), в которой Х представляет собой NR13 и R13 не является водородом и представляет собой, например, циклогексильную группу, могут быть получены путем взаимодействия соединения формулы (I), в которой Х представляет собой NH, с циклогексаноном в присутствии восстановителя, такого как триацетоксиборогидрид натрия.
Соединения формулы (III), (IV), (VI), (VIII), (IX), (X), (XIII) и (XIV), а также соединения HO-R7Z, HS-R7X и H2N-R7Z являются коммерчески доступными, или они описаны в научной литературе или их можно легко получить известными методами.
Специалистам в данной области должно быть известно, что в соответствии со способами по настоящему изобретению некоторые функциональные группы, такие как гидроксильные, карбоксильные, альдегидные, карбонильные или аминогруппы, в исходных реагентах или промежуточных соединениях должны быть защищены защитными группами. Поэтому способы получения соединений формулы (I) могут включать на некоторой стадии удаление одной или нескольких защитных групп.
Способы введения и удаления защитных групп у функциональных групп описаны в публикациях "Protective Groups in Organic Chemistry", edited by J.W.F. McOmie, Plenum Press (1973) и "Protective Groups in Organic Synthesis", 2nd edition, T.W. Greene and P.G.M. Wuts, Wiley-Interscience (1991).
Вышеуказанные соединения формулы (I) можно перевести в фармацевтически приемлемую соль или сольват, предпочтительно, в кислотно-аддитивную соль, такую как гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат или паратолуолсульфонат, или в соль щелочного металла, такую как соль натрия или калия.
Некоторые соединения формулы (I) могут существовать в стереоизомерных формах. Следует отметить, что в объем данного изобретения входят все геометрические и оптические изомеры соединений формулы (I) и их смеси, включая рацематы. Таутомеры и их смесь также образуют аспект настоящего изобретения.
Преимуществом соединений по настоящему изобретению является то, что они обладают фармакологической активностью и являются модуляторами активности рецепторов Р2Х7. Поэтому их можно использовать в качестве фармацевтических средств при лечении или профилактике ревматоидного артрита, остеоартрита, псориаза, аллергического дерматита, астмы, повышенной чувствительности дыхательных путей, хронического обструктивного заболевания легких (COPD), бронхита, септического шока, гломерулонефрита, слизистого колита, болезни Крона, неспецифического язвенного колита, атеросклероза, роста и образования метастазов клеток злокачественного новообразования, миобластомного лейкоза, диабетов, нейродегенеративного заболевания, болезни Альцгеймера, менингита, остеопороза, ожогов, ишемической болезни сердца, инсульта, заболевания периферических сосудов и варикозного расширения вен.
Таким образом, настоящее изобретение относится к описанному выше соединению формулы (I), его фармацевтически приемлемой соли или сольвату, предназначенным для использования в терапии.
Другой целью данного изобретения является применение вышеописанного соединения формулы (I), его фармацевтически приемлемой соли или сольвата для изготовления лекарственного средства, предназначенного для использования в терапии.
В настоящем описании изобретения термин "терапия" представляет собой также "профилактику", за исключением особо оговоренных случаев. Термины "терапевтический" и "терапевтически" имеют аналогичные значения.
Профилактика непосредственно связана с лечением субъектов, ранее перенесших какое-либо заболевание или характеризующихся повышенным риском его возникновения. Субъектами с повышенным риском возникновения конкретного заболевания обычно являются лица с наследственным анамнезом данного заболевания, а также лица, у которых в результате генетического тестирования или обследования выявлена предрасположенность к какому-либо заболеванию.
Данное изобретение далее относится к способу подавления иммунитета (например, при лечении ревматоидного артрита, слизистого колита, атеросклероза, псориаза, заболевания легких, например, COPD или бронхита, заболеваний центральной нервной системы, например, болезни Альцгеймера или инсульта), который включает введение нуждающемуся субъекту терапевтически эффективного количества описанного выше соединения формулы (I), его фармацевтически приемлемой соли или сольвата.
В случае вышеуказанного терапевтического применения вводимая доза будет изменяться в зависимости от используемого соединения, способа введения, требуемого лечения и конкретного заболевания. Для подавления иммунитета суточная доза соединения формулы (I) обычно составляет от 0,001 мг/кг до 30 мг/кг.
Соединения формулы (I), их фармацевтически приемлемые соли и сольваты можно использовать в чистом виде, но обычно их вводят в форме фармацевтической композиции, в которой соединение формулы (I)/соль/сольват (активный ингредиент) находится в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем. В зависимости от способа введения, фармацевтическая композиция предпочтительно содержит от 0,05 до 99 мас.% (массовых процентов), более предпочтительно от 0,10 до 70 мас.% активного ингредиента и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,90 мас.% фармацевтически приемлемого адъюванта, разбавителя или носителя; все проценты выражены в массовых процентах в расчете на общую массу композиции.
Таким образом, настоящее изобретение относится также к фармацевтической композиции, содержащей соединение формулы (I), его фармацевтически приемлемую соль или сольват в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Настоящее изобретение далее относится к способу получения фармацевтической композиции по данному изобретению, который включает смешивание соединения формулы (I), его фармацевтически приемлемой соли или сольвата с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Фармацевтическую композицию по данному изобретению можно вводить местно (например, в легкие и/или дыхательные пути или на кожу) в форме растворов, суспензий, гептафторалкановых аэрозолей и сухих порошков или системно, например, перорально в форме таблеток, капсул, сиропов, порошков или гранул, парентерально в форме растворов или суспензий, подкожно, ректально в форме суппозиториев или чрескожно.
Далее настоящее изобретение описано с отсылкой к нижеследующим иллюстративным примерам.
Пример 1
Дигидрохлорид 2-хлор-5-[[2-(2-гидроксиэтиламино)этиламино]-метил] -N(трицикло [3.3.1.13,7]дец-1-илметил) бензамида
а) 5 -Бром-2-хлор-N(трицикло [3.3.1.13,7]дец-1-илметил) бензамид
К суспензии 5-бром-2-хлорбензойной кислоты (5,00 г) в дихлорметане (25 мл) при 0°С добавляют оксалилхлорид (3,7 мл) и ДМФ (5 капель). Полученную смесь перемешивают при комнатной температуре в атмосфере азота в течение 1 часа и концентрируют при пониженном давлении, получая твердое вещество. Твердое вещество растворяют в дихлорметане (20 мл) и по каплям добавляют к раствору 1-адамантанметиламина (3,36 г) и N,N-диизопропилэтиламина (5,55 мл) в дихлорметане (20 мл). Полученный раствор перемешивают при комнатной температуре в атмосфере азота в течение 20 часов. Реакционную смесь разбавляют дихлорметаном и промывают водой, 10% водным раствором карбоната калия, 10% водным раствором гидросульфата калия и насыщенным раствором соли. Затем органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая при этом указанное в подзаголовке соединение в виде твердого вещества (7,84 г).
МС (APCI +ve) 382/384/386 (М+Н)+
1H-ЯМР (ДМСО-d6): δ 8,42 (1Н, т); 7,63 (1Н, дд); 7,57 (1Н,м); 7,45 (1Н, д), 2,93 (2Н, д); 1,94 (3Н, с, ушир.); 1,69-1,58 (6Н, м); 1,51 (6Н, с).
b) 2-Хлор-5-формил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Раствор 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (3,25 г, пример 1а) в тетрагидрофуране (150 мл) охлаждают до -78°С в атмосфере азота. Раствор 1,4 М метиллития в диэтиловом эфире (6,1 мл) добавляют к полученному раствору в течение 2 минут. Смесь перемешивают при -78°С в течение 10 минут, затем по каплям добавляют 1,7 М раствор трет-бутиллития в пентане (10,0 мл). Смесь перемешивают при -78°С еще 10 минут и добавляют диметилформамид (1,0 мл). Полученный раствор перемешивают при -78°С в течение 30 минут, гасят насыщенным водным раствором хлорида аммония (100 мл) и экстрагируют этилацетатом. Объединенные экстракты сушат над сульфатом натрия, фильтруют и фильтрат концентрируют при пониженном давлении, получая при этом указанное в подзаголовке соединение в виде твердого вещества (2,76 г).
МС (APCI +ve) 332/334 (М+Н)+
1H-ЯМР (ДМСО-d6): δ 10,04 (1Н, с); 8,49 (1H, т); 7,96-7,91 (2Н, м); 7,74 (1H, д); 2,96 (2Н, д); 1,95 (ЗН, с); 1,64 (6Н, м); 1,53 (6Н, д).
с) Дигидрохлорид 2-хлор-5-[[2-(2-гидроксиэтиламино)этиламино]-метил] -N-(трицикло[ 3.3.1.13,7]дец-1-илметил) бензамида
Смесь 2-хлор-5-формил-N(трицикло [3.3.1.13,7] дец-1-илметил)бензамида (0,244 г, пример 1b), 2-(2-аминоэтиламино)этанола (0,154 г), паратолуолсульфоновой кислоты (0,005 г) и толуола (30 мл) нагревают с обратным холодильником в аппарате Дина-Старка в течение 3 часов, охлаждают и концентрируют при пониженном давлении, получая масло. Полученное масло растворяют в этаноле (30 мл) и охлаждают до 0°С в атмосфере азота. К раствору порциями добавляют твердый борогидрид натрия (0,030 г) и смесь перемешивают при комнатной температуре в течение 30 минут. Смесь концентрируют при пониженном давлении, остаток очищают хроматографией на колонках с силикагелем (производя элюирование дихлорметаном/метанолом/35% водным раствором аммиака, 7:3:0,3) и получают свободное основание. Полученное основание растворяют в метаноле (10 мл), обрабатывают 4 М раствором соляной кислоты в диоксане (4 мл) и получают твердый осадок. Осадок отфильтровывают и промывают диэтиловым эфиром, получая указанное в заголовке соединение в виде твердого вещества (0,165 г).
МС (APCI + -ve) 420/422 (М+Н)+
1H-ЯМР (ДМСО-d6): δ 8,36 (1Н, т); 7,61-7,57 (3Н, м); 5,31 (1Н с, ушир.); 4,22 (2Н, с, ушир.); 3,68 (2Н, с, ушир.); 3,05 (2Н, с, ушир.); 2,95 (2Н, д); 1,95 (3Н, с, ушир.); 1,69-1,59 (6Н, м); 1,53 (6Н, с, ушир.).
Пример 2
2-Хлор-5-[[2-(2-гидроксиэтокси)этиламино]метил]-N-(трицикло-[3.3.1.13,7]дец-1-илметил) бензамид
К раствору 2-хлор-5-формил-N-(трицикло[3.3.1.13,1]дец-1-илметил)бензамида (0,150 г, пример 1b) и 2-(2-аминоэтокси)этанола (0,065 мл) в 1,2-дихлорэтане (6 мл) добавляют триацетоксиборогидрид натрия (0,134 г) и смесь перемешивают в течение ночи при комнатной температуре. Добавляют воду (20 мл) и дихлорметан (20 мл) и распределяют слои. Органическую часть промывают насыщенным раствором соли (30 мл), сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают ОД-ВЭЖХ, производя элюирование градиентом 0-10% этанола в дихлорметане, и получают указанное в заголовке соединение в виде белого порошка (0,016 г).
МС (APCI +ve) 421/423 (М+Н)+
1H-ЯМР (ДМСО-d6): δ 8,29 (1Н, с, ушир.); 7,42-7,34 (3Н, м); 4,60 (1Н, с, ушир.); 3,71 (2Н, с); 3,47 (4Н, с); 3,40 (2Н, д); 2,93 (2Н, д); 2,63 (2Н, д); 1,94 (3Н, с); 1,64 (6Н, кв.); 1,52 (6Н, с).
Пример 3
2-Хлор-5-[(3-гидрокси-2,2-диметилпропиламино)метил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамид
Данное соединение получают способом, описанным в примере 2, исходя из 2-хлор-5-формил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,150 г, пример 1b), 3-амино-2,2-диметилпропанола (0,093 г) и триацетоксиборогидрида натрия (0,134 г) в 1,2-дихлорэтане (6 мл). После соответствующей обработки остаток очищают ОД-ВЭЖХ, производя элюирование градиентом 0-10% этанола в дихлорметане, и получают указанное в заголовке соединение в виде белого порошка (0,035 г).
МС (APCI +ve) 419/421 (M+H)+
1H-ЯМР (ДМСО-d6): δ 8,29 (1H, т); 7,41-7,34 (3Н, м); 4,60 (1H, с, ушир.); 3,70 (2Н, с); 3,16 (2Н, с); 2,93 (2Н, д); 2,29 (2Н, с); 1,94 (3Н, с, ушир.); 1,63 (6Н, кв.); 1,52 (6Н, д); 0,80 (6Н, с).
Пример 4
2-Хлор-5-[(5-гидроксипентиламино)метил]-N-(трицикло [3.3.1.13,7]дец-1-илметил) бензамид
Смесь 2-хлор-5-формил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,100 г, пример 1b), 5-амино-1-пентанола (0,031 мг) и изопропоксида титана (IV) (0,111 мл) перемешивают в атмосфере азота в течение 1 часа при комнатной температуре. Полученный вязкий раствор разбавляют абсолютным этанолом (2 мл). Добавляют цианоборогидрид натрия (0,013 г) и раствор перемешивают в течение 20 часов при комнатной температуре. Добавляют воду (5 мл), перемешивая раствор, и образовавшийся осадок фильтруют и промывают этанолом. Фильтрат концентрируют при пониженном давлении. Сырой продукт растворяют в дихлорметане (20 мл) и фильтруют, чтобы удалить оставшийся неорганический остаток. Фильтрат сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают ОД-ВЭЖХ, производя элюирование градиентом 0-10% этанола в дихлорметане, и получают указанное в заголовке соединение в виде белого порошка (0,031 г).
МС (APCI +ve) 419/421 (М)+
1H-ЯМР (ДМСО-d6): δ 8,28 (1Н, т); 7,41-7,34 (3Н, м); 5,30 (1Н, с); 4,31 (1H, т); 3,67 (2Н, с); 3,37-3,32 (2Н, м); 2,93 (2Н, д); 2,46-2,42 (2Н, м); 1,94 (3Н, с); 1,63 (6Н, кв.); 1,52 (6Н, с); 1,43-1,36 (2Н, м); 1,32-1,28 (2Н, м); 1,27-1,21 (2Н, м).
Пример 5
2-Хлор-5-[[2-(2-гидроксиэтилтио)этиламино]метил]-N-(трицикло-[3.3.1.13,7] дец-1-илметил) бензамид
Данное соединение получают способом, описанным в примере 2, исходя из 2-хлор-5-формил-N(трицикло [3.3.1.13,7]дец-1-илметил)бензамида (0,800 г, пример 1b), 2-(2-аминоэтилтио)этанола (0,584 г) и триацетоксиборогидрида натрия (0,715 г) в 1,2-дихлорэтане (15 мл). После соответствующей обработки остаток очищают ОД-ВЭЖХ, производя элюирование градиентом 0-10% этанола в дихлорметане, и получают указанное в заголовке соединение в виде белого порошка (0,536 г).
МС (APCI +ve) 437/439 (М+Н)+
1H-ЯМР (ДМСО-d6): δ 8,29 (1Н, т); 7,42-7,35 (3Н, м); 4,78 (1Н, с, ушир.); 3,71 (2Н, с); 3,50 (2Н, т); 2,93 (2Н, д); 2,68-2,58 (4Н, м); 2,56-2,52 (2Н, м); 1,94 (3Н, с, ушир.); 1,63 (6Н, кв.); 1,52 (6Н, с).
Пример 6
Ацетат 2-хлор-5-[3-[(2-гидроксиэтил)амино]пропил]-N-(трицикло[3.3.1.13,7]дец-1-илметил) бензамида
а) Метиловый эфир (2Е)-3-[4-хлор-3-[[(трицикло [3.3.1.13,7]дец-1-илметил) амино] карбонил] фенил] -2-пропеновой кислоты
5-Бром-2-хлор-N(трицикло [3.3.1.13,7] дец-1- илметил)бензамид (5 г), метилакрилат (1,4 мл), триэтиламин (2,1 мл), ацетат палладия (0,070 г) и триортотолилфосфин (0,185 г) объединяют в N,N-диметилформамиде (20 мл). Смесь нагревают в запаянной трубке в атмосфере азота при 90°С в течение 24 часов. Реакционную смесь охлаждают и распределяют между дихлорметаном и разбавленной соляной кислотой, смешанные фазы фильтруют через целит и разделяют. Органический слой промывают разбавленной соляной кислотой и насыщенным раствором соли, сушат над сульфатом магния и концентрируют при пониженном давлении с образованием остатка, который растирают с диэтиловым эфиром и фильтруют, получая при этом указанное в подзаголовке соединение в виде не совсем белого твердого вещества (4,1 г).
МС (APCI +ve) 388/390 (M+H)+
1H-ЯМР (CDCl3): δ 7,84 (1H, д); 7,64 (1Н, д); 7,49 (1H, дд); 7,43 (1H, д); 6,45 (1H, д); 6,24 (1H, т, ушир.); 3,81 (3Н, с); 3,19 (2Н, д); 2,02 (3Н, с); 1,70 (6Н, кв.); 1,59 (6Н, д).
b) Метиловый эфир 4-хлор-3[[(трицикло [3.3.1.13,7]дец-1-илметил)амино]карбонил]бензолпропановой кислоты
5% Родий на угле (0,40 г) добавляют к раствору метилового эфира (2Е) -3[4-хлор-3[[ (трицикло [3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]-2-пропеновой кислоты (пример 6а, 2,2 г) в этилацетате/дихлорметане (4:1) (160 мл) и смесь гидрируют под давлением 3 бара в течение 24 часов. Катализатор удаляют фильтрованием и фильтрат концентрируют, получая при этом указанное в подзаголовке соединение в виде масла (2,3 г).
МС (APCI+ve) 390/392 (М+Н)+
1H-ЯМР (COCl3): δ 7,55 (1Н, д); 7,31 (1H, д); 7,20 (1Н, дд); 6,26 (1H, т, ушир.); 3,68 (3Н, с); 3,17 (2Н, д); 2,95 (2Н, т); 2,63 (2Н, т); 2,02 (3Н, с); 1,70 (6Н, кв.); 1,59 (6Н, д).
с) 4-Хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]бензолпропановая кислота
Раствор гидроксида натрия (0,475 г) в воде (30 мл) добавляют к раствору метилового эфира 4-хлор-3-[ [ (трицикло [3.3.1.13,7]дец-1-илметил)-амино]карбонил]бензолпропановой кислоты (пример 6b, 2,3 г) в метаноле (30 мл). Через 5 часов реакционную смесь концентрируют до половины объема в вакууме и подкисляют разбавленной соляной кислотой. Образовавашийся осадок белого твердого вещества собирают фильтрованием и сушат в вакууме при 50°С, получая при этом указанное в подзаголовке соединение (1,2 г).
МС (APCI +ve) 376/378 (М+Н)+
1H-ЯМР (ДМСО-d6): δ 11,18 (1H, с); 8,28 (1H, т); 7,37 (1H, д); 7,28 (1H, дд); 7,26 (1H, д); 2,92 (2Н, д); 2,82 (2Н, т); 2,54 (2Н, т); 1,94 (3Н, с); 1,63 (6Н, кв.); 1,52 (6Н, с).
d) 2-Хлор-5-(3-гидроксипропил)-N-(трицикло [3.3.1.13,7]дец-l-илметил)бензамид
Изобутилхлорформиат (0,575 мл) и триэтиламин (0,63 мл) добавляют к раствору 4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]-бензолпропановой кислоты (пример 6с, 1,64 г) в тетрагидрофуране (30 мл) при 0°С. Через 1 час осадок удаляют фильтрованием и фильтрат добавляют порциями к раствору борогидрида натрия (0,18 г) в воде (10 мл) при 0°С. Еще через 1 час реакционную смесь выливают в разбавленную соляную кислоту и экстрагируют этилацетатом. Органическую фазу дважды экстрагируют разбавленной соляной кислотой, дважды насыщенным раствором гидрокарбоната натрия и один раз насыщенным раствором соли, сушат над сульфатом магния, концентрируют при пониженном давлении с получением оста