Индуцирование толерантности
Иллюстрации
Показать всеИзобретение относится к области биохимии. Сущность его заключается в разработке применения веществ и композиций для повышения толерантности к антигенному материалу у индивидуума. К таким веществам относятся соединения, повышающие активность циклооксигеназы-2 в отдельных клетках, в частности в клетках, участвующих в иммунной реакции, а также к веществам, повышающим уровень INF-γ. В качестве антигенного материала используют пищевые и непищевые вещества: молоко, ягоды, рыбу, моющие средства, косметику, антибиотики и др. Технический результат - повышение эффективности облегчения состояний, связанных с аллергическими реакциями, у индивидуума за счет повышения толерантности. 2 н. и 6 з.п. ф-лы, 3 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии и, в частности, к способу индуцирования толерантности к антигенному материалу у индивидуума путем введения соединения, повышающего активность СОХ-2 (циклооксигеназы-2) в клетках индивидуума, в частности в клетках, участвующих в иммунной реакции, и также, возможно, повышающего уровень IFN-γ, и к материалу или его антигенным частям, в отношении к которым у индивидуума развиваются неблагоприятные иммунные реакции.
Уровень техники
Одной из современных болезней, обусловленных различными экологическими факторами индустриального общества, является аллергия. Аллергия представляет собой гиперчувствительное состояние, обуславливаемое повышенным иммунным ответом на чужеродный агент, которое затрагивает жизни миллионов живых существ и часто диктует им, что можно употреблять в пищу, до чего можно дотрагиваться, что можно нюхать и даже где могут живые существа обитать. Реакция организма на чужеродный агент может варьировать от незначительного воспаления и дискомфорта вплоть до смертельного исхода.
Клинические симптомы, проявляющиеся во время аллергических реакций, являются следствием двух различных реакций: раннего специфичного иммунного ответа и поздней воспалительной реакции. Вдыхаемые аллергены, такие как, например, пыльца или клещиковая пыль, обусловливают раннюю фазу, стимулируя обладающие высоким сродством рецепторы иммуноглобулина (IgE), например, стволовые клетки и базофилы, которые, в свою очередь, выделяют гистамин и цитокины. Эта ранняя фаза длится приблизительно 30 мин. Цитокины, выделившиеся в ранней фазе из стволовых клеток и базофилов, обусловливают позднюю фазу, направляя воспалительные клетки в носовые проходы и проходы верхнего дыхательного тракта. Приток эозинофилов, макрофагов, лимфоцитов, нейтрофилов и тромбоцитов запускает воспалительный цикл. Эта поздняя фаза обычно длится до 2 суток и усиливает начальный иммунный ответ, который, в свою очередь, включает выделение новых воспалительных клеток.
В настоящее время лечение аллергии обычно сосредоточивается на двух типах подходов. Один из режимов предусматривает простое воздействие на симптомы аллергии с использованием для этой цели таких лекарств, как антигистамины. Один из недостатков таких методов состоит в том, что такого рода подход чаще всего влечет за собой повторное применение доз соответствующего лекарства и может вызывать нежелательные побочные эффекты. Кроме того, такой подход состоит лишь в воздействии на симптомы, но не на состояние, которое лежит в их основе и которое ответственно за состояние гиперчувствительности. Другим подходом лечения аллергии является так называемая десенсибилизирующая терапия, которая включает введение индивидууму специфичных аллергенов. Такой подход вызывает дискомфорт и может потребовать до 50 посещений клинициста. К тому же аллерген, к которому гиперсенсибилизирован больной, не всегда может быть идентифицирован, что делает десенсибилизирующее лечение невозможным.
В дополнение к названным выше недостаткам ни один из указанных подходов не гарантирует устранения состояния гиперчувствительности. В то же время ни один их них не может воспрепятствовать развитию состояния гиперчувствительности.
Кроме того, что у все большего и большего числа людей развивается аллергия к встречающимся в окружающей среде агентам, таким как пыльца, строительные материалы и т.д., постоянно возрастает число потребителей, страдающих пищевой аллергией. Особенно серьезные проблемы возникают с аллергическими реакциями к злаковым культурам, орехам или молоку, поскольку в большинстве стран эти продукты потребляются как главные пищевые продукты и содержат большое число потенциальных белковых аллергенов.
До настоящего времени для лечения пищевой аллергии были приняты два различных подхода. Один из них имеет целью исключить из ежедневной диеты аллергенный пищевой материал, что, однако, оказалось трудноосуществимым на практике, поскольку это требует строгого просмотра диеты, обычно сопровождаясь ограничительными мерами, и может в конце концов повлиять на качество жизни и/или затормозить ожидаемый рост детей раннего возраста или новорожденных.
Другой подход включает модифицирование самого источника аллергенного материала таким образом, чтобы аллергический потенциал последнего был понижен. Обычно это достигается удалением из пищевого материала аллергенных компонентов, что нередко создает проблему, связанную с тем, что специфичное антигенное вещество (аллерген) в пищевом материале часто неизвестно, в результате чего в большинстве случаев не ясно, какой именно компонент должен быть избирательно удален. Другой путь к изменению аллергенности пищевого материала состоит в обработке этого пищевого материала особым образом, например, нагреванием или с помощью протеолитических ферментов.
С этой целью в патенте US-P-4293571 раскрывается приготовление гипоаллергенной композиции, в которой белковый материал подвергают гидролизной обработке, а оставшиеся негидролизованными белки подвергают коагуляции термообработкой с последующей стадией ультрафильтрации для удаления прокоагулировавшего материала и макропептидов, способных действовать как аллергены.
Проблемы, сопровождающие пищевую аллергию, еще острее у новорожденных, так как новорожденные не способны однозначно сообщить о своем дискомфорте ухаживающему за ними лицу, в результате чего аллергическое состояние чаще всего устанавливают только на основании заметных аллергических симптомов, таких как атонический дерматит, дыхательные и/или желудочно-кишечные расстройства.
Чтобы исключить аллергенный материал, необходим ряд бытовых ограничений и особый распорядок жизни у этих детей. Однако главная забота в отношении их диеты состоит в том, чтобы избежать сенсибилизации нативными белками. Было, например, показано, что при резком снижении поглощения нативных белков коровьего молока вероятность аллергии на коровье молоко может быть существенным образом уменьшена.
Какая бы ни была выбрана диета, полнота иммунной толерантности к белкам молока не может быть в конечном итоге обеспечена без введения иммунной системы вместе с ответственными за аллергию белками. До настоящего времени статус толерантности может быть установлен только путем экстраполяции к тому состоянию, когда дети не проявляют специфичного аллергического ответа: либо после локального (тесты Прика), либо после системного ввода антигенов (DBPCFC).
Таким образом, задача настоящего изобретения состоит в преодолении недостатков предшествующего уровня техники и предложении нового средства для лечения или предотвращения аллергических симптомов.
Сущность изобретения
Задача была решена в результате предложения способа индуцирования толерантности к данному антигенному материалу у индивидуума, который состоит во введении индивидууму антигенного материала и вещества, повышающего активность СОХ-2 в клетках индивидуума, в частности в клетках, вовлеченных в иммунную реакцию, таких как лимфоциты, и/или повышающего уровень IFN-γ.
Перечень фигур
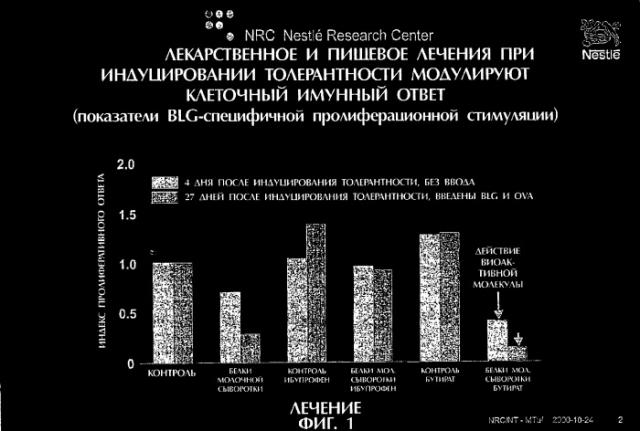
Фиг.1 демонстрирует модулирование клеточного иммунного ответа при лекарственном и пищевом лечении при индуцировании толерантности.
Фиг.2 демонстрирует модулирование гуморального иммунного ответа на BLG при лекарственном и пищевом лечении при индуцировании толерантности.
Фиг.3 показывает определение PGE2 и IFN-γ для оценки пероральной толерантности.
Раскрытие изобретения
СОХ-2 является ферментом, катализирующим, в числе прочих, синтез простагландина из арахидоновой кислоты. Другими известными субстратами для СОХ-2 являются дигомогамма-линоленовая кислота (20:3n:6) и эйкозапентаеновая кислота (ЕРА, 20:5n-3), продуцирующие, соответственно PGE1 и PGE3. Ген СОХ-2 человека был клонирован, и были описаны его геномная структура и быстрота реакции его генной экспрессии на различные элементы, такие как cAMP, NF-kB и TGF-β, IL-1 или TNF-α.
В соответствии с настоящим изобретением выражение «повышение активности СОХ-2» следует понимать как повышение ферментативной активности как таковой, например, при увеличении количества кофакторов или улучшении кооперации с этими кофакторами, или при усилении транскрипции и/или трансляции белка в клетках, или просто при увеличении количества субстрата.
Аналогичным образом, выражение «неблагоприятная иммунная реакция» следует понимать как подразумевающее любую вредную для индивидуума иммунную реакцию, например аллергические реакции, аутоиммунные реакции и отторжение органа.
Кроме того, выражение «клетки индивидуума» включает все клетки, экспрессирующие СОХ-2 и участвующие в процессах, приводящих к толерантности. В число этих клеток, в частности, входят клетки, участвующие в иммунных реакциях, такие как клетки, в которых имеются антигены, лимфоциты, в частности Т-лимфоциты, нейтрофилы, гранулоциты, моноциты и т.д.
Предназначенный для введения индивидууму антигенный материал может быть обычным материалом самой пищи, собственным материалом или непищевым несобственным материалом. Примерами пищевых материалов являются молоко, яйцо, соя, арахис, ракообразные, рыба, мясо, кунжут, молочная сыворотка, ягоды или яблоки.
В качестве собственного материала может быть упомянут любой эндогенный для индивидуума материал, например, коллаген, инсулин, миелин-связывающий белок, миелин, рецептор ацетилхолина, ретиноид-связывающий белок или синтезируемые в организме полипептиды.
Непищевые несобственные материалы могут быть первоначально экзогенными для индивидуума и способными вызывать неблагоприятные иммунные реакции. Примерами таких материалов являются аллергенные материалы, такие как пыльца, пылевидные клещики, йод, никель, медь, животный яд или латекс, все виды моющих средств, косметика, духи, штукатурка, лекарства, такие как антибиотики, а также аллоантигены, такие как трансплантационные антигены. Что касается аллоантигенов, больному, который должен получить такие аллоантигены, например, трансплантаты в виде органов, перед трансплантацией может быть введен аллоантиген и вещество, повышающее активность COX-2, с целью понижения или существенного сведения к минимуму отторжения трансплантата иммунной системой больного. Этого можно достичь введением больному частей трансплантата, таких как его клеточный материал, содержащий соответствующе антигены HLA трансплантата, и целевое вещество, с целью подготовки иммунной системы больного к перенесению будущего трансплантата.
Для повышения активности СОХ-2 в клетке индивидуума, в частности в клетках, участвующих в иммунной реакции, таких как лимфоциты, может быть использовано любое вещество, способное производить такого рода эффект. Такие вещества могут быть легко идентифицированы по их влиянию на синтез, например, PGE2 (простагландин E2) из арахидоновой кислоты в Т-лимфоцитах, что можно обнаружить с помощью обычного ферментативного иммунного анализа.
В соответствии с одним из предпочтительных вариантов вещество, которое способно повышать активность СОХ-2 в клетках индивидуума и, возможно, также повышать уровень IFN-γ, может быть выбрано из группы, в которую входят бутират, n-6 полиненасыщенные жирные кислоты, такие как арахидоновая кислота, или керамиды.
Целевое вещество может быть введено индивидууму отдельно или вместе в едином продукте.
С этой целью целевое вещество и антигенный материал могут быть включены в какой-либо известный фармацевтический состав, такой как таблетки, пакетики, растворы, капсулы и т.п., которые содержат носители и наполнители, требуемые и являющиеся желательными для соответствующего способа применения. Такими способами введения могут быть способы: местный, интранозальный, пероральный, внутривенный или внутрибрюшинный.
Антигенный материал может быть при желании предварительно обработан. Например, вместо того, чтобы включать в фармацевтическую композицию все количество материала, вызывающего неблагоприятную реакцию, можно выделить содержащееся в этом материале соответствующее антигенное соединение или его части, такие как, например, конкретные аллергенные пептиды, и затем включить эти выделенные соединения в фармацевтическую композицию.
Целевое вещество также может быть включено в пищевой материал. В этом случае возможны три варианта.
Во-первых, антигенный непищевой собственный или несобственный материал включается в общий пищевой материал вместе с целевым веществом. Этот вариант предусматривает, таким образом, добавление известного антигена, такого как упомянут выше, в пищевой материал, в который включено целевое соединение. В качестве такого рода пищевых материалов может быть предложена любая жидкость, такая как вода или даже молоко, желе, конфеты и т.п.
Второй вариант состоит в том, что пищевой материал может представлять собой антигенный материал как таковой, т.е. пищевой материал изначально содержит потенциально аллергенный материал. В этом случае для того, чтобы получить композицию в соответствии с настоящим изобретением, целевое вещество может быть просто добавлено к пищевому материалу. В качестве такого пищевого материала пригоден любой пищевой продукт, к которому у индивидуума может возникнуть аллергическая реакция, включая любые сорта ягод, яблоки, персики и т.д. Предпочтительным видом пищи, в частности, являются пищевые продукты, имеющие в основе злаковые культуры или коровье молоко, поскольку такие пищевые продукты, как известно, содержат высокоаллергенные соединения. Примерами таких пищевых продуктов являются йогурт, творог, сыр, сброженное молоко, сброженные продукты на молочной основе, мороженое или злаковые продукты, такие как продукты на основе сброженного зерна, порошковое молоко, напитки, желе на водной основе, детское питание или даже корм для животных.
Настоящее изобретение предлагает, таким образом, новую и захватывающую концепцию индуцирования пероральной толерантности к данному антигену, преимущественно к потенциально аллергенному пищевому материалу, у индивидуума путем простого ввода в пищевой материал вещества, способного повышать активность СОХ-2 в клетках индивидуума, в частности в клетках, принимающих участие в иммунной реакции, таких как лимфоциты, предпочтительно Т-клетки, которые могут обладать способностью повышать уровень IFN-γ.
Таким образом, настоящее изобретение предлагает способ индуцирования пероральной толерантности к пищевому материалу у индивидуума. Эта концепция в особенности подходит для новорожденных, которые находятся в состоянии, которое готово к развитию как толерантности, так и аллергии к пищевому материалу. Применяя принципы настоящего изобретения, можно предложить детское питание, к которому у новорожденных не возникнет аллергической реакции. Более того, иммунная система новорожденных скорее будет обучаться переносить белки упомянутого выше коровьего молока, благодаря чему при кормлении новорожденных соответствующим пищевым материалом не возникнет никаких проблем.
По третьему варианту антигенный компонент может быть добавлен к любому другому желаемому пищевому материалу. Например, арахис или подходящие компоненты его могут быть добавлены к кисломолочным продуктам, таким как йогурт, с целью получения йогурта со вкусом арахиса и, после введения целевого вещества, желаемой диеты. Такой способ может быть также осуществлен с добавлением к кисломолочным продуктам измельченных ягод, яблок и т.п.
Весьма существенно, что композиции настоящего изобретения прекрасно подходят для подавления развития аллергии у индивидуума, прежде чем она может возникнуть. Не желая вдаваться в какую бы то ни было теорию, можно полагать, что одновременное воздействие на иммунную систему антигеном и проведение биологической акции, состоящей в подавлении избыточной иммунной реакции на этот материал, обучает иммунную систему в целом не реагировать неблагоприятным образом на присутствующий специфичный антиген. Таким образом, концепция, лежащая в основе настоящего изобретения, состоит, главным образом, в модулировании биохимии и метаболизма клеток индивидуума, ответственных за индуцирование пероральной толерантности, преимущественно клеток, участвующих в иммунной реакции. Эта концепция может быть также применена к аутоиммунным болезням (собственный материал или собственный антиген) и развитию толерантности к специфичным непищевым несобственным антигенам.
Согласно настоящему изобретению можно, таким образом, не только предотвращать начало аллергии, но также и лечить уже существующее аллергическое состояние путем «обучения» иммунной системы не реагировать на материал, который присутствует одновременно с веществом, способным повышать активность СОХ-2 в клетках индивидуума, преимущественно в клетках, участвующих в иммунной реакции и, возможно, повышать уровень IFN-γ.
Само собой разумеется, количество целевого вещества в фармацевтической или пищевой композиции должно быть достаточным для получения желаемого эффекта, т.е. для того, чтобы повысить активность СОХ-2 в соответствующих клетках индивидуума, преимущественно в лимфоцитах, предпочтительнее в Т-лимфоцитах, и, возможно, повысить уровень IFN-γ в периферийных тканях таким образом, чтобы иммунная система индивидуума эффективно обучалась переносить антигенный материал, однажды признанный как чужеродный антиген, против которого вызван чрезмерный иммунный ответ.
Согласно другому варианту настоящее изобретение предлагает способ определения предрасположенности индивидуума к развитию аллергической реакции на антигенный материал, который включает взятие образца крови у индивидуума, который может быть обработан для получения клеточного материала образца, содержащего лимфоциты. Это легко произвести, собирая, например, клетки с помощью колонки или перенося образец крови в культуральную среду, получая в результате этого первичную культуру и культивируя находящиеся в крови клетки. Следующий шаг состоит в контактировании образца клеток крови, в частности лимфоцитов, преимущественно Т-лимфоцитов, с антигенным материалом с последующим определением активности СОХ-2 в образце или клетках соответственно и, возможно, определением уровня IFN-γ в образце и сравнением этих уровней с контролем, которым может быть обычная калибровочная кривая или, что предпочтительно, тот же самый образец, который не был в контакте с антигенным материалом.
Повышенная по сравнению с контролем активность СОХ-2, а также повышение уровня IFN-γ покажут, что индивидуум, у которого был взят образец, не проявит значительной, т.е. избыточной или неблагоприятной иммунной реакции на названный выше антигенный материал, но скорее будет к ней толерантен. С другой стороны, существенно пониженный уровень активности СОХ-2 и существенно пониженный уровень IFN-γ укажут на то, что данный материал вызовет у индивидуума неблагоприятную реакцию.
Описанный выше способ имеет принципиальные преимущества перед существующими, поскольку устраняется прямое введение индивидууму антигенного материала. Благодаря этому для оценки соответствующей тенденции нет необходимости, чтобы у тестируемых больных или индивидуумов развивались аллергические симптомы, в результате чего снижаются риски, связанные с тестами такого типа. Далее, поскольку настоящий способ опирается на измерения на клеточном и молекулярном уровнях, такая оценка значительно более чувствительна по сравнению с оценкой возможного развития у индивидуума аллергических симптомов. Еще одно преимущество состоит в том, что настоящий способ позволяет обследовать уже маленьких детей и даже новорожденных, не подвергая их опасности.
Сведения, подтверждающие возможность осуществления изобретения
Следующие примеры проиллюстрируют изобретение более детально, не ограничивая при этом его объема.
Были использованы следующие материалы и методы.
Животные
Использовались трехнедельные мыши-самки Balb/c, полученные от IFFA-Credo (L'Abresle, Франция). Все мыши были выкормлены и выращены на диете, не содержащей коровьего молока. Во всех опытах мышей взвешивали в день, когда они получали пищу, с целью определения количества введенной через зонд пищи по весу тела.
Антигены
BLG (лактоглобулин быка, трижды перекристаллизованный) и OVA (овальбумин, категория V) были получены от Sigma Chemical Co. Концентрат белка молочной сыворотки (Lacprodan 80) был получен от Danmark Protein AS (METHOD-Foods). Его получают ультрафильтрацией кислой сыворотки. Содержание белка 80%.
Статистика
Ответы сывороточного IgE сравнивали с использованием однофакторных тестов ANOVA. Значение получали при р<0,05.
Пример 1
Лечение мышей
В начале эксперимента мышей принудительно кормят и/или вводят внутрибрюшинно бутират (усиливающий активность СОХ-2), ибупрофен (ингибирующий активность СОХ-2) или солевой раствор (контроль) ежедневно с дня - 3 по день 4. В день 0 мыши получают в виде желудочного питания белки молочной сыворотки (3 мг/г веса тела) или некоторый объем соленой воды. Продукты, вводимые через желудочный зонд, растворяют в 0,3 мл соленой воды. На день 4 в каждом опыте всех мышей иммунизируют внутрибрюшинной инъекцией 0,08 мг BLG, а также 0,08 мг OVA в стерильном солевом растворе в смеси с 0,16 мл 2%-ного Al(ОН)3 (Superfos Biosectr A/S, Дания).
В день 4 или в день 26 отбирают образцы крови с помощью пункции сердечной аорты, применяя анестезию 3%-ным изофлураном (Abott SA). Сразу же после смерти в результате шейной дислокации забирают селезенки и объединяют их в соответствии с группами лечения в 20 мл охлажденной среды RPMI с добавкой 5% раствора FCS. Растворы с клетками селезенки гомогенизируют с помощью клеточного сита (Falcon) и очищают от эритроцитов с использованием плотностного центрифугирования Histopaque (Sigma) в течение 20 мин при скорости 390 g. Затем клетки культивируют в 96-луночных плоскодонных микротитровальных пластинах (Costar) в течение 48 ч в концентрации 5×10-5 клеток/мл в среде RPMI 1640 (Bioconcept) с добавкой 2 мМ L-глутамина (Seromed), 100 ед. пенициллина/100 мг стрептомицина (Seromed), 10% раствора PCS (Bioconcept) при 37°С в 5%-ном CO2 в присутствии 5, 2,5 и 0,1 мг/мл BLG (Sigma) или 250, 50, 10 и 2 мкг/мл фитогемагглутенина A (Seromed). В течение последних 6 ч культивирования добавляют (3H)Tdr (Amersham, Zurich), после чего продукты культивирования собирают и анализируют с помощью сцинтилляционного счетчика (TopCount, Canberra Packard, Zurich). Результаты введения (3H)Tdr выражают в срм (число импульсов в мин) в виде среднего для трех культивирований, после чего строят график зависимости средней величины за вычетом контроля от концентрации BLG (контроль). Показатели стимулирования рассчитывают как отношение опыта за вычетом контроля к контрольным значениям при 2,5 мг BLG/мл и 50 мкг/мл РНА.
Для каждой группы была произведена оценка специфической пролиферации. Выделенную сыворотку быстро замораживали при -20°С перед анализом на IgE, специфичного для BLG.
Пример 2
Измерение специфичного IgE антитела с помощью иммуноферментного анализа (ELISA)
Определение анти-BLG IgE в образцах сыворотки определяли дважды методом ELISA (в двух повторностях). Микропланшеты (NUNC Immunoplate Maxisorp F96, Дания) сенсибилизировали BLG, 0,5 мг/мл в карбонатно-бикарбонатном буфером, рН 9,6, 100 мкг на лунку в течение ночи при 4°С. Перед добавлением каждого реагента планшеты четыре раза промывали PBS-Tw содержащий 0,05% Tween. Планшеты блокировали в течение 1 часа при комнатной температуре 200 мкл на лунку 0,5%-ным рыбьим желатином в PBS-Tw. Анализировали двукратные последовательные разведения образцов или трехкратные для сыворотки от отдельных мышей (в двух повторностях). Перед анализом сыворотки сначала разводили 1/20 в PBS-Tw. После добавления разведенных образцов и инкубирования в течение 1 часа при комнатной температуре в течение 2 ч добавляли антитела крысы против Ige мыши, меченые пероксидазой (Harlan Sera-Lab, США), и затем субстрат OPD (Sigma). Через 15 мин определяли оптическую плотность при 492 нм с помощью ридера Dynatech MR500 ELISA (Dynatech, Embrach-Embraport, Швейцария). На каждой планшете в качестве отрицательного контроля использовали объединенные образцы от двадцати неиммунизованных самок мышей. Граничные разведения определяли расчетом разведения образцов, поглощение которых было в два раза больше оптического поглощения отрицательного контроля. Титры выражали в десятичных логарифмах обратных величин граничного разбавления.
Пример 3
Определение цитокинов методом ELISA
Секретирование цитоксинов индуцировали в 96-луночных микропланшетах (Costar), на которых 5×10-5 клеток селезенки стимулировали с помощью 2,5 мг/мл BLG на лунку. Супернатанты клеточных культур собирали после 48 час стимулирования. Содержание IFN-γ определяли с помощью цитокин-специфичного ELISA Endogen в соответствии с инструкциями производителя. Все образцы цитокинов анализировали дважды.
Пример 4
Определение простагландина E2 и гамма-интерферона
Содержание PGE2 в культуральной среде, полученной после культивирования лимфоцитов в течение 6 или 12 ч, определяли с помощью набора для ферментативного иммуноанализа (Cayman Chemical). Анализировали три образца при двух разведениях для каждого.
Индуцирование толерантности при кормлении мышей белками молочной сыворотки приводило к повышенной продукции PGE2 и IFN-γ BLG-стимулированными лимфоцитами в культуре через 5 дней после индуцирования толерантности по сравнению с неиндуцированными контрольными мышами.
Продукция PGE2 и INF-γ не наблюдалась, когда мыши получали ибупрофен - ингибитор СОХ. С другой стороны, мыши, получавшие бутират, отличались еще более высокой продукцией как PGE2, так и IFN-γ по сравнению с положительным контролем - мышами, получившими белки молочной сыворотки.
Пример 5
Пролиферация
Индуцирование толерантности путем кормления мышей белками молочной сыворотки приводил к пониженному индексу пролиферативного ответа через 4 дня после индуцирования толерантности (фиг.3). Показатель стимуляции ниже 0,5 указывает на то, что у мышей была индуцирована толерантность. Такой пониженный индекс пролиферативного ответа не наблюдался в том случае, когда мыши получали ибупрофен - ингибитор СОХ. С другой стороны, мыши, получавшие бутират, отличались еще более низким индексом пролиферативного ответа по сравнению с положительным контролем - мышами, получавшими белки молочной сыворотки.
Такие же и еще более высокие результаты наблюдались на 26 день после индуцирования толерантности у мышей, которым вводили BLG через 4 дня после введения толерогена.
Пример 6
IgE
Индуцирование толерантности путем кормления мышей белками молочной сыворотки приводило к снижению гуморальных титров анти-BLG IgE через 26 дней после индуцирования толерантности. Снижение по сравнению с неиндуцированными мышами статистически значимо (р<0,05). Пониженные титры анти-BLG IgE не наблюдались в том случае, когда мыши получали ибупрофен - ингибитор СОХ (см. фиг.2). С другой стороны, мыши, получавшие бутират, отличались еще более низким титрами анти-BLG IgE по сравнению с положительным контролем - мышами, получавшими белки молочной сыворотки. Это еще большее снижение титров гуморальных анти-BLG IgE по сравнению с индуцированными мышами (положительный контроль) статистически значимо (р<0,05).
1. Применение антигенного материала или его антигенных частей и, по меньшей мере, одного вещества, повышающего активность СОХ-2 (циклооксигеназы-2) в клетках индивидуума и/или повышающего уровень IFN-γ (интерферона γ) в производстве композиции для повышения толерантности к антигенному материалу.
2. Применение по п.1, в котором антигенный материал является антигенным пищевым материалом, антигенным собственным материалом или непищевым антигенным материалом.
3. Применение по п.1, в котором пищевой антигенный материал происходит из молока, яиц, сои, орехов, ракообразных, рыбы, мяса, кунжута, молочной сыворотки, ягод или яблок.
4. Применение по п.1, в котором собственный антигенный материал выбран из группы, состоящей из коллагена, инсулина, миелинсвязывающего белка, миелина, рецептора ацетилхолина, ретиноидсвязывающего белка или полипептидов.
5. Применение по п.1, в котором непищевой антигенный материал выбран из группы, состоящей из пыльцы, пылевидных клещиков, йода, никеля, меди, животных ядов, латекса, моющих средств, косметики, духов, штукатурки, антибиотиков и аллоантигенов.
6. Применение по любому из пп.1-5, в котором, по меньшей мере, одно вещество, способное повышать активность СОХ-2 в клетках индивидуума и, возможно, уровень IFN-γ, выбирают из группы, состоящей из бутирата, n-6 полиненасыщенных жирных кислот или керамидов.
7. Фармацевтическая композиция, содержащая непищевой антигенный материал или его антигенные части и, по меньшей мере, одно вещество, способное повышать активность СОХ-2 в клетках индивидуума.
8. Композиция по п.7, в которой, по меньшей мере, одно вещество, способное повышать уровень СОХ-2 в клетках индивидуума и, возможно, уровень IFN-γ, выбирается из группы, состоящей из бутирата, n-6 полиненасыщенных жирных кислот или керамидов.