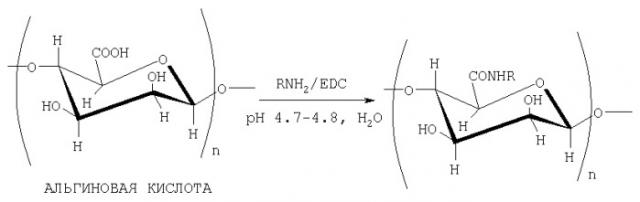
Способ получения конъюгатов альгиновой кислоты
Иллюстрации
Показать всеОписан способ получения конъюгатов альгиновой кислоты путем взаимодействия ее с аминосодержащими соединениями (RNH2) в присутствии конденсирующего реагента 1-этил-3-[3-(диметиламино)пропил]карбодиимида в водной среде при комнатной температуре, рН 4.7-4.8. В качестве аминосодержащих соединений используют ряд фармакологически значимых аминов: n- и о-аминофенолы, 5- и 4-аминосалициловые, антраниловую и n-аминобензойную кислоты, этиловый эфир n-аминобензойной кислоты (анестезин), β-диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин), 1-фенил-2,3-диметил-4-аминопиразолон-5(4-аминоантипирин), гидразид изоникотиновой кислоты (изониазид), 2-аминоэтансульфоновую кислоту (таурин), 7-аминоцефалоспориновую кислоту, а также сульфаниламидные препараты, такие как n-аминобензолсульфамид (стрептоцид), n-аминобензолсульфацетамид-натрий (сульфацил-натрий). Производные альгиновой кислоты могут быть использованы в медицине и фармакологии. 1 табл.
Реферат
Изобретение относится к области химии и биохимии, в частности к способу получения новых веществ, производных альгиновой кислоты, которые могут быть использованы в медицине, фармакологии.
Альгиновая кислота, полисахарид линейного строения, содержится в бурых водорослях, впервые выделена Е.Стендфордом в 1881 году и состоит из остатков β-D-маннуроновой и L-гулуроновой кислот, связанных между собой (1→4)-гликозидными связями. В природе альгиновая кислота находится в виде натриевой соли - альгината натрия. Химический состав и молекулярная масса альгината зависят от вида водорослей, используемых в качестве сырья, а также от способов выделения, при этом выход альгината составляет не менее 30% в расчете на высушенное сырье [Методы химии углеводов. Под редакцией чл.-корр. АН СССР Кочеткова Н.К. - Москва: 1967. - 317 С.]. Из альгинатов производятся натрий-, кальций-альгинатные, кальциево-хромовые волокна; последние устойчивы к воспламенению. Альгинаты включают в состав ряда композиционных материалов.
Свойства альгината, как неиммуногенного полисахарида, высокозаряженного полиэлектролита и комплексона, образующего очень вязкие растворы даже при умеренных концентрациях в воде, позволяют применять его в качестве загустителя в пищевом производстве, для изготовления фотографических пленок, извлечения различных металлов (в ионизированной форме) из загрязненной воды [Takeshi G., Matsushima К., Kikuchi Ken-Ichi. Preparation of aiginate-chitosan hybrid gel beads and adsorption of divalent metal ions. Short Communication. // Chemosphere 2004. V.55. P.135-140]. Альгинат также используют в фармакологии в качестве носителя лекарственных средств, например, для капсулирования инсулина [Leung Y.F., O'Shea G.M., Goosen M.F., Sun A.M. Microencapsulation of crystalline insulin or islets of Langerhans: an insulin diffusion study. // Artif. Organ. 1983. V.7(2). P.208-212], дипиридамола [Gursoy A., Kalkan F., Okar I. Preparation and tabletting of dipyridamole alginate-Eudragit microspheres. // J. Microencapsul. 1998. V.15(5). P.621-628] и других субстанций [Hughes M., Vassilakos A., Andrews D.W., Hortelano G., Belmont J.W., Chang P.L. Delivery of a secretable adenosine deaminase through microcapsules a novel approach gene therapy. // Hum. Gene Ther. 1994. V.5(12). P.1445-1455].
На основе альгиновой кислоты или ее натрий-кальциевых солей известны фармакопейные препараты: «Альгимаф» (в сочетании с сульфаниламидным препаратом «Мафенид») и «Альгипор» (в сочетании с антисептиком фурацилином) - ранозаживляющие средства с резорбтивным и регенерирующим действием [Машковский М.Д. Лекарственные средства. - Харьков: Торсинг, 1997. - Т.1, 2. - 590 С.]. Из альгинатного волокна производятся стерильные повязки для обработки раневых поверхностей с обильным отделением экссудата: «Супрасорб-А», «Мелгисорб» и «Калтостат».
В последние годы проявляется большой интерес к получению и исследованию биологических свойств кислых полисахаридов, химически модифицированных по карбоксильной функции. Модификация полисахаридов позволяет изменить их физико-химические и биологические свойства. Конъюгаты полисахаридов с лекарственными субстанциями могут обладать большей растворимостью или продолжительностью действия по сравнению с самими лекарствами, могут использоваться как препараты комбинированного действия. В результате ковалентного связывания с полимерной матрицей может снизиться токсичность аминосодержащих соединений.
Для ковалентного связывания аминосодержащих соединений с кислыми полисахаридами (ПС-СООН) в качестве водоотнимающих реагентов применяются водорастворимые карбодиимиды, например 1-этил-3-[3-(диметиламино)пропил]карбодиимид (EDC). При этом образуются соответствующие амиды
Этим методом (в водной среде при рН 6) был синтезирован конъюгат альгината с биотином, применяемый в качестве биосенсора [Polyak В., Geresh S., Marks R.S. Synthesis and characterization of a biotin-alginate conjugate and its application in a biosensor construction. // Biomacromolecules. 2004. V.5(2). P.389-396]. Конверсия карбоксигрупп альгината составила 20% мольн.
Наиболее близким к предлагаемому изобретению является способ получения конъюгатов альгиновой кислоты (альгината) с некоторыми α-аминокислотами: лизином, фенилаланином, аргинином и аспарагиновой кислотой в присутствии EDC [Huiguang Zhu, Rongyi Lin, Changyou Gao, Linxian Feng, Jiacong Shen. Surface engineering of poly (DL-lactic acid) by entrapment of alginate-amino asid derivatives for promotion of chondrogenesis. // Biomaterials. 2002. V.23. P.3141-3148]. При этом применяется предварительное активирование карбоксильных групп альгината карбодиимидом в течение 2 ч в фосфатном буфере при 4°С и рН 5. Затем в реакционную смесь добавляется соответствующая аминокислота, и реакция проводится в течение 24 ч. При этих условиях с альгиновой кислотой реагирует 2-4 мас.% соответствующей аминокислоты. Синтезированные конъюгаты полезны в качестве активаторов хондрогенеза.
Авторами предлагается способ получения конъюгатов альгиновой кислоты с соединениями, содержащими первичную аминогруппу, путем их взаимодействия с альгиновой кислотой в водной среде (рН 4.7-4.8) в присутствии 1-этил-3-[3-(диметиламино)пропил]карбодиимида. Предварительного активирования карбоксигрупп альгиновой кислоты не требуется. Реакция протекает при комнатной температуре в течение 30 минут с образованием соответствующих конъюгатов с высокой конверсией карбоксильных групп альгиновой кислоты. В качестве аминосодержащих соединений были использованы фармакологически значимые n- и о-аминофенолы, 5- и 4-аминосалициловые, антраниловая и n-аминобензойная кислоты, этиловый эфир n-аминобензойной кислоты (анестезин), β-диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин), 1-фенил-2,3-диметил-4-аминопиразолон-5 (4-аминоантипирин), гидразид изоникотиновой кислоты (изониазид), 2-аминоэтансульфоновая кислота (таурин), 7-аминоцефалоспориновая кислота, а также сульфаниламидные препараты, содержащие свободную аминогруппу, такие как n-аминобензолсульфамид (стрептоцид), n-аминобензолсульфацетамид-натрий (сульфацил-натрий) и др. (биологические свойства перечисленных соединений приведены в таблице).
где R=С6Н4ОН (остатки п- или о-аминофенола), С6Н4СООН (остатки п-аминобензойной и антраниловой кислот), C6Н3(ОН)СООН (остатки 4- или 5-аминосалициловых кислот), С6Н4СООС2Н5 (остаток этилового эфира п-аминобензойной кислоты), C6H4COO(CH2)2N(C2H5)2 (остаток бета-диэтиламиноэтилового эфира п-аминобензойной кислоты), C5H4NCONH (остаток гидразида изоникотиновой кислоты), CH2CH2SO3H (остаток 2-аминоэтансульфоновой кислоты), C9O5NSH10 (остаток 7-аминоцефалоспориновой кислоты), C9ON2H11 (остаток 1-фенил-2,3-диметил-4-аминопиразолона-5 (4-аминоантипирина), а также остатки сульфаниламидных препаратов, содержащих свободную аминогруппу, таких как C6H4SO2NH2 (остаток п-бензолсульфамида), C6H4SO2N(Na)COCH, (остаток п-аминобензолсульфацетамид-натрия).
| Таблица | |||||
| Характеристика аминосодержащих соединений RNH2 | Характеристика конъюгатов альгиновой кислоты | ||||
| Формула | УФ-спектр: (Н2О, λmax, нм) | Свойства | УФ-спектр: (Н2О, λmax, нм) | Химические сдвиги* протонов в остатках аминов, м.д. | Свойства |
| n-аминофенол (1) | 297 | Производное n-аминофенола - N-ацетил-n-аминофенол (парацетамол) является противовоспалительным и жаропонижающим средством. | 253 | 7.1 и 7.5 уш.с | противовоспалительные и антимикробные |
| о-аминофенол (2) | 284 | Участвует в метаболических путях триптофана | 281 и 308 | 7.1, 7.3 и 7.6 уш.с | антимикробные |
| п-аминобензойная кислота(3) | 272 | n-аминобензойная кислота является физиологическим веществом, необходимым для роста многих микроорганизмов (например, молочнокислых бактерий) и некоторых животных (например, цыплят); является витамином H1. n-аминобензойная кислота является антагонистом многих сульфамидов. Содержится в дрожжах, является компонентом пептидов с несколькими (6-11) остатками глютаминовой кислоты и участвует в построении молекулы фолиевой (птероилглутаминовой) кислоты. В виде эфиров применяется как местноанестезирующее средство (этиловый эфир n-аминобензойной кислоты - анестезин). В качестве действующего вещества (0.007%) входит в состав глазных капель «Актипол» с антивирусным, иммуномодулирующим (индуктор интерферона), радиопротекторным и репаративным действием. | 289 | 7.8 и 8.0 уш.с | антивирусные, иммуномодулирующие, радиопротекторные и репаративные |
| антраниловая кислота (4) | 259 и 303 | Участвует в метаболизме триптофана. Производное антраниловой кислоты - препарат «мефенамовая кислота» (N-(2,3-диметилфенил)-антраниловая кислота) обладает анальгезирующей, жаропонижающей и противовоспалительной активностью (превосходит салицилаты). | 320 | 7.3, 7.6, 8.1 и 8.5 уш.с | противовоспалительные |
| 4-аминосалициловая кислота(5) | 265 и 299 | В виде натриевой соли (ПАСК-натрий) - противотуберкулезное средство. | 267 и 304 | 6.9-7.5 уш. с | противотуберкулезные |
| 5-аминосалициловая кислота(6) | 301 | Препарат «Месалазин». Применяется для лечения острого язвенного колита и болезни Крона. Как и ацетилсалициловая кислота, является ингибитором синтеза простагландинов и обладает противовоспалительной активностью. | 313 | 7.0, 7.7 и 8.1 уш. с | противовоспалительные, антисептические, гемостатические |
| этиловый эфир n-аминобензойной кислоты (анестезин) (7) | 285 | Является активным поверхностным местноанестезирующим средством. Широко используется в виде мазей, присыпок и других лекарственных форм для обезболивания. | 271 | 7.8 и 8.1 уш.с | анестезирующие |
| β-диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин) (8) | 291 | Местноанестезирующее средство. Широко используется для местной анестезии, главным образом, для инфильтрационной и спинномозговой. Иногда также назначается для внутрикостной анестезии. | 274 | 7.8 и 8.1 уш.с | анестезирующие |
| гидразид изоникотиновой кислоты (изониазид) (9) | 266 | Противотуберкулезное средство. Также является составной частью раствора «Изонидез», применяемого как средство профилактики спаечной болезни после хирургических вмешательств на органах брюшной полости. | 263 | 8.0 и 8.9 уш.с | противотуберкулезные |
| Н2N-СН2СН2SO3Н2-аминоэтансульфоновая кислота (таурин) (10) | - | Средство, регулирующее метаболические процессы. Способствует улучшению энергетических процессов, играет большую роль в обмене жиров, входит в состав парных желчных кислот (таурохолевой, тауродезоксихолевой), способствующих эмульгированию жиров в кишечнике. В мозге таурин играет роль нейромедиаторной аминокислоты, тормозящей синаптическую передачу, обладает противосудорожной активностью, оказывает кардиотропное действие. Характерной особенностью таурина является способность | - | ** | противовоспалительные и репаративные |
| стимулировать репаративные процессы при дистрофических нарушениях сетчатки глаза, травматических поражениях тканей глаза. | |||||
| 7-аминоцефалоспориновая кислота (11) | 262 | Прекурсор для производства цефалоспориновых антибиотиков | 262 | 2.0 с (для метильных протонов СОСН3-группы) | противомикробные |
| 1-фенил-2,3-диметил-4-аминопиразолон-5(4-аминоантипирин) (12) | 245 и 281 | 1-фенил-2,3-диметил-4-аминопиразолон-5 (4-аминоантипирин) - структурный аналог анальгина, бутадиона (анальгезирующих и жаропонижающих средств). | 262 | 8.0 и 8.9 уш. с | анальгезирующие |
| n-бензолсульфамид (стрептоцид) (13) | 259 | Противомикробное средство. | 259 | 7.6 и 7.9 уш. с | антимикробные |
| п-аминобензолсульфацетамид-натрий (сульфацил-натрий, альбуцид)(14) | 260 | Противовирусное и противопаразитарное средство. Препарат эффективен при стрептоккоковых, гонококковых, пневмококковых и коли-бациллярных инфекциях. | 263 | 7.8 и 8.0 уш. с | противовирусные и антимикробные |
| * Кроме сигналов ароматических протонов, в спектрах конъюгатов альгиновой кислоты наблюдаются все сигналы, соответствующие остаткам аминосодержащих соединений (в таблице не приводятся).** Конверсию карбоксигрупп АК, модифицированной таурином, определяли по содержанию серы. |
Пример 1. К смеси 29.7 мг (0.15 ммоль) альгината (АК) и 16.4 мг (0.15 ммоль) n-аминофенола в 15 мл Н2О добавляют 0.1 н. NaOH (или, если требуется, 0.1 н. HCl) до рН 4.7-4.8, затем при интенсивном перемешивании и температуре 20-22°С вносят 28.8 мг (0.15 ммоль) карбодиимида (соотношение реагентов АК:RNH2:EDC=1:1:1), поддерживая рН 4.7-4.8 титрованием 0.1 н. HCl. Через 0.5 ч к охлажденной до 0°С реакционной смеси последовательно добавляют 0.1 н. NaOH (до рН 7-8), 2-3 мл насыщенного раствора NaCl и 15-20 мл охлажденного этанола. Выпавший осадок отделяют центрифугированием, растворяют в 10 мл 6% NaCl, добавляют 10-15 мл этанола. Вновь выпавший осадок центрифугируют, промывают этанолом (10×3 мл), затем эфиром (10×3 мл) и сушат при температуре ≤60°С и пониженном давлении. Получают ˜30 мг конъюгата в виде белого порошка. Конверсия карбоксигрупп альгиновой кислоты в конъюгате с n-аминофенолом - 100%.
Конверсию карбоксильных групп альгиновой кислоты определяют по данным 1Н-ЯМР-спектроскопии из соотношения приведенных к одному протону суммарных интенсивностей сигналов протонов, отвечающих остаткам аминов, и сигналов в области 3.5-4.5 м.д. (Н и ОН-групп пиранозного цикла альгиновой кислоты).
Спектры 1Н-ЯМР регистрировали для растворов в D2O на спектрометре Bruker АМХ-300 (рабочая частота для 1Н-ЯМР-300.13 МГц), в качестве внутреннего стандарта использовали натриевую соль 3-(триметилсилил)-1-пропансульфоновой кислоты. УФ-спектры получали на спектрофотометре Specord M-40. Контроль рН растворов проводили с помощью рН-метра «рН-340».
Пример 2-14. Реакцию альгиновой кислоты с соответствующим амином (2-14) и очистку продуктов проводят аналогично примеру 1. Конверсия карбоксигрупп альгиновой кислоты во всех случаях составляла 100%.
В таблице для каждого конъюгата АК приведены сигналы ароматических протонов (кроме таурина и 7-аминоцефалоспориновой кислоты), отвечающих остаткам аминов, относительно которых определяют конверсию карбоксигрупп альгиновой кислоты. Также приведены данные УФ-спектроскопии и охарактеризованы свойства конъюгатов.
Способ получения конъюгатов альгиновой кислоты (АК) путем ее взаимодействия с аминосодержащими соединениями в водной среде, рН 4,7-4,8, в присутствии конденсирующего реагента 1-этил-3-[3-(диметиламино)пропил]карбодиимида (EDC), отличающийся тем, что в качестве аминосодержащих веществ используют соединения общей формулы RNH2, где R=С6Н4OH (остатки n- или о-аминофенола), С6H4СООН (остатки n-аминобензойной или антраниловой кислот), С6Н3(ОН)СООН (остатки 4- или 5-аминосалициловых кислот), С6Н4СООС2Н5 (остаток этилового эфира n-аминобензойной кислоты), C6H4COO(CH2)2N(C2H5)2 (остаток β-диэтиламиноэтилового эфира n-аминобензойной кислоты), C5H4NCONH (остаток гидразида изоникотиновой кислоты), CH2СН2SO3Н (остаток 2-аминоэтансульфоновой кислоты), C9O5NSH10 (остаток 7-аминоцефалоспориновой кислоты), C9ON2H11 (остаток 1-фенил-2,3-диметил-4-аминопиразолона-5(4-аминоантипирина), а также остатки сульфаниламидных препаратов, содержащих свободную аминогруппу, таких как C6H4SO2NH2 (остаток n-бензолсульфамида), C6H4SO2N(Na)COCH3 (остаток n-аминобензолсульфацетамид-натрия) при мольном соотношении реагентов AK:RNH2:EDC=1:1:1.