Способ получения циклогептатриена-1,3,5
Иллюстрации
Показать всеИспользование: органический синтез. Проводят дигидрохлорирование и изомеризацию 7,7-дихлорбицикло[4.1.0]гептана под действием катализатора - одно- и двухвалентных солей меди и спирта (ROH, где R=Me, Et), выполняющего роль реагента связывающего HCl и растворителя, при мольном соотношении компонентов [7,7-дихлорбицикло[4.1.0]-гептан]:[КОН]:[кат]=1:10:0.01 при 60°С в течение 6 часов. Технический результат: увеличение выхода и чистоты целевого продукта и упрощение аппаратурного оформления процесса. 1 табл.
Реферат
Изобретение относится к области органического синтеза, а именно к способу получения циклогептатриена-1,3,5 (ЦГТ), который может быть использован как сырье для получения разнообразных типов полициклических (F.Turecek, V.Hanus, P.Sedmera. Coll. Czechosl. Chem Commun. 1981. Vol.46, 6, p.p.1474-1485; H.Philip. Energy Pifference Am. Chem. Soc., 1980, vol.102, p.p.331-337) и каркасных (К.Takatsuki. I.Murata. Bull. Chem. Soc. Japan., 1970, vol.43, 3, p.p.996; K.Mach, H.Antropiusova. Tetrahedron Lett., 1980, Vol.21, p.p.4879) углеводородов, в частности второго представителя гомологического ряда алмазоподобных углеводородов - диамантана, и может служить в качестве тридентатного лиганда в химии координационных соединений.
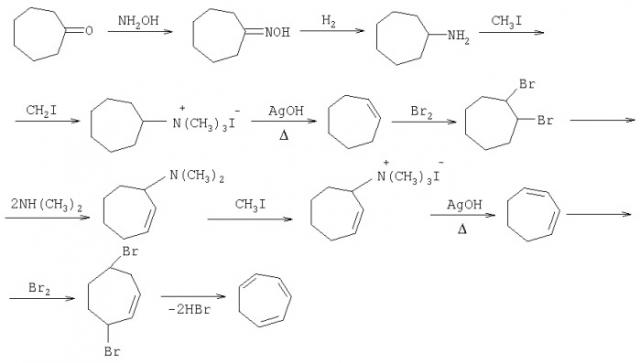
Циклогептатриен-1,3,5 может быть получен методами классического органического синтеза, исходя из циклогептанона по следующей схеме:
(R.Willstätter and E.Waser, Ber., 1911, 44, 3423. R.Willstätter and M.Heidelberger. Ber., 1913, 46, 517).
Этот синтез включает десять стадий, требует дорогостоящих реагентов, поэтому представляет теоретический интерес и пригоден для получения небольших количеств ЦГТ.
ЦГТ может быть получен циклопропанированием бензола диазометаном при облучении ультрафиолетовым светом.
(W.Von, E.Doering and Z.M.Knox. J. Am. Chem. Soc., 1950, 72, p.p.2305).
Недостатком метода является использование взрывоопасного и высокотоксичного диазометана и лампы ультрафиолетового облучения высокой мощности. Метод трудно масштабируется, его нельзя применять для получения больших количеств циклогептатриена-1,3,5.
ЦГТ с 50% выходом был синтезирован сольволизом производного бицикло[3.2.]гепт-2-ен-6-ола:
(H.L.Dryten. J. Chem. Soc., 1954, 76, p.p.7841).
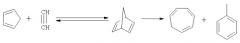
К принципиальным недостаткам данного метода следует отнести труднодоступность исходного бициклического спирта 2 и низкий выход целевого продукта. Известен метод получения циклогептатриена-1,3,5 высокотемпературной (400-420°С, 0.5-1.0 МПа) [2.4]-циклизацией циклопентадиена с ацетиленом, проходящий в две стадии. Сначала образуется бицикло[2.2.1]гептадиен, который изомеризуется в ЦГТ. Выход ЦГТ составляет 65%. Побочным продуктом реакции является толуол, содержание которого достигает 30%.
(Пат. ФРГ 931050 (1955); Пат. США 2754337 (1956); Англ. пат. 747277 (1956); Платэ А.Ф., Прянишникова М.А. ЖПХ, 1965, Т.38, с.2073-2075; А.А.Артемьев, Е.В.Генкина, Г.В.Головкин и др. Авт. свид. 1888499 (1965). Бюлл. изобр. №22 (1966)).
Недостатками метода являются:
1. Высокая температура 400-420°С.
2. Использование ацетилена - взрывоопасного реагента.
3. Сложное аппаратурное оформление.
4. Образование трудноразделимой смеси циклогептатриена-1,3,5 (tкип.=116-117°С) и толуола (tкип.=110.6°С).
Циклогептатриен-1,3,5 можно получить скелетной изомеризацией бицикло[2.2.1]гептадиена, которую проводят при температуре 450-475°С и атмосферном давлении. Выход ЦГТ не превышает 45-50% из-за образования в качестве примеси толуола (J.S.Chirtel and W.M.Halper. U.S.Patent 1956, 2, 754334. W.S.Woods, J.Org. Chem. 1958, 23, 110).
Наиболее близким аналогом предлагаемого изобретения можно рассматривать метод получения циклогептатриена-1,3,5 дегидрохлорированием 7,7-дихлорбицикло[4.1.0]гептана, используя склонность его циклопропанового фрагмента к изомеризации с расширением цикла. Реакцию проводят при температуре 490-520°С в токе азота. Процесс протекает неоднозначно с образованием смеси ЦГТ (35%) и толуола (36%).
(М.Е.Winberg. J. Org. Chem. 1959, 24, 264).
Этот метод за счет изменения параметров пиролиза: применение низкого остаточного давления (110-130 мм рт.ст.), изменение объемной скорости подачи сырья, использование тока сухого азота был усовершенствован, что привело к увеличению выхода ЦГТ почти до 90% и снижению содержания толуола до 7%. (О.М.Нефедов, Н.Н.Новицкая, И.С.Исаев. Доклады Академии наук СССР. 1966, 168, 1, с.106-109).
Недостатками этих методов являются:
высокая температура 490-520°С, применение сухого азота, вакуума, выделения агрессивного HCl, требующего специального оборудования и утилизации, образование трудноразделимой смеси ЦГТ-толуол.
Предлагается способ получения циклогептатриена-1,3,5, не имеющий недостатков прототипа. Способ основан на дегидрохлорировании и изомеризации с расширением цикла 7,7-дихлорбицикло[4.1.0]гептана под действием катализатора солей одно- и двухвалентной меди (Cu(I), Cu(II)) в среде спиртов в мольном соотношении [7,7 дихлорбицикло[4.1.0] гептана]:[ROH]:[кат.]=1:10:0.01 при температуре 160°С в течение 6 часов.
В качестве катализатора могут быть использованы следующие соли меди: CuBr2, CuCl2·2H2O, CuSO4·5H2O, CuCl, CuBr, CuI. Выход целевого продукта ЦГТ составляет 83% при использовании в качестве катализатора CuBr2.
Предлагаемый метод имеет следующие преимущества:
1. Относительно низкая температура реакции 160°С.
2. Простота аппаратурного оформления.
3. Дешевизна и малый расход катализатора.
4. Отсутствие высокоагрессивного требующего утилизации и специального оборудования хлороводорода (HCl). В условиях реакции HCl взаимодействует со спиртом с образованием 1-хлоралкила, который находит самостоятельное применение.
5. Высокий выход ЦГТ.
6. Отсутствие толуола, что облегчает выделение целевого продукта в чистом виде.
Способ поясняется примерами.
ПРИМЕР 1. В стеклянную ампулу (V=30 см3) помещают 3.6 г (22 ммоль) 7,7-дихлорбицикло[4.1.0]гептана, 0.05 г (0.22 ммоль) CuBr2, 7 г (220 ммоль) СН3ОН. Нагревают 6 часов при 160°С. Перегонкой реакционной массы выделяют 1.66 г циклогептатриена-1,3,5 (выход 83%).
ПРИМЕР 2. В микроавтоклав (V=17 см3) помещают 1.1 г (6.7 ммоль) 7,7-дихлорбицикло[4.1.0]гептана, 0.01 г (0.067 ммоль) CuCl2·2H2O, 2.1 г (67 ммоль) СН3ОН. Нагревают 6 часов при 160°С. Перегонкой выделют 0.43 г циклогептатриена-1,3,5 (выход 71%).
ПРИМЕР 3. В микроавтоклав (V=17 см3) помещают 1.1 г (6.7 ммоль) 7,7-дихлорбицикло[4.1.0]гептана, 0.15 г (0.067 ммоль) CuBr2, 3.08 г (67 ммоль) C2H5OH. Нагревают 6 часов при 160°С. Перегонкой выделяют 0.46 г циклогептатриена-1,3,5 (выход 76%).
Влияние различных катализаторов на выход целевого продукта ЦГТ отражено в таблице.
| Таблица | |||
| Влияние природы катализатора на выход циклогептатриена-1,3,5 | |||
| № п/п | Катализатор | Выход ЦГТ, % | Конверсия 7,7-дихлорбицикло[4.1.0] гептана, % |
| 1. | CuBr2 | 83 | 100 |
| 2. | CuCl2·2H2O | 71 | 98 |
| 3. | CuBr | 75 | 95 |
| 4. | CuCl | 67 | 99 |
| 5. | CuI | 56 | 96 |
| 6. | CuSO4·5H2O | 53 | 90 |
Условия реакции: [7,7 дихлорбицикло[4.1.0] гептана]:[МеОН]:[kat]=1:10:0.01; 160°С, 6 ч.
Способ получения циклогептатриена-1,3,5 путем дегидрохлорирования и изомеризации 7,7-дихлорбицикло[4.1.0]гептана, отличающийся тем, что процесс ведут в присутствии катализатора - солей одно- и двухвалентной меди, таких как CuBr2, CuCl2·2H2O, CuBr, CuCl, CuI, CuSO4·5Н2О в среде спирта общей формулы ROH (где R=Mt, Et), выполняющего роль реагента связывающего HCl и растворителя, при мольном соотношении компонентов [7,7-дихлорбицикло[4.1.0]гептан]:[КОН]:[кат.]1=1:10:0,01, при температуре 160°С в течение 6 ч.