Производные 4,5-дигидро-1h-пиразола, обладающие сильной cb1-антагонистической активностью
Иллюстрации
Показать всеНастоящее изобретение относится к группе новых производных 4,5-дигидро-1Н-пиразола, которые являются сильными антагонистами каннабиноидного (CB1) рецептора, являясь полезными для лечения болезней, связанных с нарушениями каннабиноидной системы. Соединения имеют общую формулу (Ia) или (Ib), где символы имеют обозначения, приведенные в формуле изобретения. Изобретение также относится к способам получения данных соединений, их применению, промежуточным соединениям для получения данных соединений и к фармацевтической композиции, содержащей, по меньшей мере, одно из данных соединений в качестве активного компонента. 12 н. и 3 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к группе новых производных 4,5-дигидро-1Н-пиразола, к способам получения данных соединений и к фармацевтическим композициям, содержащим одно или несколько данных соединений в качестве активного компонента.
Указанные выше 4,5-дигидро-1Н-пиразолы являются сильными антагонистами каннабиноидного рецептора (СВ1), которые могут использоваться для лечения расстройств, включающих каннабиноидную нейропередачу.
Каннабиноиды присутствуют в индийской конопле Cannabis sativa, и их использовали в качестве лекарственных средств в течение столетий (Mechoulam, R., Feigenbaum, J.J. Prog. Med. Chem. 1987, 24, 159). Однако только в последние десять лет при исследованиях каннабиноидов была обнаружена базовая информация по каннабиноидным рецепторам и их (эндогенным) агонистам и антагонистам. Открытие и последующее клонирование двух различных подтипов каннабиноидных рецепторов (СВ1 и СВ2) стимулировало поиск новых антагонистов каннабиноидных рецепторов (Munro, S et al., Nature 1993, 365, 61; Matsuda, L.A., Bonner, T.I. Cannabinoid Receptors, Pertwee, R.G. Ed. 1995, 117, Academic Press, London). Кроме того, фармацевтические компании начали интересоваться разработкой каннабиноидных лекарственных препаратов для лечения заболеваний, связанных с расстройствами каннабиноидной системы (Consroe, P. Neurobiology of Disease 1998, 5, 534; Pop, E. Curr. Opin. In CPNS Investigational Drugs 1999, 1, 587; Greenberg, D.A. Drug News Perspect. 1999, 12, 458; Pertwee, R.G., Progress in Neurobiology 2001, 63, 569). До настоящего времени было известно несколько антагонистов СВ1 рецепторов. Фирмой Sanofi описаны соединения из группы диарилпиразолов в качестве селективных антагонистов СВ1 рецептора. Типичным примером является SR-141716A (Dutta, A.K. et al., Med. Chem. Res. 1994, 5, 54; Lan, R. et al., J. Med. Chem. 1999, 42, 769; Nakamura-Palacios, E.M. et al., CNS Drug Rev. 1999, 5, 43). CP-272871 представляет собой собой производное пиразола аналогичное SR141716A, но менее эффективное и менее селективное по отношению к подтипу СВ1 рецептора по сравнению с SR141716A (Meschler, J.P. et al., Biochem. Pharmacol. 2000, 60, 1315). В качестве антагонистов СВ1 рецептора были описаны аминоалкилиндолы. Типичным примером является лодоправадолин (АМ-630), который был описан в 1995. АМ-630 представляет собой собой умеренно активный антагонист СВ1 рецептора, но иногда он ведет себя как слабый частичный агонист (Hosohata, K. et al., Life Sc. 1997, 61, PL115). Исследователи из Эли Лилли описали арил-ароил замещенные бензофураны в качестве селективных антагонистов СВ1 рецептора (например, LY-320135) (Felder, C.C. et al., J. Pharmacol. Exp. Ther. 1998, 284, 291). В качестве лигандов каннабиноидного рецептора описаны 3-алкил-5,5'-дифенилимидазолидиндионы, которые, как было показано, являются каннабиноидными антагонистами (Kanyonyo, M. et al., Biorg. Med. Chem. Lett. 1999, 9, 2233). Фирмой Авентис Фарма (Aventis Pharma) запатентованы аналоги диарилметиленазетидина в качестве антагонистов СВ1 рецепторов (Mignani, S. et al., Patent FR 2783246, 2000; Chem. Abstr. 2000, 132, 236982). В качестве антагонистов СВ1 фирмой Sanofi-Synthelabo были запатентованы трициклические пиразолы (Barth, F. et al., Patent WO 0132663, 2001; Chem. Abstr. 2001, 134, 340504). Интересным является то, что многие антагонисты СВ1 рецепторов ведут себя как обратные агонисты in vitro (Landsman, R.S. et al., Eur. J. Pharmacol. 1997, 334, R1). Состояние исследований в области каннабиноидов подробно рассмотрено в обзорах (Mechoulam, R. et al., Prog. Med. Chem. 1998, 35, 199; Lambert, D.M. Curr. Med. Chem. 1999, 6, 635; Mechoulam, R. et al., Eur. J. Pharmacol. 1998, 359, 1; Williamson, E.M., Evans, F.J. Drugs 2000, 60, 1303; Pertwee, R.G. Addiction Biology 2000, 5, 37; Robson, P. Br. J. Psychiatry 2001, 178, 107; Pertwee, R.G. Prog. Neurobiol. 2001, 63, 569; Goya, P., Jagerovic, N. Exp. Opin. Ther. Patents 2000, 10, 1529; Pertwee, R.G. Gut 2001, 48, 859).
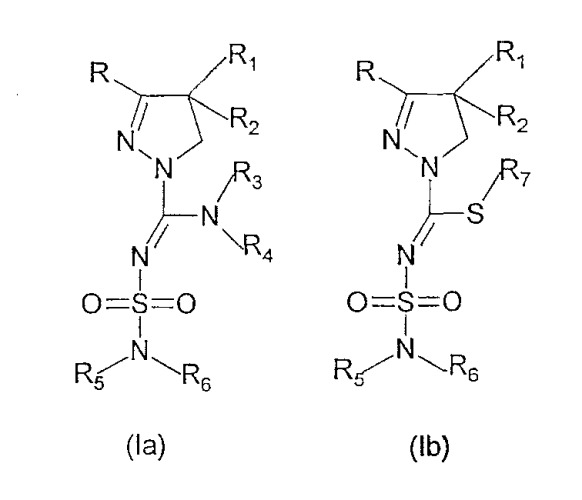
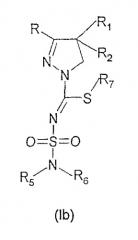
Неожиданно было обнаружено, что мощный и селективный антагонизм по отношению к каннабиноидным СВ1 рецепторам проявляется новыми производными 4,5-дигидро-1Н-пиразола формулы (Ia) или (Ib), их пролекарствами, таутомерами и солями
где
- R и R1 независимо представляют собой фенил, тиенил или пиридил, причем указанные группы могут быть замещены 1, 2 или 3 заместителями Y, которые могут быть одинаковыми или различными, выбранными из группы С1-3-алкила или алкокси, гидроксила, галогена, трифторметила, трифторметилтио, трифторметокси, нитро, амино, моно- или диалкил(С1-2)-амино, моно- или диалкил(С1-2)-амидо, (С1-3)-алкилсульфонила, диметилсульфамидо, С1-3-алкоксикарбонила, карбоксила, трифторметилсульфонила, циано, карбамоила, сульфамоила и ацетила, или R и/или R1 представляют собой нафтил,
- R2 представляет собой водород, гидроксил, С1-3-алкокси, ацетилокси или пропионилокси,
- R3 представляет собой атом водорода или разветвленную или неразветвленную С1-8-алкильную группу или С3-7-циклоалкильную группу, причем алкильная или циклоалкильная группа могут быть замещены гидроксигруппой,
- R4 представляет собой атом водорода или разветвленный или неразветвленный С1-8-алкильный, С3-8-циклоалкильный, С2-10-гетероалкильный, С3-8 неароматический гетероциклоалкильный или С4-10 неароматический гетероциклоалкилалкильный фрагмент, причем указанный фрагмент может содержать один или несколько гетероатомов, выбранных из группы (O, N, S), причем указанные фрагменты могут быть замещены кето группой, трифторметильной группой, С1-3-алкильной группой, гидроксилом, амино, моноалкиламино или диалкиламино группой или атомом фтора, или R4 представляет собой амино, гидрокси, фенокси или бензилокси группу или R4 представляет собой разветвленную или неразветвленную С1-8-алкокси, С3-8 алкенильную, С5-8 циклоалкенильную или С6-9 циклоалкенилалкильную группу, причем указанные группы могут содержать атом серы, азота или кислорода, кето группу или -SO2- группу, причем С1-8-алкокси, С3-8 алкенильная, С5-8 циклоалкенильная или С6-9 циклоалкенилалкильная группы могут быть замещены гидроксигруппой, трифторметильной группой, аминогруппой, моноалкиламиногруппой или диалкиламиногруппой или атомом фтора, или R4 представляет собой фенильную, бензильную, пиридильную, тиенильную, пиридилметильную или фенетильную группу, где ароматические кольца могут быть замещены 1, 2 или 3 заместителями Y, где Y имеет значение, указанное выше, или
R4 представляет собой группу NR8R9 при условии, что R3 представляет собой атом водорода или метильную группу, и где R8 и R9 являются одинаковыми или различными и представляют собой С1-4-алкил или С2-4-трифторалкил, или R8 и R9, вместе с атомом азота, к которому они присоединены, образуют насыщенную или ненасыщенную гетероциклическую группу, имеющую от 4 до 8 атомов в кольце, причем указанная гетероциклическая группа может содержать атом кислорода или серы, или кетогруппу, или -SO2- группу, или дополнительный атом азота, причем указанная насыщенная или ненасыщенная гетероциклическая группа может быть замещена С1-4-алкильной группой, или
R3 и R4, вместе с атомом азота, к которому они присоединены, образуют насыщенную или ненасыщенную моноциклическую или бициклическую гетероциклическую группу, имеющую от 4 до 10 атомов в цикле, причем указанная гетероциклическая группа может содержать один или несколько атомов из группы (O, N, S), или кетогруппу или -SO2- группу, причем указанная группа может быть замещена С1-4-алкильной, гидроксиалкильной, фенильной, тиенильной, пиридильной, амино, моноалкиламиноалкильной, диалкиламиноалкильной, моноалкиламино, диалкиламино, аминоалкильной, азетидинильной, пирролидинильной, пиперидинильной или гексагидро-1Н-азепинильной группой,
- R5 и R6 независимо друг от друга представляют собой атом водорода или разветвленную или неразветвленную С1-8-алкильную или алкенильную группу, причем указанные группы могут содержать один или несколько гетероатомов из группы (O, N, S), кетогруппу или -SO2- группу и могут быть замещены гидроксилом или аминогруппой, или R5 и R6 независимо друг от друга представляют собой С3-8-циклоалкильную группу или С3-8-циклоалкенильную группу, которая может содержать в цикле один или несколько гетероатомов, выбранных из группы (O, N, S), или -SO2- группу, причем указанные группы могут быть замещены гидроксигруппой, алкилом(С1-3), -SO2- группой, кетогруппой, аминогруппой, моноалкиламиногруппой (С1-3) или диалкиламиногруппой (С1-3), или
R5 представляет собой нафтильную группу или фенильную группу, причем фенильная группа может быть замещена 1, 2 или 3 заместителями Y, где Y имеет значение, указанное выше, при условии, что R6 представляет собой атом водорода или разветвленную или неразветвленную алкильную группу (С1-5), причем алкильная группа может содержать один или несколько гетероатомов из группы (O, N, S) или -SO2- группу и быть замещенной гидроксилом, кето или аминогруппой, или
- R5 и R6, вместе с атомом азота, к которому они присоединены, образуют моноциклическую, бициклическую или трициклическую алкильную или алкенильную группу, которая может содержать в цикле гетероатомы из группы (O, N, S), кето или -SO2- группу, причем указанная моноциклическая, бициклическая или трициклическая алкильная или алкенильная группа могут быть замещены гидрокси группой, алкильной(С1-3) группой, SO2 группой, кетогруппой, аминогруппой, моноалкиламиногруппой (С1-3), диалкиламиногруппой (С1-3), пирролидинильной группой или пиперидинильной группой, причем указанная моноциклическая, бициклическая или трициклическая алкильная или алкенильная группа могут содержать аннелированную фенильную группу, причем указанная аннелированная фенильная группа может быть замещена 1 или 2 заместителями Y, где Y имеет обозначение, описанное выше,
- R7 представляет собой разветвленный или неразветвленный С1-3 алкил.
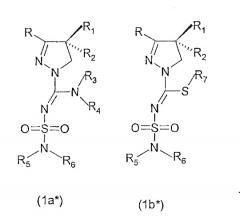
В соединениях формулы (Ia) и (Ib) присутствует, по меньшей мере, один центр хиральности (в положении С4 4,5-дигидро-1Н-пиразольной группы).
Изобретение относится как к рацематам, смесям диастереомеров, так и к индивидуальным стереоизомерам соединений, имеющих формулу (Ia) или (Ib). Особенно интересные соединения формулы (Ia) или (Ib) имеют абсолютную стереоконфигурацию в положении С4 4,5-дигидро-1Н-пиразольной группы, представленную формулами (1a*) и (1b*):
Изобретение также относится как к Е изомеру, Z изомеру, так и к E/Z смесям соединений, имеющих формулу (Ia) или (Ib).
Соединения по изобретению могут быть преобразованы в формы, подходящие для введения, обычными способами, используя вспомогательные вещества и/или жидкие или твердые носители.
Благодаря мощной СВ1 антагонистической активности, соединения по изобретению подходят для использования при лечении психиатрических расстройств, таких как психоз, состояние страха, депрессия, дефицит внимания, расстройства памяти, когнитивные расстройства, расстройства аппетита, ожирение, аддикция, влечение, лекарственная зависимость, и неврологических расстройств, таких как нейродегенеративные заболевания, слабоумие, дистония, мышечная спастичность, тремор, эпилепсия, рассеянный склероз, травма головного мозга, инсульт, болезнь Паркинсона, болезнь Альцгеймера, эпилепсия, болезнь Хантингтона, синдром Туретта, ишемия головного мозга, апоплексия мозга, черепно-мозговая травма, инсульт, травма спинного мозга, нейровоспалительные заболевания, рассеянный склероз, вирусный энцефалит, расстройства, связанные с демиелинизацией, а также для лечения болевых состояний, включающих невропатические боли, и других заболеваний, включающих каннабиноидную нейропередачу, включая лечение септического шока, глаукомы, рака, диабета, рвоты, тошноты, астмы, респираторных заболеваний, расстройств желудочно-кишечного тракта, язвы желудка, диареи и сердечно-сосудистых заболеваний.
Сродство соединений по изобретению к каннабиноидным СВ1 рецепторам определяли, используя мембранные препараты клеток яичника китайского хомяка (СНО), в которых каннабиноидный СВ1 рецептор человека прочно трансфектирован с [3H]СР-55,940 в качестве радиоактивного лиганда. После инкубации свежеприготовленных препаратов клеточной мембраны с [3H]-лигандом с добавлением или без добавления соединений по изобретению отделение связанного и свободного лиганда проводили фильтрованием через фильтры из стекловолокна. Радиоактивность на фильтре измеряли жидкостным сцинтилляционным счетчиком.
Антагонистическую активность соединений по изобретению к каннабиноидному СВ1 рецептору определяли функциональными исследованиями с использованием СНО клеток, в которых канабиноидные СВ1 рецепторы человека являются устойчиво экспрессироваными. Аденилилциклазу стимулировали, используя форсколин, и измеряли, определяя количество накопленного циклического АМФ. Сопутствующая активация СВ1 рецепторов агонистами СВ1 рецептора (например, СР-55,940 или (R)-WIN-55,212-2) может ослабить вызванное форсколином накопление цАМФ в зависящей от концентрации форме. Данную реакцию, в которой медиатором является СВ1 рецептор, можно антагонизировать антагонистами СВ1 рецептора, такими как соединения по изобретению.
Промежуточные соединения, имеющие формулу (II) (см. ниже), можно получить известными методами, например: a) Francotte, E.; Tong, Z. Chem. Abstr. 126, 213598; b) Rempfler, H.; Kunz, W. Chem. Abstr. 113, 40432; c) Rempfler, H.; Kunz, W. Chem. Abstr. 107, 217473.
Промежуточные соединения, имеющие формулу (III), где R2 представляет собой водород (см. ниже), можно получить известными способами, например, a) EP 0021506; b) DE 2529689, c) Grosscurt, A.C. et al., J. Agric. Food Chem. 1979, 27, (2), 406.
Промежуточные соединения, имеющие формулу (III), где R2 представляет собой гидроксигруппу, можно получить взаимодействием соединения, имеющего формулу (II), с гидразином или гидратом гидразина
Данная реакция, предпочтительно, проводимая в органическом растворителе, таком как этанол, дает соединение, имеющее формулу (III), где R2 представляет собой гидроксигруппу.
Подходящие пути синтеза соединений по изобретению представляют собой собой следующее:
Путь синтеза А
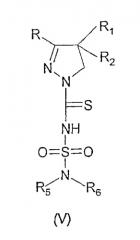
Стадия 1: взаимодействие соединения, имеющего формулу (III),
с соединением, имеющим формулу (IV).
Данную реакцию, предпочтительно, проводят в органическом растворителе, например, в дихлорметане, и получают соединение, имеющее формулу (V), где R, R1, R2, R5 и R6 обозначены так же, как указанное выше для соединения (Ia), и которые являются новыми.
Стадия 2: взаимодействие соединения, имеющего формулу (V), с соединением R7-X, где Х представляет удаляемую группу, например йодидную группу, и R7 имеет значение, указанное выше для (Ib), дает соединение, имеющее формулу (Ib).
Предпочтительно, данную реакцию проводят в присутствии основания, например, триэтиламина.
Стадия 3: взаимодействие соединения, имеющего формулу (Ib), с амином, имеющим формулу HNR3R4, где R3 и R4 имеют указанные выше значения, аналогично способу, описанному в Synth. Commun. 1996, 26, (23), 4299.
Данная реакция дает соединение, имеющее формулу (Ia).
Путь синтеза А1
Стадия 1: Взаимодействие соединения, имеющего формулу (V),
с амином, имеющим формулу HNR3R4, где R3 и R4 имеют описанные выше обозначения, в присутствии соли ртути (II), например, HgCl2, дает соединение, имеющее формулу (Ia).
Данную реакцию, предпочтительно, проводят в органическом растворителе, например, в ацетонитриле, аналогично методу, описанному в Synth. Commun. 1996, 26, (23), 4299.
Путь синтеза А2
Стадия 1: Взаимодействие соединения, имеющего формулу (III),
с производным изоцианата, имеющим формулу (VI), после чего следует обработка амином HNR5R6.
Данную реакцию, предпочтительно, проводят в органическом растворителе, аналогичном дихлорметану, и это дает соединение, имеющее формулу (VII). Соединения формулы (VII), где R, R1, R2, R5 и R6 имеют значения, указанные выше для соединения (Ia), являются новыми.
Стадия 2: взаимодействие соединения формулы (VII) с галогенирующим агентом, например с PCl5, дает соединение формулы (VIII)
где R10 представляет собой атом галогена, например атом хлора. Данную реакцию, предпочтительно, проводят в органическом растворителе, таком как хлорбензол.
Соединения, имеющие формулу (VIII), где R, R1, R2, R5 и R6 имеют значения, указанные выше для соединения (Ia), и где R10 представляет собой атом галогена, являются новыми.
Стадия 3: взаимодействие соединения, имеющего формулу (VIII), предпочтительно проводимое в инертном органическом растворителе, таком как дихлорметан, с амином, имеющим формулу HNR3R4, где R3 и R4 имеют значения, указанные выше, дает соединение, имеющее формулу (Ia).
Путь синтеза А3
Стадия 1: взаимодействие соединения, имеющего формулу (III),
с соединением, имеющим формулу (IX),
дает соединение, имеющее формулу (Ib), (см., например, Chem. Ber. 1966, 99, 2885 и Chem. Ztg. 1984, 108, (12), 404).
Получение соединений иллюстрируется следующими ниже примерами.
Пример 1
3-(4-Хлорфенил)-N'-(((этил)пропиламино)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин
Стадия А: К перемешиваемому раствору ((этил)пропиламино)сульфонилизотиоцианата (5,98 грамм, 25,4 ммоль) в сухом дихлорметане в атмосфере азота добавляют 3-(4-хлорфенил)-4-фенил-4,5-дигидро-1Н-пиразол (6,52 грамм, 25,4 ммоль). После перемешивания в течение 90 минут полученный раствор концентрируют в вакууме и очищают колоночной хроматографией (СН2Cl2, силикагель, Rf˜0,45). Полученное в результате твердое вещество перекристаллизовывают из диэтилового эфира, получая 3-(4-хлорфенил)-N-(((этил)пропиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-тиокарбоксамид (6,57 грамм, выход 56%). Температура плавления: 144-146°С.
Стадия В: К перемешиваемой суспензии 3-(4-хлорфенил)-N-(((этил)пропиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-тиокарбоксамида (2,32 грамм, 5 ммоль) в ацетонитриле (20 мл) добавляют холодный метиламин (4 мл). К полученному раствору добавляют раствор HgCl2 (1,5 грамм) в ацетонитриле (10 мл). Полученную в результате черную суспензию перемешивают в течение 4 часов. Осадок удаляют фильтрованием. Фильтрат концентрируют в вакууме, растворяют в дихлорметане и последовательно промывают водным 0,5 н. раствором NaOH и водой, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Полученное в результате маслянистое вещество кристаллизуют из диэтилового эфира, получая 3-(4-хлорфенил)-N'-(((этил)пропиламино)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин (1,78 грамм, выход 77%). Температура плавления (Тпл.): 129-131°С.
Аналогичным образом получают соединения формулы (Ia), перечисленные ниже:
2. 3-(4-хлорфенил)-N'-(((этил)метиламино)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=112-115°С.
3. 3-(4-хлорфенил)-N'-((диэтиламино)сульфонил)-N-(2-гидроксиэтил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=104-106°С.
4. 3-(4-хлорфенил)-N-(2-гидроксиэтил)-N'-((пиперидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. МС (ESI+):490(МН+).
5. 3-(4-хлорфенил)-N'-((диэтиламино)сульфонил)-N-(2-(морфолин-4-ил)этил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. МС (ESI+):547(МН+).
6. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-(2-(морфолин-4-ил)этил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество.
7. 3-(4-хлорфенил)-N'-((диэтиламино)сульфонил)-N-(2-(диметиламино)этил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. МС (ESI+):505(МН+).
8. 3-(4-хлорфенил)-N-(3-(диметиламино)пропил)-N'-((диметиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество.
9. 3-(4-хлорфенил)-N-(2-(пиперидин-1-ил)этил)-N'-((пиперидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. МС (ESI+):557(МН+).
10. 3-(4-хлорфенил)-N-(2-(морфолин-4-ил)этил)-N'-((пиперидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. МС (ESI+):559(МН+); Тпл.=174-176°С.
11. 3-(4-хлорфенил)-N-(2-(диметиламино)этил)-N'-((диметиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество.
12. 3-(4-хлорфенил)-N-(2-(диэтиламино)этил)-N'-((диметиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество.
13. 3-(4-хлорфенил)-N-(3-(диметиламино)пропил)-N'-((диэтиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. МС (ESI+):519(МН+).
14. 3-(4-хлорфенил)-N-(2-(диэтиламино)этил)-N'-((диэтиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин гемифумарат. Тпл.=182-185°С.
15. 3-(4-хлорфенил)-N-(2-(диметиламино)этил)-N'-((пиперидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество.
16. 3-(4-хлорфенил)-N-(2-(диэтиламино)этил)-N'-((пирролидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество.
17. 3-(4-хлорфенил)-N'-((диэтиламино)сульфонил)-N-(1-метилпиперидин-4-ил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество.
18. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-(2-гидроксиэтил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=123-126°С.
19. 3-(4-хлорфенил)-N'-((диэтиламино)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество. Rf˜0,4 (диэтиловый эфир).
20. 3-(4-хлорфенил)-N'-(((этил)пропиламино)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=129-131°С.
21. 3-(4-хлорфенил)-N-метил-N'-((пирролидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество. Rf˜0,3 (МТБЭ).
22. 3-(4-хлорфенил)-N-метил-N'-(((метил)пропиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=132-134°С.
23. 3-(4-хлорфенил)-N,N-диметил-N'-((пирролидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество. Rf˜0,25 (МТБЭ).
24. 3-(4-хлорфенил)-N-метил-N'-((пиперидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=175-177°С.
25. 3-(4-хлорфенил)-N'-((гексагидро-1Н-азепин-1-ил)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество.
26. 3-(4-хлорфенил)-N'-((дипропиламино)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл. =141-142°С.
27. 3-(4-хлорфенил)-N'-(((изопропил)метиламино)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=134-136°С.
28. 3-(4-хлорфенил)-N-метил-N'-((октагидроазоцин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=165-168°С.
29. 3-(4-хлорфенил)-N-этил-N'-((пиперидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество.
30. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=166-168°С.
Пример 31
3-(4-Хлорфенил)-N'-((диметиламино)сульфонил)-N-пропил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин
Стадия А: К перемешиваемому раствору хлорсульфонилизоцианата (1,73 мл, 20 ммоль) в сухом дихлорметане (20 мл) очень медленно добавляют раствор 3-(4-хлорфенил)-4-фенил-4,5-дигидро-1Н-пиразола (5,13 грамм, 20 ммоль) в сухом дихлорметане (125 мл) при -5°С. После перемешивания в течение 30 минут реакционной смеси дают нагреться до комнатной температуры и продолжают перемешивание в течение еще 2 часов. После охлаждения до 0°С добавляют жидкий диметиламин (5 мл) и полученный в результате раствор перемешивают в течение дополнительного часа при 0°С и в течение 2 часов при комнатной температуре. Раствор промывают водой, фильтруют через Hyflo и концентрируют в вакууме. Флэш-хроматография (МТБЭ, Rf˜0,3) дает 3-(4-хлорфенил)-N-((диметиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамид (4,75 г, 58%). Тпл.=210-212°С.
Стадия В: Смесь 3-(4-хлорфенил)-N-((диметиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамида (1,47 грамм, 3,62 ммоль) и пентахлорида фосфора (0,80 грамм, 3,84 ммоль) в хлорбензоле (20 мл) кипятят с обратным холодильником в течение 1 часа. После полного концентрирования в вакууме полученный 3-(4-хлорфенил)-N-((диметиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидоилхлорид суспендируют в сухом дихлорметане и проводят реакцию с холодным н.-пропиламином (1,0 мл) при 0°С. После перемешивания в течение 1 часа смесь растворяют в этилацетате, промывают водой и концентрируют в вакууме. Остаток очищают колоночной хроматографией (дихлорметан/ацетон = 19/1 (об./об., Rf˜0,35), получая маслянистое вещество (0,82 г). Кристаллизация из диэтилового эфира, после чего следует перекристаллизация из этанола, дает 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-пропил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин (0,38 грамм, выход 23%). Тпл.=127-129°С.
Аналогичным способом готовят перечисленные ниже соединения, имеющие формулу (Ia):
32. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-(2-фторэтил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=128-131°С.
33. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-4-фенил-N-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=158-159°С.
34. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-метокси-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=170-172°С.
Пример 35
Метиловый эфир 3-(4-хлорфенил)-N-((пиперидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты
Стадия А: К перемешиваемому раствору (пиперидин-1-ил)сульфонилизотиоцианата (54,77 г, 266 ммоль) в сухом дихлорметане (900 мл) под атмосферой азота добавляют 3-(4-хлорфенил)-4-фенил-4,5-дигидро-1Н-пиразол (68,3 грамм, 266 ммоль). После перемешивания в течение 16 часов добавляют дополнительное количество дихлорметана. Полученный в результате раствор дважды промывают водой, сушат над Na2SO4 и концентрируют в вакууме. После добавления МТБЭ остаток кристаллизуют. Кристаллическое вещество собирают и промывают МТБЭ, получая 3-(4-хлорфенил)-4-фенил-N-((пиперидин-1-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-тиокарбоксамид (77,6 грамм, выход 63%).
Стадия В: К перемешиваемому раствору 3-(4-хлорфенил)-4-фенил-N-((пиперидин-1-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-тиокарбоксамида (30 грамм, 64,9 ммоль) в ацетоне (1 л) добавляют триэтиламин (18,0 мл, 130 ммоль). К полученному желтому раствору добавляют метилйодид (9,12 г, 64 ммоль) и полученный раствор перемешивают в течение 16 часов при комнатной температуре. Образующийся осадок удаляют фильтрованием. Фильтрат промывают водой, концентрируют в вакууме, получая твердое желтое вещество. Перекристаллизацией из МТБЭ получают метиловый эфир 3-(4-хлорфенил)-N-((пиперидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты (27,9 грамм, выход 90%). Тпл.=192-194°С.
Аналогичным образом получают соединения формулы (Ib), перечисленные ниже:
36. Метиловый эфир 3-(4-хлорфенил)-N-((диметиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=159-160°С.
37. Метиловый эфир 3-(4-хлорфенил)-N-((диэтиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=141-143°С.
38. Метиловый эфир 3-(4-хлорфенил)-4-фенил-N-((1,2,3,4-тетрагидроизохинолин-2-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=143-145°С.
39. Метиловый эфир 3-(4-хлорфенил)-N-(((этил)фениламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=143-146°С.
40. Метиловый эфир 3-(4-хлорфенил)-N-((диэтиламино)сульфонил)-4-гидрокси-4-фенил-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Аморфное вещество.
41. Метиловый эфир 3-(4-хлорфенил)-N-((диэтиламино)сульфонил)-4-(пиридин-4-ил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Аморфное вещество.
42. Метиловый эфир 3-(4-хлорфенил)-N-((пиперидин-1-ил)сульфонил)-4-(3-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Аморфное вещество.
43. Метиловый эфир 3-(4-хлорфенил)-N-((диметиламино)сульфонил)-4-(3-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Аморфное вещество.
44. Метиловый эфир 3-(4-хлорфенил)-N-(((этил)метиламино)сульфонил)-4-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=133-136°С.
45. Метиловый эфир 3-(4-хлорфенил)-N-((пиперидин-1-ил)сульфонил)-4-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=182-185°С.
46. Метиловый эфир 3-(4-хлорфенил)-N-((морфолин-4-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=202-204°С.
47. Метиловый эфир 3-(4-хлорфенил)-4-(2-фторфенил)-N-((морфолин-4-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=205-207°С.
48. Метиловый эфир 3-(4-хлорфенил)-4-(2-фторфенил)-N-((пиперидин-1-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=196-198°С.
49. Метиловый эфир 3-(4-хлорфенил)-4-(2-фторфенил)-N-((диметиламино)сульфонил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=181-183°С.
50. Метиловый эфир 3-(4-хлорфенил)-4-(2,6-дифторфенил)-N-((морфолин-4-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=231-233°С.
51. Метиловый эфир 3-(4-хлорфенил)-4-(2,6-дифторфенил)-N-((пиперидин-1-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=221-225°С.
52. Метиловый эфир 3-(4-хлорфенил)-4-(2,6-дифторфенил)-N-((диметиламино)сульфонил)-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=181-185°С.
53. Метиловый эфир 3-(4-хлорфенил)-N-((1,1-диоксидотиоморфолин-4-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Тпл.=216-217°С.
54. Метиловый эфир 3-(5-хлортиен-2-ил)-N-((диэтиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты. Аморфное вещество.
Пример 55
3-(4-хлорфенил)-N-метил-4-фенил-N'-((пиперидин-1-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин
К охлажденной смеси (<0°С) метилового эфира 3-(4-хлорфенил)-N-((пиперидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты (10,0 грамм, 21 ммоль) в метаноле (75 мл) добавляют холодный метиламин (15 мл). Полученной смеси дают нагреться до комнатной температуры и перемешивают в течение 3 часов при 50°С. После охлаждения до комнатной температуры смесь концентрируют в вакууме, растворяют в дихлорметане, дважды промывают водой, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Последующая флэш-хроматография (EtOAc/MeOH/NH4OH (25% водн.)=95/5/0,5 (об./об.)), с последующей перекристаллизацией из диизопропилового эфира, дает 3-(4-хлорфенил)-N-метил-4-фенил-N'-((пиперидин-1-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин (7,87 грамм, выход 81%) в виде твердого белого вещества. Тпл.=175-177°С.
Аналогичным образом получают перечисленные ниже соединения формулы (Ia), включая соединения из таблицы 1:
56. 3-(4-хлорфенил)-N-циклопропил-4-фенил-N'-((пиперидин-1-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=142-144°С.
57. 3-(4-хлорфенил)-N'-((диэтиламино)сульфонил)-N-метил-4-гидрокси-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=180-182°С.
58. 3-(5-хлортиен-2-ил)-N'-((диэтиламино)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=122-123°С.
59. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-изопропил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=169-170°С.
60. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-(1-метилпиперидин-4-ил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=144-146°С.
61. 3-(4-хлорфенил)-N-циклопропил-N'-((диэтиламино)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=150-151°С.
62. 3-(4-хлорфенил)-N'-((диэтиламино)сульфонил)-N-этил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=116-119°С.
63. 3-(4-хлорфенил)-N'-((диэтиламино)сульфонил)-N,N-диметил-4-гидрокси-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=135-137°С.
64. N'-((диэтиламино)сульфонил)-N,N-диметил-3-(4-фторфенил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=159-160°С.
65. 3-(4-хлорфенил)-N'-((диэтиламино)сульфонил)-N-изопропил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=81-85°С.
66. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-этил,N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество.
67. 3-(4-хлорфенил)-N-этил,N-метил-N'-((пиперидин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=178°С.
68. 3-(4-хлорфенил)-N'-((диэтиламино)сульфонил)-N-этил-4-гидрокси-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=162-165°С.
69. 3-(4-хлорфенил)-N-метил-N'-((1,2,3,4-тетрагидроизохинолин-2-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Аморфное вещество.
70. 3-(4-хлорфенил)-N'-(((этил)фениламино)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=145-147°С.
71. N'-((диэтиламино)сульфонил)-3-(4-хлорфенил)-N-метил-4-(пиридин-4-ил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=109-111°С.
72. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-метил-4-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=157-159°С.
73. 3-(4-хлорфенил)-N'-((диэтиламино)сульфонил)-N-метил-4-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=85-89°С.
74. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-метил-4-(пиридин-4-ил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=178-182°С.
75. 3-(4-хлорфенил)-N-метил-N'-((пиперидин-1-ил)сульфонил)-4-(3-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=168-170°С.
76. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-N-метил-4-(3-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=65-68°С.
77. 3-(4-хлорфенил)-N'-(((этил)метиламино)сульфонил)-N-метил-4-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=125-128°С.
78. 3-(4-хлорфенил)-N-метил-N'-((пиперидин-1-ил)сульфонил)-4-(пиридин-3-ил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=174-177°С.
79. 3-(4-хлорфенил)-4-(2,6-дифторфенил)-N-метил-N'-((морфолин-4-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=223-235°С.
80. 3-(4-хлорфенил)-4-(2,6-дифторфенил)-N'-((диметиламино)сульфонил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=214-216°С.
81. 3-(4-хлорфенил)-4-(2,6-дифторфенил)-N-метил-N'-((пиперидин-1-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=260-263°С.
82. 3-(4-хлорфенил)-4-(3-фторфенил)-N-метил-N'-((пиперидин-1-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=170°С.
83. 3-(4-хлорфенил)-4-(2-фторфенил)-N-метил-N'-((пиперидин-1-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=223-225°С.
84. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-4-(2-фторфенил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=173-175°С.
85. 3-(4-хлорфенил)-N'-((диметиламино)сульфонил)-4-(3-фторфенил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=110°С.
86. 3-(4-хлорфенил)-4-(2-фторфенил)-N-метил-N'-((морфолин-4-ил)сульфонил)-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=165-168°С.
87. 3-(4-хлорфенил)-N'-((1,1-диоксидотиоморфолин-4-ил)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=268-271°С.
88. 3-(4-хлорфенил)-N'-((4-гидроксипиперидин-1-ил)сульфонил)-N-метил-4-фенил-4,5-дигидро-1Н-пиразол-1-карбоксамидин. Тпл.=80°С.
| Таблица 1 | |||
| Пример: R11 | R12 | Тпл. (°С) | Солевая форма |
| 89: 4-метил-1,4-диазепан-1-ил | Диметиламино | 197-200 | 0,5 фумарат |
| 90: 1,4-диазепан-1-ил | Пиперидин-1-ил | Аморфное вещество | |
| 91: 1,4-диазепан-1-ил | Диметиламино | Аморфное вещество | |
| 92: 4-метил-1,4-диазепан-1-ил | Пиперидин-1-ил | 159-164 | |
| 93: 4-метилпиперазин-1-ил | Диметиламино | 191-193 |
Пример 94
Метиловый эфир 3-(4-хлорфенил)-N-((4-метилпиперазин-1-ил)сульфонил)-4-фенил-4,5-дигидро-1Н-пиразол-1-имидотиокарбоновой кислоты
Часть А: Смесь 3-(4-хлорфенил)-4-фенил-4,5-дигидро-1Н-пиразола (3,21 грамм, 11,3 ммоль), диметилового эфира [(4-метилпиперазин-1-ил)сульфонил]дитиоимидокарбоновой кислоты (3,08 грамм, 12,0 ммоль) и пиридина (25 мл) нагревают при перемешивании при 100°С в течение 24 часов в атмосфере азота. После охлаждения до комнатной температуры смесь концентрируют в вакууме, добавляют воду и полученную в результате смесь экстрагируют дихлорметаном. Экстракт дихлорметана дв