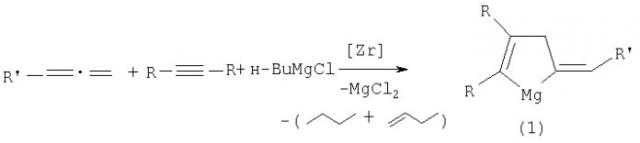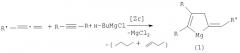Способ получения 2,3-диалкил-5-алкилиденмагнезациклопент-2-енов
Иллюстрации
Показать всеИзобретение относится к области металлорганического синтеза. Описан способ получения 2,3-диалкил-5-алкилиденмагнезациклопент-2-енов общей формулы (I):
характеризующийся тем, что дизамещенный ацетилен общей формулы R-≡-R, где R такое же, как определено выше, подвергают взаимодействию с 1,2-алкадиеном общей формулы R'-=·=, где R' такое же, как определено выше, и бутилмагнийхлоридом (н-BuMgCl) в присутствии катализатора цирконацендихлорида (Ср2ZrCl2) при соотношении R-≡-R:R'-=·=:н-BuMgCl:Cp2ZrCl2, равном 10:(10-14):(22-26):(1.0-1.4), в атмосфере аргона при нормальном давлении в тетрагидрофуране в качестве растворителя в течение 10-14 часов. Технический эффект - полученные магнийорганические соединения могут найти применение в качестве компоненты каталитических систем в процессах олигомеризации и полимеризации олефинов и диеновых углеводородов, в тонком, промышленном органическом и металлорганическом синтезе, а также в синтезе биологически активных препаратов. 1 табл.
Реферат
Предлагаемое изобретение относится к области металлоорганического синтеза, конкретно к способу получения 2,3-диалкил-5-алкилиденмагнезациклопент-2-енов общей формулы (1):
Указанные соединения могут найти применение в качестве компоненты каталитических систем в процессах олигомеризации и полимеризации олефинов и диеновых углеводородов, в тонком, промышленном органическом и металлоорганическом синтезе, а также в синтезе биологически активных препаратов.
Известен способ [R.Baker, R.C.Cookson, A.D.Saunders. Reaction of "Myrcene-Magnesium" with Esters, Acetyl Chloride and Acetic Anhydride: Formation of Cyclopentenols and Cyclopropane Derivatives // J.Chem.Soc.Perk.Fr.I, 1815-1818 (1976)] получения алкенилзамещенного магнезациклопентена взаимодействием мирцена с металлическим магнием, в присутствии катализатора FeCl3 (5 мол.%) и EtBr при температуре 20°С за 12 часов в ТГФ с выходом ˜90-92% по схеме:
Известный способ не позволяет получать 2,3-диалкил-5-алкилиденмагнезациклопент-2-ены (1).
Известен способ [К.Fujita, Y.Ohnuma, Н.Yasuda, H.Tani. Magnesium-butadiene Addition Compounds Isolation, Structural Analysis and Chemical Reactivity // J.Organomet.Chem., 201 (1976), 113] получения магнезациклонона-3,7-диена (3) реакцией бутадиена с металлическим магнием в присутствии каталитических количеств метилиодида при температуре 40°С в тетрагидрофуране за 48 часов с выходом 69% по схеме:
Известным способом не могут быть получены 2,3-диалкил-5-алкилиденмагнезациклопент-2-ены (1).
Таким образом, в литературе отсутствуют сведения по синтезу 2,3-диалкил-5-алкилиденмагнезациклопент-2-енов общей формулы (1).
Предлагается новый способ синтеза 2,3-диалкил-5-алкилиденмагнезациклопент-2-енов (1).
Сущность способа заключается во взаимодействии дизамещенных ацетиленов формулы R-≡-R, где R=С2Н5, н-С3Н7, н-С4Н9 и 1,2-алкадиенов формулы R-=·=, где R'=н-С5Н11, н-C7H15 с бутилмагнийхлоридом (н-BuMgCl) в присутствии катализатора цирконацендихлорида Cp2ZrCl2, взятых в мольном соотношении предпочтительно 10:12:24:1.2. Реакцию проводят в атмосфере аргона при комнатной температуре (˜20°С) и атмосферном давлении. Время реакции 10-14 часов, выход целевых продуктов 48-61%. В качестве растворителя необходимо использовать диэтиловый эфир, в других эфирных растворителях (ТГФ, диоксан) выход целевых продуктов (1) значительно снижается.
Реакция протекает по схеме:
R=С2Н5, н-C3Н7, H-C4H9
Целевые продукты (1) образуются только лишь с участием дизамещенного ацетилена, 1,2-алкадиена, н-BuMgCl и катализатора Cp2ZrCl2. В присутствии других катализаторов (например, Zr(acac)4, Cp2TiCl2, Pd(acac)2, Ni(acac)2, Fe(асас)3) целевые продукты (1) не образуются.
Проведение реакции в присутствии катализатора Cp2ZrCl2 больше 14 мол. % по отношению к ацетилену не приводит к существенному увеличению выхода целевых продуктов (1). Использование в реакции катализатора Cp2ZrCl2 менее 10 мол. % снижает выход МОС (1), что связано со снижением каталитически активных центров в реакционной массе. Опыты проводили при комнатной температуре ˜20°С. При более высокой температуре (например, 50°С) увеличивается содержание продуктов уплотнения, при меньшей температуре (например, 0°С) снижается скорость реакции.
Изменение соотношения исходных реагентов в сторону увеличения содержания н-BuMgCl по отношению к ацетилену не приводит к значительному повышению выхода целевых продуктов (1). Снижение количества н-BuMgCl по отношению к ацетилену уменьшает выход МОС (1).
Существенные отличия предлагаемого способа:
В предлагаемом способе используются в качестве исходных соединений дизамещенный ацетилен, 1,2-алкадиен и н-BuMgCl с участием катализатора Cp2ZrCl2. В известном способе непредельное циклическое магнийорганическое соединение (3) получают из бутадиена и активированного с помощью метилиодида (MeI) магния.
Предлагаемый способ обладает следующими преимуществами:
Способ позволяет получать с высокой селективностью 2,3-диалкил-5-алкилиденмагнезациклопент-2-ены (1), синтез которых в литературе не описан.
Способ поясняется следующими примерами:
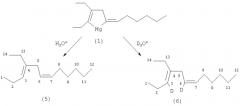
ПРИМЕР 1. В стеклянный реактор объемом 50 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 1.2 ммоль Cp2ZrCl2, 10 ммоль гекс-3-ина и 12 ммоль 1,2-октадиена, затем при температуре ˜0°С добавляют 24 ммоль бутилмагнийхлорид (н-BuMgCl) (2M раствор в Et2O). Перемешивают при комнатной температуре 12 часов. Получают индивидуальный 2,3-диэтил-5-гексилиденмагнезациклопент-2-ен (1). Выход целевого продукта определяли по продукту гидролиза. При гидролизе МОС (1) образуется 4-этил-3,6-додекадиен (5) с выходом ˜56%, а при дейтеролизе соответственно 4-этил-3,6-дидейтеро-3,6-додекадиен (6)
Спектральные характеристики продуктов гидролиза (5) и дейтеролиза (6).
Спектр ЯМР 1Н (CDCl3, δ, м.д.) 4-этил-3,6-додекадиен (5):0.87-0.93 м (9Н, СН3), 1.1-1.58 м (6Н, СН2), 1.95-2.69 м (8Н, -С-CH2), 5.45-5.82 м (3Н, -C=CH-). Спектр ЯМР 13С (δ, м.д.) 4-этил-3,6-додекадиен (5):13.38 (С4), 14.02 (С12), 14.65 (С1), 20.19 (С2), 22.85 (С11), 23.78 (С13), 27.21 (С8), 29.69 (С9), 30.29 (С10), 36.34 (С5), 125.68 (С3), 128.15 (С6), 130.89 (С7), 131.77(С4).
Спектр ЯМР 1Н (CDCl3, δ, м.д.) 4-этил-3,6-дидейтеро-3,6-додекадиен (6):0.88-0.91 м (9Н, СН3), 1.12-1.68 м (6Н, CH2), 1.89-2.47 м (8Н, =C-CH2), 5.38-5.79 м (1Н, -С=CH-).
Спектр ЯМР 13С (δ, м.д.) 4-этил-3,6-дидейтеро-3,6-додекадиен (6):13.35 (С4), 14.05 (С12), 14.72 (С1), 20.26 (С2), 22.78 (С11), 23.56 (С13), 27.32 (С8), 29.74 (С9), 30.41 (С10), 36.54 (С5), * (С3), * (С6), 130.73 (С7), 132.87(С4).
(* сигнал не наблюдается)
Другие примеры, подтверждающие способ, приведены в таблице 1.
| Таблица 1 | |||||
| №№ п/п | Ацетилен R-≡-R | Аллен | Мольное соотношение ммоль | Время реакции, час | Выход (1),% |
| 1 | гекс-3-ин | 1,2-октадиен | 10:12:24:1.2 | 12 | 56 |
| 2 | " | " | 10:12:26:1.2 | 12 | 53 |
| 3 | " | " | 10:12:22:1.2 | 12 | 51 |
| 4 | " | " | 10:12:24:1.4 | 12 | 61 |
| 5 | " | " | 10:12:24:1.0 | 12 | 50 |
| 6 | " | " | 10:12:24:1.2 | 14 | 58 |
| 7 | " | " | 10:12:24:1.2 | 10 | 49 |
| 8 | " | " | 10:10:24:1.2 | 12 | 55 |
| 9 | " | " | 10:14:24:1.2 | 12 | 57 |
| 10 | окт-4-ин | 1,2-октадиен | 10:12:24:1.2 | 12 | 50 |
| 11 | дец-5-ин | 1,2-октадиен | 10:12:24:1.2 | 12 | 48 |
| 12 | гекс-3-ин | 1,2-декадиен | 10:12:24:1.2 | 12 | 52 |
Все опыты проводили при комнатной температуре (˜20°С) в диэтиловом эфире. Во всех опытах в минорных количествах (<10%) наблюдалось образование соответствующих 2,3,4,5-тетраалкилмагнезациклопента-2,4-диенов.
Способ получения 2,3-диалкил-5-алкилиденмагнезациклопент-2-енов общей формулы (1):
характеризующийся тем, что дизамещенный ацетилен общей формулы R-≡-R, где R такое же, как определено выше, подвергают взаимодействию с 1,2-алкадиеном общей формулы R'-=·=, где R' такое же, как определено выше, и бутилмагнийхлоридом (н-BuMgCl) в присутствии катализатора цирконацендихлорида (Cp2ZrCl2) при соотношении R-≡-R:R'-=·=:н-BuMgCl:Cp2ZrCl2, равном 10:(10-14):(22-26):(1.0-1.4), в атмосфере аргона при нормальном давлении в тетрагидрофуране в качестве растворителя в течение 10-14 ч.