Трансформированные молочно-кислые бактерии, снижающие склонность к проявлению аллергических реакций, и их применение
Иллюстрации
Показать всеИзобретение относится к биотехнологии и пищевой промышленности и представляет собой трансформированные молочно-кислые бактерии, которые экспрессируют полипептид, включающий толерогенный пептид и фрагмент протеазы L.bulgaricus. Изобретение также относится к пищевым композициям, содержащим указанные микроорганизмы или их супернатант. Заявленное изобретение позволяет снижать склонность индивидуума к проявлению аллергических реакций. 4 н. и 5 з.п. ф-лы, 2 ил., 3 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии, в частности к новым штаммам молочно-кислых бактерий, способных уменьшать индивидуальную склонность к проявлению аллергических реакций. Более конкретно, настоящее изобретение относится к новым штаммам молочно-кислых бактерий, которые экспрессируют полипептиды, в том числе толерогенные пептиды, и к их применению для уменьшения индивидуальной склонности к проявлению аллергических реакций. Кроме этого, настоящее изобретение относится к пищевым и фармацевтическим композициям, содержащим указанные микроорганизмы или их активные фракции.
Уровень техники
Аллергии представляют собой неадекватные реакции иммунной системы на различные вещества (аллергены). Как правило, в организме человека не возникает существенный иммунный ответ на вещества, обычно присутствующие в окружающей среде, например на пыльцу и пищевые вещества, причем такая толерантность, по-видимому, главным образом связана с механизмом подавления (супрессии) самой иммунной системы. Однако в ослабленном состоянии иммунная система неспособна проявлять указанную подавляющую активность (обозначаемую, как толерантность), что приводит к специфическим иммунным реакциям на аллергены - аллергическим реакциям. Аллергические реакции включают выделение биологически активных соединений, медиаторов воспаления, таких как гистамин, лейкотриены и ферменты, из особых клеток, главным образом мастоцитов (тучных клеток) и базофильных гранулоцитов, в окружающие ткани и сосудистые системы. Мастоциты диспергируются в тканях организма, тогда как базофилы циркулируют в сосудистой системе. В последовательности событий, включающих участие IgE антител, соединения/медиаторы выделяются из целевых мастоцитов, прерывая фармакологические реакции.
В последнее время наблюдается увеличение числа людей, страдающих аллергией, что часто связывается с повышением загрязненности атмосферы за счет выброса выхлопных газов. Развитию аллергии также способствует увеличенное потребление белковых продуктов, в особенности это относится к росту случаев пищевой аллергии. Предполагается также, что дефицит микробных инфекций в развитых странах может служить другой возможной причиной аллергических заболеваний.
Пищевые аллергии и даже непереносимость некоторых видов пищи становятся общим явлением. Было установлено, что большая часть заболевших людей не переносит некоторые компоненты пищи и примерно у 5 процентов населения развиваются достаточно серьезные реакции на съеденные вещества, требующие медицинской помощи.
В последние годы были получены доказательства того, что основная причина пищевой непереносимости заключается в поглощении организмом веществ, которые обычно исключаются, но которые поглощаются желудочно-кишечным трактом им людей, склонных к аллергии. Такое болезненное поглощение, по-видимому, связано с дефектами в тканях, выстилающих пищеварительный тракт (Peters с сотр., (1988) Can. J. Of Gastroenterol. 2, 127; Olaison с сотр., (1990) Scand. J. Of Gastroenterol. 25, 321; Hollander с сотр., (1986) Ann. Of Int. Med. 105, 883). Недавно установленная способность эпителиальных клеток, выстилающих желудочно-кишечный тракт, процессировать и презентировать антигены, также может запускать неадекватные иммунные реакции, приводящие к воспалению и аллергическим проявлениям (Campbell с сотр., (1999) Immunol. Rev. 172, 315).
Проявления пищевой аллергии могут затрагивать практически любую ткань организма. Большая площадь поглощения желудочно-кишечного тракта, по-видимому, делает его основным местом всасывания раздражающих веществ. Многие симптомы пищевой аллергии проявляются в самом пищеварительном тракте, но поражение может распространяться и на другие ткани, включая кожу и дыхательные пути.
Предложены различные подходы к лечению аллергии, особенно пищевой аллергии.
Один из таких подходов состоит в модификации самого источника аллергического материала, вследствие чего снижается его аллергенный потенциал. Это может достигаться ограничением или отказом потребления пищи или ее компонентов, являющихся причиной возникновения аллергии. Сложность такого подхода, как правило, заключается в том, что конкретное специфическое антигенное вещество (аллерген) в соответствующем пищевом продукте часто неизвестно, вследствие чего в большинстве случаев неясно, какой из компонентов следует селективно удалять.
В US-5480660 сообщается, что протекание аллергии у пациентов с аллергической реакцией на пшеницу может быть ослаблено путем исключения или уменьшения содержания в муке белков с молекулярным весом менее 30000 Да и белков с молекулярным весом 50000-70000 Да.
В JP 046721 раскрывается способ снижения аллергенности содержащего белок пищевого продукта, согласно которому пищевой продукт смешивают с пшеничной мукой и полученную смесь подвергают тепловой обработке при 180°С в течение более 3 минут.
В US 4293571 описывается получение гипоаллергенной композиции, согласно которому белковый материал подвергают гидролизу, оставшиеся, негидролизованные белки подвергают тепловой коагуляции с последующей ультрафильтрацией с целью удаления коагулированного материала и макропептидов, которые возможно являются аллергенами.
В US 5039532 раскрывается другой способ получения гипоаллергенного пищевого продукта, в котором сывороточный продукт подвергают ферментативному гидролизу.
Все описанные способы обработки пищевых продуктов или даже исключение их из пищевого рациона оказываются трудными для практического применения, поскольку требуют пересмотра рациона питания, как правило, включают жесткие ограничительные меры и, в конечном счете, влияют на качество жизни и/или подавляют ожидаемый рост индивидуума.
Другой подход к лечению пищевой аллергии и непереносимости пищи направлен на восстановление и сохранение кишечной целостности, препятствующей попаданию в организм пищевых аллергенов. Так в US 5192750 описывается применение N-ацетил глюкозамина, способствующего формированию слизистой кишечника необходимого барьера, препятствующего поступлению пищевых аллергенов, и обеспечивающего нормальное функционирование.
Согласно еще одному подходу к лечению аллергии предлагается вакцинация против молекул IgE, которая ингибирует запуск мастоцитов и базофилов. В WO 9731948 предложены специальные пептиды для такой вакцинации, напоминающие по своей трехмерной структуре участки молекулы IgE, иммуноглобулинов, участвующих в выделении медиаторов регуляции аллергических и воспалительных реакций. Предполагается, что собственная иммунная система человека, в конечном счете, образует антитела к указанным молекулам IgEm, которые служат ловушками IgE иммуноглобулинов. Однако рассматриваемый способ имеет недостаток, состоящий в том, что образовавшиеся антитела могут обладать кросс-реактивностью по отношению к иммуноглобулинам других классов, что может оказывать нежелательное действие на защитные механизмы организма.
В пока еще не опубликованной заявке на патент ЕР 99200130.5, поданной автором настоящей заявки, раскрывается еще один подход. Предлагается гипоаллергенная композиция, содержащая неаллергенный, интенсивно гидролизованный белковый материал и/или свободную аминокислотную основу, а также, по крайней мере, один толерогенный пептид соответствующего аллергенного белка. Хотя такая композиция обладает рядом преимуществ над известными составами, пока еще трудно получать толерогенный пептид, который продуцировался бы для каждой партии de novo.
В связи со сказанным выше имеется потребность в разработке улучшенных средств для лечения аллергии.
Сущность изобретения
Цель настоящего изобретения заключается в создании таких средств.
Указанная цель была достигнута в результате разработки новых штаммов молочно-кислых бактерий, способных уменьшать склонность индивидуума к проявлению аллергических реакций. Новые молочно-кислые бактерии экспрессируют полипептид, содержащий толерогенный пептид, сохраняя при этом его специфическую последовательность и, возможно, пространственную структуру, а также его стабильность, что создает возможность распознавания такого пептида иммунной системой организма.
Перечень чертежей
На фиг.1 показана первичная структура пептидов, содержащихся в соответствующих фракциях гидролизата β-лактоглобулина; вертикальными линиями показаны дисульфидные связи.
На фиг.2 приведены результаты, полученные при использовании толерогенных пептидов/пептидных фракций в различных экспериментах.
Подробное описание изобретения
Было показано, что молочно-кислые бактерии, особенно Lactobacilli и Bifidobacteria модулируют иммунную систему, не покидая свое местоположение в ней в результате продуцирования посредников (цитокинов), участвующих в регуляции иммунной системы. Молочно-кислые бактерии не запускают продукцию таких провоспалительных цитокинов, как IL-8, TNF-a, МСР-1 и GM-CSF, а вместо этого промотируют продукцию цитокинов, подавляющих воспаление, например TGF-β (Blum с сотр., (1999) Antonie van Leeuwenhoek 76, 199), вовлекая их в важные процессы, касающиеся поддержания кишечного иммунного гомеостаза и целостности эпителиального барьера (Planchon с сотр., (1999) J. Cell Physiol. 181,55). Было показано, что пероральное применение гомогенатов lactobacilli оказывает подавляющее действие на митоген-индуцированную пролиферацию моноядерных клеток (Pessi с сотр., (1999) Appl. Environ. Microbiol. 65, 4725).
Молочно-кислые бактерии (LAB) могут использоваться для гетерологической суперпродукции белков и пептидов в системах, позволяющих экспрессировать чужеродный ген на основе хромосомной интеграции или эписомных плазмид (см. Kuipers с сотр., (1997) Tibtech 15, 140). Более того, молочно-кислые бактерии обладают способностью колонизировать поверхность слизистой и обладают природными адъювантными свойствами за счет мурамилпептидов, образующихся при деградации пептидогликана.
Также было показано, что некоторые штаммы Lactobacillus промотируют антиген-специфичные иммунные реакции, особенно в IgA классе (Majamaa с сотр., (1995) J. Pediatr / Gastroenterol. Nutr. 20, 333). Неспособность человеческого IgA в комплексе с антигенами активировать комплемент, имеет важное значение в поддержании целостности поверхностей слизистой. В результате предотвращаются локальные воспалительные реакции, включающие приток лейкоцитов и выделение иммунологических эффекторов, усиливающих проницаемость мембран слизистых за счет повреждения тканей. Кроме этого, в результате реализации механизма иммунной эксклюзии IgA способен ограничивать дополнительную абсорбцию антигенов-свидетелей и тем самым прекращать анафилактические реакции, под действием антител IgE и IgA изотипов.
Кроме этого, было показано, что лактобактерии потенцируют продукцию IFN-гамма под воздействием Т-клеток (Halpern с сотр., (1991) Int. J. Immunother. 7, 205). Недавно было продемонстрировано, что IFN-гамма ингибирует выделение TNF-альфа мастоцитами слизистой кишечника (Bissonnette с сотр., (1995) Int. Arch. Allergy Immunol. 107, 156). Повышенная секреция IFN-гамма может предотвращать повреждающее воздействие TNF-альфа (Hernandes-Pando с сотр., (1994) Immunology 82,591) и, следовательно, противодействовать нарушениям проницаемости, связанным с пищевой аллергией. Так, например, повреждение кишечного барьера в отношении поглощения антигена при атопическом дерматите может играть ключевую роль в развитии аномальных иммунных реакций на обычные пищевые и окружающие аллергены.
В ходе широких исследований, реализовавшихся в настоящее изобретение, авторы разработали способы комбинации преимуществ молочно-кислых бактерий с потенциалом толерогенных пептидов, в результате чего был создан мощный агент, способный снижать или даже существенно минимизировать склонность к проявлению аллергических реакций.
Молочно-кислые бактерии, используемые в настоящем изобретении, предпочтительно принадлежат к группе Lactobacillus, или группе Bifidobacterium, или группе Lactococcus, и более предпочтительно, когда их выбирают из группы L.acidophilis, L.johnsonii, L.gasseri, L.casei, L.paracasei или L.reuteri, как человеческого, так и животного происхождения соответственно.
Толерогенный пептид, происходящий из какого-либо белка, вызывающего аллергию, обычно имеет мол. вес 200-600 Да и представляет собой пептид, способный индуцировать толерантность, по крайней мере, к белку, из которого он был получен. Такой пептид может индуцировать толерантность к любому материалу, имеющему такую же антигенную детерминанту (эпитоп), что и специфический толерогенный пептид. Согласно настоящему изобретению толерогенный пептид с помощью рекомбинантных методов встраивают в полипептид, синтезируемый в молочно-кислых бактериях, причем такой полипептид может быть как эндогенным, так и экзогенным по отношению к бактерии. Встраивание толерогенного пептида осуществляют таким образом, чтобы он оказался на периферии полученного в результате рекомбинантного полипептида и мог распознаваться иммунной системой.
Указанный полипептид можно экспрессировать в молочно-кислых бактериях, используя хорошо известные способы. Так, для плазмидной экспрессии можно использовать коммерчески доступные векторы pNZ124 (Platteuw с сотр., (1994) Appl. Env. Microbiol. 60, 587), pGK12 (Walke с сотр., (1996) FEMS Microbiol. 138,233), или pG+host9 (Maguin с сотр., (1996) J.Bacteriol. 178, 931). С учетом превосходной стабильности хромосомной интеграции такой подход представляется предпочтительным для рекомбинантного гена, кодирующего соответствующий полипептид. Интеграцию в хромосому можно осуществлять с помощью гомологичной рекомбинации, например путем замены эндогенного гена рекомбинантным геном молочно-кислых бактерий, содержащим толерогенный пептид. Способы введения рекомбинантных генов в хромосому хозяина хорошо известны специалисту в данной области.
Экспрессируемый полипептид может быть локализован внутри клетки, или секретироваться молочно-кислыми бактериями, либо встраиваться в клеточную стенку, причем часть, содержащая толерогенный пептид, должна локализоваться вне клетки. Примерами полипептидов, используемых в настоящем изобретении, могут служить pepN, pepX, молочная дегидрогеназа или β-галактозидаза, или представитель класса бактериозинов, или белок S-слоя или протеаза, встроенная в клеточную стенку.
Природа полипептида не имеет решающего значения при условии, что толерогенный пептид встраивается таким образом, чтобы он оставался доступным для иммунной системы. Однако после идентификации подходящего толерогенного пептида ему следует обеспечить необходимую локализацию. К этому моменту специалист должен построить трехмерные модели полипептидов, в которые следует встраивать толерогенный пептид и на основании полученных данных сконструировать соответствующий рекомбинантный белок.
Согласно предпочтительному варианту получают секретируемые рекомбинантные полипептиды или локализованные в клеточной стенке бактерий таким образом, чтобы толерогенный пептид постоянно находился в контакте с окружающей средой.
Толерогенный пептид получают из пищевого материала, вызывающего аллергическую реакцию. Аминокислотная последовательность необязательно должна полностью соответствовать последовательности природного белка, однако любая пептидная последовательность, имеющая сходную аминокислотную последовательность и возможно трехмерную структуру, что и исходный пептид или полученный на его основе полипептид, обеспечивающий те же результаты, т.е. индуцирующий уменьшение аллергической реакции, подходят для рассматриваемого применения.
В качестве предпочтительных источников толерогенных пептидов можно упомянуть молоко, сою, арахис, ракообразных, рыбу, мясо, кунжут или сыворотку, например β-лактоглобулин, бычий сывороточный альбумин или казеин.
Для идентификации толерогенных пептидов аллергенный материал вначале подвергают ферментативному гидролизу до степени гидролиза 10-50%, а остаточную ферментативную активность в гидролизате инактивируют, например, путем тепловой обработки. Белковый гидролизат осветляют и при необходимости дополнительно очищают. Полученные пептиды разделяют, например, осаждением или хроматографией.
Затем фракции, содержащие различные пептиды, тестируют на наличие толерогенных свойств на животных моделях. Для этого таких животных, как мыши, кормят соответствующими пептидными фракциями, иммунизируют аллергеном и определяют степень аллергической реакцию, например, путем оценки изменения внешнего вида или путем определения содержания IgE в организме животного. Фракции толерогенных пептидов будут снижать реакцию животных на аллергены, и по результатам такого можно будет установить толерогенные пептидные фракции.
После установления толерогенного пептида и определения его аминокислотной последовательности, ДНК-последовательность, кодирующая пептид, который должен быть экспрессирован в молочно-кислых бактериях, с помощью методов генной инженерии встраивают в ген, кодирующий соответствующий бактериальный белок-носитель. Методы и манипуляции с ДНК-последовательностями и экспрессия белков в микроорганизмах описаны в книге Sambrook с сотр., А Laboratory manual cold spring harbor (1992).
Настоящее изобретение также относится к пищевым и фармацевтическим композициям, содержащим, по меньшей мере, одну из таких рекомбинантных молочно-кислых бактерий.
Бактериальный штамм можно вводить в пищевую композицию в количестве 105-1012 КОЕ (колониеобразующая единица) в расчете на грамм материала. В композицию можно также вводить супернатант культуры молочно-кислых бактерий или его активную фракцию.
Пищевая композиция может представлять собой молоко, йогурт, творог, сыр, кисло-молочные продукты, молочные ферментированные продукты, мороженое, продукты на основе ферментированных хлебных злаков, молочные порошки, детское питание или в случае животных корм для домашних животных.
Фармацевтическая композиция может иметь форму таблеток, или готовиться в виде жидких бактериальных суспензий или препаратов, включающих фрагменты бактерий, например только фракцию клеточных стенок, полученную лизисом бактериальных клеток с последующим сбором компонентов клеточных стенок, сухих добавок для перорального приема, влажных добавок, питательных устройств с сухой или влажной тубами.
Фармацевтический препарат можно применять перорально или назально.
Настоящее изобретение также предусматривает вакцины, содержащие бактерии по изобретению или их фрагменты. Могут использоваться живые или ослабленные бактерии, т.е. микроорганизмы с уменьшенной способностью к росту. В качестве фрагментов бактерий, главным образом, используют клеточные стенки, содержащие интересующий антиген. Клеточные стенки могут быть легко получены лизисом клеток и разделением соответствующих компонентов.
Сведения, подтверждающие возможность осуществления изобретения
Следующие ниже примеры дополнительно иллюстрируют изобретение, не ограничивая его область.
Пример 1
Выделение толерогенных пептидов
а) Выделение пептидов
220 г β-лактоглобулина (Sigma) растворяли в бидистиллированной воде до концентрации 5% (мас./мас.). К полученному в результате раствору добавляли обработанный ТРСК трипсин с соотношением фермент/субстрат (E/S) 1/100 (мас./мас.) и раствор инкубировали при 40°С и рН 7,6 при постоянном перемешивании. Через 1 час добавляли такое же количество фермента с соотношением (E/S) 2/100. Инкубацию продолжали в течение 4 часов и фермент инактивировали тепловой обработкой (85°С, 5 минут) для прекращения реакции. Затем триптиновый гидролизат лиофилизировали и полученные пептидные продукты разделяли методом препаративной хроматографии на катионообменной смоле.
Было получено 15 пептидных фракций, содержащих пептиды длиной 2-23 аминокислот (мол. вес от 240 до 2720 Да). Индивидуальные фракции подвергали нанофильтрации, диафильтрации, диализу, снова лиофилизировали и хранили при комнатной температуре до применения. Содержание пептидов в полученных фракциях определяли с помощью высокоэффективной жидкостной хроматографии (HPLC) с обращенными фазами. Было получено 15 фракций (F1-F15), содержащих пептиды (Т) в качестве основного компонента.
| Фракции | F1 | F2 | F3 | F4 | F5 | F6 | F7 | F8 | F9 | F10 | F11 | F12 | F13 | F14 | F15 |
| Масса (г) | 52 | 13,9 | 11 | 11,8 | 2,57 | 1,94 | 4,37 | 13,1 | 5,01 | 6,53 | 1,05 | 3,46 | 1,9 | 2, 67 | 28,8 |
| Обогащение пептидами | - | Т6Т17Т18 | Т23 | Т23 | - | Т7Т9 | Т20Т21Т24 | Т9Т12Т24 | Т12Т21 | Т10Т21 | Т11 | Т10 | Т10Т11 | Т10Т11 | - |
Пептиды выделяли и определяли их аминокислотные последовательности. Эти последовательности приведены на фигуре 1. Различные пептиды оказались толерогенными при проведении экспериментов, подробно описанных Pesquet R, Bovetto L, Maynard F, Fritsche R., Peptides obtained by tryptic hydrolysis of bovine B-lactoglobulin induce specific oral tolerance in mice, J. Allergy Clin Immunol (2000) 105:514-21, включенную в настоящее описание в качестве ссылки.
b) Синтез толерогенных пептидов
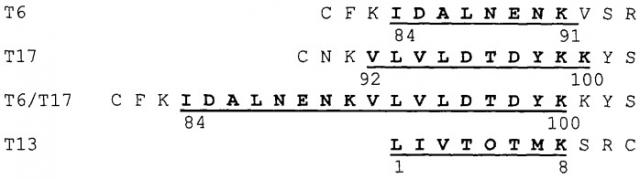
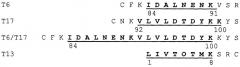
Три толерогенных пептида β-лактоглобулина (BLG) T6, Т17 и Т16/Т17, и Т6Т17 (в соответствии с классификацией указанной выше ссылки), а также контрольный пептид Т13 были химически синтезированы с использованием дополнительной фланкирующей последовательностью BLG, а также дополнительным остатком цистеина:
с) Тестирование на животных
Для оценки толерогенных свойств различных пептидов использовали самок мышей линии Balb/c, полученных от IFFA-Credo (L'Abresle France). Все животные находились на безмолочной диете. К началу эксперимента возраст животных составлял 3 недели. Животные без ограничений получали природный β-лактоглобулин (5 мг/г веса тела в день), различные количества переваренного β-лактоглобулина и разные количества различных пептидов, полученных согласно пункту а). Контрольные животные получали в пищу физиологический раствор. Через 5 дней пребывания на такой диете всех мышей иммунизировали β-лактоглобулином и овальбумином (фракция V, Sigma) в качестве неродственного антигена для оценки специфичности иммунной реакции. Оценку гиперчувствительности замедленного типа (DTH) осуществляли через 21 день после начала эксперимента путем сравнения толщины левой задней подушечки лап до и после иммунизации. Через 24 часа после иммунизации измеряли толщину подушечки лап животного (и выражали в виде Δ толщины в мм). Далее у всех мышей отбирали пробы крови и извлекали селезенки, которые объединяли в группы в соответствии с типом лечения. В каждой группе проводили анализ на спленоцит-специфичную пролиферацию. Содержимое кишечника собирали индивидуально. Сыворотку и кишечные образцы замораживали при -80°С до проведения соответствующих анализов. В образцах сыворотки и кишечника определяли содержание анти-β-лактоглобулинового IgE и анти-овальбуминового IgE.
d) Определение IgE иммуноглобулинов
Сывороточную и кишечную жидкости разводили и с помощью ELISA определяли содержание анти-β-лактоглобулинового IgE и анти-овальбуминового IgE. В качестве отрицательного контроля использовали объединенные образцы от 20 неиммунизированных мышей. Титры определяли путем определения разведения образца, поглощение которого в два раза превышало поглощение отрицательного контроля. Титры выражали как log10 величины обратного разведения.
e) Клеточные культуры
Суспензию клеток селезенки гомогенизировали в PBS и очищали. Клетки ко-культивировали в присутствии β-лактоглобулина или фитогемагглютинина А. Тритированный тимидин ([3H]-Thy (Amersham, Zurich) добавляли в течение последних шести часов культивирования, клетки собирали и определяли их количество с помощью сцинтилляционного счетчика. Индексы стимулирования рассчитывали в виде отношения значений в опытном и контрольном тесте, выражая его в виде среднего в cpm включения [3H]-Thy в ходе трех культивации.
f) определение толерантности, индуцированной при пероральном введении синтетических пептидов
Синтетические пептиды анализировали на их толерогенную активность в модельных парентеральных опытах на мышах. Были получены следующие результаты:
| IgE титр (Log) (опыт/ контроль) | SI-индекс лимфоцитов селезенки (опыт/контроль) | SI-индекс лимфоцитов лимфоузлов MLN (опыт/контроль) | |
| Т-6 | 3,24/3,39 | 0,53 | 0,29 |
| Т-17 | 2,67/3,39 | 0,31 | 0,41 |
| Т6/Т17 | 3,40/3,39 | 0,92 | 0,81 |
| Т-13 | 3,20/3,39 | 1,70 | 0,87 |
MLN: мезентериальный лимфатический узел SI: индекс стимуляции;
Как можно видеть из приведенных данных, синтетический пептид Т-17 уменьшает, как синтез IgE, так и пролиферацию Т-клеток, тогда как Т-6 подавляет лишь реакцию Т-клеток. В отличие от этого контрольный пептид Т-13 не индуцирует толерантность к BGL при пероральном введении.
Пример 2
Конструирование рекомбинантного полипептида
Получали слитый белок, состоящий из пептидов Т6 и Т17 (идентифицированы в примере 1, как пептиды, обладающие толерогенными свойствами) и протеазы, локализованной на поверхности клетки, с целью локализации толерогенных пептидов на поверхности бактериальных клеток. В качестве отрицательного контроля использовали пептид Т13, представляющий собой N-концевой фрагмент β-лактоглобулина.
Аминокислотная последовательность указанной выше протеазы Lactobacillus bulgaricu ранее была опубликована Gilbert с сотр., (1996) J.Bacteriol, 178, 3059-3065. Рассматриваемый белок, состоящий из 2000 аминокислот, включает лидерный пептид из 33 аминокислот (препептид), отвечающий за секрецию фермента из клетки, фрагмент из 154 аминокислот (про-пептид), отщепление которого приводит к активации протеолитической активности фермента, и фрагмент из 700-800 аминокислот, представляющий собой собственно зрелый активный фермент, включающий активный центр. Предполагается, что фрагмент длиной около 1000 аминокислот определяет специфичность расщепления и транспорт в клетке и локализацию синтезированных пептидов клеточной стенке. Указанная протеаза встраивается в клеточную стенку своим карбоксильным концом, причем последние 200 аминокислот ответственны за специфическое ковалентное связывание с пептидогликановой структурой клеточной стенки.
Сначала протеазный ген амплифицировали со своим промотором с использованием следующих двух праймеров:
5'-TTTTGTGGATCCTTAACTTCATAGCACG-3'
(содержащий сайт BamHI перед промотором гена)
5'-ATATTATCTAGAATTGAATAGATTGCC-3'
(содержащий сайт XbaI после ρ-независимого терминатора гена)
Продукт амплификации расщепляли BamHI и Xbal и клонировали в векторе pNZ124 молочно-кислых бактерий, который расщепляли с теми же рестриктазами и вводили методом электропорации в безплазмидную (отрицательную по бета-галактозидазе и протеазе) Lactococcus lactis.
Фрагмент активного центра клонированной протеазы заменяли на последовательность целевого пептида/полипептида. Для этого клонированный ген протеазы расщепляли Nhel по сайту, расположенному на 50 пар оснований перед последовательностью отщепления лидерного пептида и PvuI по сайту, расположенному на 800 bp после гена. ДНК-последовательность, кодирующую толерантные пептиды (длиной до 10 аминокислот), встраивали между этими двумя рестрикционными сайтами в виде двух олигонуклеотидов, которые специально были сконструированы таким образом, чтобы после гибридизации на их концах образовывали эти рестрикционные сайты. При конструировании олигонуклеотидов также обеспечивали сохранение открытой рамки считывания в фрагменте гена протеазы после лигирования.
Встраивание более крупных полипептидов осуществляли с помощью ДНК-амплификации с использованием праймеров, содержащих указанные сайты рестрикции. Продукт амплификации расщепляли этими рестрикционными эндонуклеазами, лигировали фрагменты ДНК протеазным геном и с помощью электропорации вводили в клетки Lactococcus lactis и Lactobacillus johnsonii.
22-го сентября 2000 г. рекомбинантные плазмиды, содержащие пептиды Т6 и Т17, были депонированы в соответствии с Будапештским договором в Институте Пастера и им присваивали депозитные №№ CNCM I-2563 и CNCM I-2564 соответственно.
Пример 3
Трансформация Lactococcus lactis и Lactobacillus johnsonii
Для трансформации штамм Lactococcus lactis (MG1363, без плазмиды) и штамм La1 Lactobacillus johnsonii (полученной из Института Пастера под каталожным номером CNCM I-1225) выращивали в течение ночи в MRS среде при 37°С в анаэробной системе GasPak. Аликвоту культуры использовали для инокуляции другой порции культурной среды, содержащей 0,5 М сахарозы. После дополнительной реиннокуляции в количестве 2% в 200 мл MRS+0,5 М сахарозы культуру выращивали до значения оптической плотности OD595 0,6. Клетки собирали центрифугированием со скоростью 5000 об/мин в течение 10 минут при 4°С, дебрис однократно промывали половинным объемом раствора, содержащего 1 М сахарозы и 2,5 мМ CaCl2, однократно - 1/4 объема раствора, содержащего 1 М сахарозы, 2,5 мМ CaCl2, и материал, полученный после центрифугирования, ресуспендировали в 3,5 мл раствора, содержащего 1 М сахарозы, 2,4 мМ CaCl2+0,459 мл 87% глицерина (конечная концентрация 10%). Полученные клетки можно непосредственно использовать для трансформации или хранить в замороженном состоянии при -80°С.
Для электропорации 40 мкл клеток смешивали с 10-100 нг ДНК (в объеме <5 мкл) и переносили в 0,2 см электропорационную кювету, находящуюся во льду. На охлаждаемую льдом 0,2 см электропорационную кювету подавали импульсы в 200 Ω, 25 μF, 2,5 kV. В кювету добавляли 1 мл MRS+20 мМ MgCl2, 2 мМ CaCl2 и полученную суспензию инкубировали в течение 2-3 часов при соответствующей температуре (при 30°С для Lactococcus lactis и при 37°С для Lactobacillus johnsonii, для ts плазмид (pG+host9) инкубацию проводили при 30°С). Аликвоты объемом 10 мкл и 100 мкл соответственно высевали на чашки с MRS-агаром, содержащим соответствующий антибиотик, при трансформации плазмидной ДНК. При трансформации продуктами лигирования объем аликвот составлял 100 мкл и 500 мкл. Чашки анаэробно инкубировали в течение 24-28 часов при указанной выше температуре.
В качестве селекционной среды использовали MRS с эритромицином (2,5 мкг/мл) или MRS с канамицином (5 мкг/мл).
Пример 4
Получение крысиной сыворотки и моноклональных антител против толерогенных BLG пептидов.
BLG пептиды Т6, Т17, Т6/Т17 и Т13 (охарактеризованные в примере 1) иммобилизовали на малеимид-активированном KLH и вместе с адъювантом Titermax иммунизировали крыс, находящихся на молочной безбелковой диете. Анализ образцов крови, отбираемых с интервалом в 2 недели вплоть до 115 дня после первой иммунизации с помощью ELISA, показал, что в крови содержатся антитела, специфичные к BLG пептидам.
Анти-Т6 и анти Т-13 сыворотки также реагировали с нативной (ELISA) или денатурированной (SDS-PAGE+Western blot) формами BLG. Было показано, что анти-Т6 и анти-Т17 сыворотки специфически распознают BLG пептиды, экспрессированные на поверхности рекомбинантных L.Lactis. Полученные результаты представлены в табл.1.
| Таблица 1Реактивность сыворотки против β-лактоглобулиновых пептидов | ||||||||||||
| Антисыворотка, специфичная к | Т6 | Т17 | T16/17 | Т13 | ||||||||
| Порядковый номер крыс | А1 | А2 | A3 | B4 | B5 | B6 | C7 | C8 | C9 | D10 | D11 | D12 |
| Т6 (ELISA) | +++ | +/- | + | - | NT | NT | - | NT | NT | - | NT | NT |
| Т17 (ELISA) | - | NT | NT | + | - | - | +++ | NT | NT | - | NT | NT |
| Т6/Т17 (ELISA) | +++ | NT | NT | + | NT | NT | +++ | + | - | - | NT | NT |
| Т13 (ELISA) | - | NT | NT | - | NT | NT | - | NT | NT | + | + | +/- |
| Нативный BLG (ELISA) | +++ | +/- | +++ | +/- | - | - | - | - | - | + | + | +/- |
| Денатурированный BLG (SDS-PAGE+WB) | +++ | NT | ++ | - | NT | NT | - | NT | NT | +/- | +++ | ++ |
| L1/T6 (ELISA) | +/- | - | +++ | - | NT | NT | - | - | - | - | NT | NT |
| L1/T17 (ELISA) | - | NT | NT | + | - | - | - | - | - | - | NT | NT |
| L1/T13 (ELISA) | - | NT | NT | - | NT | NT | - | NT | NT | - | - | - |
| ELISA/OD490 nm (15'/37°С) | ||||||||||||
| +++ >0,3 | ||||||||||||
| ++ 0,2-0,3 | ||||||||||||
| + 0,1-0,2 | ||||||||||||
| +/- 0,05-0,1 | ||||||||||||
| - <0,1 | ||||||||||||
| NT не тестировали |
Нативный BLG: трижды перекристаллизованный BLG (Sigma), растворенный в PBS
Денатурированный BLG: трижды перекристаллизованный BLG (Sigma), разбавленный и прокипяченный в SDS буфере для образцов
LI/T Рекомбинантный Lactococcus lactis, экспрессирующий протеиназу Lactobacillus bulgaricus, с вставкой пептида BLG.
Для получения гибридом, секретирующих моноклональные антитела против BLG пептидов, у иммунизированных крыс удаляли селезенки. Клетки селезенки с использованием стандартных методик сливали с миеломными клетками и уже в первом скрининге были обнаружены клеточные популяции, продуцирующие антитела к анти-Т6 или анти-Т17. Клонирование таких клеток проводили с использованием клеточного сортера для гарантии присутствия единственной клетки в лунке.
Пример 5
Определение толерогенных пептидов с помощью антител
Для определения, способны ли молочно-кислые бактерии экспрессировать толерогенные пептиды таким образом, чтобы они были доступными и могли распознаваться антителами, бактерии, содержащие рекомбинантный ген, выращивали в 50 мл культуры и клетки собирали центрифугированием. Затем полученные клетки дважды промывали 50 мл TBS и суспендировали в 6 мл TBS. 75 мкл суспензии помещали в лунки планшета для ELISA и инкубировали, оставляли без крышек 24 часа при 37°С для высушивания лунок. Лунки трижды промывали TBS/PBS для удаления несвязавшихся бактерий и блокировали TBS-казеином (1,5 г/л) в течение 2 часов при 37°С. В лунки добавляли антитела против специфических пептидов. Для разведения использовали TBS-казеин, содержащий 0,2% Tween 20. Лунки инкубировали в течение ночи при комнатной температуре. Затем лунки трижды промывали TBS, добавляли вторые антитела (конъюгированные с HRP козлиным анти-крысиным IgG) и инкубировали при 37°С. Для разведений использовали TBS-казеин, содержащий 0,2% Tween. Лунки трижды промывали TBS, добавляли OPD/H2O2 и просчитывали при 490 нм.
Было показано, что для штаммов Lactococcus lactis и Lactobacillus johnsonii наблюдается положительная реакция, что подтверждает, что антитела способны распознавать толерогенные пептиды.
Пример 6
Получение кроличьей антисыворотки, реагирующей с аминокислотными остатками 472-659 L bulgaricus prtB протеинаэы
Последовательность prtB (bp 1414-1977), кодирующую аминокислотные остатки 472-659 (первая аминокислота представляет собой инициаторный метионин), амплифицировали с помощью PCR с использованием pMD114 в качестве матрицы и
праймера, расположенного перед геном, (prtB3'-1977) с последовательностью
5'-CGCAAGCTTGTGCGAAGTGTTCATGGC-3' (содержащий 5' сайт BamHI), и
праймера, расположенного после гена, (prtB3'-1977) с последовательностью
5'-CGCAAGCTTGTGCGAAGTGTTCATGGC-3' (содержащий 5' сайт HindIII).
Специфический продукт PCR был получен с помощью Taq ДНК-полимеразы (Perkin-Elmer) и 3 циклов, включающих денатурацию 30 сек при 95°С, отжиг праймера 30 сек при 56°C и синтез 45 сек при 72°С, после чего проводили еще 27 циклов, доводя температуру на стадии отжига до 60°С.
После обессоливания и удаления праймеров и dNTPs (High Pure PCR Product Purification Kit, Roche), образец расщепляли BamHI и HindIII, фрагменты разделяли с помощью электрофореза в агарозном геле и интересующие полосы ДНК выделяли из геля (E.Z.N.A. Gel Extraction Kit, Peqlab).
Очищенный амплифицированный продукт лигировали по сайтам BamHI и HindIII экспрессирующего вектора pQE-9 E.coli (Qiagen), после 6-histidine tag.
Векторы pREP4 трансформировали E.coli штамм М15, экспрессию гетерологичного белка осуществляли путем индукции 1 мМ IPTG.
Клетки, содержащиеся в одном литре культуры, собирали и лизировали в денатурирующих условиях (8М мочевина). Лизат осветляли центрифугированием и наносили его на Ni2+-NTA агарозные шарики (Qiagen), уравновешенные при рН 8,0, для связывания меченного 6-ю гистидинами белка. После промывки при рН 6,3 рекомбинантный белок элюировали при рН 4,5.
Полученный материал нейтрализовали 100 мМ Трис-Cl (рН 7,5), количественно определяли содержание белка с использованием бисинхониновой кислоты (Pierce) и доводили концентрацию до 1 мг/мл тем же буфером.
Антиген эмульгировали в полном адьюванте Фрейнда и иммунизировали двух кроликов с помощью нескольких подкожных инъекций. Инъекции проводили на 0, 14, 28 и 56 день. Кровь собирали на 80 день.
Реактивность сыворотки, оказавшуюся неожиданно высокой, подтверждали с помощью иммуноферментного анализа (ELISA)