Новый ген пептидобразующего фермента
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой новый фермент, способный катализировать реакцию пептидного синтеза из карбоксильного компонента и аминокомпонента. Данный фермент получают культивированием бактериальной клетки-хозяина, которая трансформирована ДНК, кодирующей пептидобразующий фермент, с последующим накоплением данного фермента. Для получения дипептида полученную культуру смешивают с карбоксильным компонентом и аминокомпонентом. Данное изобретение позволяет получать пептиды с высоким выходом без осуществления сложной методики синтеза. 24 н. и 14 з.п. ф-лы, 4 ил, 18 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому ферменту, на основе которого может быть легко получен пептид с высоким выходом и недорого, без потребностей в сложном способе синтеза. Более конкретно настоящее изобретение относится к новому ферменту, который катализирует реакцию образования пептида из карбоксильного компонента и компонента с аминогруппой, к микробу, который продуцирует данный фермент, и к способу получения дипептида с использованием указанного фермента или микроба.
Предпосылки создания изобретения
Пептиды используются при производстве фармацевтических препаратов, в пищевой промышленности и в различных других областях. В частности, например, L-аланил-L-глутамин в связи с тем, что он обладает большей стабильностью и водорастворимостью, чем L-глутамин, широко используется в качестве компонента жидкостей, применяемых для инфузии, и в составе бессывороточных сред.
Способы химического синтеза, которые известны как способы образования пептидов, не всегда являются легко выполнимыми. Известные примеры таких способов включают способ, в котором используется N-бензилоксикарбонилаланин (далее в описании называемый как "Z-аланин") и защищенный L-глутамин (см. Bull. Chem. Soc. Jpn., 34, 739 (1961), Bull. Chem. Soc. Jpn., 35, 1966 (1962)), способ, в котором используется Z-аланин и защищенный сложный γ-метиловый эфир L-глутаминовой кислоты (см. Bull. Chem. Soc. Jpn., 37, 200 (1964)), способ, в котором используется сложный эфир Z-аланина и незащищенная глутаминовая кислота (см. Патентный документ 1), способ, который включает синтез производного N-(2-замещенного)пропионилглутамина в качестве промежуточного продукта из 2-замещенного пропионилгалогенида в качестве исходного материала (см. Патентный документ 2).
Однако, поскольку все указанные способы требуют введения, а затем удаления защитных групп или использования оптически активных промежуточных продуктов, они не являются достаточно удовлетворительными с точки зрения их промышленной применимости.
С другой стороны, широко известны примеры обычных способов производства пептидов с использованием ферментов, которые включают проведение реакции конденсации и в которых используют N-защищенный и C-незащищенный карбоксильный компонент, а также N-незащищенный, C-защищенный компонент с аминогруппой, или аминокомпонент (способ, обозначаемый далее как "реакция 1"), и реакцию замещения, в которой используют N-защищенный и C-защищенный карбоксильный компонент и N-незащищенный, C-защищенный аминокомпонент (способ, обозначаемый далее как "реакция 2"). Примером реакции 1 является способ получения сложного метилового эфира Z-аспартилфенилаланина из Z-аспарагиновой кислоты и сложного метилового эфира фенилаланина (см. Патентный документ 3), а примером реакции 2 является способ получения амида ацетилфенилаланиллейцина из сложного этилового эфира ацетилфенилаланина и амида лейцина (см. Biochemical J., 163, 531, (1977)). Имеются сообщения, относящиеся к примерам очень небольшого числа исследований, направленных на поиски способа, в котором использовался бы N-незащищенный, С-защищенный карбоксильный компонент. Пример реакции замещения, в которой используется N-незащищенный, С-защищенный карбоксильный компонент и N-незащищенный, С-защищенный аминокомпонент (способ, обозначаемый далее как "реакция 3"), описан в публикации по Международному патенту WO 90/01555 (Патентный документ 4). В частности, в этой связи можно указать на способ получения амида аргиниллейцина из сложного этилового эфира аргинина и амида лейцина. Примеры реакций замещения, в которых используют N-незащищенный, С-защищенный карбоксильный компонент и N-незащищенный, С-незащищенный аминокомпонент (способ, обозначаемый далее как "реакция 4") описаны в публикации по Европейскому патенту EP 278787A1 (Патентный документ 5) и в публикации по Европейскому патенту EP 359399В1 (Патентный документ 6). В частности, может быть указан способ получения тирозилаланина из сложного этилового эфира тирозина и аланина.
Патентный документ 1: Публикация выложенной заявки на патент Японии, No. Н1-96194 Gazette.
Патентный документ 2: Публикация выложенной заявки на патент Японии, No. Н6-234715 Gazette.
Патентный документ 3: Публикация выложенной заявки на патент Японии, No. S53-92729 Gazette.
Патентный документ 4: Публикация по международному патенту WO 90/01555 Gazette.
Патентный документ 5: Публикация по международному патенту EP 278787A1 Gazette.
Патентный документ 6: Публикация по международному патенту EP 359399B1 Gazette.
Документ 1, не относящийся к патентным публикациям: Biochemical J., 163, 531 (1977).
Описание изобретения
Самый недорогой способ получения среди указанных способов применения реакций 1-4 относится к классу реакции 4, которая включает наименьшее число защитных групп.
Однако вариант осуществления реакции 4 в уровне техники (см. публикацию по Европейскому патенту EP 278787A1) характеризуется следующими основными проблемами: (1) чересчур низкая скорость образования пептида, (2) низкий выход пептида, (3) получаемые пептиды ограничены теми пептидами, которые содержат аминокислоты со сравнительно высокой гидрофобностью, (4) количество добавляемого фермента чрезвычайно велико и (5) требуются относительно дорогие препараты карбоксипептидазы, получаемые из плесневых грибов, дрожжей или растений. В том что касается реакции 4, неизвестны способы, которые бы включали использование фермента, полученного из микробов или дрожжей, отличных от представителей рода Saccharomyces, и неизвестен способ получения аланилглутамина и других пептидов, которые бы характеризовались высокой гидрофильностью. В свете уровня техники в данной области, очевидна потребность в разработке подходящего для промышленного применения недорогого способа получения указанных пептидов.
Целью настоящего изобретения является разработка нового фермента, который позволял бы получать пептид легко, с высоким выходом и недорого, без применения сложного способа синтеза. Более конкретно, целью настоящего изобретения является обеспечение нового фермента, который катализирует реакцию образования пептида из карбоксильного компонента и компонента, содержащего аминогруппу (аминокомпонента), микроба, который продуцирует данный фермент, и способ получения недорогого пептида с использованием указанного фермента или микроба.
В результате проведенных обширных исследований в контексте указанной выше цели авторы настоящего изобретения обнаружили новый фермент, который эффективно образует пептид и который имеется в новых обнаруженных ими бактериях, принадлежащих к роду Empedobacter и т.п., при этом авторы определили последовательность гена, кодирующего данный фермент, что и составило суть настоящего изобретения.
А именно, настоящее изобретение описано ниже.
[1] ДНК, кодирующая белок, указанный в пунктах (А) или (В) ниже:
(А) белок, имеющий аминокислотную последовательность, состоящую из аминокислотных остатков с номерами 23-616, в аминокислотной последовательности, описанной в виде SEQ ID NO:6 в перечне последовательностей,
(В) белок, имеющий аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, состоящей из аминокислотных остатков с номерами 23-616 в аминокислотной последовательности, описанной в виде SEQ ID NO:6 в перечне последовательностей, и обладающий активностью по образованию пептида.
[2] ДНК, кодирующая белок, указанный в пунктах (С) или (D) ниже:
(С) белок, имеющий аминокислотную последовательность, состоящую из аминокислотных остатков с номерами 21-619 в аминокислотной последовательности, описанной в виде SEQ ID NO:12 в перечне последовательностей,
(D) белок, имеющий аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, состоящей из аминокислотных остатков с номерами 21-619 в аминокислотной последовательности, описанной в виде SEQ ID NO:12 в перечне последовательностей, и обладающий активностью по образованию пептида.
[3] ДНК, кодирующая белок, указанный в пунктах (E) или (F) ниже:
(E) белок, имеющий аминокислотную последовательность, состоящую из аминокислотных остатков с номерами 23-625 в аминокислотной последовательности, описанной в виде SEQ ID NO:18 в перечне последовательностей,
(F) белок, имеющий аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, состоящей из аминокислотных остатков с номерами 23-625 в аминокислотной последовательности, описанной в виде SEQ ID NO:18 в перечне последовательностей, и обладающий активностью по образованию пептида.
[4] ДНК, кодирующая белок, указанный в пунктах (G) или (H) ниже:
(G) белок, имеющий аминокислотную последовательность, состоящую из аминокислотных остатков с номерами 23-645 в аминокислотной последовательности, описанной в виде SEQ ID NO:23 в перечне последовательностей,
(H) белок, имеющий аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, состоящей из аминокислотных остатков с номерами 23-645 в аминокислотной последовательности, описанной в виде SEQ ID NO:23 в перечне последовательностей, и обладающий активностью по образованию пептида.
[5] ДНК, кодирующая белок, указанный в пунктах (I) или (J) ниже:
(I) белок, имеющий аминокислотную последовательность, состоящую из аминокислотных остатков с номерами 26-620 в аминокислотной последовательности, описанной в виде SEQ ID NO:25 в перечне последовательностей,
(J) белок, имеющий аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, состоящей из аминокислотных остатков с номерами 26-620 в аминокислотной последовательности, описанной в виде SEQ ID NO:25 в перечне последовательностей, и обладающий активностью по образованию пептида.
[6] ДНК, кодирующая белок, указанный в пунктах (К) или (L) ниже:
(К) белок, имеющий аминокислотную последовательность, состоящую из аминокислотных остатков с номерами 18-644 в аминокислотной последовательности, описанной в виде SEQ ID NO:27 в перечне последовательностей,
(L) белок, имеющий аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, состоящей из аминокислотных остатков с номерами 18-644 в аминокислотной последовательности, описанной в SEQ ID NO:27 в перечне последовательностей, и обладающий активностью по образованию пептида.
[7] ДНК, кодирующая белок, указанный в пунктах (M) или (N) ниже:
(М) белок, обладающий аминокислотной последовательностью, описанной в SEQ ID NO:6 в перечне последовательностей,
(N) белок, содержащий участок зрелого белка, который имеет аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, описанной в SEQ ID NO:6 в перечне последовательностей, и который обладает активностью по образованию пептида.
[8] ДНК, кодирующая белок, указанный в пунктах (O) или (P) ниже:
(O) белок, обладающий аминокислотной последовательностью, описанной в SEQ ID NO:12 в перечне последовательностей,
(P) белок, содержащий участок зрелого белка, который имеет аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, описанной в SEQ ID NO:12 в перечне последовательностей, и который обладает активностью по образованию пептида.
[9] ДНК, кодирующая белок, указанный в пунктах (Q) или (R) ниже:
(Q) белок, обладающий аминокислотной последовательностью, описанной в SEQ ID NO:18 в перечне последовательностей,
(R) белок, содержащий участок зрелого белка, который имеет аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, описанной в SEQ ID NO:18 в перечне последовательностей, и который обладает активностью по образованию пептида.
[10] ДНК, кодирующая белок, указанный в пунктах (S) или (T) ниже:
(S) белок, обладающий аминокислотной последовательностью, описанной в SEQ ID NO:23 в перечне последовательностей,
(T) белок, содержащий участок зрелого белка, который имеет аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, описанной в SEQ ID NO:23 в перечне последовательностей, и который обладает активностью по образованию пептида.
[11] ДНК, кодирующая белок, указанный в пунктах (U) или (V) ниже:
(U) белок, обладающий аминокислотной последовательностью, описанной в SEQ ID NO:25 в перечне последовательностей,
(V) белок, содержащий участок зрелого белка, который имеет аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, описанной в SEQ ID NO:25 в перечне последовательностей, и который обладает активностью по образованию пептида.
[12] ДНК, кодирующая белок, указанный в пунктах (W) или (X) ниже:
(W) белок, обладающий аминокислотной последовательностью, описанной в SEQ ID NO:27 в перечне последовательностей,
(X) белок, содержащий участок зрелого белка, который имеет аминокислотную последовательность, включающую замещение, делецию, вставку, добавление и/или инверсию одной или множества аминокислот в аминокислотной последовательности, описанной в SEQ ID NO:27 в перечне последовательностей, и который обладает активностью по образованию пептида.
[13] ДНК, указанная в пунктах (a) или (b) ниже:
(a) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 127-1908 в последовательности оснований, описанной в SEQ ID NO:5 в перечне последовательностей,
(b) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 127-1908 в последовательности оснований, описанных в SEQ ID NO:5 в перечне последовательностей, и которая кодирует белок, обладающий активностью по образованию пептида.
[14] ДНК, указанная в пунктах (c) или (d) ниже:
(с) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 121-1917 в последовательности оснований, описанной в SEQ ID NO:11 в перечне последовательностей,
(d) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 121-1917 в последовательности оснований, описанной в SEQ ID NO:11 в перечне последовательностей, и которая кодирует белок, обладающий активностью по образованию пептида.
[15] ДНК, указанная в пунктах (e) или (f) ниже:
(e) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 127-1935 в последовательности оснований, описанной в SEQ ID NO:17 в перечне последовательностей,
(f) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 127-1935 в последовательности оснований, описанной в SEQ ID NO:17 в перечне последовательностей, и которая кодирует белок, обладающей активностью по образованию пептида.
[16] ДНК, указанная в пунктах (g) или (h) ниже:
(g) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 127-1995 в последовательности оснований, описанной в SEQ ID NO:22 в перечне последовательностей,
(h) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 127-1995 в последовательности оснований, описанной в SEQ ID NO:22 в перечне последовательностей, и которая кодирует белок, обладающий активностью по образованию пептида.
[17] ДНК, указанная в пунктах (i) или (j) ниже:
(i) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 104-1888 в последовательности оснований, описанной в SEQ ID NO: 24 в перечне последовательностей,
(j) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 104-1888 в последовательности оснований, описанной в SEQ ID NO:24 в перечне последовательностей, и которая кодирует белок, обладающий активностью по образованию пептида.
[18] ДНК, указанная в пунктах (k) или (l) ниже:
(k) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 112-1992 в последовательности оснований, описанной в SEQ ID NO:26 в перечне последовательностей,
(l) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 112-1992 в последовательности оснований, описанной в SEQ ID NO:26 в перечне последовательностей, и которая кодирует белок, обладающий активностью по образованию пептида.
[19] ДНК, указанная в пунктах (m) или (n) ниже:
(m) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 61-1908 в последовательности оснований, описанной в SEQ ID NO:5 в перечне последовательностей,
(n) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 61-1908 в последовательности оснований, описанной в SEQ ID NO:5 в перечне последовательностей, и которая кодирует белок, содержащий участок зрелого белка, который обладает активностью по образованию пептида.
[20] ДНК, указанная в пунктах (o) или (p) ниже:
(o) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 61-1917 в последовательности оснований, описанной в SEQ ID NO:11 в перечне последовательностей,
(p) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 61-1917 в последовательности оснований, описанной в SEQ ID NO:11 в перечне последовательностей, и которая кодирует белок, содержащий участок зрелого белка, который обладает активностью по образованию пептида.
[21] ДНК, указанная в пунктах (q) или (r) ниже:
(q) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 61-1935 в последовательности оснований, описанной в SEQ ID NO:17 в перечне последовательностей,
(r) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 61-1935 в последовательности оснований, описанной в SEQ ID NO:17 в перечне последовательностей, и которая кодирует белок, содержащий участок зрелого белка, который обладает активностью по образованию пептида.
[22] ДНК, указанная в пунктах (s) или (t) ниже:
(s) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 127-1995 в последовательности оснований, описанной в SEQ ID NO:22 в перечне последовательностей,
(t) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 127-1995 в последовательности оснований, описанной в SEQ ID NO:22 в перечне последовательностей, и которая кодирует белок, содержащий участок зрелого белка, который обладает активностью по образованию пептида.
[23] ДНК, указанная в пунктах (u) или (v) ниже:
(u) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 29-1888 в последовательности оснований, описанной в SEQ ID NO:24 в перечне последовательностей,
(v) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 29-1888 в последовательности оснований, описанной в SEQ ID NO:24 в перечне последовательностей, и которая кодирует белок, содержащий участок зрелого белка, который обладает активностью по образованию пептида.
[24] ДНК, указанная в пунктах (w) или (x) ниже:
(w) ДНК, имеющая последовательность оснований, состоящую из оснований с номерами 61-1992 в последовательности оснований, описанной в SEQ ID NO:26 в перечне последовательностей,
(x) ДНК, которая гибридизуется в строгих условиях с ДНК, имеющей последовательность оснований, комплементарную к последовательности оснований, состоящей из оснований с номерами 61-1992 в последовательности оснований, описанной в SEQ ID NO:26 в перечне последовательностей, и которая кодирует белок, содержащий участок зрелого белка, который обладает активностью по образованию пептида.
[25] ДНК по любому из пунктов [13]-[24], где строгие условия включают такие условия, в которых промывка проводится при температуре 60°C с использованием концентрации соли, эквивалентной 1 × SSC и 0,1% ДСН.
[26] Рекомбинантная ДНК, включающая ДНК по любому из пунктов [1]-[25].
[27] Трансформированная клетка, включающая введенную в нее рекомбинантную ДНК, описанную в пункте [26].
[28] Способ получения пептидобразующего фермента, включающий:
культивирование трансформированной клетки по пункту [27] в среде и создание условий, способствующих накоплению пептидобразующего фермента в среде и/или в трансформированной клетке.
[29] Способ получения дипептида, включающий: культивирование трансформированной клетки по пункту [28] в среде с получением культуры и последующее смешивание такой культуры с карбоксильным компонентом и с аминокомпонентом для синтеза дипептида.
[30] Способ получения дипептида, включающий: получение дипептида из компонента с карбоксигруппой и компонента с аминогруппой, с использованием культуры микроба, принадлежащего к роду Sphingobacterium и обладающего способностью образовывать дипептид из компонента с карбоксигруппой и компонента с аминогруппой, с последующим отделением микробной клетки от культуры, продукта обработанной микробной клетки данного микроба или пептидобразующего фермента, полученного из данного микроба.
Кроме того, аминокислотная последовательность, описанная в SEQ ID NO:6, определяется природой ДНК, описанной в SEQ ID NO:5 в перечне последовательностей. Аминокислотная последовательность, описанная в SEQ ID NO:12, определяется природой ДНК, описанной в SEQ ID NO:11. Аминокислотная последовательность, описанная в SEQ ID NO:18, определяется природой ДНК, описанной в SEQ ID NO:17. Аминокислотная последовательность, описанная в SEQ ID NO:23, определяется природой ДНК, описанной в SEQ ID NO:22. Аминокислотная последовательность, описанная в SEQ ID NO:25, определяется природой ДНК, описанной в SEQ ID NO:24. Аминокислотная последовательность, описанная в SEQ ID NO:27, определяется природой ДНК, описанной в SEQ ID NO:26.
Краткое описание фигур
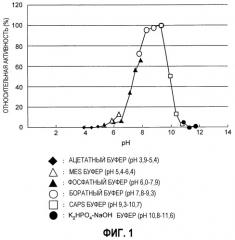
Фиг.1 представляет собой график, иллюстрирующий оптимальный pH для фермента из Empedobacter по настоящему изобретению.
Фиг.2 представляет собой график, иллюстрирующий оптимальную температуру для фермента из Empedobacter по настоящему изобретению.
Фиг.3 представляет собой график, иллюстрирующий образование с течением времени L-аланил-L-глутамина из сложного метилового эфира L-аланина и L-глутамина.
Фиг.4 представляет собой диаграмму, иллюстрирующую количество фермента, присутствующего во фракции цитоплазмы (Cy) и во фракции периплазмы (Pe).
Наилучший способ осуществления изобретения
Ниже приводится описание гена для нового фермента, образующего дипептид, и дипептидобразующего фермента, который является продуктом данного гена.
(1) Микробы, содержащие ДНК по настоящему изобретению
ДНК по настоящему изобретению кодирует белок, который обладает способностью образовывать пептид из компонента с карбоксильной группой и компонента с аминогруппой. В настоящем описании компонент с карбоксильной группой относится к компоненту, который обеспечивает карбонильный участок (СО) в пептидной связи (-CONH-), тогда как компонент с аминогруппой относится к компоненту, который обеспечивает аминный участок (NH) в пептидной связи. Кроме того, в настоящем описании, если особо не оговорено иное, термин "пептид" при использовании его без дополнительных определений относится к полимеру, имеющему по меньшей мере одну пептидную связь. Кроме того, в настоящем описании термин "дипептид" относится к пептиду, имеющему одну пептидную связь.
Примеры микробов, содержащих ДНК по настоящему изобретению, включают бактерии, принадлежащие к роду Empedobacter, к роду Sphingobacterium, к роду Pedobacter, к роду Taxeobacter, к роду Cyclobacterium или к роду Psycloserpens, тогда как более конкретные примеры их включают Empedobacter brevis, штамм ATCC 14234 (штамм FERM P-18545, штамм FERM BP-8113), Sphingobacterium sp. штамм FERM BP-8124, Pedobacterheparinus штамм IFO 12017, Taxeobacter gelupurpurascens штамм DSMZ 11116, Cyclobacterium marinum штамм АТСС 25205 и Psycloserpensburtonensis штамм АТСС 700359. Empedobacter brevis штамм АТСС 14234 (штамм FERM P-18545, штамм FERM BP-8113), Sphingobacterium sp. штамм FERM BP-8124, Pedobacterheparinus штамм IFO 12017, Taxeobacter gelupurpurascens штамм DSMZ 11116, Cyclobacterium marinum штамм АТСС 25205 и Psycloserpensburtonensis штамм АТСС 700359) представляют собой бактерии, которые были выбраны в результате поисков авторами настоящего изобретения тех бактерий, которые продуцируют фермент, способный образовывать с высоким выходом пептид на основе компонента с карбоксильной группой и компонента с аминогруппой.
В числе указанных штаммов микроорганизмов, те микробы, которые обозначены номерами с аббревиатурой FERM, депонированы независимой корпорацией, Национальным Институтом современной промышленной науки и технологии (National Institute of Advanced, Industrial Science and Technology), в Международном Депозитарии запатентованных организмов (International Patent Organism Depositary) (Chuo Dai-6, 1-1 Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, Япония) и могут быть найдены по ссылке на данный номер.
Среди указанных штаммов микроорганизмов, те микробы, наименования которых содержат номера АТСС, депонированы в Американской Коллекции типовых культур (American Type Culture Collection (P.O. Box 1549, Manassas, VA 20110, Соединенные Штаты Америки) и могут быть найдены по ссылке на данный номер.
Среди указанных штаммов микроорганизмов, те микробы, наименования которых содержат номера IFO, депонированы в Институте ферментации (Institute of Fermentation) в Осаке (2-17-85 Jusanbon-cho, Yodogawa-ku, Osaka-shi, Япония) и могут быть найдены по ссылке на данный номер.
Среди указанных штаммов микроорганизмов, те микробы, наименования которых содержат номера NBRC, депонированы в Центре Биологических Ресурсов Национального Института технологии и аналитической оценки (NITE Biological Resource Center of the National Institute of Technology and Evaluation) (5-8 Kazusa-Kamaashi, 2-Chome, Kisarazu-shi, Chiba-ken, Япония) и могут быть найдены по ссылке на данный номер.
Среди указанных штаммов микроорганизмов, те микробы, наименования которых содержат номера DSMZ, депонированы в Германском Институте микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (German Collection of Microbes and Cell Cultures) (Mascheroder Weg, 1b, 38124 Braunschweig, Германия) и могут быть найдены по ссылке на данный номер.
Empedobacter brevis штамм АТСС 14234 (штамм FERM P-18545, штамм FERM BP-8113) был депонирован в Международном Депозитарии запатентованных организмов (International Patent Organism Depositary) независимой корпорацией, Национальным Институтом современной промышленной науки и технологии в Японии (National Institute of Advanced Industrial Science and Technology) (Chuo Dai-6, 1-1 Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, Япония) 1 октября 2001 года и ему был присвоен депозитный номер FERM P-18545. Функция контроля данного организма была перенесена впоследствии в Депозитарий, функционирующий в рамках Будапештского договора при Международном Депозитарии запатентованных организмов (International Patent Organism Depositary) независимой корпорации, Национального Института современной промышленной науки и технологии в Японии (National Institute of Advanced Industrial Science and Technology) 8 июля 2002 года и ему был присвоен депозитный номер FERM BP-8113 (наименование микроорганизма: Empedobacter brevis штамм AJ 13933).
Sphingobacterium sp. штамм AJ110003 был депонирован в Международном Депозитарии запатентованных организмов (International Patent Organism Depositary) независимой административной корпорации, Национального Института современной промышленной науки и технологии (National Institute of Advanced Industrial Science and Technology) 22 июля 2002 года и ему был присвоен депозитный номер FERM BP-8124. Следует отметить, что штамм AJ 110003 (FERM BP-8124) был идентифицирован, как указано выше, как Sphingobacterium sp. по результатам идентифицирующего эксперимента, описанного ниже. Штамм FERM BP-1824 представляет собой Грамотрицательные палочки (размером 0,7-0,8 × 1,5-2,0 мкм), которые не образуют спор и не являются подвижными. Его колонии имеют округлую форму с практически гладкими краями, содержат мало выступов и характеризуются блестящей светло-желтой окраской. Данный микроорганизм растят при температуре 30°C, он является положительным по каталазе, положительным по оксидазе и отрицательным по результатам OF теста (на глюкозу) и на основе указанных свойств был идентифицирован как бактерия, принадлежащая к роду Sphingobacterium. Кроме того, в связи с наличием таких свойств, как отрицательная реакция в отношении восстановления нитрата, отрицательная реакция в отношении образования индола, отрицательная реакция в отношении образования кислоты из глюкозы, отрицательная реакция на аргининдигидролазу, позитивная реакция на уреазу, позитивная реакция в отношении гидролиза эскулина, отрицательная реакция в отношении гидролиза желатина, положительная реакция на β-галактозидазу, положительная реакция в отношении ассимиляции глюкозы, отрицательная реакция в отношении ассимиляции L-арабинозы, положительная реакция в отношении ассимиляции D-маннозы, отрицательная реакция в отношении D-маннита, положительная реакция в отношении ассимиляции N-ацетил-D-глюкозамина, положительная реакция в отношении ассимиляции мальтозы, отрицательная реакция в отношении ассимиляции глюконата калия, отрицательная реакция в отношении ассимиляции н-капроновой кислоты, отрицательная реакция в отношении ассимиляции адипиновой кислоты, отрицательная реакция в отношении ассимиляции ди-яблочной кислоты, отрицательная реакция в отношении ассимиляции цитрата натрия, отрицательная реакция в отношении ассимиляции фенилацетата и положительная реакция на цитохромоксидазу, было показано, что они аналогичны свойствам, характерным для Sphingobacterium multivorum или Sphingobacterium spiritivorum. Кроме того, несмотря на то, что результаты анализа гомологии по последовательности оснований гена 16S рРНК указывают на наивысший уровень гомологии со Sphingobacterium multivorum (98,8%), не было штамма, с которым указанный бактериальный штамм совпадал бы полностью. Соответственно, данный бактериальный штамм был идентифицирован как Sphingobacterium sp.
(2) Культивирование микроорганизмов
Для получения микробных клеток микроорганизмов, включающих ДНК по настоящему изобретению, указанные микробы культивируют и растят в соответствующей среде. При этом отсутствуют какие-то специфические ограничения в отношении среды, используемой для данной цели, главное, чтобы она позволяла бактериям расти. Указанная среда может представлять собой обычную среду, содержащую обычные источники углерода, источники азота, источники фосфора, источники серы, неорганические ионы и органические питательные источники, по необходимости.
Например, может быть использован любой источник углерода, если указанные микробы могут его утилизировать. Конкретные примеры источников углерода, которые могут при этом использоваться, включают сахара, такие как глюкоза, фруктоза, мальтоза и амилоза, спирты, такие как сорбит, этанол и глицерин, органические кислоты, такие как фумаровая кислота, лимонная кислота, уксусная и пропионовая кислота, и их соли, углеводороды, такие как парафин, а также их смеси.
Примеры источников азота, которые могут при этом использоваться, включают аммониевые соли неорганических кислот, такие как сульфат аммония и хлорид аммония, аммониевые соли органических кислот, такие как фумарат аммония и цитрат аммония, нитраты, такие как нитрат натрия и нитрат калия, соединения органического азота, такие как пептоны, дрожжевой экстракт, мясной экстракт и жидкий кукурузный экстракт, а также их смеси.
Кроме того, могут быть соответствующим образом смешаны и далее использованы питательные источники, используемые в обычных средах, такие как неорганические соли, соли микроэлементов (металлов) и витамины.
При этом отсутствуют какие-либо специфические ограничения по условиям культивирования, так что культивирование может проводиться, например, в течение периода времени от примерно 12 до примерно 48 часов, при соответствующем контроле значений pH и температуры, которые должны оставаться в диапазоне значений pH от 5 до 8 и в диапазоне температур от 15°C до 40°C, соответственно, в аэробных условиях.
Очистка фермента
ДНК по настоящему изобретению кодирует пептидобразующий фермент. Указанный пептидобразующий фермент может быть выделен и очищен из бактерий, принадлежащих, например, к роду Empedobacter. Способ выделения и очистки пептидобразующего фермента из Empedobacter brevis поясняется ниже как пример очистки фермента.
Вначале получают экстракт из бактериальных клеток Empedobacter brevis, например, из штамма FERM BP-8113 (Депонирующий Институт: независимая административная корпорация, Национальный Институт современной промышленной науки и технологии в Японии, Международный Депозитарий запатентованных организмов (National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary), Адрес Депонирующего Института: Chuo Dai-6, 1-1 Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, Япония), дата поступления в Международный Депозитарий: 8 июля 2002 года) путем разрушения клеток с помощью физического способа, такого как ультразвуковое разрушение, или ферментативного способа с использованием фермента, растворяющего клеточную стенку, с последующим удалением нерастворимой фракции центрифугированием и т.п. Далее пептидобразующий фермент может быть подвергнут очистке путем фракционирования раствора экстракта бактериальных клеток, полученного указанным выше способом, комбинированием обычных способов очистки белков, таких как анионообменная хроматография, катионообменная хроматография или гель-фильтрационная хроматография.
Примером носителя, используемого в анионообменной хроматографии, является сефароза Q-Sepharose HP (производство компании Amersham). Фермент восстанавливают из неадсорбируемой фракции в условиях pH 8,5 путем пропускания содержащего фермент клеточного экстракта через колонку, заполненную носителем.
Примером носителя, используемого в катионообменной хроматографии, являются MonoS HR (производство компании Amersham). После адсорбции фермента на колонку пропускают содержащий фермент клеточный экстракт через колонку, заполненную носителем, после чего промывают колонку, тогда как фермент элюируется буферным раствором, обогащенным высокой концентрацией соли. В процессе элюирования концентрация соли может последовательно повышаться или может использоваться концентрационный градиент. Например, в случае использования MonoS HR адсорбированный на колонку фермент элюируют с использованием NaCl в концентрации от примерно 0,2 до примерно 0,5М.
Фермент, очищенный указанным выше способом, может быть затем подвергнут очистке методом гель-фильтрационной хроматографии и т.п. Примером носителя, используемого в качестве геля в фильтрационной хроматографии, является сефадекс (Sephadex 200pg) (производство компании Amersham).
В приведенных выше процедурах очистки фракция, содержащая фермент, может быть подвергнута анализу для подтверждения наличия пептидобразующей активности в каждой из фракций способом, указанным в описанных ниже примерах. Внутренняя аминокислотная последовательность очищенного таким образом фермента показана в виде SEQ ID NO:1 и SEQ ID NO:2 в перечне последовательностей.
(4) ДНК по настоящему изобретению и трансформанты
(4-1) ДНК по настоящему изобретению
ДНК по настоящему изобретению, имеющая последовательность оснований, состоящую из оснований с номерами 61-1908, и описанная в SEQ ID NO:5, была выделена из Empedobacter brevis штамм FERM BP-8113 (Депонирующий институт: независим