Производные 4-(фенил-пиперазинил-метил)-бензамида, способ их получения и фармацевтическая композиция на их основе
Иллюстрации
Показать всеНастоящее изобретение относится к производным 4-(фенил-пиперазинил-метил)-бензамида общей формулы 1 или их соли, или отдельные энантиомеры и их соли,
в которой R1 - фенил, пиридинил, тиенил, фуранил, имидазолил, возможно замещенные, R2 - этил и изопропил, R3 - водород, фтор, R4 - NH2, NHSO2R5, R5 С1-С6-алкил. Соединения являются полезными в терапии и, в частности, для лечения боли. Описаны также способы получения соединений формулы 1 и фармацевтическая композиция на их основе. 5 н. и 7 з.п. ф-лы, 1 табл.
Реферат
Область изобретения
Настоящее изобретение относится к новым соединениям, к способу их получения, их применению и фармацевтическим композициям, содержащим эти новые соединения. Эти новые соединения являются полезными в терапии и, в частности, для лечения боли, тревоги и функциональных желудочно-кишечных расстройств.
Предшествующий уровень техники
δ-Рецептор идентифицирован как рецептор, играющий роль во многих функциях организма, таких как сердечно-сосудистая и лимфатическая и болепроводящая системы. Следовательно, лиганды для δ-рецептора могут найти потенциальное применение в качестве анальгетиков и/или в качестве гипотензивных агентов. Показано также, что лиганды для δ-рецептора обладают иммуномодулирующей активностью.
Идентификация по меньшей мере трех различных групп опиоидных рецепторов (μ, δ и к) в настоящее время четко установлена, и очевидно, что все три находятся как в центральной, так и в периферической нервных системах многих видов, включая человека. Анальгезию наблюдали в различных животных моделях при активации одного или более чем одного из этих рецепторов.
За редким исключением, имеющиеся в настоящее время селективные δ-опиоидные лиганды являются пептидными по природе и не подходят для введения посредством системных путей. Одним из примеров непептидного δ-агониста является SNC80 (Bilsky E.J. et al., Journal of Pharmacology and Experimental Therapeutics, 273 (1) pp.359-366 (1995)). Однако все еще существует необходимость в селективных δ-агонистах, обладающих не только повышенной селективностью, но также улучшенным профилем побочных эффектов.
Таким образом, задачей, лежащей в основе настоящего изобретения, являлся поиск новых анальгетиков, обладающих улучшенными болеутоляющими эффектами, а также с улучшенным профилем побочных эффектов по сравнению с современными μ-агонистами, а также обладающих улучшенной системной эффективностью.
Анальгетики, которые идентифицированы и имеются в уровне техники, имеют много недостатков, заключающихся в том, что они обладают неудовлетворительной фармакокинетикой и не оказывают болеутоляющего действия при введении посредством системных путей. Также документально подтверждено, что предпочтительные соединения δ-агонисты, описанные в данном уровне техники, проявляют значительные судорожные эффекты при системном введении.
Авторами изобретения в настоящее время обнаружены некоторые соединения, которые демонстрируют неожиданно улучшенные свойства, среди прочего улучшенные δ-агонистическую эффективность, эффективность in vivo, фармакокинетику, биодоступность, стабильность in vitro и/или более низкую токсичность.
Краткое изложение сущности изобретения
Новые соединения по настоящему изобретению определены формулой I
где
R1 выбран из любого из
(1) фенила
(2) пиридинила
(3) тиенила
(4) фуранила
(5) имидазолила
(6) триазолила
(7) пирролила
(8) тиазолила
(9) пиридил-N-оксида
где каждое гетероароматическое кольцо R1 может быть возможно и независимо дополнительно замещено 1, 2 или 3 заместителями, выбранными из прямого и разветвленного C1-С6алкила, галогенированного C1-С6алкила, NO2, CF3, C1-С6алкокси, хлоро, фторо, бромо и йодо,
R2 независимо выбран из этила и изопропила;
R3 независимо выбран из водорода и фторо;
R4 независимо выбран из -ОН, -NH2 и -NHSO2R5; и
R5 независимо выбран из водорода, -CF3 и C1-С6алкила,
при условии, что, когда R2 представляет собой этил, и R3 представляет собой водород, тогда R4 не может представлять собой -ОН.
Замещения на гетероароматическом кольце могут иметь место в любом положении на указанных кольцевых системах.
Когда фенильное кольцо R1 и гетероароматическое(ие) кольцо(а) R1 замещены, предпочтительные заместители выбраны из любого из: CF3, метила, йодо, бромо, фторо и хлоро, из которых наиболее предпочтителен метил.
Еще одним воплощением настоящего изобретения, таким образом, является соединение формулы I, где R1 является таким, как определено выше, и каждое фенильное кольцо R1 и гетероароматическое кольцо R1 может быть независимо дополнительно замещено метильной группой.
Еще одним воплощением настоящего изобретения является соединение формулы I, где R1 представляет собой фенил, пирролил, фуранил, тиенил или имидазолил: R2 представляет собой этил или изопропил; R3 представляет собой водород или фторо; R4 представляет собой -NH2 или -NHSO2R5; и R5 представляет собой C1-С6алкил, возможно с 1 или 2 из предпочтительных заместителей на фенильном кольце R1 или на гетероароматическом кольце R1.
Дополнительным воплощением настоящего изобретения является соединение формулы I, где R1 представляет собой фенил, пирролил, фуранил, тиенил или имидазолил; R2 представляет собой этил или изопропил; R3 представляет собой водород; R4 представляет собой -NHSO2R5; и R5 представляет собой С1-С6алкил, возможно с 1 или 2 из предпочтительных заместителей на фенильном кольце R1 или на гетероароматическом кольце R1.
Другими воплощениями настоящего изобретения являются соединения формулы I, где a) R1 представляет собой фенил, пирролил или фуранил; R2 представляет собой этил или изопропил; R3 представляет собой водород или фторо; и R4 представляет собой -NH2; б) R1 представляет собой тиенил или имидазолил: R2 представляет собой этил или изопропил; R3 представляет собой водород или фторо, и R4 представляет собой -NH2; в) R1 представляет собой фенил, пирролил, фуранил, тиенил или имидазолил; R2 представляет собой этил или изопропил; R3 представляет собой водород или фторо; R4 представляет собой -NHSO2R5; и R5 представляет собой С1-С6алкил; и г) R1 представляет собой фенил, пирролил, фуранил, тиенил или имидазолил; R2 представляет собой этил или изопропил; R3 представляет собой водород или фторо; R4 представляет собой -NHSO2R5; и R5 представляет собой C1-С6алкил, где все воплощения а)-г) могут быть возможно замещены 1 или 2 из предпочтительных заместителей на фенильном кольце R1 или на гетероароматическом кольце R1.
В объем настоящего изобретения также входят отдельные энантиомеры и соли соединений формулы I, включая соли энантиомеров. Также в объем настоящего изобретения входят смеси отдельных энантиомеров, такие как рацемическая смесь, а также соли смесей отдельных энантиомеров.
Разделение рацемических смесей на отдельные энантиомеры хорошо известно в данной области техники и может быть осуществлено, например, путем разделения на подходящей хиральной хроматографической колонке.
Получение солей хорошо известно в данной области техники и может быть осуществлено, например, путем смешивания соединения формулы I в подходящем растворителе с желаемой протонной кислотой и выделения способами, стандартными в данной области техники. Соли соединений формулы I включают в себя фармацевтически приемлемые соли, а также фармацевтически неприемлемые соли.
Новые соединения по настоящему изобретению являются полезными в терапии, особенно для лечения различных болевых состояний, таких как хроническая боль, невропатическая боль, острая боль, раковая боль, боль, вызванная ревматоидным артритом, мигрень, висцеральная боль и так далее. Этот перечень, однако, не следует интерпретировать как исчерпывающий.
Соединения по настоящему изобретению являются полезными в качестве иммуномодуляторов, особенно при аутоиммунных заболеваниях, таких как артрит, для кожных трансплантатов, трансплантатов органов и подобных хирургических нужд, при коллагенозах, различных аллергиях, для применения в качестве противоопухолевых агентов и противовирусных агентов.
Соединения по настоящему изобретению являются полезными при болезненных состояниях, при которых имеется дегенерация или дисфункция опиоидных рецепторов, либо дегенерация или дисфункция опиоидных рецепторов вовлечена в процесс. В диагностические методики и в применения, связанные с визуализацией, такие как позитронная эмиссионная томография (ПЭТ), может быть также вовлечено использование меченых изотопами вариантов соединений по настоящему изобретению.
Соединения по настоящему изобретению являются полезными для лечения диареи, депрессии, тревоги и расстройств, связанных со стрессом, таких как расстройства, связанные с посттравматическим стрессом, паническое расстройство, генерализованное тревожное расстройство, социальная фобия и обсессивно-компульсивное расстройство; недержания мочи, различных психических заболеваний, кашля, отека легких, различных желудочно-кишечных расстройств, например запора, функциональных желудочно-кишечных расстройств, таких как синдром раздраженной кишки и функциональная диспепсия, болезни Паркинсона и других двигательных расстройств, травматического повреждения головного мозга, удара, кардиопротекции после инфаркта миокарда, повреждения спинного мозга и привыкания к чрезмерному употреблению лекарств, включая лечение злоупотребления алкоголем, никотином, опиоидами и другими лекарствами, а также для лечения расстройств симпатической нервной системы, например гипертензии.
Соединения по настоящему изобретению являются полезными в качестве анальгетического агента для применения во время общей анестезии и контролируемой коррекции анестезии. Комбинации агентов с различными свойствами часто применяют для достижения баланса эффектов, необходимого для поддержания состояния анестезии (например, амнезии, анальгезии, мышечной релаксации и седативного эффекта). В данную комбинацию включены ингаляционные анестетики, снотворные средства, анксиолитики, нейромышечные блокаторы и опиоиды.
В объем настоящего изобретения также входит применение любого из соединений формулы I, указанной выше, для производства лекарства для лечения любого из состояний, обсуждаемых выше.
Следующим аспектом настоящего изобретения является способ лечения субъекта, страдающего любым из состояний, обсуждаемых выше, при котором пациенту, нуждающемуся в таком лечении, вводят эффективное количество соединения формулы I, приведенной выше.
Способы получения
Соединения по настоящему изобретению можно получить, используя следующую общую методику.
Получение фенолов. Примеры 1-3
Соединения формулы I, где R4 представляет собой -ОН, получают путем осуществления взаимодействия соединения общей формулы II
где R2 и R3 являются такими, как определено в формуле I, a R4 представляет собой ОМе, с Вос-пиперазином в ацетонитриле в присутствии триэтиламина в стандартных условиях с последующим удалением защитной группы Вос в стандартных условиях с получением соединения формулы III
которое затем подвергают алкилированию в восстановительных условиях соединением формулы R1-CHO с последующим расщеплением метилового эфира с использованием BBr3 в дихлорметане с получением соединения формулы I, где R4 представляет собой -ОН.
Получение анилинов. Примеры 4-6
Соединения формулы I, где R4 представляет собой -NH2, получают путем осуществления взаимодействия соединения общей формулы IV
где R2 и R3 являются такими, как определено в формуле I, a R4 представляет собой NO2, с Вос-пиперазином в ацетонитриле в присутствии триэтиламина в стандартных условиях с последующим удалением защитной группы Вос в стандартных условиях с получением соединения формулы V
которое затем подвергают алкилированию в восстановительных условиях соединением формулы R1-CHO с последующим восстановлением нитрогруппы с использованием водорода и палладия на угле с получением соединения формулы I, где R4 представляет собой -NH2.
Получение метилсульфонанилидов. Примеры 7-8
Соединение формулы I, где R4 представляет собой -NHSO2R5, получают путем осуществления взаимодействия соединения общей формулы VI
где R2 и R3 являются такими, как определено в п.1, a R4 представляет собой NO2, с Вос-пиперазином в ацетонитриле в присутствие триэтиламина в стандартных условиях с последующими восстановлением нитрогруппы путем гидрогенолиза с использованием палладия на угле в качестве катализатора, метансульфонилированием с использованием метансульфонилангидрида в дихлорметане в присутствии триэтиламина, а затем удалением защитной группы Вос в стандартных условиях с получением соединения формулы VII
которое затем подвергают алкилированию в восстановительных условиях соединением формулы R1-CHO с последующим восстановлением нитрогруппы с использованием водорода и палладия на угле с получением соединения формулы I, где R4 представляет собой -NHSO2R5.
В объем настоящего изобретения также входят отдельные энантиомеры и соли соединений формулы I, включая соли энантиомеров. Соединения формулы I являются хиральными соединениями с диарилметилпиперазиновой группой в качестве хирального центра, смотри формулу I* ниже.
Следующим воплощением настоящего изобретения, таким образом, является (-)-энантиомер соединения формулы I, а также соль указанного соединения.
Еще одним воплощением настоящего изобретения, таким образом, является (+)-энантиомер соединения формулы I, а также соль указанного соединения.
ПРИМЕРЫ
Далее изобретение будет описано более подробно с помощью следующих Примеров, которые не следует рассматривать как ограничивающие изобретение.
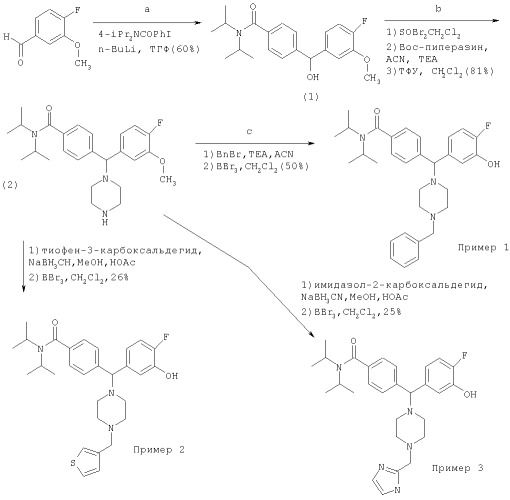
Схема 1: Получение фторфенолов. Примеры 1-3
Промежуточное соединение 1: 4-[(4-Фтор-3-метоксифенил)(гидрокси)-метил]-N,N-диизопропил-бензамид
N,N-Диизопропил-4-йодбензамид (6,0 г, 18 ммоль) растворяли в ТГФ (200 мл) и охлаждали до -78°С в атмосфере азота. N-BuLi (14 мл, 1,3 М раствор в гексане, 18 ммоль) добавляли по каплям в течение 10 мин при температуре от -65°С до -78°С. Добавляли по каплям 4-фтор-3-метоксибензальдегид (2,8 г, 18 ммоль), растворенный в ТГФ (5 мл). Через 30 мин добавляли NH4Cl (водн.). Остаток после концентрирования в вакууме, экстракции EtOAc/водой, высушивания (MgSO4) и упаривания органической фазы очищали хроматографией на диоксиде кремния (0-75% EtOAc/гептан) с получением желаемого продукта (3,9 г, 60%). 1Н ЯМР (CDCl3) δ 1.0-1.6 (m, 12H), 2.65 (d, J=4 Гц, 1H), 3.4-3.9 (m, 2H), 3.80 (s, 3Н), 6.10 (d, J=4 Гц, 1H), 6.76 (m, 1H), 6.95 (m, 1H), 7.04 (m, 1H), 6.76 (m, 1H), 7.25, 7.40 (2d, J=7.5 Гц, 4Н).
Промежуточное соединение 2: 4-Г(4-Фтор-3-метоксифенил)(1-пиперазинил)метил]-N,N-диизопропил-бензамид.
Промежуточное соединение 1 (3,9 г, 11 ммоль) растворяли в безводном СН2Cl2 (50 мл) и обрабатывали SOBr2 (0,88 мл, 11 ммоль) при температуре от 0 до 25°С в течение 30 мин. После нейтрализации КНСО4 (водн.) и высушивания (К2CO4) органической фазы растворитель выпаривали в вакууме. Остаток и Et3N (1,8 мл, 13 ммоль) растворяли в MeCN (50 мл) и перемешивали с Вос-пиперазином (2,1 г, 11 ммоль) при 25°С в течение 12 ч. После концентрирования в вакууме и хроматографии на диоксиде кремния (от 0 до 50% EtOAc в гептане) получили 4,6 г. 1,6 г обрабатывали ТФУ в СН2Cl2 (1:1), концентрировали в вакууме, экстрагировали СН2Cl2/K2CO4 (водн.), высушивали (K2CO4) и упаривали в вакууме с получением промежуточного соединения 2 (1,3 г, 81% от промежуточного соединения 1). МС (ЭР; электрораспыление) 428,21 (МН+).
Пример 1: 4-[1-(4-Бензил-пиперазин-1-ил)-1-(4-фтор-3-гидрокси-фенил)-метил]-N,N-диизопропил-бензамид
Промежуточное соединение 2 (0,41 г, 0,96 ммоль) и триэтиламин (0,20 мл, 1,4 ммоль) растворяли в MeCN (10 мл). Бензилбромид (0,14 мл, 1,1 ммоль) добавляли при перемешивании при 25°С. Через 12 ч этот раствор концентрировали и очищали хроматографией с обращенной фазой (LiChroprep RP-18, 10-80% MeCN в воде, 0,1% ТФУ). Получили 0,53 г свободного основания после экстракции СН2Cl2/K2CO4 (водн.), высушивания (K2CO4) и упаривания в вакууме. После обработки трибромидом бора (4 экв., 1 М раствор в СН2Cl2) в СН2Cl2 при -78°С, добавления воды, концентрирования в вакууме и хроматографии с обращенной фазой получили соединение Примера 1 в виде трифторацетата (0,35 г, 50%). МС (ЭР) 504.22 (МН+). ИК (NaCl) 3222, 1677, 1592, 1454, 1346, 1201, 1135 (см-1). 1Н ЯМР (CD3OD) δ=1.1, 1.5 (m, 12H), 2.3 (m, 3Н), 2.9-3.8 (m, 7H), 4.33 (s, 2H), 4.75 (s, 1H), 6.60 (m, 1H), 6.83 (m, 1H), 6.94 (m, 1Н), 7.24 (d, J=8 Гц, 2Н), 7.47 (m, 7H). Аналитически вычислено для C31H38FN3O2×0,8С4Н2F6O4 С: 59,87, Н: 5,82, N: 6,12. Обнаружено: С: 60,06, Н: 5,83, N: 6,19.
Пример 2: 4-[1-(4-Фтор-3-гидрокси-фенил)-1-(4-тиофен-3-илметил-пиперазин-1-ил)-метил]-N,N-диизопропил-бензамид
Промежуточное соединение 2 (0,43 г, 1,0 ммоль) растворяли в МеОН (5 мл) с 3-тиофен-карбоксальдегидом (0,11 мл, 1,2 ммоль) и НОАс (57 мкл, 1,0 ммоль) и перемешивали в течение 1 ч. Цианоборгидрид натрия (63 мг, 1,0 ммоль) добавляли порциями в течение 6 ч, и эту реакционную смесь перемешивали при 25°С в течение дополнительных 12 ч, после чего подвергали обработке концентрированием в вакууме и экстракцией (СН2Cl2/K2CO4 (водн.)). После очистки хроматографией с обращенной фазой, как для Примера 1, получили 0,32 г (0,62 ммоль) в виде свободного основания. После обработки трибромидом бора, как для Примера 1, и хроматографии получили соединение Примера 2 (0,20 г, 26%) в виде трифторацетата. МС (ЭР) 510,17 (МН+). ИК (NaCl) 3281, 1674, 1606, 1454, 1346, 1200, 1135 (см-1). 1Н ЯМР (CD3OD) δ=1.1, 1.5 (m, 12H), 2.30 (m, 2Н), 2.9-3.7 (m, 10H), 4.37 (s, 2H), 4.75 (s, 1Н), 6.60 (m, 1Н), 6.84 (m, 1Н), 6.94 (m, 1Н), 7.18 (m, 1H), 7.25, 7.48 (2d, J=8 Гц, 4Н), 7.55 (m, 1Н), 7.65 (m, 1Н). Аналитически вычислено для С29Н36FN3O2S×0,8С4Н2F6O4 С: 55,16, Н: 5,55, N: 5,99. Обнаружено: С: 55,12, Н: 5.39, N: 6.07.
Пример 3: 4-{1-(4-Фтор-3-гидрокси-фенил)-1-[4-(1Н-имидазол-2-илметил)-пиперазин-1-ил]-метил}-N,N-диизопропил-бензамид
Используя такую же методику, как для Примера 2, для взаимодействия с 2-имидазол-карбоксальдегидом (0,10 г, 1,1 ммоль) с последующей обработкой трибромидом бора (6 экв.) получили соединение Примера 3 (0,18 г, 25%) в виде трифторацетата. МС (ЭР) 494,23 (МН+). ИК (NaCl) 3123, 1673, 1592, 1454, 1350, 1201, 1135 (см-1). 1Н ЯМР (CD3OD) δ=1.1, 1.5 (m, 12H), 2.7-3.8 (m, 10Н), 3.95 (s, 2Н), 5.20 (m, 1Н), 6.70 (m, 1Н), 6.94 (m, 1Н), 7.02 (m, 1Н), 7.32, 7.58 (2d, J=8.0 Гц, 4Н), 7.46 (s, 1Н). Аналитически вычислено для С28Н36FN5O2×1,2С4Н2F6O4×0,7Н2O С: 50,51, Н: 5,14, N: 8,98. Обнаружено: С: 50,44, Н: 5,18, N: 9,11.
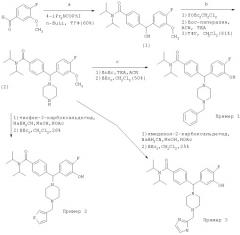
Схема 2: Получение анилинов. Примеры 4-6
Промежуточное соединение 3: 4-[Гидрокси(3-нитрофенил)метил]-N,N-диизопропил-бензамид
Методика как для промежуточного соединения 1, но после добавления n-BuLi раствор канюлировали в раствор 3-нитробензальдегида (2,7 г, 18 ммоль) в толуоле/ТГФ (примерно 1:1, 100 мл) при -78°С. Обработкой и хроматографией получили промежуточное соединение 3 (2,4 г, 37%). 1Н ЯМР (CDCl3) δ 1.1-1.7 (m, 12Н), 3.90 (d, J=3.5 Гц, 1H), 3.4-3.9 (m, 2H), 5.91 (s, J=3.5 Гц, 1Н), 7.27, 7.35 (2d, J=8 Гц, 4Н), 7.51 (m, 1H), 7.71 (m, 1H), 8.13 (m, 1H), 8.30 (s, 1H).
Промежуточное соединение 4: N,N-Диизопропил-4-[(3-нитрофенил)(1-пиперазинил)метил]бензамид
Используя такую же методику, как для промежуточного соединения 2, из промежуточного соединения 3 (2.4 г, 6,7 ммоль) получили Вос-защищенное промежуточное соединение 4 (2,83 г, 81%). В результате обработки ТФУ количественно получили промежуточное соединение 4, МС (ЭР) 425,23 (МН+).
Пример 4: 441-(3-Амино-фенил)-1-(4-бензил-пиперазин-1-ил)-метил]-N,N-диизопропил-бензамид
После реакции 7 (0,40 г, 0,94 ммоль) с бензилбромидом, как для Примера 1, осуществляли гидрирование (H2, 40 фунт/кв. дюйм (275,79 кПа)) с 10% Pd/C (50 мг) в EtOH (25 мл) и 2 н. HCl (1,2 мл, 2,4 ммоль) в течение 2 ч. Очисткой хроматографией с обращенной фазой, используя такие же условия, как для Примера 1, получили соединение Примера 4 (0,20 г, 30%) в виде трифторацетата. МС (ЭР) 485.40 (МН+). ИК (NaO) 3414, 1673, 1605, 1455, 1345, 1201, 1134 (см-1). 1Н ЯМР (CD3OD) δ=1.1, 1.5 (m, 12H), 2.3 (m, 2H), 2.9-3.8 (m, 8H). 4.31 (s, 2H), 4.47 (s, 1H), 7.02 (m, 1H), 7.21-7.52 (m, 12H). Аналитически вычислено для C31H40N4O×1,2C4H2F6O4×0,5Н2O С: 56,04, Н: 5,70, N: 7,30. Обнаружено: С: 56,06, Н: 5,67, N: 7,41.
Пример 5: 4-[1-(3-Амино-фенил)-1-(4-тиофен-3-илметил-пиперазин-1-ил)-метил]-N,N-диизопропил-бензамид
После реакции промежуточного соединения 4 (0,40 г, 0,94 ммоль) с 3-тиофен-карбоксальдегидом, как для Примера 2, осуществляли гидрирование (Н2, 30 фунт/кв. дюйм (206.84 кПа)) с 10% Pd/C (50 мг) в EtOH (25 мл) и 2 н. HCl (1,0 мл, 2,0 ммоль) в течение 12 ч. Очисткой хроматографией с обращенной фазой, используя такие же условия, как для Примера 1, получили соединение Примера 5 (0,13 г, 20%) в виде дитрифторацетата. МС (ЭР) 491,28 (МН+). ИК (NaCl) 3408, 1673, 1605, 1455, 1345, 1201, 1134 (см-1). 1Н ЯМР (CD3OD) δ=1.1, 1.5 (m, 12H), 2.3 (m, 2H), 2.9-3.8 (m, 8H), 4.35 (s, 2H), 4.44 (s, 1H), 6.98 (m, 1H), 7.16-7.32 (m. 6H), 7.49 (d, J=8 Гц, 2H), 7.55 (m, 1H), 7.64 (m, 1H). Аналитически вычислено для C29H38N4OS×1,3С4Н2F6O4×0,6Н2O С: 51,48, Н: 5,28, N: 7,02. Обнаружено: С: 51,51, Н: 5,20, N: 7,01.
Пример 6, 4-{1-(3-Амино-фенил)-1-[4-(1Н-имидазол-2-илметил)-пиперазин-1-ил]-метил}-N,N-диизопропил-бензамид
Используя такую же методику, как для Примера 2, путем осуществления взаимодействия промежуточного соединения 4 с 2-имидазол-карбоксальдегидом (0,10 г, 1,1 ммоль) с последующим гидрированием получили соединение Примера 6 (45 мг, 7%) в виде соли дитрифторацетата. МС (ЭР) 475,30 (МН+). ПК (2хТФУ, NaCl) 3351, 1674, 1621, 1455, 1349, 1202, 1134 (см-1). 1Н ЯМР (2хТФУ, CD3OD) δ=1.1, 1.5 (m, 12H), 2.9-3.8 (m, 8H), 4.35 (s, 2H), 4.44 (s, 1H), 6.98 (m, 1H), 7.16-7.32 (m, 6H), 7.49 (d, J=8 Гц, 2H), 7.55 (m, 1H), 7.64 (m, 1H). Аналитически вычислено для C28H38N6O×1,6С4Н2F6O4×0,8Н2O С: 48,39, Н: 5,05, N: 9,84. Обнаружено: С: 48,43, Н: 5,06, N: 9,85.
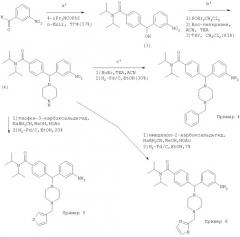
Схема 3: Получение метилсульфонанилидов. Примеры 7-8
Промежуточное соединение 5: N,N-Диизопропил-4-[{3-[(метилсульфонил)-амино]фенил}(1-пиперазинил)метил]бензамид
Из промежуточного соединения 3 получили Вос-защищенное промежуточное соединение 4, как описано выше для промежуточного соединения 4. Вос-защищенное промежуточное соединение 4 (1,21 г, 2,3 ммоль) гидрировали в атмосфере H2 при 30 фунт/кв. дюйм (206,84 кПа) с 10% Pd/C (150 мг) в АсОН (25 мл) в течение 12 ч. После упаривания в вакууме и экстракции CH2Cl2/K2CO4 (водн.) получили 1,1 г (2,3 ммоль) промежуточного анилина, который растворяли в MeCN/CH2Cl2 (1:1, 10 мл). Et3N (0,48 мл, 3,4 ммоль), затем метансульфонилангидрид (0,41 г, 2,4 ммоль) добавляли при 0°С. После нагревания до комнатной температуры эту реакционную смесь обрабатывали экстракцией CH2Cl2/рассол. Очисткой хроматографией на диоксиде кремния (0-5% MeOH/CH2Cl2) получили Вос-защищенное промежуточное соединение 5 (1,3 г, 97%). Обработкой ТФУ в CH2Cl2 количественно получили промежуточное соединение 5. МС (ЭР) 473,16 (МН+).
Пример 7: N,N-Диизопропил-4-[1-(3-метансульфониламино-фенил)-1-(4-тиофен-3-илметил-пиперазин-1-ил)-метил]-бензамид
Методикой восстановительного аминирования, как для Примера 2, из промежуточного соединения 5 (0,20 г, 0,43 ммоль) получили соединение Примера 7 (90 мг, 26%) в виде соли дитрифторацетата. Соль дигидрохлорид получили после экстракции свободного основания CH2Cl2/KzCO4 (водн.) и обработки 2 экв. HCl (водн.). МС (ЭР) 569,21 (МН+). ПК (свободное основание, NaCl) 1604, 1455, 1340, 1151 (см-1). 1Н ЯМР (свободное основание. CDCl3) δ=0.9-1.7 (m, 12Н), 2.5 (m, 8H), 2.85 (s, 3Н), 3.55 (s, 2H), 3.8 (m, 2H), 4.22 (s, 1H), 7.00-7.40 (m, 12Н). Аналитически вычислено для C30H40N4O3S2×2,6 HCl С: 54,30, Н: 6,47, N: 8.44. Обнаружено: С: 54,33, Н: 6,20, N: 8,32.
Пример 8: 4-([4-(3-Фурилметил)-1-пиперазинил]{3-[(метилсульфонил)-амино]фенил}-N,N-диизопропил-бензамид
Используя такую же методику, как для промежуточного соединения 7, из промежуточного соединения 5 (0,21 г, 0,45 ммоль) получили соединение Примера 8 (80 мг, 32%) в виде свободного основания. МС (ЭР) 553,23 (МН+). ИК (свободное основание, NaCl) 1604, 1455, 1340, 1151 (см-1). 1Н ЯМР (свободное основание, CDCl3) δ=1.0-2.6 (m, 20H), 2.91 (s, 3Н), 3.40 (s, 2H), 4.22 (s, 1Н), 6.39 (s, 1H), 7.06-7.42 (m, 11H). Аналитически вычислено для C30H40N4O4S×2,8HCl С: 55,03, Н: 6,59, N: 8,56. Обнаружено: С: 54.93, Н; 5,93, N: 8,49.
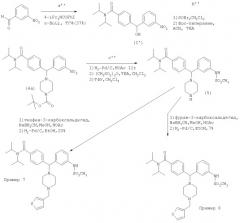
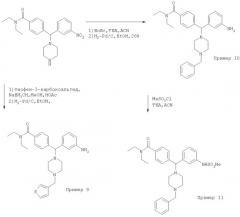
Схема 4: Получение соединений Примеров 9-11
Пример 9: 4-{(3-Аминофенил)[4-(3-тиенилметил)-1-пиперазинил]метил}-N,N-диэтилбензамид. N,N-Диэтил-4-{(3-нитрофенил)(1-пиперазинил)метил]бензамид (получен аналогично промежуточному соединению (4) на Схеме 2) (0,85 г, 2,1 ммоль) растворяли в MeOH (5 мл) с 3-тиофенкарбоксальдегидом (0,40 мл, 4,3 ммоль) и HOAc (60 мкл, 1,0 ммоль) и перемешивали в течение 1 ч. Цианоборгидрид натрия (135 мг, 2,1 ммоль) добавляли порциями в течение 6 ч, и эту реакционную смесь перемешивали при 25°С в течение дополнительных 12 ч, после чего подвергали обработке концентрированием в вакууме и экстракцией (СН2Cl2/K2CO4 (водн.)). После очистки хроматографией на диоксиде кремния получили 3-тиенилметильное производное (0,45 г, 43%). После гидрирования этого продукта (0,30 г, 0,61 ммоль) и хроматографии с обращенной фазой получили соединение, указанное в заголовке (0,17 г, 35%) в виде трис-трифторацетата. МС (ЭР) 463,34 (МН+). ИК (NaCl) 3418, 1673, 1600, 1461, 1200, 1135 (см-1). 1Н ЯМР (CD3OD) δ=1.17, 1.31 (m, 6H), 2.45 (m, 2H), 3.11 (m, 2H), 3.24-3.66 (m, 10Н), 4.47 (s, 2H), 4.62 (s, 1H), 7.21 (m, 1H), 7.31 (m, 1H), 7.39-7.56 (m, 5H), 7.61-7.68 (m, 3H), 7.77 (m, 1H).
Пример 10: 4-[(3-Аминофенил)(4-бензил-1-пиперазинил)метил]-N,N-диэтилбензамид.
N,N-Диэтил-4-[(3-нитрофенил)(1-пиперазинил)метил]-бензамид (1,7 г, 4,3 ммоль) и триэтиламин (1,2 мл, 8,6 ммоль) растворяли в MeCN (10 мл). Бензилбромид (0,56 мл, 4,7 ммоль) добавляли при перемешивании при 25°С. Через 12 ч этот раствор концентрировали в вакууме. После экстракции (СН2Cl2/K2CO4 (водн.)) и очистки хроматографией на диоксиде кремния получили бензилированный продукт (1,4 г, 2,9 ммоль). После гидрирования (Н2, 40 фунт/кв. дюйм (275,79 кПа)) с 10% Pd/C (100 мг) в EtOH (25 мл) и 2 н. HCl (2,5 мл, 5 ммоль) в течение 4 ч с последующими концентрированием в вакууме и хроматографией с обращенной фазой получили соединение, указанное в заголовке, в виде трис-трифторацетата (0,9 г, 26%). МС (ЭР) 457,26 (МН+). ИК (NaCl) 3422, 1672, 1603, 1458, 1209, 1133 (см-1). 1Н ЯМР (CD3OD) δ=1.1, 1.2 (m, 6H), 2.3 (m, 2H), 2.9-3.6 (m, 10Н), 4.33 (s, 2H), 4.49 (s, 1H), 5.48 (s, 2H), 7.01 (m, 1H), 7.24-7.34 (m, 5H), 7.47 (m, 5H), 7.52 (d, J=7.5 Гц, 2Н).
Пример 11: 4-((4-Бензил-1-пиперазинил){3-[(метилсульфонил)амино1-фенил}метил)-N,N-диэтилбензамид. Продукт Примера 10 (0,35 г, 0,76 ммоль) и триэтиламин (0,12 мл, 0,84 ммоль) растворяли в MeCN (10 мл) и добавляли метансульфоновый ангидрид (0,14 г, 0,84 ммоль) при 0°С. После перемешивания в течение 10 мин при 25°С этот раствор концентрировали в вакууме и очищали хроматографией с обращенной фазой с получением соединения, указанного в заголовке, в виде бис-трифторацетата (0,23 г, 40%). МС (ЭР) 535,21 (МН+). ИК(NaCl) 3479, 1673, 1604, 1458, 1337, 1200, 1150 (см-1). 1Н ЯМР (CD3OD) δ=1.18, 1.31 (m, 6H), 2.41 (m, 2H), 2.98 (s, 3H), 3.13 (m, 2H), 3.28-3.65 (m, 8H), 4.44 (s, 2H), 4.57 (s, 1H), 5.57 (d, J=2 Гц, 2H), 7.15 (m, 1H), 7.30 (m, 1H), 7.37 (m, 1H), 7.42 (m, 2H), 7.54-7.60 (m, 6H), 7.63 (m, 2H).
Фармацевтические композиции
Новые соединения согласно настоящему изобретению можно вводить перорально, внутримышечно, подкожно, местным путем, интраназально, внутрибрюшинно, интраторакально, внутривенно, эпидурально, внутриоболочечно, интрацеребровентрикулярно и путем инъекции в суставы.
Предпочтительным путем введения является пероральный, внутривенный или внутримышечный.
Дозировка будет зависеть от пути введения, тяжести заболевания, возраста и массы пациента и других факторов, обычно учитываемых лечащим врачом при определении индивидуального режима и уровня дозировки как наиболее подходящих для конкретного пациента.
Для изготовления фармацевтических композиций из соединений по данному изобретению инертные фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Препараты твердых форм включают в себя порошки, таблетки, диспергируемые гранулы, капсулы, крахмальные капсулы и суппозитории.
Твердым носителем может быть одно или более чем одно из веществ, которые могут также действовать в качестве разбавителей, корригирующих агентов, солюбилизирующих агентов, смазывающих агентов, суспендирующих агентов, связывающих агентов или разрыхляющих агентов для таблеток; он также может быть инкапсулирующим материалом.
В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным активным компонентом. В таблетках активный компонент смешан с носителем, обладающим необходимыми связывающими свойствами в подходящих пропорциях, и спрессован в желаемую форму желаемого размера.
Для изготовления композиций в виде суппозиториев сначала плавят легкоплавкий воск, такой как смесь глицеридов жирных кислот и масла какао, и активный ингредиент диспергируют в нем, например, путем перемешивания. Затем эту расплавленную однородную смесь заливают в формы удобного размера и оставляют охлаждаться и затвердевать.
Подходящими носителями являются карбонат магния, стеарат магния, тальк, лактоза, сахар, пектин, декстрин, крахмал, трагакант, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, легкоплавкий воск, масло какао и тому подобное.
Соли включают в себя, но не ограничены ими, фармацевтически приемлемые соли. Примеры фармацевтически приемлемых солей в пределах объема настоящего изобретения включают в себя: ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, бромид, ацетат кальция, камсилат, карбонат, хлорид, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эзилат, фумарат, глюкаптат, глюконат, глутамат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, изетионат, лактат, лактобионат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, памоат (эмбонат), пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, сульфат, таннат, тартрат, теоклат, триэтиодид, соли бензатина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглумина, прокаина, соли алюминия, кальция, лития, магния, калия, натрия и цинка. Примеры фармацевтически неприемлемых солей в пределах объема настоящего изобретения включают в себя: гидройодид, перхлорат и тетрафторборат. Фармацевтически неприемлемые соли можно использовать в связи с их преимущественными физическими и/или химическими свойствами, такими как кристалличность.
Предпочтительными фармацевтически приемлемыми солями являются гидрохлориды, сульфаты и битартраты. Особенно предпочтительны соли гидрохлориды и сульфаты.
В термин «композициям следует включать препарат активного компонента с инкапсулирующим материалом в качестве носителя, образующим капсулу, в которой активный компонент (с другими носителями или без них) окружен носителем, который, таким образом, ассоциирован с ним. Подобным образом включены крахмальные капсулы.
Таблетки, порошки, крахмальные капсулы и капсулы можно применять в качестве твердых лекарственных форм, подходящих для перорального введения.
Композиции в виде жидких форм включают в себя растворы, суспензии и эмульсии. Растворы активных соединений в стерильной воде или в воде-пропиленгликоле можно упомянуть в качестве примера жидких препаратов, подходящих для парентерального введения. Жидкие композиции можно также изготавливать в виде раствора препарата в растворе водного полиэтиленгликоля.
Водные растворы для перорального введения можно изготавливать путем растворения активного компонента в воде и добавления подходящих красителей, корригентов, стабилизаторов и загущающих агентов по желанию. Водные суспензии для перорального применения можно изготавливать путем диспергирования тонко измельченного активного компонента в воде вместе с вязким материалом, таким как природные и синтетические смолы, камеди, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и другие суспендирующие агенты, известные в области фармацевтических препаратов.
Предпочтительно фармацевтические композиции находятся в стандартной лекарственной форме. В такой форме композиция разделена на стандартные дозы, содержащие подходящие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, причем упаковка содержит дискретные количества препаратов, например упакованных таблеток, капсул и порошков во флаконах или в ампулах. Стандартная лекарственная форма может также представлять собой капсулу, крахмальную капсулу или таблетку саму по себе, либо может представлять собой подходящее количество любых из этих упакованных форм.
БИОЛОГИЧЕСКАЯ ОЦЕНКА
Модель in vitro
Культура клеток
А. Клетки человека 293S, экспрессирующие клонированные μ-, δ- и к-рецепторы человека и устойчивость к неомицину, выращивали в суспензии при 37°С и 5% CO2 в качалочных колбах, содержащих свободную от кальция модифицированную Дульбекко среду Игла (DMEM), 10% FBS, 5% BCS, 0,1% плюроник (Pluronic) F-68 и 600 мкг/мл генетицина.
Б. Головной мозг мышей и крыс взвешивали и промывали в охлажденном на льду фосфатно-буферном растворе (PBS) (содержащем 2,5 мМ ЭДТА, рН 7,4). Мозги гомогенизировали гомогенизатором Polytron в течение 15 с (мышь) или 30 с (крыса) в охлажденном на льду буфере (50 мМ Трис, рН 7,0, 2,5 мМ ЭДТА с фенилметилсульфонилфторидом, добавленным непосредственно перед использованием до 0,5 мМ из 0,5 М исходного раствора в смеси ДМСО : этанол).
Препарат мембран
Клетки осаждали и ресуспендировали в буфере для лизиса (50 мМ Трис, рН 7,0, 2,5 мМ ЭДТА с фенилметилсульфонилфторидом (PMSF), добавленным непосредственно перед использованием до 0,1 мМ из 0,1 М исходного раствора в этаноле), инкубировали на льду в течение 15 мин, затем гомогенизировали, используя Potytron, в течение 30 с. Суспензию центрифугировали при 1000 g (максимум) в течение 10 мин при 4°С. Супернатант хранили на льду, а осадки ресуспендировали и центрифугировали, как описано выше. Супернатанты от обоих центрифугирований объединяли и центрифугировали при 46000 g (максимум) в течение 30 мин. Осадки ресуспендировали в холодном Трис-буфере (50 мМ Трис/Cl, рН 7,0) и снова центрифугировали. Конечные осадки ресуспендировали в буфере для мембран (50 мМ Трис, 0,32 М сахароза, рН 7,0). Аликвоты (1 мл) в полипропиленовых пробирках замораживали в сухом льду/этаноле и хранили при -70°С до использования. Концентрации белка определяли модифицированным анализом по Лоури с додецилсульфатом натрия (SDS).
Анализы связывания
Мембраны подвергали оттаиванию при 37°С, охлаждали на льду, пропускали 3 раза через иглу 25 размера и разбавляли в связывающем буфере (50 мМ Трис, 3 мМ MgCl2, 1 мг/мл бычьего сывороточного альбумина (BSA) (Sigma A-7888), рН 7,4, который хранили при 4°С после фильтрования через 0,22 м фильтр, и к которому были добавлены свежеприготовленные 5 мкг/мл апротинина, 10 мкМ бестатина, 10 мкМ дипротина А (без DTT). Аликвоты по 100 мкл добавляли в охлажденные на льду полипропиленовые пробирки 12×75 мм, содержащие 100 мкл соответствующего радиоактивного лиганда и 100 мкл тестируемого соединения в различных концентрациях. Общее (ОС) и неспецифическое (НС) связывание определяли в отсутствие и в присутствии 10 мкМ налоксона соответственно. Пробирки встряхивали и инкубировали при 25°С в течение 60-75 мин, и через это время содержимое быстро фильтровали в вакууме и промывали примерно 12 мл/пробирку охлажденного на льду буфера для отмывки (50 мМ Трис, рН 7,0, 3 мМ MgCl2) через фильтры GF/B (Whatman), предварительно замоченные в течение по меньшей мере 2 ч