Способ получения ингибиторов hmg-coa редуктазы
Иллюстрации
Показать всеИзобретение относится к способу получения энантиомерно чистых ингибиторов HMG-CoA редуктазы. Описывается способ получения соединения формулы
или его соли, особенно фармацевтически приемлемой соли с основанием, или его лактона, где элемент представляет собой -СН2-СН2- или -СН=СН- и R представляет собой циклический остаток. Технический результат: обеспечение энантиоселективного синтеза соединений формулы (I), с высокими выходами, уменьшение экологического загрязнения окружающей среды, возможность крупномаштабного производства. 4 з.п. ф-лы.
Реферат
Изобретение относится к способу получения энантиомерно чистых ингибиторов HMG-CoA редуктазы, стадиям способа и к новым промежуточным соединениям.
Ингибиторы HMG-CoA редуктазы (также называемые ингибиторами β-гидрокси-β-метилглутарил-коэнзим-А редуктазы и также называемые статинами) являются активными агентами, которые могут предпочтительно использоваться для понижения в крови уровня липидов, включая холестерин, и могут использоваться, например, для профилактики или лечения гиперлипидемии и атеросклероза.
Класс ингибиторов HMG-Co-редуктазы включает соединения, имеющие различные структуры. Например, могут быть упомянуты соединения, выбранные из группы, состоящей из аторвастатина, церивастатина, флувастатина, ловастатина, питавастатина (ранее итавастатин), правастатина, росувастатина и симвастатина или, в каждом случае, из их фармацевтически приемлемых солей.
Предпочтительными ингибиторами HMG-Co-редуктазы являются агенты, которые присутствуют на рынке, наиболее предпочтительными являются флувастатин, аторвастатин, питавастатин, особенно его кальциевая соль, или симвастатин или его фармацевтически приемлемая соль.
Аторвастатин формулы
описан и заявлен в US 5273995.
Церивастатин формулы
описан и заявлен в US 5177080.
Рацемический флувастатин с син-конфигурацией гидроксигрупп в формуле
описан и заявлен в US 5345772.
Ловастатин формулы
описан и заявлен в US 4231938.
Питавастатин формулы
описан и заявлен в US 5856336.
Правастатин формулы
описан и заявлен в US 4410629.
Росувастатин формулы
описан и заявлен в US 5260440.
Симвастатин формулы
описан и заявлен в US 4444784.
Структуры активных агентов, определенные выше или далее по их названиям генериков или товарных знаков, могут быть обнаружены в текущем издании стандартного сборника "The Merck Index" или из баз данных, например, Patents International или LifeCycle Patents International, соответственно (например, IMS World Publications). Их соответствующее содержание, таким образом, включено в качестве ссылки. Любой специалист в данной области техники может полностью идентифицировать активные агенты и, основываясь на этих ссылках, аналогично может получить и протестировать фармацевтические показания и свойства на стандартных испытательных моделях in vitro и in vivo.
Кислотные представители ингибиторов HMG-Co-редуктазы разрабатываются в виде солей, например, флувастатин в виде натриевой соли и питавастатин в виде кальциевой соли.
Соответствующие активные ингредиенты или их фармацевтически приемлемые соли могут также использоваться в форме сольвата, такого как гидрат, или включая другие растворители, используемые для кристаллизации.
По существу, статины включают циклический основной элемент и элемент боковой цепи формулы
(группа 3,5-дигидроксигепт-6-еновой кислоты), который может образовывать 5 соответствующую группу лактона структурной формулы
или
или
(производное 3,5-дигидроксигептановой кислоты), которая может образовывать соответствующую группу лактона структурной формулы .
В указанных элементах боковой цепи (IIa) или (IIв), соответственно, 3,5-син структура диола и R-конфигурация в С-3 являются существенными особенностями, так как соответствующие статины с этим конкретным элементом проявляют самую высокую биологическую активность.
Цель настоящего изобретения состоит в обеспечении энантиоселективного синтеза соединений формулы (I) с высокими выходами и, кроме того, с гарантированным уменьшением экологического загрязнения окружающей среды, что является экономически выгодным, например, благодаря меньшему количеству стадий реакции в последовательности реакции получения соединений формулы I, и приводящим в значительной степени к энантиомерно чистым целевым продуктам и к хорошо кристаллизуемым продуктам. Кроме того, другая цель настоящего изобретения состоит в обеспечении способа, который может быть осуществлен в крупном масштабе и может таким образом использоваться для соответствующего способа производства. Кроме того, существует потребность в устранении любого разделения и расщепления стереоизомеров.
Неожиданно было обнаружено, что способ настоящего изобретения достигает вышеупомянутые цели. Способ относится к энантиоселективному синтезу, использующему по существу так называемую конденсацию Виттига-Водсворта-Эммонса (Виттига-Хорнера) или Виттига посредством химической десимметризации. Например, может быть достигнут энантиомерный избыток (ее) соединения формулы (I) или его соли ≥95%, предпочтительно ≥98% и наиболее предпочтительно ≥99%. Кроме того, может быть легко получен ее ≥99,5%. Кроме того, в соответствии с настоящим изобретением может быть легко достигнут диастереомерный избыток (de)≥95%, предпочтительно ≥98% и наиболее предпочтительно ≥99% для соединения формулы (I) или его соли, полученных в соответствии с настоящим изобретением.
Изобретение относится к способу получения энантиомерно чистой формы ингибитора HMG-CoA редуктазы производного мевалоновой кислоты формулы (I)
или соли, особенно его фармацевтически приемлемой соли с основанием или его лактона, где
элемент представляет собой -СН2-СН2- или -СН=СН-, и R представляет собой циклический остаток.
Солью соединения формулы (I) является, например, соль с основанием, предпочтительно, его соответствующая фармацевтически приемлемая соль.
Лактон соединения формулы (I) представлен формулой (Ia)
или
Соответствующий циклический остаток R включает циклический остаток, выбранный из группы, состоящей из
; ;
;
; ;
; ;
.
Многочисленные экспериментальные испытания неожиданно привели к последовательности способа получения, который отвечает вышеупомянутым критериям, проявляя указанные преимущества.
По сравнению со способом, раскрытым в J.Org. Chem. 1991, 56, 3744-3747, было неожиданно обнаружено, что способ в соответствии с настоящим изобретением может быть упрощен, опуская (i) стадию окисления с N2O4 для получения соответствующего N-нитрозамина, (и) гидролиз для получения свободной кислоты и (iii) метилирование для получения метилового эфира.
Было доказано, что последовательность реакции в соответствии с настоящим изобретением, особенно при использовании соответствующего исходного материала и промежуточных соединений, имеющих амидную группу, когда амидный элемент представлен формулой
, особенно
например, вместо применения соответствующего эфира, имеющего спиртовой элемент формулы
приводит к вышеупомянутым преимуществам.
Кроме того, в недавней публикации [Bioorg. Med. Chem. Lett. 9 (1999) 2977-2982)] был раскрыт улучшенный способ получения питавастатина путем постадийного образования боковой цепи формулы (IIa), что приводит к образованию смеси диастереомеров, которые нужно разделять. Следовательно, одна половина диастереомера не может использоваться. В противоположность указанной процедуре, способ настоящего изобретения явно более экономичный.
Способ получения энантиомерно чистой формы соединения формулы
или его соли в соответствии с настоящим изобретениям характеризуется (а) реакцией соединений (IIIa) или (IIIб)
или
где Х4 и Х5, независимо друг от друга, представляют собой С1-С7-алкил или фенил-С1-С7-алкил;
Х6, Х7 и Х8, независимо друг от друга, представляют собой фенил, который является незамещенным или замещен одним или несколькими заместителями, выбранными из группы, состоящей из С1-С7алкила, гидрокси, С1-С7алкокси, С2-С8алканоилокси, галогена, нитро, циано и CF3; и Hal- представляет собой галогеновый анион;
с металлированным алканом с образованием соответствующего илида и затем реакцией полученного илидного промежуточного соединения с соединением формулы
где
X представляет собой этерифицированный гидрокси, этерифицированный гидрокси или незамещенный или моно- или дизамещенный амино;
X1 представляет собой защищенный гидрокси;
Х2 представляет собой С1-С7алкил и
Х3 представляет собой водород или один или несколько заместителей, например, выбранных из группы, состоящей из С1-С7алкила, гидрокси, С1-С7алкокси, С2-С8алканоилокси, галогена, нитро, циано и CF3;
(б) необязательно, при необходимости, преобразованием полученного соединения формулы (IIIг)
в котором X1, X2 и Х3 имеют вышеупомянутые значения и Y представляет собой группу формулы (Х4O)(Х5O)Р(=O)- или (X6)(X7)(X8)P+Hal- и Х4, Х5, Х6, Х7, X8 и Hal- имеют вышеупомянутые значения;
в соединение формулы (IIIд)
в котором Х2, Х3 и Y имеют вышеупомянутые значения и где Y1 представляет собой гидрокси или защищенный гидрокси, и Y2 представляет собой водород, и Y3 представляет собой гидрокси или защищенный гидрокси, и Y1 и Y3 образуют син-диольную конфигурацию; или в котором
Y1 и Y3 вместе представляют собой -O-Alk-O- и Alk, являющийся C1-С7алкилиденом; и Y2 представляет собой водород, и Y1 и Y3 образуют син-диольную конфигурацию;
(в) реакцией соединения формулы (IIIд),
в которой Х2, Х3 и Y имеют вышеупомянутые значения и в которой
Y1 представляет собой гидрокси или защищенный гидрокси, и Y2 представляет собой водород, и Y3 представляет собой гидрокси или защищенный гидрокси, и Y1 и Y3 образуют син-диольную конфигурацию; или в которой
Y1 и Y3 вместе представляют собой -O-Alk-O- и Alk, являющийся C1-С7алкилиденом; и Y2 представляет собой водород, и Y1 и Y3 образуют син-диольную конфигурацию; или в которой
Y1 и Y3 вместе представляют собой оксогруппу и Y3 представляет собой защищенный гидроксил (соответствующий соединениям формулы (IIг));
с альдегидом формулы (IIIe) R-CH(=O), приводя к получению соединения формулы (IIIж)
в которой R, Х2, Х3, Y1, Y2 и Y3 и элемент имеют вышеупомянутые значения;
при необходимости, восстанавливая соответствующие соединения формулы (IIIж), в которой элемент представляет собой -СН=СН-, с получением соединения, в котором указанный элемент представляет собой -СН2-СН2-; и
(г) если получают соединение формулы (IIIж), в котором один из Y1 и Y3 представляет собой защищенный гидрокси и другой представляет собой гидрокси, или оба Y1 и Y3 представляют собой защищенные гидрокси, и в каждом случае Y2 представляет собой водород; и Y1 и Y3 образуют син-конфигурацию; или
Y1 и Y3 вместе представляют собой -O-Alk-O- и Alk, являющийся C1-С7алкилиденом, и Y1 и Y3 образуют син-конфигурацию; и Y2 представляет собой водород; или
удалением защиты гидроксигруппы(групп) с получением соединения формулы
или
при необходимости, восстановлением соответствующего соединения формулы (IIIз), в котором элемент представляет собой -СН=СН-, с получением соединения, в котором указанный элемент представляет собой -СН2-СН2-;
(д) если получают соединение формулы (IIIж), в котором Y1 и Y2 вместе образуют оксогруппу =O; и Y3 представляет собой защищенный гидрокси (X1); преобразованием указанного соединения формулы (IIIж) в соединение формулы (IIIи)
удалением защитной гидроксигруппы;
в которой R, X2, Х3 и элемент имеют вышеупомянутые значения; и последующим восстановлением указанного соединения формулы (IIIи) в соединение формулы (IIIз);
(е) гидролизом соединения формулы (IIIз) в соединение формулы (I) или его соли и
(ж) выделением полученного соединения формулы (I) или его соли;
и, при необходимости, преобразованием полученной свободной кислоты формулы (I) в его соль или в лактон формулы (Ia) или (Iб), соответственно, или преобразованием полученного лактона формулы (Ia) или (Iб) в кислоту формулы (I) или ее соль.
Наиболее предпочтительно, в соединениях формул (IIIв), (IIIг), (IIIд), (IIIж), (IIIз) и (IIIи), в каждом случае X2 представляет собой метил и Х3 представляет собой водород.
В соответствии с настоящим способом, описанным выше и далее, может быть получен любой из энантиомеров, например, используя соединение формулы (IIIc"") или ее энантиомер для стадии десимметризации. Кроме того, используя рацемическую смесь соединения формулы (IIIc""), могут быть получены рацемические формы упомянутых ингибиторов HMG-CoA редуктазы.
Используемые выше и далее общие термины имеют следующие значения, если не определено иначе.
Этерифицированный гидрокси представляет собой, например, С1-С7алкокси, ар-С1-С7алкокси, С3-С8пиклоалкокси, С3-С8-циклоалкил-С1-С7алкокси.
Этерифицированный гидрокси представляет собой, например, R-CO-O, ароилокси, С2-С8-алканоилокси или ар-С2-С8-алканоилокси.
В моно- или дизамещенном амине аминогруппа является монозамещенной или, независимо друг от друга, дизамещенной заместителем, выбранным из группы, состоящей из С1-С7алкокси, С1-С7алкила, ар-С1-С7алкила, С3-C8-циклоалкила, С3-С8-циклоалкил-С1-С7алкила.
С1-С7Алкокси представляет собой, например, метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси, втор-бутилокси, трет-бутилокси или соответствующий пентилокси, гексилокси, или гептилокси остаток. С1-С4алкокси является предпочтительным. Метокси является особенно предпочтительным.
С1-С7Алкил представляет собой, например, остаток метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила, трет-бутила или соответствующего пентила, гексила или гептила. С1-С4алкил, особенно метил, является предпочтительным.
С3-С8циклоалкокси и С3-С8циклоалкокси в С3-С8циклоалкокси-С1-С7алкиле являются предпочтительно С3-С8циклоалкокси, например, циклопропокси, циклопентокси или циклогексилокси.
С3-С8циклоалкил представляет собой, в частности, С3-С8циклоалкил, такой как циклопропил, циклобутил, циклопентил или циклогексил. Циклопропил является особенно предпочтительным.
С3-С8алканоил в С3-С8алканоилокси представляет собой, в частности, ацетил, пропионил, бутирил, изобутирил или пивалоил. С3-С8алканоил является предпочтительным.
Галоген представляет собой, в частности, галоген с атомным номером включительно до 35, то есть фтор, хлор или бром, и в более широком смысле включают йод. Фтор или хлор являются предпочтительными.
Фенил-С1-С7алкил представляет собой, в частности, фенил-С1-С4алкил, такой как бензил или 1- или 2-фенэтил.
С1-С7Алкилиден представляет собой, в частности, метилен, этилиден, 1,1-или 2,2-пропилиден, а также 1,1- или 2,2-бутилиден или 1,1-, 2,2- или 3,3-пентилиден. С2-С5алкилиден является предпочтительным.
Защищенный гидрокси (Х2 и/или Х4) представляет собой силилокси, этерифицированный гидрокси, тетрагидропиранилокси. Силилокси представляет собой, например, три-С1-С7алкилсилилокси, особенно трет-бутилдиметилсилилокси.
С1-С7Алкилен представляет собой предпочтительно С1-С4алкилен, например, метилен, 1,2-этилен, 1,2- или 1,3-пропилен, а также включает С2-С7алкилиден, предпочтительно С2-С4алкилен, например, 1,1-этилен, 1,1- или 2,2-пропилиден. Наиболее предпочтительным является 2,2-пропилиден.
Арильный остаток (ар) представляет собой предпочтительно карбоциклический арил, такой как фенил, бифенилил или нафтил, или гетероциклический арил, такой как пиридил. Соответственно может быть незамещенным или замещенным одним или несколькими, например, двумя или тремя, остатками, например, выбранными из группы, состоящей из С1-С7алкила, гидрокси, С1-С7алкокси, С2-С8алканоилокси, галогена, нитро, циано и CF3.
Реакции, описанные в вариантах выше и ниже, проводятся, например, в отсутствии или обычно в присутствии подходящего растворителя или разбавителя или их смеси, реакция, при необходимости, проводится с охлаждением, при комнатной температуре или при нагревании, например, в температурном диапазоне от -80°С до температуры кипения реакционной среды, предпочтительно приблизительно от -10° до +200°С, и, при необходимости, в закрытом сосуде, под давлением, в атмосфере инертного газа и/или при безводных условиях.
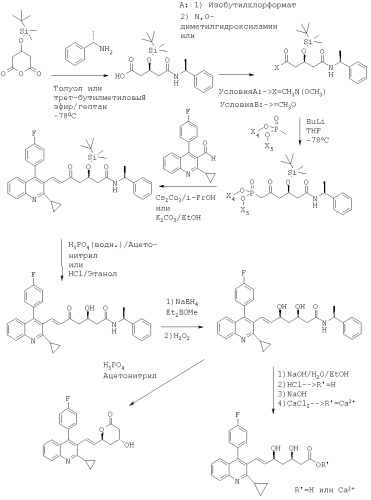
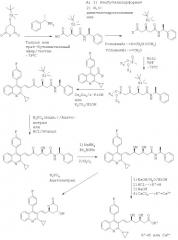
Стадия (а):
В реакции стадии (а) реакцию соединения формулы (IIIa) или (IIIб), соответственно, с металлированным алканом проводят в инертном растворителе, таком как эфир, предпочтительно тетрагидрофуран, и при низких температурах, например, от -78° до 0°С, предпочтительно при -78°С. Последующее добавление соединения формулы (IIIв) производят при тех же условиях реакции, предпочтительно в растворителе тетрагидрофуране и при -78°С.
Предпочтительный Х представляет собой С1-С7алкокси, особенно метокси или этокси, или N-С1-С7алкил-Н-С1-С7алкоксиамино, наиболее предпочтительно N-метил-N-метоксиамино. Соответствующие N-C1-C7алкил-N-C1-С7алкоксиаминопроизводные являются новыми.
Соответственно, настоящее изобретение также относится к соединению формулы (IIIв), в котором Х представляет собой N-C1-C7алкил-N-C1-С7алкоксиамино, наиболее предпочтительно N-метил-N-метоксиамино.
Метилированными алканами являются, например, алканы щелочных металлов, такие как бутиллитий или гексиллитий и т.д. Предпочтительным металлированным алканом является бутиллитий.
Стадия (б)
Х4 и Х5, в каждом случае, предпочтительно представляют собой C1-С7алкил, особенно С1-С4алкил, наиболее предпочтительно метил или этил.
Х6, Х7 и Х8, в каждом случае представляют собой, предпочтительно, фенил.
Галид Hal- является предпочтительно хлоридом, а также бромидом и йодидом.
Предпочтительной является реакция с соединением формулы (IIIa).
Для получения соединения формулы (IIIд), в котором Х2, Х3 и Y имеют вышеупомянутые значения, и в котором Y1 представляет собой гидрокси или защищенный гидрокси, и Y2 представляет собой водород, и Y3 представляет собой гидрокси или защищенный гидрокси, и Y1 и Y3 образуют син-диольную конфигурацию; соответствующее соединение формулы (IIIд), в котором Y1 и Y2 вместе образуют оксогруппу, восстанавливают подходящим восстановительным агентом.
Восстановление осуществляют соответствующим восстановительным агентом, например, каталитическим гидрированием в присутствии катализатора гидрирования, например катализатора рутения, такого как (Ru(cod)(nu-3-(2-метилалли))2, восстановлением гидридом, например гидридом, который, при необходимости, может быть комплексным, таким как гидрид, образованный из элемента 1-ой и 3-ей основной группы периодической таблицы элементов, например, боргидрид или алюмогидрид, например, литийборгидрид, литийалюмогидрид, диизобутилалюмогидрид (может быть необходима дополнительная стадия восстановления, используя цианоборгидрид щелочного металла, такой как цианоборгидрид натрия), а также биборан.
Предпочтительным восстановительным агентом является, например, гидрид, например боргидрид щелочного металла, особенно натрий боргидрид, предпочтительно в присутствии ди-С1-С7алкил-С1-С7алкоксиборана, наиболее предпочтительно диэтилметоксиборана.
Восстановление осуществляют в инертном растворителе, таком как эфир, предпочтительно тетрагидрофуран, и при низких температурах, например от -78° до 0°С, предпочтительно при -78°С. Для расщепления соответствующего борного эфира реакционную смесь затем окисляют окислительным агентом, таким как пероксид, особенно, перекись водорода. Окисление осуществляют в инертном растворителе, таком как нитрил, предпочтительно ацетонитрил, и в температурном диапазоне, например, от 0°С до температуры кипения растворителя, предпочтительно в диапазоне от 20° до 50°С.
При необходимости в полученном соединении формулы (IIIд), в котором Y1 представляет собой гидрокси и Y2 представляет собой водород, гидроксигруппа Y1 является защищенной, например, реакцией с галидом, например, галидом формулы Y1-Hal и Hal является галогеном, особенно, хлорид, бромид или йодид.
При необходимости, в полученном соединении формулы (IIIд), в котором Y1 представляет собой гидрокси и Y2 представляет собой водород, защищенную гидроксигруппу X1 удаляют, например, обработкой сильной кислотой, такой как минеральная кислота, например Н3PO4. Предпочтительно, этерифицированную гидроксигруппу или силилоксигруппу отщепляют обработкой кислотой.
Для получения соединения формулы (IIIд), в котором Х2, Х3 и Y имеют определенное выше значение и в котором Y1 и Y3 вместе представляют собой -O-Alk-O- и Alk является С1-С7алкилиденом; и Y2 представляет собой водород, и Y1 и Y3 образуют син-диольную конфигурацию; соответствующее соединение формулы (IIIд), в котором Y1 и Y3, каждый, представляет собой гидрокси и Y2 представляет собой водород, и Y1 и Y3 образуют син-диольную конфигурацию; этерифицируют обработкой, например, соединением формулы Hal-Alk-Hal, например, в присутствии основания.
Стадия (в):
Стадию (в) осуществляют в присутствии основания, такого как алкан щелочного металла, особенно бутиллития, или гидрида, например, гидрида натрия или карбоната щелочного металла, особенно К2СО3 или Cs2СО3, или объемного амина, такого как 1,5-диазабицикло[4,3,0]нон5-ен (DBN) и 1,8-диазабицикло[5,4,0]ундек7-ен (DBU), особенно DBU в присутствии хлорида лития или гидроксида щелочного металла, особенно КОН. Образование соединения формулы (IIIж) осуществляют в инертном растворителе, таком как тетрагидрофуран, или в протонном растворителе, таком как спирт, предпочтительно изопропанол или этанол, и в температурном диапазоне, например, от -78°С до температуры кипения растворителя, предпочтительно от комнатной температуры до 45°С, в зависимости от используемого основания и растворителя.
Предпочтительными соединениями формулы (IIIг) являются соединения, в которых Y представляет собой группу формулы (Х4O)(Х5O)Р(=O)- и Х4 и Х5, в каждом случае особенно представляют собой, С1-С4алкил, предпочтительно метил или этил.
Стадия (г):
Для получения соединения формулы (IIIз) соединение формулы (IIIж), в котором один из Y1 и Y3 является защищенным гидрокси и другой представляет собой гидрокси или оба Y1 и Y3 являются защищенными гидрокси и в каждом случае Y2 представляет собой водород; и Y1 и Y3 образуют син-конфигурацию; или
Y1 и Y3 вместе представляют собой -O-Alk-O- и Alk является C1-С7алкилиденом и Y1 и Y3 образуют син-конфигурацию; и Y2 представляет собой водород; используется в качестве исходного материала, и защиту гидроксигруппы (групп) удаляют, или -O-Alk-O-группу расщепляют обработкой, например сильной кислотой, такой как минеральная кислота, например гидрогалогеновая кислота, особенно HCl, или фосфорная кислота, особенно Н3PO4.
Если защищенным гидрокси является соответствующая силилоксигруппа, ее можно расщепить фторидной солью, например, тетрабутиламмонийфторидом, или кислотой, такой как минеральная кислота, например, гидрогалогеновая кислота или фосфорная кислота, особенно Н3PO4. Гидроксизащитная группа расщепляется в инертном растворителе, таком как нитрил, предпочтительно ацетонитрил, и в температурном диапазоне, например, от -78°С до температуры кипения растворителя, предпочтительно в диапазоне от 0° до 50°С.
Предпочтительной гидроксизащитной группой является трет-бутилдиметилсиланилоксигруппа, которая расщепляется с помощью минеральной кислоты, например H2SO4, HF, Н3PO4, особенно HCl.
Стадия (д):
Для получения соединения формулы (IIIз) соединение формулы (IIIж), в котором Y1 и Y2 вместе образуют оксогруппу и Y3 представляет собой защищенный гидрокси; используется в качестве исходного материала и защитную группу Y3 удаляют, например, обработкой сильной кислотой, такой как минеральная кислота, например, гидрогалогеновая кислота или фосфорная кислота, особенно Н3PO4.
Если защищенный гидрокси представляет собой соответствующую силилоксигруппу, ее можно расщепить фторидной солью, например тетрабутиламмонийфторидом или кислотой, такой как минеральная кислота, например гидрогалогеновая кислота или фосфорная кислота, особенно Н3PO4. Гидроксизащищенная группа расщепляется в инертном растворителе, таком как нитрил, предпочтительно ацетонитрил, и в температурном диапазоне, например, от -78°С до температуры кипения растворителя, предпочтительно в диапазоне от 0° до 50°С.
Предпочтительная гидроксизащитная группа представляет собой трет-бутилдиметилсиланилоксигруппу, которая расщепляется с помощью минеральной кислоты, например H2SO4, HF, Н3PO4, особенно HCl.
Полученное соединение формулы (IIIж), в котором Y1 и Y3 вместе образуют оксогруппу, и Y3 представляет собой гидрокси, восстанавливают подходящим восстановительным агентом, например, каталитическим гидрированием в присутствии катализатора гидрирования, например, катализатора рутения, такого как (Ru(cod)(nu-3-(2-метилалли))2, восстановлением гидридом, например, гидридом, который, при необходимости, может быть комплексным, таким как гидрид, образованный из элемента 1-ой и 3-ой основной группы периодической таблицы элементов, например боргидрид или алюмогидрид, например литийборгидрид, литийалюмогидрид, диизобутилалюмогидрид (может быть необходима дополнительная стадия восстановления, используя цианоборгидрид щелочного металла, такой как цианоборгидрид натрия), а также диборан.
Предпочтительным восстановительным агентом является, например, гидрид, например боргидрид щелочного металла, особенно натрий боргидрид, предпочтительно в присутствии ди-С1-С7алкил-С1-С7алкоксиборана, наиболее предпочтительно диэтилметоксиборана.
Восстановление осуществляют в инертном растворителе, таком как эфир, предпочтительно тетрагидрофуран, и при низких температурах, например, от -78° до 0°С, предпочтительно при -78°С. Для расщепления соответствующего борного эфира реакционную смесь затем окисляют окислительным агентом, таким как пероксид, особенно, перекись водорода. Окисление осуществляют в инертном растворителе, таком как нитрил, предпочтительно ацетонитрил, и в температурном диапазоне, например, от 0°С до температуры кипения растворителя, предпочтительно в диапазоне от 20° до 50°С.
Стадия (е):
Стадию гидролиза (е) осуществляли, например, обработкой амида формулы (IIIж) сильным основанием, таким как гидроксид щелочного металла, предпочтительно NaOH или Ca(OH)2, и подкисляя полученную реакционную смесь.
Стадия (ж):
Стадию выделения (ж) соединения формулы (I) осуществляли в соответствии с обычными методами выделения, такими как кристаллизация полученного соединения формулы (I) из реакционной смеси или хроматографией реакционной смеси.
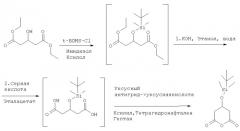
Исходный материал формулы (IIIв) может быть получен, например, этерификацией или амидированием соединения формулы
известным способом.
Кроме того, настоящее изобретение относится к способу получения соединения формулы
в котором Х представляет собой N-С1-С7алкил-N-С1-С7алкоксиамино, предпочтительно, N-метил-N-метоксиамино,
особенно формулы
где указанный способ включает реакцию соединения формулы
в котором X1 представляет собой защищенный гидрокси, особенно трет-бутилдиметилсилилокси,
особенно (Соединение (1)),
с соединением формулы
в котором Х2 и Х3 имеют указанные выше значения, в присутствии стерически затрудняющего амина или предпочтительно в присутствии по крайней мере двух эквивалентов указанного выше 1-фенетиламина, и последующее амидирование N-С1-С7алкил-N-С1-С7-алкоксиамином, особенно N-метилом-N-метоксиамином.
Стерически затрудняющий амин представляет собой, например, N-C1-С7алкил-N-С1-С7-алкоксиамино, особенно N-этилдиизопропиламин.
Способ получения исходного материала формулы (IIIв), особенно соединения формулы (IIIв), в котором Х представляет собой N-С1-С7алкил-N-С1-С7-алкоксиамино, особенно N-метил-N-метоксиамино, является аналогичным объекту настоящего изобретения. Может быть достигнута существенно более высокая селективность.
Соединение формулы (IIIв), в котором Х представляет собой N-C1-С7алкил-N-С1-С7-алкоксиамино, особенно N-метил-N-метоксиамино, является аналогичным объекту настоящего изобретения.
Кроме того, настоящее изобретение также относится к стадии реакции (а), особенно при использовании соединения формулы (IIIв), в котором Х предпочтительно представляет собой N-С1-С7алкил-N-С1-С7-алкоксиамино, наиболее предпочтительно N-метил-N-метоксиамино. При применении этого метода не наблюдается никакого существенного β-отщепления защищенной гидроксигруппы X1, особенно ввиду присутствия фенилэтиламида, который стабилизирует защищенную гидроксигруппу, предотвращая β-отщепление и приводя к высокой селективности для реакции замещения.
При использовании соответствующих диэфиров из уровня техники известно, что β-отщепление происходит как побочная реакция и селективность значительно снижается.
Кроме того, настоящее изобретение также относится к стадии реакции (б), особенно при использовании соединения формулы (IIIв), в котором Х предпочтительно представляет собой N-С1-С7алкил-N-С1-С7-алкоксиамино, наиболее предпочтительно N-метил-N-метоксиамино. Здесь аналогично не наблюдалось никакого β-отщепления и может быть достигнута значительная селективность реакции.
Настоящее изобретение, кроме того, относится к соответствующим соединениям формулы (IIIг), особенно соединениям, в которых X1 представляет собой силилокси, предпочтительно трет-бутилдиметилсилилокси.
Настоящее изобретение, кроме того, относится к соответствующим соединениям формулы (IIIд), особенно соединениям, в которых Y3 представляет собой силилокси, предпочтительно трет-бутилдиметилсилилокси.
Кроме того, настоящее изобретение также относится к стадии реакции (в), особенно при использовании соединения формулы (IIIд), в котором Y3 представляет собой силилокси, предпочтительно трет-бутилдиметилсилилокси. Здесь аналогично не наблюдалось никакого β-отщепления и может быть достигнута значительная селективность реакции.
Соединение формулы (IIIд) предпочтительно представлено следующими формулами
или
где Alk1 представляет собой предпочтительно 1-метил-1,1-этилиден.
Настоящее изобретение аналогично относится к соединению формул (IIIд'), (IIIд'') и (IIIд''') и к их получению.
Настоящее изобретение, кроме того, относится к соответствующим соединениям формулы (IIIж), особенно соединениям, в которых Y3 представляет собой силилокси, предпочтительно трет-бутилдиметилсилилокси.
Настоящее изобретение аналогично относится к новому соединению, как описано в части рабочих примеров.
Настоящее изобретение аналогично относится к конкретным продуктам, непосредственно полученным последовательностью способа или отдельным стадиям способа, особенно соответствующим продуктам, которые находятся по существу в энантиомерно чистой форме.
Преобразование кислоты формулы (I) в соль осуществляли известным способом. Таким образом, например, соль соединений формулы I с основанием получали обработкой основанием. Соли могут быть преобразованы в свободные соединения общепринятыми способами, и соли с основанием могут быть преобразованы, например, обработкой подходящим кислотным агентом с получением свободной кислоты.
Преобразование кислоты формулы (I) в соответствующий лактон формулы (Ia) или (Iб), соответственно, осуществляли в присутствии кислоты, предпочтительно минеральной кислоты, в подходящем растворителе, например, протонном или апротонном, таком как этанол или ацетонитрил. В зависимости от кислоты, преобразование осуществляли в температурном диапазоне, например, от -78° до температуры кипения растворителя. Наиболее предпочтительно используется Н3PO4 в ацетонитриле при 60°С.
Преобразование лактона формулы (Ia) или (Iб), соответственно, в соль кислоты формулы (I) осуществляли, например, в смеси протонного растворителя, например, этанола, и воды, используя гидроксид щелочного металла, такой как LiOH, NaOH или Са(ОН)3. Альтернативно, лактон может быть гидролизован, используя гидроксид щелочного металла, такой как LiOH, NaOH, и полученная соль может быть преобразована в кальциевую соль кислоты питавастатина добавлением водного раствора CaCl2 в воде.
Вариант способа в соответствии с настоящим изобретением включает прямое образование соединения лактона формулы (I). Образование указанного лактона может быть осуществлено обработкой соединения формулы (IIIз) кислотой, такой как минеральная кислота, предпочтительно Н3PO4.
Способ получения соединений формулы (I) и их солей может быть, например, иллюстрирован с помощью сле