Производные альфа-(n-сульфонамидо)ацетамида как ингибиторы бета-амилоида
Иллюстрации
Показать всеИзобретение относится к новым α-(N-сульфонамидо)ацетамидам формулы (I) или их оптическим изомерам
где значения для R; R1; R2 и R3 указаны в п.1 формулы. Данные соединения являются ингибиторами продукции β-амилоидного пептида (β-АР) и применимы для ингибирования продукции β-амилоидного пептида. Изобретение также относится к фармацевтической композиции на основе этих соединений и к способу ингибирования продукции β-амилоидного пептида. 3 н. и 19 з.п. ф-лы, 4 табл.
Реферат
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение охватывает новые соединения α-(N-сульфонамидо)ацетамида, обладающие лекарственными и биоактивными свойствами, их фармацевтические композиции и способы применения. В частности, изобретение относится к α-(N-арилсульфонамидо)ацетамидам. Эти соединения обладают свойством уникального ингибирования продуцирования β-амилоидного пептида (β-АР), тем самым предупреждают накопление отложений амилоидного пептида в мозге. Более конкретно, настоящее изобретение относится к лечению болезни Альцгеймера (AD).
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Болезнь Альцгеймера является прогрессирующим нейродегенеративным заболеванием, характеризующимся ухудшением памяти и когнитивной дисфункцией. AD характеризуется патологическим накоплением сенильных (нейритных) бляшек, нейрофибриллярных клубков, амилоидных отложений в невральных тканях и сосудах, утратой синаптических контактов и гибелью нейронов. Она представляет собой самую обычную форму деменции и в настоящее время является третьей основной причиной смерти после сердечно-сосудистых заболеваний и рака. Затраты на болезнь Альцгеймера огромны (в США более $100 миллиардов ежегодно). По мере увеличения продолжительности жизни в обществе частота AD заметно повышается. По оценкам, если методы предупреждения и лечения не будут найдены, к 2020 году более 10 миллионов американцев будут страдать AD. В настоящее время считают, что болезнью Альцгеймера (AD) поражено 10% населения в возрасте старше 65 лет и до 50% в возрасте старше 85 лет. В настоящее время нет метода лечения, который бы эффективно предупреждал AD или уменьшал (сводил на нет) клинические симптомы и основную патофизиологию (см. обзор Selkoe, D.J. Ann. Rev. Cell Biol., 1994, 10:373-403).
Существует множество теорий относительно этиологии и патогенеза AD. Эти теории либо основываются на аналогии с другими заболеваниями и состояниями (например, теории медленного вируса и "алюминиевая") или на наблюдениях за патологией (например, холинергическая, амилоидная или клубочковая теории). Генетический анализ, вероятно, поможет сделать выбор между конкурентными теориями. Идентификация мутаций в предшественнике β-амилоидного белка (β-АРР) индивидуумов, предрасположенных к ранним формам AD и родственньм заболеваниям, в значительной степени подтверждает амилоидогенные теории.
Гистопатологическое исследование тканей мозга, полученных при аутопсии или при изучении нейрохирургических проб пораженных болезнью людей, выявляет наличие амилоидных бляшек и нейрофибриллярных клубочков в коре головного мозга таких больных. Аналогичные изменения наблюдаются у больных трисомией 21 (синдром Дауна). Биохимические и иммунологические исследования показывают, что доминантный белковый компонент амилоидной бляшки представляет собой белок размером примерно 4,2 килодальтон, содержащий около 39-43 аминокислот. Этот белок называют Aβ, β-амилоидный пептид и иногда β/А4; в данном описании его называют Аβ. Помимо отложения в амилоидных бляшках Аβ обнаруживают в стенках менингеальных и паренхимных артериол, малых артерий, капилляров и иногда венул. Неопровержимые доказательства, накопленные за последнее десятилетие, показывают, что Аβ является внутренним полипептидом, образованным из типа 1 интегрального мембранного белка, названного белком-предшественником β-амилоидного пептида (β-амилоида) (АРР) (Selkoe, D. Physiol. Rev. 2001, 81, 741-766; Wolfe, M. J. Med. Chem. 2001, 44, 2039-2060). βAPP обычно продуцируется многими клетками как in vivo, так и культивированными клетками различных животных и людей. Некоторые протеолитические фрагменты АРР образуются в присутствии протеиназ, называемых секретазами. Субпопуляция этих протеолитических фрагментов, названная β-амилоидный пептид (Аβ), содержит 39-43 аминокислоты и получается при совместном участии β-секретазы и γ-секретазы. β-Секретаза представляет собой мембраносвязанную аспартил-протеиназу, которая образует N-конец Аβ пептида. С-Конец Аβ пептида образуется с участием γ-секретазы, по-видимому, олигомерным комплексом, который включает пресенилин-1 и/или пресенилин-2. Пресенилин-1 и пресенилин-2 представляют собой политопные заполняющие мембрану (интегрированные в мембрану) белки, которые могут содержать каталитические компоненты γ-секретазы (Seiffert, D., Bradley, J. et al. J. Biol. Chem. 2000, 275, 34086-34091).
Многочисленные данные, взятые вместе, неуклонно наводят на мысль, что снижение уровней Аβ в мозге предупреждает начало и развитие AD. Во-первых, Аβ является основным компонентом бляшек в паренхиме мозга, наблюдаемых у всех больных AD, и амилоидных отложений в сосудах головного мозга, наблюдаемых у 90% больных AD (обзор Selkoe, D. Physiol. Rev. 2001, 81, 741-766; Wolfe, M. J. Med. Chem. 2001, 44, 2039-2060). Эти бляшки образуются в результате агрегации растворимого Аβ, уровень которого в мозге четко коррелирует с тяжестью AD нейродегенерации (McLean, С., Cherny, R. et al. Ann. Neurol. 1999, 46, 860-866). Во-вторых, мутации в трех генах (АРР, PS-1 или PS-2), которые повышают уровень Аβ, вызывают семейную AD (FAD), при которой начало AD ускоряется, по меньшей мере, на десятилетие. В том числе мутации, повышающие уровень Аβ, приводят к трисомии хромосомы 21, что является причиной синдрома Дауна. В-третьих, трансгенные мыши, клетки которых экспрессируют один или более мутантных генов FAD, у которых наблюдается повышенный уровень Aβ, образование бляшек в паренхиме мозга и церебральные васкулярные отложения, содержащие Аβ, проявляют нарушение памяти (Chapman, P., White, G. et al. Nature Neurosci. 1999, 2, 271-276) и, как следствие, нейрофибриллярную дегенерацию у мышей, клетки которых также сверхэкспрессируют мутантный тау протеин (Lewis, J.; Dickson, D. et al. Science 2001, 293, 1487-1491). В-четвертых, Аβ является токсическим для культивированных клеток (Dahlgren, К; Manelli, A. et al. J. Biol. Chem. 2002, 277, 32046-32053), вызывает образование нейрофибриллярных клубочков у мышей с мутантным тау (Gotz, J., Chen, F. et al. Science 2001, 293, 1491-1495) и препятствуют продолжительной потенциации, вероятной составляющей памяти (Walsh, D., Klyubin, I. et al. Nature 2002, 416, 535-539 и приведенные в статье ссылки). Все вместе эти данные приводят специалиста в данной области к заключению, что избыток продукции Аβ и/или пониженный клиренс Аβ вызывает AD. Из этого следует, что снижение уровня Аβ в мозге с помощью ингибирования γ-секретазы предупреждает начало и прогрессирование AD.
Помимо AD, избыточная продукция и/или пониженный клиренс Аβ вызывает церебральную амилоидную ангиопатию (САА) (обзор Thal, D., Gherbremedhin, E. et al., J. Neuropath, exp. Neuro. 2002, 61, 282-293). У этих больных сосудистые амилоидные отложения вызывают дегенерацию стенок сосудов и аневризмы, которые могут быть ответственны за 10-15% случаев кровоизлияния у престарелых больных. Как и при AD, мутации в гене, кодирующем Аβ, ведут к ранней форме САА, называемой внутримозговым кровоизлиянием с амилоидозом голландского типа, а у мышей, экспрессирующих этот мутантный белок, развивается САА, аналогичный человеческому.
Выдвинута гипотеза, что ингибирование продуцирования Аβ предупреждает и уменьшает нейродегенерацию, снижающую нейротоксичность и, как правило, опосредующую патологию, ассоциированную с продуцированием Аβ. Способы лечения могут быть нацелены на образование Аβ при участии ферментов, включенных в протеолитическое процессирование β-амилоидного белка-предшественника. Соединения, которые ингибируют β- или γ-секретазную активность, непосредственно или опосредованно, могут контролировать продуцирование Аβ. Благоприятным является то, что соединения, которые специфично нацелены на γ-секретазы, могут контролировать продуцирование Аβ. Такое ингибирование β- или γ-секретаз может тем самым уменьшить продуцирование Аβ, может уменьшить или предупредить неврологические нарушения, ассоциированные с белком Аβ.
В Международной заявке WO 00/50391, опубликованной 31 августа 2000 года, описан ряд сульфонамидных соединений, которые могут модулировать продуцирование амилоидного β белка, как средство для лечения различных заболеваний, особенно болезни Альцгеймера и других заболеваний, связанных с отложением амилоида. В японском патенте 11343279, опубликованном 14 декабря 1999, описан ряд сульфонамидных производных, которые являются ингибиторами TNF-альфа, применимыми для лечения аутоиммунных заболеваний.
Ничто в этих ссылках нельзя интерпретировать как описывающее или предполагающее новые соединения по данному изобретению и их применение для ингибирования продуцирования β-АР.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Синтезирован ряд производных α-(N-сульфонамидо)ацетамида. Эти соединения специфично ингибируют продуцирование β-амилоидного пептида (β-АР) из белка-предшественника β-амилоидного белка (β-АРР). Фармакологическое действие этих соединений делает их применимыми для лечения состояний, ответственных за ингибирование β-АР у пациентов, например болезни Альцгеймера (AD) и синдрома Дауна. Терапия с применением введения этих соединений больным, страдающим этими заболеваниями или подверженных им, включает уменьшение β-АР в мозге этих пациентов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение включает соединения Формулы I, их фармацевтические препараты и их применение для ингибирования (подавления) продуцирования β-АР у пациентов, страдающих AD или подверженных AD или другим нарушениям, возникающим в результате накопления β-АР в тканях мозга. Соединения Формулы I, которые включают нетоксические фармацевтически приемлемые соли и/или их гидраты, имеют следующую формулу и нижеследующие обозначения:
где R1 выбирают из группы, состоящей из
(а) линейного или разветвленного C1-6 алкила или С2-6 алкенила, необязательно имеющего заместители, выбранные из группы, состоящей из гидрокси, С3-7 циклоалкила, С1-4 алкокси, С1-4 алкилтио и галогена;
(б) С3-7 циклоалкила, необязательно замещенного гидрокси или галогеном;
R обозначает водород или R1 и R вместе обозначают C2-5 алкилен;
R2 выбирают из группы, состоящей из
(а) линейного или разветвленного С1-6 алкила или С3-6 алкенила, имеющего, необязательно, заместители, выбранные из группы, состоящей из галогена, С1-4 алкокси и NR4R5;
(б) С3-7 циклоалкилметила, имеющего, необязательно, заместители, выбранные из группы, состоящей из амино, (С1-4алкил)NH-, ди(С1-4алкил)N-, С1-4алкилС(=O)NH- и С1-4алкилОС(=O)NH-;
(в) линейного или разветвленного С1-6алкил-С(=O)-А;
(г) -В-нафтила;
(д)
D и Е, каждый независимо, обозначают простую связь, линейный или разветвленный С1-6алкил, С2-6алкенил или С3-7циклоалкил;
Z выбирают из группы, состоящей из водорода, С1-4 алкила, С1-4 алкокси, галогена, циано, гидрокси, -OCHF2, -OCF3, -CF3 и -CHF2;
Х и Y, каждый независимо, выбирают из группы, состоящей из водорода, гидрокси, галогена, (галоген)3С-, (галоген)2СН-, С1-4 алкилS-, С1-4 алкилS(O)-, С1-4 алкилSO2-, нитро, F3S- и циано; -OR6; -NR4R5; -NR7C(=O)R8; -NR7C(=O)OR8; NHSO2C1-4 алкил; -N(SO2C1-4 алкил)2; C(=O)W, где W выбирают из группы, состоящей из гидрокси, C1-4 алкил, C1-4 алкокси, фенокси и -NR4R5; -OC(=O) C1-4 алкила; фенила, причем указанный фенил, необязательно, может быть замещен циано, галогеном, C1-4 алкокси, С1-4 алкилS-, СН3С(=O), C1-4 алкилS(O)- или С1-4 алкилSO2-, и гетероциклической группы, где указанную гетероциклическую группу выбирают из ряда, состоящего из фуранила, тиофуранила, пирролила, имидазолила, пиразолила, триазолила, тетразолила, пиридинила, пиримидинила, оксадиазолила, оксазолила, изоксазолила, тиадиазолила и тиазолила, причем указанная гетероциклическая группа, необязательно, замещена заместителями, выбранными из группы, состоящей из циано, галогена, C1-4 алкила, (галоген)С1-4 алкила и CO2C1-4 алкила;
(е) -В-(гетероцикла), где указанный гетероцикл выбирают из группы, состоящей из фуранила, тиофуранила, пирролила, имидазолила, пиразолила, триазолила, тетразолила, пиридинила, пиримидинила, оксадиазолила, оксазолила, изоксазолила, тиадиазолила и тиазолила, причем указанный гетероцикл, необязательно, имеет заместители, выбранные из группы, состоящей из циано, галогена, C1-4 алкила, CO2 C1-4 алкила, амино, (С1-4 алкил)NH-, ди(С1-4 алкил)N-, морфолин-4-ила, тиоморфолин-4-ила, пирролидин-1-ила, пиперидин-1-ила, пиперазин-1-ила и 4-(С1-6алкил)пиперазин-1-ила;
(ж) -В-(пиперидин-4-ила), где указанный пиперидин-4-ил, необязательно, имеет заместители, выбранные из группы, состоящей из линейного или разветвленного C1-6 алкила, СН2С(=O)фенила, фенила и фенилметила, причем указанный C1-6 алкил и указанный фенил, необязательно, имеют заместители, выбранные из группы, состоящей из циано, галогена, бензимидазол-2-ила, пиридила и тетрагидрофуран-2-ила, и -C(=O)W', где W' выбирают из группы, состоящей из C1-4 алкокси, R9 и -NR4R5;
А обозначает гидрокси, C1-4 алкокси или NR4R5;
В обозначает линейный или разветвленный C1-6 алкил или С3-6 алкенил;
R3 обозначает фенил или пиридил, имеющий, необязательно, заместители, выбранные из группы, состоящей из галогена, гидрокси, C1-4 алкокси, C1-4 алкила, (галоген)3С-, (галоген)2СН- и галогенСН2-;
R4 и R5, каждый независимо, обозначают водород, линейный или разветвленный C1-6 алкил, С3-6 алкенил, С3-6 алкинил, С3-7 циклоалкил, С3-7 циклоалкилметил, C1-4 алкокси, фенил, бензил, пиридил, пиперидин-4-ил, индан-1-ил, индан-2-ил, тетрагидрофуран-3-ил или пирролидин-3-ил, где каждый, необязательно, имеет заместители, выбранные из группы, состоящей из гидрокси, циано, галогена, (галоген)3С-, (галоген)2СН-, галогенСН2-, гидроксиметила, бензилоксиметила, фенила, пиридила, C1-4 алкила, C1-4 алкокси, (галоген)3С-О-, (галоген)2СН-O-, C1-4 алкилтио, амино, (C1-4 алкил)NH-, ди(С1-4 алкил)N-, морфолин-4-ила, тиоморфолин-4-ила, пирролидин-1-ила, пиперидин-1-ила, пиперазин-1-ила, 4-(C1-6 алкил)пиперазин-1-ила, 4-фенилпиперазин-1-ила, 4-бензилпиперазин-1-ила, 4-пиридилпиперазин-1-ила, СО2Н, СО2С1-4 алкила, C(=O)NHC1-4 алкила и C(=O)N(C1-4 алкил)2;
R4 и R5 вместе могут обозначать морфолин-4-ил, тиоморфолин-4-ил, пирролидин-1-ил, 1,2,3,4-тетрагидроизохинолин-2-ил, декагидрохинолин-1-ил, пиперидин-1-ил, пиперазин-1-ил, [1,4]оксазепан-4-ил, азетидин-1-ил, 2,3-дигидро-1Н-изоиндол-2-ил или 2,3-дигидро-1H-индол-1-ил, где каждый, необязательно, имеет заместители, выбранные из группы, состоящей из гидрокси, циано, галогена, (галоген)3С-, (галоген)2СН-, галогенСН2-, фенила, пиридила, бензила, C1-6 алкила, С3-7 циклоалкила, C1-4 алкокси, C1-4 алкилтио, амино, (C1-4 алкил)NH-, ди(С1-4 алкил)N-, CO2H, СО2С1-4 алкил, C(=O)NHC1-4 алкил и C(=O)N(C1-4 алкил)2;
R6 обозначает линейный или разветвленный C1-6 алкил, С3-6 алкенил, бензил или фенил, где каждый, необязательно, имеет заместители, выбранные из группы, состоящей из галогена, C1-4 алкила, C1-4 алкокси, амино, (C1-4 алкил)NH-, ди(С1-4 алкил)N-, (С1-4 алкил)(фенил)N-, морфолин-4-ила, тиоморфолин-4-ила, пирролидин-1-ила, пиперидин-1-ила, пиперазин-1-ила и 4-(С1-6 алкил)пиперазин-1-ила;
R7 обозначает линейный или разветвленный C1-6 алкил;
R8 обозначает линейный или разветвленный С1-6 алкил, С3-7 циклоалкил, фенил, пиридил или фуранил, где каждый, необязательно, имеет заместители, выбранные из группы, состоящей из галогена, С1-4 алкила, С1-4 алкокси, (С1-4 алкил)NH-, ди(С1-4 алкил)N-, морфолин-4-ила, тиоморфолин-4-ила, пирролидин-1-ила, пиперидин-1-ила, пиперазин-1-ила и 4-(С1-6алкил)пиперазин-1-ила;
R9 обозначает линейный или разветвленный C1-6 алкил, С3-6 алкенил, бензил, фенил, оксазолил или пиридил, где каждый, необязательно, имеет заместители, выбранные из группы, состоящей из галогена, (галоген)3С-, (галоген)2СН-, галогенСН2-, С1-4 алкила, С1-4 алкокси, амино, (С1-4 алкил)NH-, ди(С1-4 алкил)N-, морфолин-4-ила, тиоморфолин-4-ила, пирролидин-1-ила, пиперидин-1-ила, пиперазин-1-ила и 4-(С1-6алкил)пиперазин-1-ила;
или их нетоксические фармацевтически приемлемые соли.
Настоящее изобретение также охватывает способ лечения или смягчения нарушений, ассоциированных с β-амилоидным пептидом, особенно болезни Альцгеймера, который заключается во введении, совместно с обычным адъювантом, носителем или разбавителем, терапевтически эффективного количества соединения формулы I или его нетоксической фармацевтически приемлемой(го) соли, сольвата или гидрата.
Термин "C1-6алкил", употребляемый в данном описании и в формуле изобретения (если в тексте не указано иначе), обозначает линейные или разветвленные алкильные группы, такие как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, 3-метилбутил, гексил и т.п. Термин "С2-6алкенил, обозначает линейные или разветвленные алкенильные группы, такие как этенил (т.е. винил), пропенил, аллил, бутенил, 3-метилбутенил, пентенил, гексенил и т.п. Если не указано иначе, термин "галоген", предполагает бром, хлор, йод и фтор, тогда как термин "галогенид" предполагает анион бромид, хлорид и йодид.
Термин "С3-7 циклоалкил" обозначает углеродный цикл, такой как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
Термин "C1-4 галогеналкил" обозначает линейную или разветвленную C1-4алкильную группу, содержащую 1-3 атомов галогена, такую как трифторметил, фторэтил, 1,2-дихлорэтил, трихлорэтил и т.п.
Термин "С2-5алкилен" обозначает линейную или разветвленную алкиленовую группу, такую как метилен, этилен, пропилен, метилэтилен, бутилен, метилпропилен, пентилен, метилбутилен и этилпропилен.
Так как соединения по данному изобретению содержат асимметрический атом углерода, настоящее изобретение включает рацемат, а также индивидуальные энантиомерные формы соединений Формулы I по данному описанию и в соответствии с формулой изобретения. Предполагается, что однобуквенное обозначение (R) или (S) включает преимущественно один стереоизомер. Смеси изомеров можно делить на индивидуальные изомеры методами, известными сами по себе, например фракционной кристаллизацией, адсорбционной хроматографией или другими подходящими методами деления. Полученные рацематы можно разделять на антиподы обычным способом путем введения подходящих солеобразующих групп, например, получая смесь диастереоизомерных солей с оптически активными солеобразующими агентами, разделяя смесь на отдельные диастереоизомерные соли и превращая разделенные соли в свободные соединения. Возможные энантиомерные формы можно также делить фракционированием на колонках для хиральной жидкостной хроматографией высокого давления.
Термин "нетоксическая фармацевтически приемлемая соль" предполагает нетоксические соли присоединения основания. Соответствующие соли включают соли, образованные из органических и неорганических кислот, таких как, но без ограничения, хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота, метансульфоновая кислота, уксусная кислота, винная кислота, молочная кислота, сульфиновая кислота, лимонная кислота, малеиновая кислота, фумаровая кислота, сорбиновая кислота, аконитовая кислота, салициловая кислота, фталевая кислота и т.п.
В способе по данному изобретению термин "терапевтически эффективное количество" обозначает общее количество каждого активного компонента по данному способу, которого достаточно, чтобы увидеть значительное улучшение состояния пациента, т.е. излечивание острых состояний, характеризующееся подавлением (ингибированием) продукции β-амилоидного пептида. Если индивидууму дают один активный ингредиент, термин относится к одному ингредиенту. Если дают комбинацию, термин относится к общему количеству активных ингредиентов, которое дает терапевтический эффект, вводимых в комбинации, периодически или одновременно. Термины "лечить, лечение, терапия, обработка", применяемые в данном описании и в формуле изобретения, обозначают предупреждение или уменьшение интенсивности заболеваний, обусловленных β-амилоидным пептидом.
Общие схемы реакций
Общие методики синтеза соединений Формулы I описаны в Реакционных схемах 1-23. Предполагается, что обоснованные, разумные вариации описанных методик, очевидные для специалиста в данной области техники, входят в объем настоящего изобретения.
Реакционная схема 1
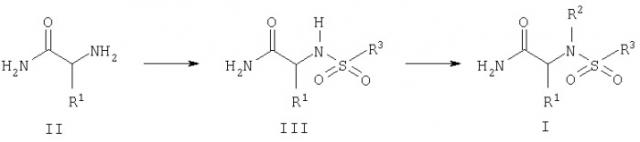
Исходные (α-амино)ацетамиды Формулы II применяют в виде рацематов или в виде чистых энантиомеров, выпускаемых промышленностью, или их получают по общеизвестным литературньм методикам из товарных (имеющихся в продаже) (α-амино)кислот (общая ссылка для получения амидов: R.C.Larock "Comprehensive Organic Transformations, VCH Publishers, New York, 1989, pp.972-976; см. также на Реакционной схеме 18 превращение кислоты Формулы XLVIII в амид Формулы XLIX). Соединение Формулы II обрабатывают соответствующим основанием и сульфонилирующим агентом, таким как сульфонилхлорид, в апротонном растворителе, таком как СН2Cl2, при комнатной температуре, получая (α-сульфонамидо)ацетамид Формулы III. Соответствующие основания включают триэтиламин и пиридин.
По одному методу превращения соединения Формулы III в сульфонамид Формулы I соединение Формулы III обрабатывают соответствующим основанием и алкилирующим агентом в апротонном растворителе при нагревании или без нагревания. Соответствующие основания для этой реакции включают карбонат калия и карбонат цезия. Алкилирующие агенты включают алкилгалогениды (например, хлористый алкил, бромистый алкил или йодистый алкил) и алкилсульфонаты (тозилаты, мезилаты, трифторметансульфонаты). Предпочтительные растворители включают ДМФА и ацетонитрил. Температурный интервал для этой реакции, как правило, составляет 20-100°С.
Альтернативный метод превращения соединения Формулы III в соединение Формулы I включает обработку соединения Формулы III трифенилфосфином, диалкилазодикарбоксилатом и спиртом в инертном растворителе при нагревании или без нагревания.
Реакционная схема 1 на твердом носителе
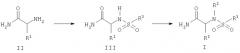
Соединения Формулы I можно также получать, используя методологию твердофазного синтеза. Например, FMOC-защищенную амидную смолу Ринка обрабатывают пиперидином в ДМФА для удаления FMOC-группы. Затем смола конденсируется с защищенной по амину (α-амино)кислотой в присутствии конденсирующего агента, такого как 1-гидроксибензотриазол и диалкилкарбодиимид в инертном растворителе, таком как ДМФА, при нагревании или в отсутствие нагревания. Депротекцией аминогруппы получают связанный с полимером амид Формулы IV. В случае FMOC-защищенной аминокислоты снятие защиты можно проводить обработкой пиперидином в ДМФА.
Реакцией соединения Формулы IV с соответствующим основанием, таким как пиридин, и сульфонилирующим агентом, таким как сульфонилхлорид, в инертном растворителе получают связанный со смолой сульфонамид Формулы V. Алкилирование соединения Формулы V алкилгалогенидом (например, хлористым алкилом, бромистым алкилом или йодистым алкилом) или алкилсульфонатом (тозилатом, мезилатом, трифторметансульфонатом) проводят в присутствии основания в инертном растворителе при комнатной температуре. Предпочтительным основанием является 2-трет-бутиламино-2-диэтиламино-1,3-диметилпергидро-1,2,3-диазафосфорин. Снятие с полимерной подложки дает сульфонамид Формулы I. В случае амидной смолы Ринка снятие предпочтительно проводят трифторуксусной кислотой в инертном растворителе, таком как CH2Cl2.
Реакционная схема 2
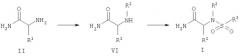
Соединения Формулы I можно также получать, как показано на Реакционной схеме 2. Восстановительное алкилирование амина Формулы I с целью получения амина Формулы VI проводят, обрабатывая альдегидом и восстановителем - гидридом - в присутствии кислого катализатора при нагревании или без нагревания. Предпочтительным восстановителем является цианоборогидрид натрия. Предпочтительным кислым катализатором является кислота Льюиса, такая как ZnCl2. Предпочтительным растворителем в этой реакции является метанол. Затем амин Формулы VI обрабатывают сульфонилирующим агентом, таким как сульфонилхлорид, в присутствии амина, такого как триэтиламин. Эту реакцию проводят в инертном растворителе, таком как CH2Cl2, при нагревании или без нагревания, получая продукт Формулы I. Реакцию, как правило, проводят при комнатной температуре.
Реакционная схема 3
где линкер - линейный или разветвленный С1-6 алкил или С3-6 алкенил;
LG = уходящая группа.
Получение соединений Формулы VIII выполняют, как показано на Реакционной схеме 3, реакцией соединения Формулы VII с амином в присутствии акцептора кислоты, такого как триэтиламин, в инертном растворителе, таком как CH2Cl2, при нагревании или без нагревания. Соединение Формулы VII получают последовательными реакциями (цепь реакций), изображенными на Реакционной схеме 1 или Реакционной схеме 2.
Реакционная схема 4
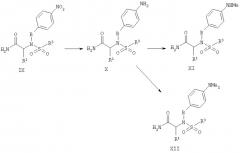
Соединения Формулы XI и XII получают, как показано на Реакционной схеме 4. Восстановление нитрогруппы в соединении Формулы IX (полученном последовательными реакциями, изображенными на Реакционной схеме 1 или 2) газообразным водородом под давлением в присутствии палладиевого катализатора, кислоты и в растворителе, таком как метанол, дает производное анилина Формулы X. Монометилирование соединения Формулы Х с целью получения соединения Формулы XI проводят реакцией с 1,1 эквивалента метилгалогенида или метилсульфоната, например диметилсульфата, в присутствии основания, такого как триэтиламин, и в инертном растворителе, таком как ДМФА. Реакцию монометилирования, как правило, проводят при температуре 20-40°С. Диметиланилин Формулы XII получают, обрабатывая анилин Формулы Х избытком метилгалогенида, такого как йодистый метил, или метилсульфоната в присутствии основания, например карбоната цезия, в растворителе, таком как ДМФА, при нагревании или в отсутствие нагревания.
Реакционная схема 5
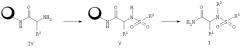
На Реакционной схеме 5 показан синтез сложных эфиров Формулы ХIII, кислот Формулы XIV и амидов Формулы XV. Реакция соединения Формулы III с эфиром галоидалкилкарбоновой кислоты, например с трет-бутиловым эфиром бромуксусной кислоты, в присутствии основания, такого как карбонат калия, и в инертном растворителе, таком как ДМФА, дает сложный эфир Формулы XIV. Депротекцией сложноэфирной группы методами, известными специалистам в данной области техники (ссылка: T.W. Greene and P.G.M. Wuts, "Protecting Groups in Organic Synthesis", Wiley Interscience, New York, 1999, pp.373-442). Например, в случае трет-бутилового эфира отщепление с образованием кислоты Формулы XIV проводят, обрабатывая трифторуксусной кислотой в растворителе, таком как СН2Cl2. Превращение кислоты в амид Формулы XV проводят по обычным методикам реакций амидов, хорошо известньм специалистам в данной области техники (ссылка: R.C. Larock "Comprehensive Organic Transformations, VCH Publishers, New York, 1989, pp.972-976). По предпочтительному методу кислоту Формулы XIV обрабатывают первичным или вторичным амином в присутствии 1-гидроксибензотриазола и 1,3-дициклогексилкарбодиимида в апротонном растворителе, таком как СН2Cl2 или ДМФА.
Реакционная схема 6
.
Получение кислот Формулы XVII и амидов Формулы XVIII показано на Реакционной схеме 6. Превращение сложного эфира Формулы XVI (полученного как показано на Реакционных схемах 1 или 2) в кислоту Формулы XVII выполняют в стандартных условиях расщепления эфиров, хорошо известных специалистам в данной области техники (ссылка: T.W. Greene and P.G.M. Wuts, "Protecting Groups in Organic Synthesis", Wiley Interscience, New York, 1999, pp.373-442). В случае метилового эфира Формулы XVI обработкой водным раствором гидроксида натрия в растворителе, таком как метанол или смесь метанол/ТГФ, при 20-40°С получают кислоту Формулы XVII. Превращение кислоты Формулы XVII в амид Формулы XVII проводят обычными методами получения амидов, хорошо известными специалистам в данной области техники (ссылка: R.C. Larock "Comprehensive Organic Transformations, VCH Publishers, New York, 1989, pp.972-976). По предпочтительному методу кислоту Формулы XIV обрабатывают первичным или вторичным амином в присутствии 1-гидроксибензотриазола и карбодиимида, например 1-(3-диметиламинопропил)-3-этилкарбодиимида в растворителе, таком как ДМФА или CH2Cl2. В качестве акцептора кислоты можно добавлять основание, такое как диизопропилэтиламин.
Реакционная схема 7
Синтез производных пиперидина Формулы XIX, XX, XXI и XXIII показан на Реакционной схеме 7. Реакцией соединения Формулы III с N-защищенным пиперидином с 4-галоидалкильной или 4-сульфонилалкильной группой в качестве заместителя, такого как 4-(толуолсульфонилоксиметил)-1-(трет-бутоксикарбонил)пиперидин), в присутствии основания, такого как карбонат цезия, в растворителе, таком как ДМФА, при нагревании или в отсутствие нагревания, получают карбамат Формулы XIX. Отщепление карбаматной группы проводят в стандартных условиях, хорошо известных специалистам в данной области техники (ссылка: T.W. Greene and P.G.M. Wuts, "Protecting Groups in Organic Synthesis", Wiley Interscience, New York, 1999, pp.503-550), получая пиперидин Формулы XX. В случае (трет-бутоксикарбонил)пиперидина отщепление проводят в присутствии трифторуксусной кислоты в СН2Cl2.
Превращение пиперидина Формулы XX в амид Формулы XXI проводят обычными методами получения амидов, хорошо известными специалистам в данной области техники (ссылка: R.C. Larock "Comprehensive Organic Transformations, VCH Publishers, New York, 1989, pp.972-976). По предпочтительному методу пиперидин Формулы XX обрабатывают ацилхлоридом в присутствии амина, такого как триэтиламин, и инертного растворителя, такого как СН2Cl2, при нагревании или без нагревания. Или же пиперидин Формулы XX можно конденсировать с кислотой в присутствии конденсирующего агента, такого как гидроксибензотриазол и карбодиимид, получая амид Формулы XXI. Мочевину Формулы XXII получают, обрабатывая амин Формулы XX изоцианатом и основанием, таким как триэтиламин, в растворителе, таком как CH2Cl2, при нагревании или без нагревания. Алкилированием пиперидина Формулы XX получают N-замещенные пиперидины Формулы XXIII. Как правило, пиперидин обрабатывают алкилгалогенидом или алкилсульфонатом в присутствии основания, такого как триэтиламин, и растворителя, такого как CH2Cl2.
Реакционная схема 8
Спирты Формулы XXV и амины Формулы XXV и амины Формулы XXVI синтезируют как показано на Реакционной схеме 8. Защищенный спирт Формулы XXIV получают по Реакционным схемам 1 или 2. Снятие защиты со спиртовой группы (депротекция) в условиях, соответствующих выбранной защитной группе (ссылка: T.W. Greene and P.G.M. Wuts, "Protecting Groups in Organic Synthesis", Chapter 2) дает спирт Формулы XXV. Например, если защитной группой является тетрагидропиранильная группа, свободную спиртовую группу получают по реакции соединения Формулы XXIV с п-толуолсульфокислотой в растворителе, таком как метанол. Гидроксильную группу соединения Формулы XXV превращают в уходящую группу (например, галоидную или сульфонатную), а затем обрабатывают первичным или вторичным амином, получая амин Формулы XXVI. Например, спирт можно превратить в мезилат реакцией с метансульфонилхлоридом и основанием, таким как CH2Cl2. Последующей реакцией мезилата с первичным или вторичным амином в присутствии основания, такого как триэтиламин, в растворителе, таком как СН2Cl2, получают амин Формулы XXVI.
Реакционная схема 9
Амиды Формулы XXVIII получают из аминов Формулы XXVII, как показано на Реакционной схеме 9. Амины Формулы XXVII, где D обозначает простую связь, получают по Реакционной схеме 1 или 4. Амины Формулы XXVII, где D имеет иное значение, нежели простая связь, получают по Реакционной схеме 8. Превращение аминов Формулы XXVII в амиды Формулы XXVIII проводят в условиях получения амидов, хорошо известных специалистам в данной области техники (ссылка: R.C. Larock "Comprehensive Organic Transformations, VCH Publishers, New York, 1989, pp.972-976). Например, реакцией амина Формулы XXVII с хлорангидридом кислоты в присутствии основания, такого как триэтиламин, в растворителе, таком как СН2Cl2, получают амид Формулы XXVIII. Превращение аминов Формулы XXVII в карбаматы можно осуществлять в условиях, хорошо известных специалистам в данной области техники (ссылка: T.W. Greene and P.G.M. Wuts, "Protecting Groups in Organic Synthesis", Wiley Interscience, New York, 1999, pp.503-550). Сульфонамиды можно также получать из амина Формулы XXVII способами, описанными для превращения интермедиата Формулы II в сульфонамид Формулы III.
Реакционная схема 10
Синтез пиридинов Формулы XXX выполняют, как показано на Реакционной схеме. Хлорпиридин Формулы XXIX получают методами, описанными в Реакционных схемах 1 или 2. Реакцией соединения XXIX с первичным или вторичным амином в растворителе, таком как ТГФ, при температурах 20-100°С в запаянном сосуде под давлением получают аминопиридин Формулы XXX.
Реакционная схема 11
Аминозамещенные эфиры фенолов Формулы XXXII получают из (O-аллил)фенолов, как показано на Реакционной схеме 11. Исходные аллиловые эфиры Формулы XXXI получают, как показано на Реакционных схемах 1 или 2. Реакцией соединения Формулы XXXI с тетраоксидом осмия и триметиламин-N-оксидом в растворителе, таком как ацетон, с последующей обработкой периодатом натрия получают промежуточный альдегид, который, как правило, используют без дополнительной очистки. Реакцией неочищенного альдегида с первичным или вторичным амином и восстановителем, таким как триацетоксиборогидрид натрия, в растворителе, таком как этанол, при нагревании или в отсутствие нагревания, получают амин Формулы XXXII.
Реакционная схема 12
Превращение сложного эфира Формулы XXXIII в третичный спирт Формулы XXXIV проводят, как показано на Реакционной схеме 12. Реакция эфира Формулы XXXIII с избытком метилметаллоорганического реагента, такого как метилмагнийбромид, в растворителе, таком как ТГФ, в интервале температур 0-25°С дает спирт Формулы XXXIV.
Реакционная схема 13
1,3,4-Оксадиазол Формулы XXXVI получают, как показано на Реакционной схеме 13, с применением методов, хорошо известных специалистам в данной области техники (ссылка: Joule, J.A.; Mills, К; Smith, G.F. Heterocyclic Chemistry, 3rd ed., Chapman & Hall: London, 1995; 452-456 и цитируемые ссылки). Например, эфир Формулы XXXV обрабатывают гидразином в метаноле при кипячении. Полученный промежуточный ацилгидразид используют без очистки в последующей реакции с алкилацетимидатом в пиридине при кипячении, получая оксадиазол Формулы XXXVI.
Реакционная схема 14
Синтез 1,2,4-оксадиазола Формулы XXXVI проводят, как показано на Реакционной Схеме 14, используя методы, хорошо известные специалистам в данной области техники (ссылка: Joule, J.A.; Mills, К; Smith, G.F. Heterocyclic Chemistry, 3rd ed., Chapman & Hall: London, 1995; 452-456 и цитируемые ссылки). Например, обработкой кислоты Формулы XVII гидроксибензотриазолом, карбодиимидом и ацетамидоксимом (N-гидроксиэтанимидатом) в присутствии основания, такого как триэтиламин, получают интермедиат, который при нагревании в кипящем пиридине дает оксадиазол Формулы XXXVII.
Реакционная схема 15
1,2,4-Оксадиазол Формулы XXXIX получают из нитрила Формулы XXXVIII (Реакционная схема 15) мето