Способ оценки качества вакцинных препаратов против холеры
Иллюстрации
Показать всеИзобретение направлено на повышение эффективности оценки качества вакцинных препаратов против холеры. Сущность изобретения включает проведение морфологических исследований с использованием морфометрической оценки качества препарата по безвредности и эффективности местной защитной реакции по состоянию трех групп клеточных элементов слизистой оболочки кишечника, содержащей межэпителиальные лимфоциты, апудоциты, бокаловидные клетки. Забор материала осуществляют из трех отделов кишечника: двенадцатиперстной, подвздошной и восходящего отдела ободочной кишки. Полученные количественные данные подвергают математической обработке с использованием разработанных коэффициентов (К) и индексов (И), вычисляемых по формулам. Преимущество изобретения заключается в расширении арсенала оценочных критериев. 4 табл.
Реферат
Изобретение относится к области медицины, в частности к вакцинологии.
Оценка безвредности, иммунологической безопасности и эффективности защиты от инфекции после иммунизации является определяющим моментом при создании новых и усовершенствовании существующих вакцинных препаратов.
Известны методические приемы оценки новых медицинских иммунобиологических препаратов, заключающиеся в лабораторно-экспериментальном определении качества испытуемого препарата с помощью адекватных методов исследования. Большое значение при доклиническом испытании вакцин отводится морфологическому анализу изменений, выявляемых с помощью морфологических и гистохимических приемов [1, 2, 8].
Современные требования к оценке качества вакцинных препаратов предполагают применение объективных и унифицированных методов исследования, что предусматривает целый комплекс мероприятий, направленных на обеспечение поступления в практику здравоохранения полностью безопасных, стандартных и эффективных вакцин [3, 4]. Важнейшим звеном в комплексе этих мероприятий является система испытаний вакцинных препаратов с целью определения их безвредности, реактогенности, профилактической эффективности.
До настоящего времени основной принцип морфологической оценки безвредности и эффективности вакцинирующего препарата ориентирован на качественную характеристику выявляемых изменений [1, 2, 3].
Известен способ оценки качества штаммов кандидатов в вакцины, направленный на определение безвредности штаммов и определение иммуногенной активности [5, 6].
При определении безвредности штаммов кандидатов в вакцины морфологическими методами учитывают макроскопические изменения внутренних органов и гистологическими методами описывают качественные изменения клеточных структур ЖКТ и внутренних органов биомоделей. Недостатком подобной методики является отсутствие объективной количественной характеристики изменений, что снижает эффективность оценки качества вакцинных препаратов.
Иммунологическую активность вакцинного штамма определяют по наличию в слизистой оболочке тонкого кишечника в значимых количествах копроантител; протективные свойства - по снижению способности микроорганизма прикрепляться к слизистой кишечника и по числу выживших животных (LD50) с помощью RITARD-метода. Известный способ не отражает изменения на клеточном уровне.
Иммунологическую активность вакцинного штамма определяют по наличию в слизистой оболочке тонкого кишечника в значимых количествах копроантител; протективные свойства - по снижению способности микроорганизма прикрепляться к слизистой кишечника и по числу выживших животных (LD50) с помощью RITARD-метода. При этом не исследуют защитную функцию слизистой ЖКТ морфологическими методами.
Известный способ обладает недостаточно полной информативностью, так как не отражает изменения на клеточном уровне.
Выбор критериально значимых показателей для оценки неблагоприятного воздействия вакцинирующего препарата или способности последнего предотвратить развитие таковых у биомоделей при моделировании соответствующего инфекционного процесса является наиболее сложным и важных вопросом.
Известно, что инфекционный процесс, протекающий под действием возбудителей кишечных инфекций, в первую очередь повреждает слизистую оболочку кишечника, которая является мощным барьером на пути микроба. От полноценного функционирования клеток желудочно-кишечного тракта (ЖКТ) во многом зависит степень защиты организма от кишечной инфекции [10].
Известно, что особая роль в функционировании местной иммунной системы ЖКТ принадлежит эпителиальным клеткам, клеткам собственной пластинки слизистой оболочки (Lamina propria) - лимфоцитам, плазматическим клеткам, эозинофилам, тучным клеткам, нейтрофилам, а также клеткам APUD-системы - апудоцитам.
Среди указанных клеток выделяют межэпителиальные лимфоциты (МЭЛ), представляющие большую группу гетерогенной популяции лимфоцитов, расположенных в эпителиальном пласте. Эти клетки способны активно покидать эпителий и возвращаться в собственную пластинку слизистой оболочки кишечника, обладают функцией естественных киллеров, регулируют работу эпителия, тучных и плазматических клеток [6, 9].
В основе гоместатических реакций при вакцинации лежат нейроэндокринные механизмы, которые координируют общую направленность процессов иммуногенеза [7].
Состояние апудоцитов коррелирует с клинико-морфологическими проявлениями активности патологического процесса в ЖКТ, что позволяет использовать результаты морфофункциональной характеристики этих клеток (по степени наполнения секретом) для построения алгоритма оценки качества препаратов для специфической профилактики кишечных инфекций [11].
Состояние бокаловидных клеток отражает интенсивность секреторной функции ЖКТ. Бокаловидные клетки - одноклеточные секреторные железы, секрет которых содержит углеводно-белковые комплексы, играющие защитную роль [6].
В задачу предлагаемого изобретения положено расширение арсенала оценочных критериев вакцинирующих препаратов против холеры, объективизация и унификация способа оценки качества вакцинных препаратов.
Поставленная задача в способе оценки качества вакцинных препаратов против холеры, включающем морфологические исследования материала от биопробы, достигается тем, что морфологические исследования проводят с использованием морфометрической оценки качества препарата по безвредности и эффективности местной защитной реакции. При этом учитывается состояние трех групп клеточных элементов слизистой оболочки кишечника, содержащей межэпителиальные лимфоциты, апудоциты, бокаловидные клетки, которые отражают барьерную функцию последнего. Результаты выражают в количественных показателях. Забор материала осуществляют из трех отделов кишечника: двенадцатиперстной, подвздошной и восходящего отдела ободочной кишки. Полученные количественные данные подвергают математической обработке с использованием разработанных коэффициентов (К) и индексов (И). Индексы и коэффициенты вычисляют по формулам:
1. Индекс регенеративной активности ИР
2. Коэффициент активности апудоцитов КА
где
Иап - активность апудоцитов определяют по формуле:
3. Коэффициент секреторной активности КС
где
Иса - секреторная активность. Определяют отношением клеток, содержащих кислый гликозамингликан (КМПС), к сумме клеток содержащих нейтральный гликозамингликан (НМПС) и смешанный продукт реакции, выраженное в процентах.
Безвредность и эффективность защиты вакцинного препарата оценивают относительным показателем данных, полученных при морфометрическом анализе опытных и контрольных образцов.
Безвредность вакцинного препарата оценивают по величине индексов и коэффициентов как отношение данных, полученных при морфометрическом анализе опытных образцов, к результатам контрольных образцов (интактных биомоделей, положительный контроль). При этом вакцинные препараты считаются безвредными при отклонении показателя от единицы не более чем на 0,5.
Эффективность местной защиты биомоделей после иммунизации вакцинным препаратом с последующим заражением вирулентной культурой определяют по величине индексов и коэффициентов отношением морфометрических значений контрольных образцов (интактных, зараженных биомоделей, отрицательный контроль) к опытным. При этом количественное значение коэффициентов и индекса отражает положительные или отрицательные воздействия вакцинирующего препарата на биомодель. При значениях коэффициентов КА и КС больше 1,5, а индексе ИР меньше или равно 1, степень защиты от патогена считается достаточной.
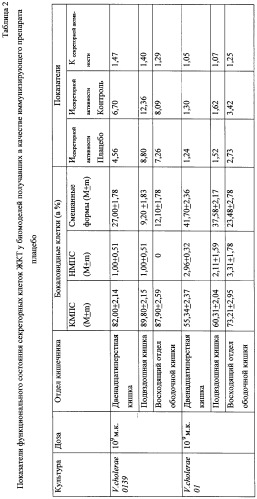
Экспериментальным путем показано, что у биомоделей, получивших в качестве иммунизирующего препарата плацебо, колебания показателей КА и КС составили от 1,02 до 1,47. Результаты приведены в таблицах 1 и 2.
В известных авторам источниках патентной и научно-технической информации не описано способа количественной оценки определения качества вакцинных препаратов с использованием морфологических критериев.
Впервые авторами предложено использовать изменения состояния трех групп клеточных элементов слизистой оболочки кишечника в материале от биомодели для оценки качества вакцинирующих препаратов. Впервые для количественной оценки качества вакцинных препаратов разработаны коэффициенты и индексы. Осуществлен выбор определенных отделов ЖКТ для такого рода исследований, который обусловлен степенью функциональной нагрузки на него в условиях проведения испытаний оральных препаратов против кишечных инфекций и исходя из удобства забора материала у биомоделей и дальнейшей его обработки, а также учитывая, что различные отделы ЖКТ имеют свои морфологические и физиологические особенности.
Двенадцатиперстная кишка выполняет в организме пищеварительную функцию, является основным звеном секреторной и моторной функции пищеварительной системы, в которой сосредоточено максимальное количество желез (бруннеровы железы), секретирующих НМПС. Основная масса апудоцитов по частоте встречаемости и видовому разнообразию представлена в этом отделе кишечника. Здесь же активно идет процесс всасывания белков, углеводов и жиров, токсических субстанций, в нем преобладают МЭЛ, поэтому учет их реакции в этом отделе кишечника наиболее обоснован.
В подвздошном отделе кишечника сосредоточено максимальное количество лимфоидных скоплений и специальных образований - пейеровых бляшек, являющихся индуктивной зоной иммунной системы ЖКТ в тесной связи, в которой находится эффекторная зона, представленная МЭЛ. В этом отделе кишечника активно идет процесс резорбции поступивших веществ, в том числе и токсических субстанций, в нем развивается основной патологический симптомокомплекс, при многих кишечных инфекциях воспроизводимых у биомоделей.
Восходящий отдел ободочной кишки отличается особой реакцией клеток APUD-системы, дегрануляциия апудоцитов здесь начинается уже через 6 ч после поступления антигенного материала и продолжается до суток, в то время как в поперечно-ободочной кишке такой реакции не наблюдается, а в дистальных отделах кишечника реакция со стороны указанных клеток задерживается во времени.
Способ осуществляется следующим образом: вакцинный препарат вводят в дозах, необходимых для выработки антител, экспериментальным животным (биомоделям). В сроки оптимального накопления количества антител с момента иммунизации биомоделей определяют безвредность и эффективность местной защиты от патогена.
Для оценки безвредности препарата на гистологическое исследование у иммунных животных берут три отрезка (размером 1,5 см3) кишечника: двенадцатиперстной, подвздошной, восходящий отдел ободочной кишки. Аналогичный материал забирают у интактных (не иммунных) биопроб - положительный контроль.
Для оценки эффективности местной защиты вакцинирующего препарата иммунным биомоделям вводят вирулентный штамм возбудителя кишечной инфекции в дозах, достаточных для проявления патологического действия. На гистологическое исследование берут три отрезка кишечника. У интактных биопроб, зараженных вирулентной культурой в аналогичной дозе, также забирают три отрезка кишечника - отрицательный контроль.
Все отрезки кишечника фиксируют в 10% водном нейтральном растворе формалина. По общепринятой в гистологии схеме получают парафиновые блоки. Подготовленные срезы окрашивают различными красителями в зависимости от задач по выявлению групп клеток. В окрашенных срезах при морфометрическом исследовании подсчитывают количество МЭЛ, количество и функциональное состояние апудоцитов, определяют характер секрета и количество бокаловидных клеток. Затем вычисляют коэффициент секреторной активности (КС), коэффициент активности апудоцитов (КА), индекс регенеративной активности (ИР). Оценку безвредности и эффективности местной защиты вакцинного препарата определяют в соответствии с предлагаемыми формулами - относительным показателем данных опытных и контрольных образцов.
Пример 1. Оценка эффективности местной защиты коммерческой холерной бивалентной химической таблетированной вакцины.
Взрослых кроликов однократно per os иммунизировали коммерческой холерной бивалентной химической таблетированной вакциной в количестве (3 таблетки), соответствующем одной иммунизирующей дозе для человека.
В наших предварительных исследованиях и по литературным данным, для холерных антигенов лучшим сроком для изучения иммунологической перестройки в макроорганизме являются 14-21 сутки. В таблице 1 представлена динамика накопления антител в сыворотке крови биомодели в зависимости от продолжительности срока от момента иммунизации. В сроки оптимального накопления антител (14-е сутки) животных заражали вирулентными холерными вибрионами в дозе 2×109 м.к. методом RITARD. Наблюдали за животными в течение 5 суток, выживших кроликов хлороформировали, отбирали три отрезка кишечника (двенадцатиперстную, подвздошную, восходящий отдел ободочной кишки) размером 1,5 см3, которые фиксировали в 10% водном нейтральном растворе формалина. По общепринятой в гистологии схеме готовили парафиновые блоки. Из них получали полутонкие срезы, которые окрашивали:
- одновременно альциановым синим и Шифф-реактивом - для оценки секреторной активности бокаловидных клеток, содержащих кислые и нейтральные гликозамингликаны (КМПС и НМПС соответственно);
- гемотоксилином и эозином - для выявления и характеристики МЭЛ;
- импрегнировали серебром по Гримелиусу - для оценки активности клеток АПУД-системы (апудоцитов).
В окрашенных срезах при морфометрическом исследовании подсчитывали количество МЭЛ, количество и функциональное состояние апудоцитов, определяли характер секрета и количество бокаловидных клеток. Подсчет можно проводить с использованием окулярной сетки Автандилова или автоматно-программного комплекса.
Аналогичным образом проводили морфометрическое исследование интактных, зараженных вирулентными холерными вибрионами в указанной выше дозе биомоделей (отрицательный контроль). В таблице 3 представлена характеристика отрицательных и положительных контролей. Цифровые значения индексов (ИА) и (ИС) использовали для вычисления коэффициентов (КС, КА), а индекс ИР получали отношением среднеарифметических данных.
Отношение двух показателей - отрицательного контроля к опыту показывает эффективность местной защиты.
Двенадцатиперстная кишка:
Подвздошный отдел тонкого кишечника:
Восходящий отдел ободочной кишки:
Эффективность защиты биомодели от холерной инфекции указанным коммерческим препаратом согласно установленным значениям используемых коэффициентов и индекса отражает оптимальное функциональное состояние апудоцитов (КА больше 1,5), сохранение секреторной активности на достаточно высоком уровне бокаловидными клетками (КС больше 1,5) и достаточную для указанной антигенной нагрузки активность МЭЛ (ИР меньше или равно 1), что свидетельствует о достаточной степени защиты биомодели от патогена. У животных проявлений патологических признаков не обнаружено.
Пример 2. Оценка безвредности штамма холерных вибрионов, предлагаемого для иммунопрофилактики.
Взрослых кроликов однократно per os иммунизировали холерными вибрионами штамма КМ 184 (предложенного в качестве вакцинного) в дозе 5×109 м.к. и на 14-е сутки после иммунизации забирали материал для гистологического исследования: отбирали три отрезка кишечника (двенадцатиперстную, подвздошную, восходящий отдел ободочной кишки) размером 1,5 см3, которые фиксировали в 10% водном нейтральном растворе формалина. По общепринятой в гистологии схеме готовили парафиновые блоки. Из них получали полутонкие срезы, которые окрашивали:
- одновременно альциановым синим и Шифф-реактивом - для оценки секреторной активности бокаловидных клеток, содержащих кислые и нейтральные гликозамингликаны (КМПС и НМПС соответственно);
- гемотоксилином и эозином - для выявления и характеристики МЭЛ;
- импрегнировали серебром по Гримелиусу - для оценки активности клеток АПУД-системы (апудоцитов).
В окрашенных срезах при морфометрическом исследовании подсчитывали количество МЭЛ, количество и функциональное состояние апудоцитов, определяли характер секрета и количество бокаловидных клеток. Подсчет можно проводить с использованием окулярной сетки Автандилова или автоматно-программного комплекса.
Аналогичным образом проводили морфометрическое исследование интактной биомодели (положительный контроль). При морфометрическом исследовании определяли КА, КС, ИР.
Отношение двух показателей - опыта к положительному контролю отражает безвредность препарата.
Двенадцатиперстная кишка:
Подвздошный отдел тонкого кишечника:
Отклонение полученных значений коэффициентов и индексов от единицы не более чем на 0,5 указывает на качество (безвредность) препарата.
На большом экспериментальном материале (обработано более 5000 срезов) показана эффективность способа при доклиническом испытании различных вакцинных препаратов: химические вакцины, штаммы-кандидаты в вакцины, а также клеточные вакцины, полученные с применением новых технологий. Таблица 4.
Приведенные примеры, а также данные в таблицах подтверждают, что изобретение осуществимо, его использование позволяет определять безвредность и эффективность местной защиты вакцинных препаратов.
Предлагаемый способ оценки качества вакцинных препаратов против холеры позволяет расширить арсенал оценочных критериев, с помощью которых возможно определять безвредность и защитные свойства вакцинного препарата. Способ обеспечивает повышение эффективности оценки качества вакцинных препаратов против холеры за счет введения новых объективных количественных морфометрических показателей, оценивающих состояние местной защитной реакции биомодели от возбудителя болезни и безвредности препарата. Разработанные коэффициенты и индексы унифицируют подход к оценке качества различных вакцинирующих препаратов,
Таким образом, предлагаемый способ с применением подобранных показателей и разработанных критериев позволяет повысить качество оценки вакцинных препаратов против холеры, объективизировать и унифицировать методы морфологического исследования.
Источники информации
1. Методические указания (МУ 3.3.1112-02): Основные требования к вакцинным штаммам сибиреязвенного микроба для иммунизации людей. - М.: Федеральный центр госсанэпиднадзора Минздрава России, 2002. - 47 с.
2. Методические указания (МУ 3.3.1113-02): Основные требования к вакцинным штаммам чумного микроба. - М.: Федеральный центр госсанэпиднадзора Минздрава России, 2002. - 63 с.
3. Доклинические испытания новых медицинских иммунобиологических препаратов. Основные положения. РД 42-28-8-89-М., 1989.
4. Медуницын Н.В. Вакцинология. Из-е 2-е переработанное и дополненное. - М.: Триада, 2004 - 446 с.
5. Методические указания: Основные критерии оценки вакцинных штаммов холерного вибриона. - Саратов, 1995 - 28 с.
6. Ипатов Ю.П., Комарова Л.Г., Переслегина И.А., Шабунина Е.И. Ключи к проблеме гастероэнтерологических заболеваний у детей / под ред. проф. А.И.Волкова. - Н.Новгород, 1997. - С.74-78.
7. Райхлин И.Т., Кветной И.М., Осадчук М.А. APUD-система (иммунобиологические и онкологические аспекты). - Обнинск, 1993 - 109 с.
8. Исупов И.В., Бугоркова С.А., Кутырева В.В. Патоморфологические аспекты доклинических испытаний различных вакцин против чумы, сибирской язвы и холеры. - Саратов, из-во ЗАОПЦ "ИППОЛиТ-99". - 2004. - 113 с.
9. Козырева Л.А., Сорокина Т.Б., Глянько Е. В. Количественная оценка межэпителиальных лимфоцитов слизистой тонкого кишечника морских свинок, вакцинированных препаратом Холероген-анатоксин-0 антиген. - Пробл. особо опасных инф. - 1993. - № 3 (73). - с.158-167.
10. Хаитов P.M., Пинегин Б.В. Иммунная система желудочно-кишечного тракта, особенности строения и функционирования в норме и патологии. - Иммунология. - 1997. - № 5 - с.47.
11. Патент РФ 2103008.
12. Патент US 6960345 01.11.2005
| Таблица 1Показатели функционального состояния апудоцитов ЖКТ у биомоделей, получавших в качестве иммунизирующего препарата плацебо | ||||||||
| Культура | Доза | Отдел кишечника | Апудоциты (в %) | Показатели | ||||
| Опустошенные клетки (М±m) | Гистохимически активные клетки (М±m) | Клетки в состоянии функционального покоя (М±m) | И активности апудоцитов Плацебо | И активности апудоцитов Контроль | К активности апудоцитов | |||
| V.cholerae 01 | 109 м.к. | Двенадцатиперстная кишка | 54,56±2,37 | 4,66±1,69 | 40,78±2,59 | 1,45 | 1,5 | 1,03 |
| Подвздошная кишка | 54,60±2,14 | 4,50±1,76 | 40,90±2,15 | 1,44 | 1,55 | 1,08 | ||
| Восходящий отдел ободочной кишки | 63,68±2,60 | 6,22±1,50 | 30,10±2,53 | 2,32 | 2,73 | 1,18 | ||
| V.cholerae 0139 | 109 м.к. | Двенадцатиперстная Кишка | 70,33±2,15 | 2,33±0,94 | 27,34±1,78 | 2,66 | 2,7 | 1,02 |
| Подвздошная кишка | 53,50±1,78 | 1,50±0,31 | 45,00±2,56 | 1,15 | 1,30 | 1,13 | ||
| Восходящий отдел ободочной кишки | 46,90±1,48 | 14,87±1,83 | 38,23±1,84 | 1,62 | 1,76 | 1,09 |
| Таблица 4Результаты оценки качества различных вакцинных препаратов по разработанным показателям | |||||||||||||
| Название препарата | Схема иммунизации | Доза препарата | Заражение | Количество образцов | Показатели | ||||||||
| Двенадцатиперстная кишка | Подвздошный отдел тонкого кишечника | Восходящий отдел ободочной кишки | |||||||||||
| КА | КС | ИР | КА | КС | ИР | КА | КС | ИР | |||||
| Коммерческая холерная химическая бивалентная таблетированная вакцина | Per os Однократно | 3 таблетки (1 человекодоза) | На 14-е сутки после иммунизации вирулентной культурой в дозе 2×109 м.к. | 27 | 5,36 | 8,67 | 0,94 | 2,98 | 4,79 | 0,73 | 5,80 | 12,74 | 0,75 |
| Коммерческая холерная вакцина (производства Швейцарии) | Per os Однократно | 109 убитыхм.к. | «-« | 27 | 4,69 | 13,88 | 0,84 | 3,59 | 5,10 | 0,83 | 4,50 | 6,56 | 0,71 |
| Препарат «VCG+TCP» V.cholerae 01 | Per os 2-х кратно с интервалом в 14 дней | 20 мг | «-« | 27 | 4,69 | 19,69 | 1,21 | 3,11 | 4,96 | 0,83 | 3 | 7,64 | 0,52 |
| Препарат «VCG+TCP» V.cholerae 01 | Per os 2-х кратно с интервалом в 14 дней | 40 мг | «-« | 27 | 3,23 | 7,19 | 0,54 | 1,75 | 3,18 | 0,92 | 2,14 | 4,42 | 0,79 |
| Препарат «VCG-TCP» V.cholerae 01 | Per os 2-х кратно с интервалом в 14 дней | 20 мг | «-« | 27 | 3,07 | 8,53 | 1,16 | 3,37 | 3,69 | 1,25 | 3,78 | 3,12 | 0,81 |
| Препарат «VCG-TCP» V.cholerae 0139 | Per os 2-х кратно с интервалом в 14 дней | 20 мг | «-« | 27 | 6,72 | 23,88 | 1,27 | 2,47 | 23,02 | 1,62 | 6,44 | 16,24 | 0,89 |
| Авирулентный штамм (кандидат в живые вакцины) | Per os однократно | 5×109 м.к. | - | 27 | 0,96 | 0,92 | 1,37 | 0,85 | 1,12 | 1,04 | 1,27 | 0,63 | 0,57 |
| Авирулентный штамм холерных вибрионов 0139-серогруппы | Per os 2-х кратно с интервалом в 14 дней | 5×109 м.к. | - | 27 | 0,92 | 0,42 | 0,95 | 1,57 | 0,97 | 0,99 | 1,49 | 0,42 | 0,92 |
Способ оценки качества вакцинных препаратов против холеры, включающий морфологические исследования с использованием морфометрической оценки качества препарата по безвредности и эффективности местной защитной реакции по состоянию трех групп клеточных элементов: межэпителиальные лимфоциты, апудоциты, бокаловидные клетки из трех отделов кишечника - двенадцатиперстной, подвздошной и восходящего отдела ободочной кишки с применением коэффициентов и индексов, вычисляемых по формулам
индекс регенеративной активности ИР
коэффициент активности апудоцитов КА
где Иап - активность апудоцитов определяют по формуле
коэффициент секреторной активности КС
где Иса - секреторная активность определяют по формуле
при этом безвредность оценивают по величине индексов и коэффициентов отношением данных, полученных при морфометрическом анализе опытных образцов, к контролю, причем препарат считают безвредным при отклонении показателя от единицы не более чем на 0,5, а эффективность защиты вакцинного препарата оценивают по величине индексов и коэффициентов отношением данных, полученных при морфометрическом анализе контрольных образцов, к опытным, считая значения коэффициентов КА и КС больше 1,5 и индекса ИР меньше или равно 1 достаточной степенью защиты от патогена.