Водорастворимые производные фенилпиридазина и содержащие их лекарственные средства
Иллюстрации
Показать всеИзобретение относится к производному фенилпиридазина формулы (I), где: R1 представляет собой С1-С12алкил, необязательно содержащий С3-С6 циклические алкильные структуры или необязательно замещенный фенилом, который может быть замещен 1-2 атомами галогена или С1-С12алкенил, замещенный фенилом, который может быть замещен атомом галогена; R2 и R3, каждый независимо, представляет водород или С1-С12алкил, C1-С12гидроксиалкил, С1-С12дигидроксиалкил или С3-С12алкинил, или R2 и R3, соединенные вместе со смежным атомом азота, образуют 5-6-членную насыщенную гетероциклическую группу, содержащую 1-2 атома азота и необязательно содержащую атом кислорода, при этом указанная гетероциклическая группа необязательно замещена С1-С12алкильной, C1-С12алкоксикарбонильной или фенилС1-С7алкильной группой; X, Y и Z, каждый независимо, представляет водород или галоген, С1-С12алкил, который может быть замещен атомом(ами) галогена, С1-С12алкокси, С1-С12алкилтио, С1-С12алкилсульфинил или С1-С12алкилсульфонил, или фенил; и n означает число от 1 до 5; при условии, что R2 и R3 одновременно не являются водородом или одинаковыми C1-С3алкильными группами, когда R1 представляет собой бензильную группу или C1-С3 алкильную группу; или его соли. Эти соединения обладают ингибиторной активностью против продуцирования интерлейкина IL-1β, высокой растворимостью в воде и хорошей пероральной абсорбируемостью. Изобретение также относится к лекарственному средству, ингибитору продуцирования интерлейкина-1β фармацевтической композиции, применению вышеописанных соединений, способу лечения заболевания, вызванного стимуляцией продуцирования интерлейкина-1β и способу лечения заболеваний иммунной системы, воспалительных заболеваний, ишемических заболеваний, остеопороза или септицемии с помощью вышеописанных соединений. 7 н. и 15 з.п. ф-лы, 4 ил., 2 табл.
Реферат
Область изобретения
Настоящее изобретение относится к водорастворимым производным фенилпиридазина, которые демонстрируют отличную активность по ингибированию продуцирования интерлейкина-1β, обладают высокой водорастворимостью и пероральной абсорбируемостью и являются полезными, например, для профилактики и лечения заболеваний иммунной системы, воспалительных заболеваний и ишемических заболеваний, а также к лекарственным средствам, содержащим такие соединения в качестве активного ингредиента.
Предпосылки изобретения
При многих заболеваниях, таких как ревматизм, артрит, остеопороз, воспалительный колит, синдром иммунодефицита, септицемия, гепатит, нефрит, ишемические заболевания, инсулинзависимый сахарный диабет, артериальный склероз, болезнь Паркинсона, болезнь Альцгеймера и лейкоз, наблюдается стимуляция продуцирования интерлейкина-1β, воспалительного цитокина. Такой интерлейкин-1β индуцирует синтез фермента, который, как считается, участвует в воспалении, такого как коллагеназа и PLA2, и при введении путем внутрисуставной инъекции животным вызывает многосуставные повреждения, сильно напоминающие ревматоидный артрит. С другой стороны, в здоровом организме активность интерлейкина-1β контролируется рецептором интерлейкина-1, растворимым рецептором интерлейкина-1 и антагонистом рецептора интерлейкина-1.
В результате исследований, проводимых с использованием рекомбинантных вариантов таких ингибирующих биоактивность веществ, антиинтерлейкин-1β антител и антител против рецептора, направленных против различных моделей заболеваний, а также в результате исследований, проводимых с использованием "knockout" мышей, было обнаружено, что интерлейкин-1β играет важную роль в организме, такие исследования ведут к увеличению потенциала веществ, обладающих активностью ингибирования интерлейкина-1β, в качестве терапевтических средств для лечения таких заболеваний.
Например, были сообщения о том, что иммуносупрессоры и стероиды, используемые для лечения ревматизма, ингибируют продуцирование интерлейкина-1β. Из разрабатываемых в настоящее время соединений, KE298, производное бензоилпропионовой кислоты [The Japanese Society of Inflammation (11th), 1990], например, как сообщалось, демонстрирует ингибиторную активность против продуцирования интерлейкина-1β, хотя оно является иммунорегулятором. Ингибиторная активность против продуцирования интерлейкина-1β также наблюдается у группы соединений, называемых "селективными ингибиторами COX-2", таких как нимесулид, который представляет собой производное феноксисульфонанилида (DE 2333643), T-614, который представляет собой производное феноксибензопирана (US Patent 4954518), и тенидап (производное оксииндола), являющийся двойным ингибитором (COX-1/5-LO).
Однако активность по ингибированию продуцирования интерлейкина-1β не является основным действием какого-либо из указанных соединений, следовательно, ингибиторная активность против продуцирования интерлейкина-1β меньше, чем их основное действие.
Недавно были проведены широкие исследования в области синтеза, в основном направленные на исследование ингибиторной активности против продуцирования интерлейкина-1β. Ингибиторы продуцирования можно классифицировать на (1) группу соединений, которые ингибируют процесс передачи сигнала воспаления ядрам клеток, и (2) другую группу соединений, которые ингибируют фермент ICE, функционирующий в процессинге предшественника интерлейкина-1β. Известные примеры соединений, которые, как полагают, обладают первым действием (1), включают SB203580 [Japanese Language Laid-Open (Kohyo) Publication (PCT) No. HEI 7-503017], FR167653 (Eur. J. Pharm., 327, 169-175, 1997), E-5090 (EP 376288), CGP47969A (Gastroenterology, 109, 812-828, 1995), производные гидроксииндола (Eur. J. Med. Chem.31, 187-198, 1996), и производные триарилпиррола (WO 9705878), тогда как известные примеры соединений, которые, как полагают, обладают вторым действием (2), включают VE-13,045, которое является пептидным соединением (Cytokine, 8 (5), 377-386, 1996).
Однако ни одно из этих соединений не проявляет достаточную ингибиторную активность против продуцирования интерлейкина-1β.
С другой стороны, известно, что производные 5,6-дифенилпиридазина проявляют аналгетическое и противовоспалительное действие (Eur. J. Med. Chem., 14, 53-60, 1979). Кроме того, 6-фенилпиридазиноны, как сообщалось, являются полезными в качестве кардиотонических соединений (US Patent 4404203). Однако не было никаких сообщений относительно ингибиторной активности этих пиридазиновых соединений против продуцирования интерлейкина-1β.
Ранее, в WO 99/44995, авторы настоящего изобретения сообщали, что высокую ингибиторную активность против продуцирования интерлейкина-1β наблюдали у производных фенилпиридазина. Недавно сообщалось о некоторых соединениях фенилпиридазина, обладающих ингибиторной активностью против продуцирования интерлейкина-1β (JP 7-69894 A, WO 98/41511, WO 99/10331, WO 99/10332, WO 99/25697, WO 00/50408). Однако указанные в этих заявках соединения отличаются по своей химической структуре от соединений по настоящему изобретению.
Описание изобретения
Соединения, раскрытые в WO 99/44995, проявляют сильную ингибиторную активность против продуцирования интерлейкина-1β. Однако растворимость в воде таких соединений настолько низкая, что их формулирование в фармацевтические препараты, такие как таблетки, практически невозможно. В ходе дальнейших исследований авторы настоящего изобретения обнаружили, что введение замещенной или незамещенной аминоалкильной группы в положение 4 6-фенилпиридазин-3-она дает соединение, полезное в качестве профилактического или терапевтического средства для лечения заболеваний иммунной системы, воспалительных заболеваний и ишемических заболеваний, например, благодаря его значительно улучшенной водорастворимости, хорошей пероральной абсорбируемости и отличной ингибиторной активности против и продуцирования нтерлейкина-1β, что привело к созданию настоящего изобретения.
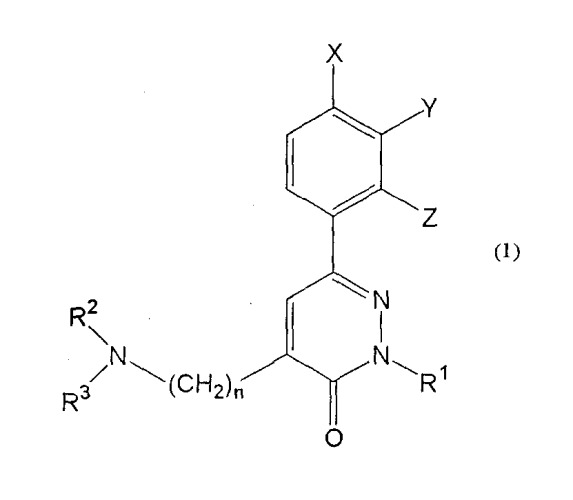
Таким образом, в одном своем аспекте настоящее изобретение обеспечивает соединение фенилпиридазина, представленное формулой (1):
где:
R1 представляет собой замещенную или незамещенную алкильную группу или замещенную или незамещенную алкенильную группу;
R2 и R3, каждый независимо, представляет собой атом водорода или алкильную, гидроксиалкильную, дигидроксиалкильную или алкинильную группу, или R2 и R3, соединенные вместе со смежным атомом азота, могут образовывать замещенную или незамещенную азотсодержащую насыщенную гетероциклическую группу;
X, Y и Z, каждый независимо, представляет собой атом водорода или галогена, замещенную или незамещенную алкильную, алкокси, алкилтио, алкилсульфинильную или алкилсульфонильную группу или замещенную или незамещенную арильную группу; и
n имеет значение от 1 до 5;
при условии, что R2 и R3 одновременно не могут представлять атомы водорода или одинаковые C1-C3 алкильные группы, когда R1 представляет собой бензильную группу или C1-C3 алкильную группу; или его соль.
В другом аспекте настоящего изобретения обеспечивается также лекарственное средство, включающее соединение фенилпиридазина (1) или его соль в качестве активного ингредиента.
В следующем аспекте настоящего изобретения обеспечивается также фармацевтическая композиция, включающая соединение фенилпиридазина (1) или его соль и фармакологически приемлемый носитель.
В еще одном аспекте настоящего изобретения обеспечивается также соединение фенилпиридазина (1) или его соль для получения лекарственного средства.
И в еще одном аспекте настоящего изобретения обеспечивается также способ лечения заболевания, вызванного стимуляцией продуцирования интерлейкина-1β, который включает введение соединения фенилпиридазина (1) или его соли.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 графически представлена пероральная абсорбируемость соединения по настоящему изобретению (Пример 83) и сравнительного соединения 3;
На фиг.2 графически представлена пероральная абсорбируемость другого соединения по настоящему изобретению (Пример 23);
На фиг.3 графически представлена пероральная абсорбируемость еще одного соединения по настоящему изобретению (Пример 25);
На фиг.4 графически представлена пероральная абсорбируемость еще одного соединения по настоящему изобретению (Пример 143).
НАИЛУЧШИЕ СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В приведенной выше формуле (1), алкильные фрагменты в алкильной, гидроксиалкильной, дигидроксиалкильной, алкокси, алкилтио, алкилсульфинильной и алкилсульфонильной группах представляют собой фрагменты, содержащие от 1 до 12 атомов углерода, более предпочтительно от 1 до 7 атомов углерода. Такие алкильные фрагменты могут включать линейные, разветвленные и циклические алкильные группы, а также алкильные группы, содержащие циклические структуры, например метил, этил, н-пропил, изопропил, н-бутил, изобутил, циклопропил, циклобутил, циклопентил, циклогексил, циклопропилметил, циклопропилэтил, циклобутилметил, циклопентилметил и циклогексилметил.
В приведенной выше формуле (1), алкильная группа, представленная R1, предпочтительно содержит от 1 до 12 атомов углерода, более предпочтительно, от 1 до 7 атомов углерода, например, от 4 до 7 атомов углерода. Примерами таких алкильных групп являются линейные, разветвленные и циклические алкильные группы, а также алкильные группы, содержащие циклические структуры. Предпочтительные примеры могут включать метил, этил, пропил, изобутил, циклобутил, циклопентил, циклогексил, циклопропилметил, циклопропилэтил, циклобутилметил, циклопентилметил и циклогексилметил, при этом метил, этил, изобутил, циклопропилметил и циклопентилметил являются особенно предпочтительными.
Алкенильная группа, представленная R1, предпочтительно содержит от 2 до 12 атомов углерода, при этом количество атомов углерода от 2 до 7 является особенно предпочтительным. Примерами таких алкенильных групп являются линейные и разветвленные алкенильные группы, в частности винил, пропенил, бутенил и пентенил.
Примерами группы (групп), которые алкильные или алкенильные группы, представленные R1, могут содержать в качестве заместителя (ей), являются замещенные или незамещенные арильные группы и замещенные или незамещенные гетероарильные группы. Примеры арильных групп включают арильные группы, содержащие от 6 до 14 атомов углерода, в частности фенил и нафтил, при этом фенил является особенно предпочтительным. Примеры гетероарильных групп, с другой стороны, включают 5- или 6-членные гетероарильные группы, содержащие от 1 до 3 атомов азота, в частности пирролил, имидазолил, пиразолил, пиридил, пиримидил, пиразинил и пиридазинил, при этом пиридил является особенно предпочтительным.
Такие арильные или гетероарильные группы могут содержать от 1 до 3 заместителей, таких как атом галогена, алкильные группы или алкокси группы. Примеры атома галогена включают фтор, хлор, бром и иод, при этом фтор и хлор являются особенно предпочтительными. Указанные алкильные и алкокси группы предпочтительно содержат от 1 до 12 атомов углерода, при этом количество атомов углерода от 1 до 7 является особенно предпочтительным.
Алкильные, гидроксиалкильные и дигидроксиалкильные группы, представленные R2 и R3, предпочтительно содержат от 1 до 12 атомов углерода, при этом количество атомов углерода от 1 до 7 является особенно предпочтительным. Предпочтительно такие группы могут быть линейными или разветвленными. Конкретные примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, гидроксиэтил, гидроксипропил, гидроксибутил, дигидроксипропил и дигидроксибутил.
Алкинильные группы, представленные R2 и R3, предпочтительно содержат от 3 до 12 атомов углерода, при этом количество атомов углерода от 3 до 7 является особенно предпочтительным. Примеры представляют собой пропаргил (2-пропинил).
Примерами азотсодержащей насыщенной гетероциклической группы, которая может быть образована в результате соединения R2 и R3 со смежным атомом азота, являются 5-7-членные насыщенные гетероциклические группы, в частности пирролидинил, пиперидино, пиперазинил, гомопиперазинил и морфолино, при этом пиперазинил, пиперидино и морфолино являются особенно предпочтительными.
Примерами группы (групп), которые указанные гетероциклические группы могут содержать в качестве заместителя (ей), являются атом галогена, алкильные группы, алкоксикарбонильные группы и аралкильные группы. Примеры атома галогена включают фтор, хлор, бром и иод. Алкильные группы могут содержать от 1 до 12 атомов углерода, предпочтительно, от 1 до 7 атомов углерода. Примерами алкоксикарбонильных групп являются C1-C12 алкилоксикарбонильные группы, при этом C1-C7 алкилоксикарбонильные группы являются предпочтительными. Примерами аралкильных групп являются группы фенил (C1-C7 алкил), при этом особенно предпочтительным является бензил.
Примерами атомов галогена, представленных X, Y и Z, являются фтор, хлор, бром и иод. Алкильные группы могут содержать от 1 до 12 атомов углерода, при этом количество атомов углерода от 1 до 7 является особенно предпочтительным. Из таких алкильных групп линейные или разветвленные группы являются особенно предпочтительными. Примерами группы (групп), которые алкильная группа может содержать в качестве заместителя (ей), являются атомы галогенов и алкоксигруппы. Алкокси, алкилтио, алкилсульфинильные и алкилсульфонильные группы могут содержать от 1 до 12 атомов углерода, при этом количество атомов углерода от 1 до 7 является особенно предпочтительным. Из таких алкокси, алкилтио, алкилсульфинильных и алкилсульфонильных групп линейные или разветвленные группы являются особенно предпочтительными. Конкретные примеры включают метокси, этокси, пропокси, изопропокси, бутокси, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, бутилсульфинил, метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил и бутилсульфонил. Примерами арильной группы являются арильные группы, содержащие от 6 до 14 атомов углерода, в частности фенил и нафтил, при этом фенил является особенно предпочтительным. Примерами группы (групп), которые арильная группа может содержать в качестве заместителя (ей), являются атомы галогенов, алкильные группы и алкоксигруппы.
n представляет собой число от 1 до 5, более предпочтительно от 1 до 3, и наиболее предпочтительно, 1 или 3.
Когда R1 представляет собой бензильную группу или C1-C3 алкильную группу, R2 и R3 одновременно не являются атомами водорода или одинаковыми C1-C3 алкильными группами.
В формуле (1) в качестве R1 особенно предпочтительными являются изобутил, циклопропилметил, циклопентилметил, циннамил, галогенциннамил, бензил, галогенобензил, дигалогенобензил и (галогенофенил)пропил. В качестве R2 и R3 предпочтительными являются водород, C1-7 алкил, C1-7 гидроксиалкил и пропаргил. В качестве гетероциклической группы, образованной R2 и R3, предпочтительными являются пиперазинил, пиперидино, пирролидинил и морфолино, каждый из которых необязательно замещен одной или несколькими C1-7 алкильными или бензильными группами. В качестве X предпочтительными являются метил, метокси, метилтио и галогены. В качестве Y предпочтительными являются водород, метил и галогены. В качестве Z предпочтительным является водород. Предпочтительными значениями n являются 1 и 3.
В качестве соли соединения (1) по настоящему изобретению предпочтительной является кислотно-аддитивная соль. Примеры кислотно-аддитивной соли включают соли неорганических кислот, такие как гидрохлорид, сульфат, нитрат и фосфат, и соли органических кислот, такие как метансульфонат, малеат, фумарат, цитрат и оксалат.
Соединения по настоящему изобретению могут также существовать в форме сольватов или кето-енольных таутомеров. Такие сольваты и таутомеры входят в объем настоящего изобретения. Примерами сольватов являются такие сольваты, которые образуются в результате добавления растворителей, используемых при получении соединений, например воды и спиртов. Нет никаких конкретных ограничений, касающихся растворителей, при условии, что они не оказывают неблагоприятного влияния на ингибиторную или подобную активность соединения по настоящему изобретению против продуцирования интерлейкина-1β. В качестве сольвата предпочтительным является гидрат.
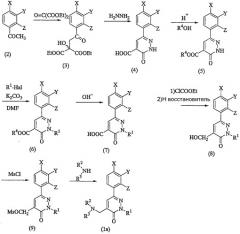
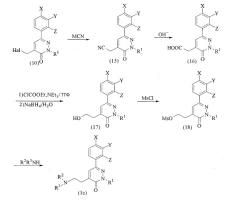
Соединение фенилпиридазина (1) по настоящему изобретению можно получить, например, с использованием указанных ниже способов получения (a) - (d).
Способ получения соединений формулы (1),
в которых n=1
где R4 представляет собой алкильную группу, Hal представляет собой атом галогена, Ms представляет собой метансульфонильную группу и R1, R2, R3, X, Y и Z имеют значения, определенные выше.
Далее будут описаны отдельные стадии реакций.
На стадиях от ацетофенона (2) до соединения (5) ацетофенон (2) и диэтилкетомалонат нагревают при перемешивании с получением соединения (3). Соединение подвергают воздействию гидразина для осуществления реакции циклизации и затем продукт реакции обрабатывают щелочью, например гидроксидом натрия или т.п., с получением соединения (4). Затем соединение (4) подвергают взаимодействию со спиртом, таким как метанол, с получением соединения (5).
R1-Hal подвергают взаимодействию с соединением (5) в присутствии щелочи, такой как карбонат калия, с получением соединения (6). Соединение (6) гидролизуют с получением соединения (7). После воздействия на соединение (7) этилхлоркарбонатом для преобразования его в ангидрид кислоты, ангидрид кислоты восстанавливают при помощи восстановителя, такого как боргидрид натрия, с получением соединения (8). Взаимодействие метансульфонилхлорида с соединением (8) в присутствии основания, такого как триэтиламин, дает соединение (9), являющееся ключевым промежуточным соединением в этой схеме реакций.
Реакция желаемого амина (R2 (R3)NH) с соединением (9) дает целевое соединение (1a). Эту реакцию предпочтительно осуществлять, например, в полярном растворителе, таком как диметилформамид, в присутствии или в отсутствие щелочи, такой как карбонат калия. В случае если в группе R2 или R3 в амине содержится аминогруппа, реакцию можно осуществлять с использованием исходного вещества, защищенного подходящей защитной группой, например алкоксикарбонильной группой, с последующим удалением защитной группы.
Для получения соединения (1a), в котором R2 и R3 являются атомами водорода, фталимид калия подвергают взаимодействию с соединением (9) и затем продукт реакции подвергают взаимодействию с гидразином или т.п.
Соединение (1a), в котором X, Y и/или Z представляет собой метилсульфинильную группу или метилсульфонильную группу, можно получить окислением соответствующего соединения, в котором X, Y и/или Z представляет собой метилтиогруппу, перкислотой, например пербензойной кислотой. Такое метилсульфинирование или метилсульфонирование можно осуществлять на стадии промежуточного соединения (9).
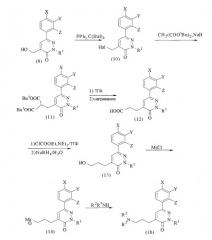
Способ получения соединений формулы (1),
в которых n=3
где Hal, Ms, R1, R2, R3, X, Y и Z имеют значения, определенные выше.
В соответствии со способом получения (b) тетрагалогенид углерода, такой как тетрабромид углерода, сначала подвергают взаимодействию с соединением (8), в присутствии трифенилфосфина с получением галогенида (10) с последующим взаимодействием этого соединения с малонатом в присутствии гидрида натрия с получением соединения (11). Соединение (11) подвергают взаимодействию с кислотой, такой как трифторуксусная кислота, для преобразования его в дикарбоновую кислоту с последующим нагреванием с получением соединения (12). Соединение (12) подвергают воздействию этилхлоркарбоната для преобразования в ангидрид кислоты, который затем восстанавливают при помощи восстановителя, такого как боргидрид натрия, с получением соединения (13). Соединение (13) подвергают взаимодействию с метансульфонилхлоридом в присутствии основания, такого как триэтиламин, с получением соединения (14), ключевого промежуточного соединения в способе по настоящему изобретению.
Целевое соединение (1b) можно получить взаимодействием соответствующего амина (R2R3NH) с соединением (14). Эту реакцию можно предпочтительно осуществлять, например, в присутствии или в отсутствие щелочи, такой как карбонат калия, в полярном растворителе, таком как диметилформамид. Когда в группе R2 или R3 амина содержится аминогруппа, реакцию можно осуществлять с использованием исходного вещества, в котором аминогруппа защищена подходящей защитной группой (например, алкоксикарбонильной группой), с последующим удалением защитной группы.
Для получения соединения (1b), в котором R2 и R3 оба представляют собой атомы водорода, это соединение может быть получено взаимодействием фталимида калия с соединением (14) и затем взаимодействием с гидразином или т.п.
(c) Способ получения соединений формулы (1),
в которых n=2
где M представляет атом металла, и Hal, Ms, R1, R2, R3, X, Y и Z имеют значения, определенные выше.
В соответствии со способом получения (c) цианид, такой как цианид натрия, подвергают взаимодействию с галогенидом (10) для преобразования его в нитрильное производное (15), которое затем гидролизуют с получением соединения (16). Из соединения (16) целевое соединение (1c) может быть получено через производное спирта (17) и мезилоксипроизводное (18) с использованием процедуры, аналогичной той, которую используют для получения соединений, каждое из которых содержит три метиленовых группы.
(d) Способ получения соединений формулы (1),
в которых n=4 или 5
Эти соединения можно получить путем объединения способов синтеза (b) и (c).
Соль соединения (1) по настоящему изобретению можно получить действием органической или неорганической кислоты способом, известным из уровня техники.
Соединение (1) по настоящему изобретению можно выделить и очистить, подвергая его очистке, обычно проводимой в химии органического синтеза, например фильтрации, экстракции, промывке, сушке, концентрированию, перекристаллизации, различным хроматографическим методам и/или т.п. Каждый промежуточный продукт можно использовать в последующей реакции без дополнительной очистки. Соединение (1) может быть получено в форме сольвата, в частности в форме гидрата, при использовании растворителя, такого как растворитель, используемый в реакции, или растворитель для перекристаллизации.
Соединение (1) по настоящему изобретению обладает отличной растворимостью в воде, оно также хорошо абсорбируется при пероральном введении и обладает ингибиторной активностью против продуцирования интерлейкина-1β и поэтому является полезным в качестве профилактического или терапевтического средства для лечения заболеваний иммунной системы, воспалительных заболеваний, ишемических заболеваний, остеопороза, ишемии и т.п. Примеры ишемических заболеваний включают ишемические заболевания сердца, ишемическую энцефалопатию, ишемический нефрит и ишемический гепатит.
Фармацевтическая композиция по настоящему изобретению содержит в качестве активного ингредиента соединение (1) или его соль. Активный ингредиент можно использовать отдельно или вместе с фармакологически приемлемым носителем, таким как солюбилизатор, эксципиент, связующее или наполнитель, для получения фармацевтических препаративных форм, таких как таблетки, капсулы, гранулы, порошки, инъекции и суппозитории. Такие фармацевтические препараты можно получать известными методами. Например, препараты для перорального введения можно получать формулированием соответствующих композиций соединения (1) или его соли в сочетании с солюбилизаторами, такими как камедь трагаканта, аравийская камедь, сложные эфиры сахарозы, лецитин, оливковое масло, соевое масло и ПЭГ 400; эксципиентами, такими как крахмал, маннит и лактоза; связующими, такими как натрий карбоксиметилцеллюлоза и гидроксипропилцеллюлоза; разрыхлителями, такими как кристаллическая целлюлоза и кальций карбоксиметилцеллюлоза; смазывающими веществами, такими как тальк и стеарат магния; агентами против прилипания, такими как легкая безводная кремневая кислота. Фармацевтические композиции по настоящему изобретению водят перорально или парентерально.
Вводимая доза фармацевтической композиции по настоящему изобретению варьирует в зависимости от веса тела, возраста, пола, условий и т.п. каждого пациента. Однако, как правило, предпочтительно введение взрослому человеку примерно от 0,01 до 1000 мг, предпочтительно от 0,1 до 100 мг фармацевтической композиции по настоящему изобретению в расчете на соединение (1), в день 1 - 3 порциями.
ПРИМЕРЫ
Далее настоящее изобретение будет описано со ссылкой на примеры. Примеры представлены исключительно в целях иллюстрации, и никоим образом не должны рассматриваться как ограничивающие изобретение.
Пример 1
Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она
1) Получение4-(1-гидроксиэтил)-2-фтортолуола
К охлажденному льдом раствору 3-фтор-4-метилбензальдегида (50 мг, 0,36 ммоль) в ТГФ (0,5 мл) добавляли по каплям 0,93 M раствор (0,47 мл) метилмагнийбромида (0,44 ммоль) в ТГФ. Смеси снова давали нагреться до комнатной температуры, при которой реакционную смесь перемешивали в течение 1 часа. Затем добавляли 2 моль/л хлористоводородной кислоты и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением указанного в заголовке соединения в виде бледно-желтого масла (55,8 мг, количественный выход).
1H ЯМР (400 МГц, CDCl3) δ: 1,46 (3Н, д, J=6,4 Гц), 2,26 (3Н, д, J=1,8 Гц), 4,85 (1Н, кв., J=6,4 Гц), 6,99-7,06 (2Н, м), 7,14 (1Н, дд, J=7,8, 7,8 Гц).
2) Получение 3'-фтор-4'-метилацетофенона
К раствору 4-(1-гидроксиэтил)-2-фтортолуола (55,8 мг, 0,36 ммоль) в метиленхлориде (1 мл) добавляли молекулярные сита 4A (56,0 мг) и PCC 94,0 мг (0,43 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали через Celite и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением указанного в заголовке соединения в виде бледно-желтого масла (47,5 мг, 86,0%).
1H ЯМР (400 МГц, CDCl3) δ: 2,32 (3Н, д, J=1,8 Гц), 2,56 (3Н, с), 7,26 (1Н, дд, J=7,6, 7,6 Гц), 7,56 (1Н, дд, J=1,6, 10,4 Гц), 7,62 (1Н, дд, J=1,6, 7,8 Гц).
3) Получение этил 2-этоксикарбонил-4-(3-фтор-4-метилфенил)-2-гидрокси-4-оксобутаноата
Смесь 3'-фтор-4'-метилацетофенона (4,92 г, 32,3 ммоль) и диэтилкетомалоната (6,19 г, 35,6 ммоль) перемешивали при 120°С в течение 48 час. Температуре реакционной смеси давали понизиться до комнатной и смесь очищали колоночной хроматографией на силикагеле [силикагель 100 г, хлороформ/этилацетат (10/1)] с получением указанного в заголовке соединения в виде желтых кристаллов (8,41 г, 79,3%).
Температура плавления: 68,7-69,0°С
1H ЯМР (400 МГц, CDCl3) δ: 1,30 (6Н, т, J=7,1 Гц), 2,34 (3Н, с), 3,78 (2Н, с), 4,25 (1Н, с), 4,31 (4Н, кв., J=7,1 Гц), 7,29 (1Н, дд, J=7,6 Гц), 7,59 (1Н, д, J=10,2 Гц), 7,65 (1Н, дд, J=1,5, 7,8 Гц).
ИК (KBr) см-1: 3485, 1740, 1684, 1253, 856, 577.
4) Получение 4-карбокси-6-(3-фтор-4-метилфенил)-2H-пиридазин-3-она
К раствору этил 2-этоксикарбонил-4-(3-фтор-4-метилфенил)-2-гидрокси-4-оксобутаноата (8,41 г, 25,8 ммоль) в изопропаноле (100 мл) добавляли гидразинмоногидрат (2,84 г, 56,8 ммоль) и смесь нагревали при перемешивании при 100°С в течение 6 час. Затем добавляли 2 моль/л гидроксида натрия и смесь продолжали перемешивать при той же температуре в течение 4 час. Реакционную смесь охлаждали на льду и добавляли концентрированную хлористоводородную кислоту для подкисления системы. Осадок отфильтровывали, тщательно промывали водой и сушили с получением указанного в заголовке соединения в виде желтоватого кристаллического порошка (5,67 г, 87,7%).
Температура плавления: 281,3-282,0°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 2,28 (3Н, д, J=1,0 Гц), 7,41 (1Н, дд, J=8,1, 8,1 Гц), 7,67-7,73 (2Н, м), 8,49 (1Н, с), 14,09 (1Н, ушир.).
ИК (KBr) см-1: 1736, 1641, 1441, 1125, 926, 806.
5) Получение 6-(3-фтор-4-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-она
К охлажденной льдом суспензии 4-карбокси-6-(3-фтор-4-метилфенил)-2H-пиридазин-3-она (5,50 г, 22,2 ммоль) в метаноле (100 мл) добавляли по каплям тионилхлорид (2,72 г, 24,4 ммоль) и смесь перемешивали при 80°С в течение 8 час. Температуре реакционной смеси давали понизиться до комнатной и растворитель отгоняли при пониженном давлении. К охлажденному на льду остатку добавляли воду. Осадок отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения в виде бледно-желтых тонких игольчатых кристаллов (5,43 г, 92,7%).
Температура плавления: 206,0-207,3°С
1H ЯМР (400 МГц, CDCl3) δ: 2,33 (3Н, д, J=1,7 Гц), 4,00 (3Н, с), 7,29 (1Н, дд, J=7,9, 7,9 Гц), 7,46-7,53 (2Н, м), 8,32 (1Н, с), 11,61 (1Н, с).
ИК (KBr) см-1: 1715, 1671, 1266, 1177, 1091, 812.
6) Получение 6-(3-фтор-4-метилфенил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-она
К раствору 6-(3-фтор-4-метилфенил)-4-метоксикарбонил-2H-пиридазин-3-она (5,28 г, 20,0 ммоль) в N,N-диметилформамиде (40 мл) добавляли карбонат калия (5,53 г, 40,0 ммоль) и изобутилбромид (3,29 г, 24,0 ммоль) и смесь перемешивали при 80°С в течение 1 часа. Температуре реакционной смеси давали снова понизиться до комнатной. Добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле [силикагель 100 г, хлороформ/метанол (100/1→50/1)) с получением указанного в заголовке соединения в виде оранжевого масла (5,41 г, 84,9%).
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,6 Гц), 2,32-2,42 (1Н, м), 2,33 (3Н, с), 3,98 (3H, с), 4,12 (2Н, д, J=7,4 Гц), 7,28 (1Н, дд, J=7,8, 7,8 Гц), 7,46 (1Н, дд, J=1,6, 7,8 Гц), 7,50 (1Н, дд, J=1,6, 10,7 Гц), 8,21 (1Н, с).
7) Получение 4-карбокси-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она
К суспензии 6-(3-фтор-4-метилфенил)-2-изобутил-4-метоксикарбонил-2H-пиридазин-3-она (5,27 г, 16,6 ммоль) в метаноле (50 мл) добавляли 2 моль/л водного раствора гидроксида натрия (50 мл) и смесь перемешивали при 60°С в течение 15 мин. Температуре реакционной смеси давали снова понизиться до комнатной и затем добавляли воду. После подкисления системы концентрированной хлористоводородной кислотой, смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смеси хлороформ-гексан с получением указанного в заголовке соединения в виде бесцветных тонких игольчатых кристаллов (4,73 г, 93,8%).
Температура плавления: 159,0-159,5°С
1H ЯМР (400 МГц, CDCl3) δ: 1,02 (6Н, д, J=6,7 Гц), 2,33-2,42 (1Н, м), 2,35 (3Н, д, J=1,6 Гц), 4,21 (2Н, д, J=7,4 Гц), 7,32 (1Н, dd, J=7,8,7,8 Гц), 7,52 (1Н, dd, J=1,8,8,0 Гц), 7,55 (1Н, дд, J=1,8, 10,6 Гц), 8,63 (1Н, с), 14,13 (1Н, с).
ИК (KBr) см-1: 2960, 1742, 1633, 1574, 1425, 1101, 820.
8) Получение 6-(3-фтор-4-метилфенил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-она
К раствору 4-карбокси-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она (4,53 г, 14,9 ммоль) в ТГФ (40 мл) добавляли триэтиламин (1,66 г, 16,4 ммоль). К охлажденной льдом смеси добавляли по каплям раствор этилхлоркарбоната (1,78 г, 16,4 ммоль) в ТГФ (5 мл) и смесь перемешивали в течение 30 мин. Гидрохлорид триэтиламина отфильтровывали. К фильтрату добавляли раствор боргидрида натрия (564 мг, 14,9 ммоль) в воде (1 мл) и смесь перемешивали при комнатной температуре в течение 10 мин. Затем к реакционной смеси добавляли 2 моль/л хлористоводородной кислоты и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле [силикагель 300 г, хлороформ/метанол (100/1>50/1)) с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (1,08 г, 25,0%).
Температура плавления: 147,3-147,5°С
1H ЯМР (400 МГц, CDCl3)δ: 0,99 (6Н, д, J=6,6 Гц), 2,29-2,39 (1Н, м), 2,32 (3Н, д, J=1,8 Гц), 3,05 (1Н, т, J=6,0 Гц), 4,08 (2Н, д, J=7,4 Гц), 4,71 (2Н, дд, J=1,2, 6,0 Гц), 7,26 (1Н, дд, J=7,8 Гц), 7,46 (1Н, дд, J=7,8, 7,8 Гц), 7,50 (1Н, дд, J=1,8, 10,8 Гц), 7,65 (1Н, с).
ИК (KBr) см-1: 3330, 1644, 1596, 1514, 1226, 1087, 824.
9) Получение 6-(3-фтор-4-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-она
К охлажденному льдом раствору 6-(3-фтор-4-метилфенил)-4-гидроксиметил-2-изобутил-2H-пиридазин-3-она (1,08 г, 3,73 ммоль) в метиленхлориде (20 мл) добавляли триэтиламин (491 мг, 4,85 ммоль) и метансульфонилхлорид (513 мг, 4,48 ммоль) и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и затем смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смеси хлороформ-гексан с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (964 мг, 70,4%).
Температура плавления: 142,7-143,4°С
1H ЯМР (400 МГц, CDCl3) δ: 0,99 (6Н, д, J=6,8 Гц), 2,30-2,34 (1Н, м), 2,33 (3Н, д, J=1,8 Гц), 3,17 (3Н, с), 4,08 (2Н, д, J=7,4 Гц), 5,27 (2Н, д, J=1,4 Гц), 7,27 (1Н, дд, J=7,8, 7,8 Гц), 7,45 (1Н, дд, J=1,8, 8,0 Гц), 7,50 (1Н, дд, J=1,8, 10,9 Гц), 7,76 (1Н, т, J=1,4 Гц).
ИК (KBr) см-1: 3435, 2964, 1658, 1610, 1354, 1165, 875.
10) Получение 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она
К раствору 6-(3-фтор-4-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-она (100 мг, 0,27 ммоль) в ацетонитриле (1 мл) добавляли карбонат калия (56,3 мг, 0,41 ммоль) и трет-бутил 1-пиперазинкарбоксилат (60,7 мг, 0,33 ммоль) и смесь перемешивали при 80°С в течение 2 час. Температуре реакционной смеси давали снова понизиться до комнатной и затем добавляли воду. Смесь экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле [хлороформ/метанол (40/1)] с получением указанного в заголовке соединения в виде желтого масла (115 мг, 92,4%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=3,4 Гц), 1,47 (9Н, с), 2,28-2,40 (1Н, м), 2,33 (3Н, с), 2,52 (4Н, т, J=4,7 Гц), 3,51 (4Н, т, J=4,7 Гц), 3,58 (2Н, с), 4,07 (2Н, д, 4,1 Гц), 7,27 (1Н, дд, J=7,6, 7,6 Гц), 7,44-7,52 (2Н, м), 7,77 (1Н, с).
Пример 2
Получение дигидрохлорида 6-(3-фтор-4-метилфенил)-2-изобутил-4-(1-пиперазинил)метил-2H-пиридазин-3-она
К раствору 4-(4-трет-бутоксикарбонил-1-пиперазинил)метил-6-(3-фтор-4-метилфенил)-2-изобутил-2H-пиридазин-3-она (115 мг, 0,25 ммоль) в этилацетате (2 мл) добавляли 4 моль/л раствора (2 мл) хлористоводородной кислоты в этилацетате и смесь перемешивали при 50°С в течение 1 часа. Температуре реакционной смеси давали снова понизиться до комнатной и затем добавляли диэтиловый эфир. Осадок отделяли с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка (81,1 мг, 75,0%).
Температура плавления: 186,2-195,0°С (разл.)
1H ЯМР (400 МГц, ДМСО-d6) δ: 0,95 (6Н, д, J=6,8 Гц), 2,22-2,33 (1Н, м), 2,29 (3Н, д, J=2,0 Гц), 3,15 (4Н, ушир.), 3,32 (4Н, т, J=5,2 Гц), 3,93 (2Н, с), 4,02 (2Н, д, J=7,1 Гц), 7,40 (1Н, дд, J=8,1, 8,1 Гц), 7,59-7,66 (2Н, м), 8,21 (1Н, с).
ИК (KBr) см-1: 1656, 1610, 1425, 1306, 956.
Mass m/z: 358 (M+)
Пример 3
Получение 6-(3-фтор-4-метилфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
Следуя методике примера 1(10), подвергали взаимодействию 6-(3-фтор-4-метилфенил)-2-изобутил-4-метансульфонилоксиметил-2H-пиридазин-3-он и 1-метилпиперазин с получением указанного в заголовке соединения в виде желтого масла (выход: 93,4%).
1H ЯМР (400 МГц, CDCl3) δ: 0,98 (6Н, д, J=6,8 Гц), 2,28-2,40 (1Н, м), 2,33 (6Н, с), 2,52 (4Н, ушир.), 2,62 (4Н, ушир.), 3,58 (2Н, с), 4,07 (2Н, д, J=7,4 Гц), 7,27 (1Н, дд, J=7,9, 7,9 Гц), 7,46-7,52 (2Н, м), 7,75 (1Н, д, J=1,0 Гц).
Пример 4
Получение дигидрохлорида 6-(3-фтор-4-метилфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пиридазин-3-она
К раствору 6-(3-фтор-4-метилфенил)-2-изобутил-4-(4-метил-1-пиперазинил)метил-2H-пирид