Производные вариолина и их применение в качестве противоопухолевых средств
Иллюстрации
Показать всеНастоящее изобретение относится к производным вариолина формулы (5а), где R1 выбран из группы, состоящей из галогена и С1-С12алкила; R2 выбран из водорода и галогена; R3, R4, R4, R5; R6 и R7 представляют собой водород; X1 является аминогруппой, незамещенной или замещенной C1-С12алкоксигруппой бензиламиногруппой, С1-С12алкилсульфинильной группой или С1-С12тиоалкилом; Х2 является аминогруппой, C1-С12тиоалкилом, С1-С12алкилсульфинильной группой или незамещенной или замещенной С1-С12алкоксигруппой бензиламиногруппой; или пары групп R1 и R2 могут быть объединены в конденсированную бензольную кольцевую систему, которая может быть замещена С1-С12алкоксигруппой. Вышеописанные соединения обладают противоопухолевым действием. Кроме того, объектами изобретения являются фармацевтическая композиция на основе этих соединений, применение этих соединений для получения лекарственного средства для примения при лечении рака и способ получения промежуточного вариолинового соединения. 4 н. и 12 з.п. ф-лы, 2 табл.
Реферат
Настоящее изобретение относится к противоопухолевым соединениям и, в частности, к новым противоопухолевым аналогам вариолиновых соединений, включая вариолин B и дезоксивариолин B.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
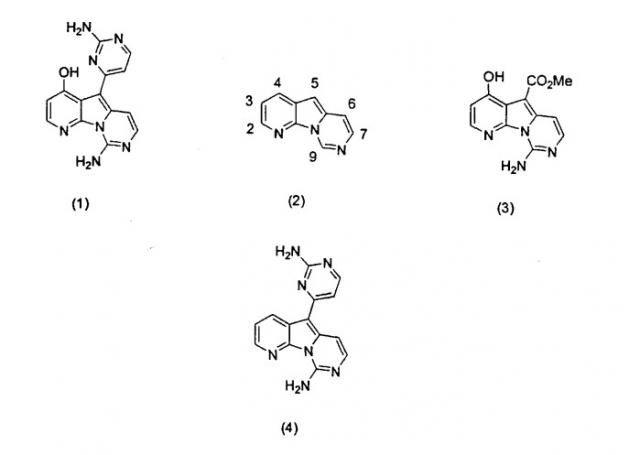
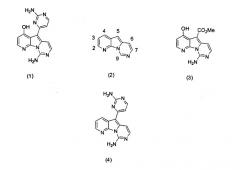
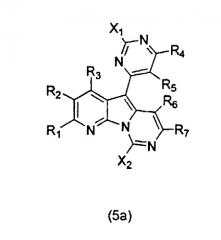
Вариолины, типичным примером которых является вариолин B (1), являются классом морских алкалоидов, выделенных из редкой и труднодоступной антарктической губки Kirkpatrickia varialosa. Все вариолины содержат конденсированный пиридо[3',2':4,5]пирроло[1,2-c]пиримидиновый остов (2) с присоединенным в положении C5 или гетероциклическим ароматическим кольцом, или сложноэфирной группой, как в вариолине B (1), вариолине D (3) и дезоксивариолине B (4).
Показано, что вариолины обладают противоопухолевой активностью и другими полезными свойствами. Полное строение этих и родственных соединений представлено в работах N.B. Perry et al., Tetrahedron 1994, 50, 3987-3992 и G. Trimurtulu et al., Tetrahedron 1994, 50, 3993-4000.
Исследования синтеза 2-аминопиримидиновых алкалоидов вариолинов и меридианинов являются предметом работы Tetrahedron Lett. 2000, 41, 4777-4780. В работе M. Alvarez et al., Tetrahedron Lett. 2001, 42, 315-317 описан синтез дезоксивариолина B с применением 7-азаиндола в качестве исходного материала. Исследования полного синтеза вариолинов описаны в работе Tetrahedron Lett. 2001, 42, 311-313. Первый полный синтез вариолина B был описан в работе R.J. Anderson et al., Tetrahedron Lett. 2001, 42, 8697-8699. Позднее в работе P. Molina et al., Tetrahedron Lett. 2002, 43, 1005-1007 также был описан синтез вариолина B путем тандемной аза-Виттиг/карбодиимидной циклизации.
В заявке на выдачу международного патента WO 0204447, опубликованной 17 января 2002 года, вместе с получением новых производных вариолина также описан способ получения вариолина B (1) и дезоксивариолина B (4) из простых моногетероароматических исходных материалов.
Заявка на выдачу международного патента WO 0212240, опубликованная 14 февраля 2002 года, относится к производным вариолина B.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям общей формулы (5), которые содержат конденсированную пиридопирролопиримидиновую кольцевую систему вариолиновых соединений:
где каждый из заместителей, определенных как X2, R1, R2, R3, R6, R7 и R12, независимо выбран из группы, включающей H, OH, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', NHSO2R', CN, галоген, =O, C(=O)H, C(=O)R', CO2H, CO2R', карбоксиалкил, C1-C12-алкил, C2-C12-алкенил, C2-C12-алкинил, замещенный или незамещенный арил, замещенный или незамещенный аралкил и замещенную или незамещенную гетероароматическую группу;
где каждая из R'-групп независимо выбрана из группы, включающей H, OH, SH, NO2, NH2, CN, галоген, =O, C(=O)H, C(=O)CH3, CO2H, CO2CH3, C1-C12-алкил, C2-C12-алкенил, C2-C12-алкинил, арил, аралкил и гетероароматическую группу;
где пары групп R1 и R2, R2 и R3, R3 и R12, R12 и R6 или R6 и R7 могут быть объединены в карбоциклическую или гетероциклическую кольцевую систему.
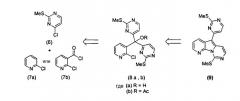
В следующем аспекте настоящее изобретение относится к соединениям формулы (5a):
где каждый из заместителей, определенных как X1, X2, R1, R2, R3, R4, R5, R6 и R7, независимо выбран из группы, состоящей из H, OH, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', NHSO2R', CN, галогена, =O, C(=O)H, C(=O)R', CO2H, CO2R', карбоксиалкила, C1-C12-алкила, C2-C12-алкенила, C2-C12-алкинила, замещенного или незамещенного арила, замещенного или незамещенного аралкила и замещенной или незамещенной гетероароматической группы;
где каждая из R'-групп независимо выбрана из группы, состоящей из H, OH, SH, NO2, NH2, CN, галогена, =O, C(=O)H, C(=O)CH3, CO2H, CO2CH3, C1-C12-алкила, C2-C12-алкенила, C2-C12-алкинила, арила, аралкила и гетероароматической группы;
где пары групп R1 и R2, R4 и R5 или R6 и R7 могут быть объединены в карбоциклическую или гетероциклическую кольцевую систему.
Подходящие галогеновые заместители в соединениях по настоящему изобретению включают F, Cl, Br и I.
Алкильные группы, предпочтительно, содержат от 1 до приблизительно 12 атомов углерода, более предпочтительно, от 1 до приблизительно 8 атомов углерода, еще более предпочтительно, от 1 до приблизительно 6 атомов углерода и, наиболее предпочтительно, 1, 2, 3 или 4 атома углерода. Метил, этил и пропил, включая изопропил, являются особенно предпочтительными алкильными группами в соединениях по настоящему изобретению. Используемый здесь термин «алкил», если не определено иначе, относится и к циклическим и к нециклическим группам, хотя циклические группы должны содержать в составе кольца, по крайней мере, три атома углерода.
Предпочтительные алкенильные и алкинильные группы в соединениях по настоящему изобретению содержат одну или несколько ненасыщенных связей и от 2 до приблизительно 12 атомов углерода, более предпочтительно, от 2 до приблизительно 8 атомов углерода, еще более предпочтительно, от 2 до приблизительно 6 атомов углерода и, еще более предпочтительно, 2, 3 или 4 атома углерода.
Используемые здесь термины «алкенил» и «алкинил» относятся и к циклическим, и к нециклическим группам, хотя неразветвленные или разветвленные нециклические группы являются, как правило, более предпочтительными.
Предпочтительные алкоксигруппы в соединениях по настоящему изобретению включают группы, содержащие одну или несколько кислородных связей и от 1 до приблизительно 12 атомов углерода, более предпочтительно, от 1 до приблизительно 8 атомов углерода и, еще более предпочтительно, от 1 до приблизительно 6 атомов углерода и, наиболее предпочтительно, 1, 2, 3 или 4 атома углерода.
Предпочтительные алкилтиогруппы в соединениях по настоящему изобретению содержат одну или несколько тиоэфирных связей и от 1 до приблизительно 12 атомов углерода, более предпочтительно, от 1 до приблизительно 8 атомов углерода и еще более предпочтительно, от 1 до приблизительно 6 атомов углерода. Алкилтиогруппы, содержащие 1, 2, 3 или 4 атома углерода, являются особенно предпочтительными.
Предпочтительные алкилсульфинильные группы в соединениях по настоящему изобретению включают те группы, которые содержат одну или несколько сульфоксидных (SO) групп и от 1 до приблизительно 12 атомов углерода, более предпочтительно, от 1 до приблизительно 8 атомов углерода и, еще более предпочтительно, от 1 до приблизительно 6 атомов углерода. Алкилсульфинильные группы, содержащие 1, 2, 3 или 4 атома углерода, являются особенно предпочтительными.
Предпочтительные алкилсульфонильные группы в соединениях по настоящему изобретению включают те группы, которые содержат одну или несколько сульфонильных (SO2) групп и от 1 до приблизительно 12 атомов углерода, более предпочтительно, от 1 до приблизительно 8 атомов углерода и, еще более предпочтительно, от 1 до приблизительно 6 атомов углерода. Алкилсульфонильные группы, содержащие 1, 2, 3 или 4 атома углерода, являются особенно предпочтительными.
Предпочтительные аминоалкильные группы включают те группы, которые содержат первичные, вторичные и/или третичные аминогруппы и от 1 до приблизительно 12 атомов углерода, более предпочтительно, от 1 до приблизительно 8 атомов углерода, еще более предпочтительно, от 1 до приблизительно 6 атомов углерода и, еще более предпочтительно, 1, 2, 3 или 4 атома углерода. Вторичные и третичные аминогруппы являются, как правило, более предпочтительными, чем радикалы первичных аминов.
Подходящие карбоксиалкильные группы включают моно- и дикарбоксизамещенные алкильные группы. Карбоксигруппы обычно представлены в виде COOR', в особенности, где R' является водородом или алкилом, предпочтительно, водородом или метилом.
Подходящие гетероциклические группы включают гетероароматические и гетероалициклические группы. Подходящие гетероароматические группы в соединениях по настоящему изобретению содержат один, два или три гетероатома, выбранных из атомов N, O или S, и включают, например, кумаринил, включая 8-кумаринил, хинолинил, включая 8-хинолинил, пиридил, пиразинил, пиримидил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, индолил, бензофуранил и бензотиазол. Подходящие гетероалициклические группы в соединениях по настоящему изобретению содержат один, два или три гетероатома, выбранных из атомов N, O или S, и включают, например, тетрагидрофуранильную, тетрагидропиранильную, пиперидинильную, морфолино- и пирролидинильную группы.
Подходящие карбоциклические арильные группы в соединениях по настоящему изобретению включают однокольцевые и многокольцевые соединения, включая многокольцевые соединения, которые содержат раздельные и/или конденсированные арильные группы. Типичные карбоциклические арильные группы содержат от 1 до 3 раздельных или конденсированных колец и от 6 до приблизительно 18 атомов углерода в составе колец. Особенно предпочтительные карбоциклические арильные группы включают фенил, включая замещенный фенил, такой как 2-замещенный фенил, 3-замещенный фенил, 4-замещенный фенил, 2,3-замещенный фенил, 2,4-замещенный фенил, 2,5-замещенный фенил, 2,6-замещенный фенил, 3,4-замещенный фенил, 3,5-замещенный фенил, 3,6-замещенный фенил, 2,3,4-замещенный, 2,3,5-замещенный, 2,3,6-замещенный, 2,4,5-замещенный, 2,4,6-замещенный и 3,4,5-замещенный фенил, включая группы, где один или несколько заместителей фенила являются группой, такой как галоген, цианогруппа, нитрогруппа, алканоил, сульфинил, сульфонил и тому подобное; нафтил, включая 1-нафтил и 2-нафтил; бифенил; фенантрил; и антрацил.
Указанные здесь ссылки на замещенные R'-группы в соединениях по настоящему изобретению относятся к конкретному радикалу, который может быть замещен в одном или нескольких доступных положениях одной или несколькими подходящими группами, например галогеном, таким как фтор, хлор, бром и йод; цианогруппой; гидроксилом; нитрогруппой; азидогруппой; алканоилом, таким как C1-6-алканоильная группа, такая как ацил, и тому подобное; карбоксамидогруппой; алкильными группами, включая те группы, которые содержат от 1 до приблизительно 12 атомов углерода, или от 1 до приблизительно 6 атомов углерода и, более предпочтительно, 1-3 атома углерода; алкенильными и алкинильными группами, включая группы, содержащие одну или несколько ненасыщенных связей и от 2 до приблизительно 12 атомов углерода, или от 2 до приблизительно 6 атомов углерода; алкоксигруппами, включая те группы, которые содержат одну или несколько кислородных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; арилоксигруппами, такими как феноксигруппа; алкилтиогруппами, включая те радикалы, которые содержат одну или несколько тиоэфирных связей и от 1 до приблизительно 12 атомов углерода, или от 1 до приблизительно 6 атомов углерода; алкилсульфинильными группами, включая те радикалы, которые содержат одну или несколько сульфинильных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; алкилсульфонильными группами, включая те радикалы, которые содержат одну или несколько сульфонильных связей и от 1 до приблизительно 12 атомов углерода, или от 1 до приблизительно 6 атомов углерода; аминоалкильными группами, такими как группы, содержащие один или несколько атомов азота и от 1 до приблизительно 12 атомов углерода, или от 1 до приблизительно 6 атомов углерода; карбоциклическим арилом, содержащим 6 или более атомов углерода, в частности фенилом (где, например, R является замещенным или незамещенным бифенильным радикалом); и аралкилом, таким как бензил.
Предпочтительно, из объема настоящего изобретения исключены известные соединения вариолин A, вариолин B, вариолин D, N-(3')-метилтетрагидровариолин B и дезоксивариолин B.
Соединения по настоящему изобретению могут быть синтезированы, используя метод, описанный в заявке на выдачу международного патента WO 0204447, в котором остов вариолина конструируют из простых моногетероароматических исходных материалов, основываясь на следующем ретросинтезе.
В зависимости от выбора моногетероароматических исходных материалов (6) и (7) методика может быть легко расширена для возможности получения широкого ряда аналогов вариолина, как представлено здесь в примерах.
Заявка на выдачу международного патента WO 0212240 также относится к руководству по синтезу вариолиновых соединений.
Таким образом, настоящее изобретение также относится к путям синтеза соединений по настоящему изобретению.
Противоопухолевая активность данных соединений включает лейкоз, рак легких, рак толстой кишки, рак почек, рак матки, рак предстательной железы, рак яичников, рак поджелудочной железы, эндотелиома, рак молочной железы, саркома и меланома.
Таким образом, настоящее изобретение относится к способу лечения любого страдающего от рака млекопитающего, в особенности человека, который включает введение больному терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтической композиции.
Другим, особенно предпочтительным, воплощением настоящего изобретения являются как применяемые в качестве противоопухолевых средств фармацевтические композиции, которые содержат в качестве активного ингредиента соединение или соединения по настоящему изобретению, так и способы их получения.
Примеры фармацевтических композиций включают любые твердые (таблетки, пилюли, капсулы, гранулы и т.д.) или жидкие (растворы, суспензии или эмульсии) композиции с подходящим составом для перорального, местного или парентерального введения.
Введение соединений или композиций по настоящему изобретению может осуществляться любым подходящим способом, таким как препарат для внутривенного введения, препарат для перорального приема, препарат для внутрибрюшинного или внутривенного введения.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ
R1, предпочтительно, является водородом, алкилом или галогеном; более предпочтительно, водородом, метилом или хлором. Альтернативно, R1 и R2, предпочтительно, образуют конденсированное кольцо, более предпочтительно, конденсированное ароматическое кольцо и, наиболее предпочтительно, конденсированное бензольное кольцо. Такое кольцо может быть замещено, например, OR', NR'2 или галогеном; более предпочтительно, гидроксигруппой, алкоксигруппой, аминогруппой или галогеном; наиболее предпочтительно, гидроксигруппой, метоксигруппой, аминогруппой, фтором или хлором.
R2, предпочтительно, является водородом или галогеном; более предпочтительно, водородом, фтором или хлором. Как было упомянуто, альтернативно R1 и R2, предпочтительно, образуют конденсированное кольцо.
R3, предпочтительно, является водородом, OR', NR'2 или галогеном; более предпочтительно, водородом, гидроксигруппой, алкоксигруппой, защищенной гидроксигруппой, аминогруппой, защищенной аминогруппой или галогеном; наиболее предпочтительно, водородом, гидроксигруппой, метоксигруппой, бензилоксигруппой, аминогруппой, метоксибензиламиногруппой или хлором.
По-видимому, наибольшая активность наблюдается, когда R3 является водородом, затем гидроксигруппой, галогеном (хлором), метоксигруппой, аминогруппой.
R4, предпочтительно, является водородом.
R5, предпочтительно, является водородом.
R6, предпочтительно, является водородом.
R7, предпочтительно, является водородом.
R12, предпочтительно, является алкилом, арилом или гетероарилом; более предпочтительно, алкилом, фенилом или гетероарилом с 5 или 6 атомами в составе кольца и 1 или 2 гетероатомами, наиболее предпочтительно, изопропилом, фенилом, пиримидинилом, тиофенилом или пиридинилом. Арильные или гетероарильные группы являются незамещенными или содержат предпочтительные заместители, выбранные из OR', в особенности, алкоксигруппы, такие как метоксигруппа, или нитрогруппы, а пиримидинил может содержать определенный заместитель X1.
По-видимому, наибольшая активность наблюдается, когда R12 является 4-пиримидинилом, как в формуле (5a).
X1, предпочтительно, является водородом, алкилом, OR', NR'2, SR', SOR', SO2R', карбоксиалкилом или аралкилом; более предпочтительно, водородом, алкилом, гидроксигруппой, алкоксигруппой, арилоксигруппой, аминогруппой, защищенной аминогруппой, тиоалкилом, алкилсульфинилом, алкилсульфонилом или дикарбоксиалкилом; наиболее предпочтительно, водородом, метилом, гидроксигруппой, метоксигруппой, этоксигруппой, бензилоксигруппой, феноксигруппой, аминогруппой, метоксибензиламиногруппой, тиометилом, метилсульфинилом, метилсульфонилом или диметилкарбоксиэтилом.
По-видимому, если X1 является SR', SOR',SO2R', то наблюдается высокая избирательность в отношении рака матки. В тестах на культуре клеток Hela активность возрастала на 2-3 порядка. Конкретно, X1, предпочтительно, является S-алкилом, SO-алкилом или SO2-алкилом, где алкилом обычно является метил.
X2, предпочтительно, является NR'2 или SR'; более предпочтительно, NH2 или тиоалкилом; наиболее предпочтительно, NH2 или тиометилом.
Таким образом, предпочтительные соединения по настоящему изобретению соответствуют формуле (5), где заместители соответствуют одному или нескольким, предпочтительно всем, из указанных предпочтительных, более предпочтительных или наиболее предпочтительных определений.
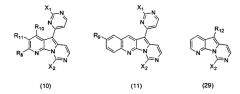
Особенно предпочтительными воплощениями настоящего изобретения являются вариолиноподобные соединения с общими формулами (10), (11) и (29).
где каждый из заместителей, обозначенных как X1 и X2, независимо выбран из группы, состоящей из H, OH, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', NHSO2R', CN, галогена, =O, C(=O)H, C(=O)R', CO2H, CO2R', карбоксиалкила, C1-C12-алкила, C2-C12-алкенила, C2-C12-алкинила, замещенного или незамещенного арила, замещенного или незамещенного аралкила и замещенной или незамещенной гетероароматической группы, но наиболее предпочтительными являются NH2, SMe, SOMe или SO2Me;
где R8 выбран из группы, состоящей из H, OH, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', NHSO2R', CN, галогена, =O, C(=O)H, C(=O)R', CO2H, CO2R', C1-C12-алкила, C2-C12-алкенила, C2-C12-алкинила, замещенного или незамещенного арила, замещенного или незамещенного аралкила и замещенной или незамещенной гетероароматической группы, но наиболее предпочтительными являются H, метил или Cl;
где R9 выбран из группы, состоящей из H, OH, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', NHSO2R', CN, галогена, =O, C(=O)H, C(=O)R', CO2H, CO2R', C1-C12-алкила, C2-C12-алкенила, C2-C12-алкинила, замещенного или незамещенного арила, замещенного или незамещенного аралкила и замещенной или незамещенной гетероароматической группы, но наиболее предпочтительными являются H или OMe;
где R10 выбран из группы, состоящей из H, OH, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', NHSO2R', CN, галогена, =O, C(=O)H, C(=O)R', CO2H, CO2R', C1-C12-алкила, C2-C12-алкенила, C2-C12-алкинила, замещенного или незамещенного арила, замещенного или незамещенного аралкила и замещенной или незамещенной гетероароматической группы, но наиболее предпочтительными являются H, OH, Cl, F, NH2 или OMe;
где R11 выбран из группы, состоящей из H, OH, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', NHSO2R', CN, галогена, =O, C(=O)H, C(=O)R', CO2H, CO2R', C1-C12-алкила, C2-C12-алкенила, C2-C12-алкинила, замещенного или незамещенного арила, замещенного или незамещенного аралкила и замещенной или незамещенной гетероароматической группы, но наиболее предпочтительными являются H, Cl или F;
где R12 выбран из группы, состоящей из H, OH, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', NHSO2R', CN, галогена, =O, C(=O)H, C(=O)R', CO2H, CO2R', C1-C12-алкила, C2-C12-алкенила, C2-C12-алкинила, замещенного или незамещенного арила, замещенного или незамещенного аралкила и замещенной или незамещенной гетероароматической группы, но наиболее предпочтительными являются алкил, замещенный или незамещенный арил, или замещенной или незамещенной гетероароматической группой, и еще более предпочтительными являются алкил, замещенный или незамещенный фенил или замещенный или незамещенный тиофенил, пиридинил или пиримидинил, а предпочтительные заместители включают алкоксигруппу или нитрогруппу, в особенности метоксигруппу или нитрогруппу, вместе с разрешенными для группы X1 определениями;
где каждая из R'-групп независимо выбрана из группы, состоящей из H, OH, SH, NO2, NH2, CN, галогена, =О, C(=O)H, C(=O)CH3, CO2H, CO2CH3, C1-C12-алкила, C2-C12-алкенила, C2-C12-алкинила, арила, аралкила и гетероароматической группы.
Конкретные воплощения соединений формулы (10) включают те соединения, где один или несколько заместителей являются следующими:
значения X1 определены выше, включая предпочтительные, более предпочтительные и наиболее предпочтительные значения;
значения X2 определены выше, включая предпочтительные, более предпочтительные и наиболее предпочтительные значения;
значения R8 определены выше для R1, включая предпочтительные, более предпочтительные и наиболее предпочтительные значения;
значения R10 определены выше для R3, включая предпочтительные, более предпочтительные и наиболее предпочтительные значения;
значения R11 определены выше для R2, включая предпочтительные, более предпочтительные и наиболее предпочтительные значения.
Конкретные воплощения соединений формулы (11) включают те соединения, где один или несколько заместителей являются следующими:
значения X1 определены выше, включая предпочтительные, более предпочтительные и наиболее предпочтительные значения;
значения X2 определены выше, включая предпочтительные, более предпочтительные и наиболее предпочтительные значения;
R9 является одним из разрешенных для арильного кольца заместителей, таким как водород или алкоксигруппа, предпочтительно, водород или метоксигруппа.
Конкретные воплощения соединений формулы (29) включают те соединения, где один или несколько заместителей являются следующими:
значения X2 определены выше;
R12 не является пиримидинилом и, предпочтительно, является алкилом, арилом или гетероарилом за исключением пиримидинила; более предпочтительно, алкилом, фенилом или гетероарилом с 5 или 6 атомами в составе кольца и 1 или 2 гетероатомами; наиболее предпочтительно, изопропилом, фенилом, тиофенилом или пиридинилом. Арильные или гетероарильные группы являются незамещенными или содержат предпочтительные заместители, выбранные из OR', в особенности алкоксигруппы, такие как метоксигруппа, или нитрогруппы.
Соединения общих формул (10), (11) и (29) могут быть синтезированы с применением модификаций метода, описанного в заявках на выдачу международного патента WO 0204447 и WO 0212240.
Некоторые из предпочтительных способов получения соединений по настоящему изобретению описаны ниже в следующих схемах реакций с примерами типичных заместителей. Настоящее изобретение не ограничивается этими типичными заместителями, а способ получения следует понимать в более общем смысле без особого внимания к конкретным значениям кодовых символов.
Из этих соединений было получено множество активных противоопухолевых соединений и полагают, что с применением методик в соответствии с раскрытием сущности настоящего изобретения может быть получено еще больше соединений.
Получение соединений общей формулы (11) проиллюстрировано ниже на примере, где R9 является H или OMe.
Получение соединений общей формулы (10) проиллюстрировано на примере, где R8 является метилом, а R10 и R11 являются H.
Получение соединений общей формулы (10) проиллюстрировано на примере, где R8 является H или Cl, R10 является H и R11 является F или Cl.
Получение соединений общей формулы (10) проиллюстрировано на примере, где R8, R10 и R11 являются H.
Для получения ключевого промежуточного продукта (8b, пример 17: соединение 18 в заявке на выдачу международного патента WO 0204447) с применением известного способа было необходимо осуществлять взаимодействие между 2-хлорникотиноилхлоридом (7b) и йодпиримидином (13) при -100°C. Когда авторы предприняли попытку масштабирования реакции, им пришлось увеличить времядобавлениядля удержания температуры реакционной смеси ниже -95°C. Эта большая продолжительность приводила к увеличению побочных реакций и снижала выход.
Для того чтобы избежать использования столь низкой температуры при получении соединения (8b), авторы разработали новый путь получения соединения (8b). Так, соединение (7b) преобразовывали в соответствующий амид Уайнреба (30), который вступал во взаимодействие с магниевым производным соединения (13) при -5°C с получением кетона (31). Преобразование соединения (30) в соединение (8b) осуществляли двумя способами: a) путем осуществления взаимодействия с магниевым производным соединения (13) при 0°С или b) путем осуществления взаимодействия с литиевым производным соединения (13) в условиях Барбье при -78°С. При использовании обоих способов реакцию легко масштабировали, а выходы реакции были лучше, чем в оригинальном способе.
Как отражение этого открытия настоящее изобретение относится к способу получения вариолинового промежуточного продукта формулы (8z):
где hal является галогеном, а значения остальных заместителей определены выше; который включает осуществление взаимодействия соединения формулы (31z):
где значения заместителей определены выше, с соединением формулы (13z):
где значения заместителей определены выше.
В этой реакции заместители X1 и X2 могут быть одними и теми же или различными и, предпочтительно, оба являются -SMe; hal обычно является Cl; R' обычно является H или Ac, а остальные заместители обычно являются H или как для предпочтительных соединений по настоящему изобретению.
Соединение формулы (31z) подходящим образом получают путем осуществления взаимодействия соединения формулы (30z):
где значения заместителей определены выше, с соединением формулы (13z). Соединение формулы (13z), применяемое для осуществления взаимодействия с соединением формулы (30z), может быть одним и тем же или отличаться от соединения формулы (13z), применяемого для осуществления взаимодействия с соединением формулы (31z).
Получение соединений общей формулы (10) проиллюстрировано на примере, где R8 и R11 являются H, и R10 является OBn.
Получение соединений общей формулы (29) проиллюстрировано на примере, где R12 является замещенным или незамещенным аралкилом и замещенным или незамещенным гетероароматическим соединением.
Таким образом, существует возможность трансформировать ряд простых гетероароматических соединений во множество промежуточных продуктов и производных с потенциальной противоопухолевой терапевтической активностью.
Для соединений общей формулы (10) и (11) взаимопревращения ряда простых функциональных групп позволяют получать широкий ряд дополнительных производных с различными заместителями X1, X2 и R10, как проиллюстрировано ниже.
Примеры биологической активности соединений по настоящему изобретению включены в таблицу (см. в конце описания).
По настоящей заявке испрашивается приоритет в соответствии с заявкой на выдачу патента Великобритании. Авторы специально включают в настоящее изобретение в качестве ссылки любое раскрытие в описании указанной заявки на выдачу патента Великобритании, не содержащееся в настоящем описании.
Экспериментальные методики и физико-химические характеристики соединений являются следующими:
ОСНОВНЫЕ ЭКСПЕРИМЕНТАЛЬНЫЕ УСЛОВИЯ
Если не определено иначе, все взаимодействия осуществляли в атмосфере аргона в предварительно высушенной стеклянной посуде.
Пример 1: Соединение 13
Йодпиримидин (13) получали в соответствии с экспериментальной методикой, описанной в литературе в работе A.J. Majeed et al. Tetrahedron 1989, 45, 993.
Пример 2: Соединение 14a
Способ A
Раствор 4-йод-2-метилтиопиримидина (соединение 13, 5,13 г, 20,3 ммоль) в тетрагидрофуране (75 мл) обрабатывали n-BuLi (8,1 мл, 20,3 ммоль, 2,5 М в гексанах) при -100°C. Реакционную смесь перемешивали при -100°C в течение 45 мин и обрабатывали раствором 2-хлор-3-хинолинкарбоксальдегида (соединение 12a, 3,0 г, 15,7 ммоль) в тетрагидрофуране (60 мл) при -100°C в течение 2,5 ч. Реакцию гасили добавлением насыщенного водного раствора хлорида аммония, нагревали до 23°C и распределяли между этилацетатом и насыщенным водным раствором хлорида аммония. Органический слой сушили над сульфатом натрия, фильтровали и упаривали. Неочищенный продукт подвергали хроматографии (элюируя гексаном:этилацетатом от 4:1 до 1:1) с получением соединения 14a в виде желтого твердого вещества (4,0 г, 81%).
1H ЯМР (CDCl3, 300 МГц) δ 8,45 (д, J=7,8 Гц, 1H), 8,25 (с, 1Н), 8,02 (д, J=8,3 Гц, 1Н), 7,81 (д, J=8,0 Гц, 1Н), 7,74 (т, J=7,3 Гц, 1Н), 7,56 (т, J=7,0 Гц, 1Н), 7,02 (д, J=7,8 Гц, 1Н), 6,24 (д, J=4,1 Гц, 1H), 4,91 (д, J=4,2 Гц, 1Н, OH), 2,58 (с, 3H).
13C ЯМР (CDCl3, 75 МГц) δ 172,4, 169,5, 157,9, 149,4, 147,0, 138,0, 133,9, 130,9, 127,9, 127,9, 127,4, 127,2, 113,5, 71,7, 14,2.
МС (ESI) m/z 318 (М+1)+.
Rf: 0,12 (гексан:этилацетат 4:1).
Способ B
Раствор 4-йод-2-метилтиопиримидина (соединение 13, 5,1 г, 20,3 ммоль) в толуоле (40 мл) обрабатывали i-PrMgCl (10 мл, 20,0 ммоль, 2 M в тетрагидрофуране) при 0°C в течение 1 ч и добавляли через канюлю к раствору 2-хлор-3-хинолинкарбоксальдегида (соединение 12a, 3,0 г, 15,7 ммоль) в толуоле (150 мл) при 0°C. Реакционную смесь перемешивали при 0°C в течение 16 ч, гасили добавлением насыщенного водного раствора хлорида аммония, нагревали до 23°C и распределяли между насыщенным водным раствором хлорида аммония и этилацетатом. Органический слой сушили над сульфатом натрия, фильтровали и упаривали. Остаток подвергали хроматографии (элюируя гексаном:этилацетатом от 4:1 до 1:1) с получением соединения 14a в виде желтого твердого вещества (3,5 г, 70%).
Пример 3: Соединение 14b
Раствор 4-йод-2-метилтиопиримидина (соединение 13, 3,4 г, 13,5 ммоль) в тетрагидрофуране (60 мл) обрабатывали n-BuLi (5,4 мл, 2,5 M в гексане, 13,5 ммоль) при -100°C и перемешивали при -100°C в течение 45 мин. Потом добавляли раствор 2-хлор-6-метокси-3-хинолинкарбоксальдегида (соединение 12b, 1,7 г, 7,9 ммоль) в тетрагидрофуране (35 мл) при -100°C и перемешивали в течение 2,5 ч. Реакцию гасили добавлением насыщенного водного раствора хлорида аммония, нагревали до 23°C и распределяли между этилацетатом и насыщенным водным раствором хлорида аммония. Органический слой сушили над сульфатом натрия, фильтровали и упаривали. Остаток подвергали хроматографии (элюируя гексаном:этилацетатом от 4:1 до 3:1) с получением соединения 14b в виде желтого твердого вещества (1,8 г, 67%).
1H ЯМР (CDCl3, 300 МГц) δ 8,42 (дд, J=5,1, 1,0 Гц, 1H), 8,11 (с, 1H), 7,86 (д, J=9,3 Гц, 1H), 7,34 (дд, J=9,3, 2,7 Гц, 1H), 7,03 (д, J=5,1 Гц, 1H), 7,00 (д, J=2,7 Гц, 1Н), 6,20 (ушир.с, 1H), 5,09 (ушир.с, 1H), 3,87 (с, 3H), 2,53 (ушир.с, 3H).
13C ЯМР (CDCl3, 75 МГц) δ 172,7, 168,4, 158,6, 157,9, 146,6, 143,5, 136,8, 133,6, 129,7, 128,6, 123,9, 113,5, 105,3, 71,2, 55,8, 14,4.
МС (ESI) m/z 370 (M+23)+.
Rf: 0,37 (гексан:этилацетат 1:1).
Пример 4: Соединение 15a
Раствор соединения 14a (4,0 г, 12,6 ммоль) и PDC (7,1 г, 18,9 ммоль) в CH2Cl2 (50 мл) перемешивали при 23°C в течение 24 ч. Реакционную смесь фильтровали через броунмиллерит, упаривали и подвергали хроматографии (элюируя гексаном:этилацетатом 4:1) с получением соединения 15a в виде белого твердого вещества (3,0 г, 75%).
1H ЯМР (CDCl3, 300 МГц) δ 8,85 (д, J=4,9 Гц, 1H), 8,42 (с, 1H), 8,11 (д, J=8,5 Гц, 1H), 7,93 (д, J=8,1 Гц, 1H), 7,88 (т, J=7,1 Гц, 1H), 7,69 (д, J=4,9 Гц, 1H), 7,66 (т, J=7,1 Гц, 1H), 2,35 (с, 3H).
13C ЯМР (CDCl3, 75 МГц) δ 192,7, 173,7, 159,7, 159,3, 148,3, 146,8, 140,6, 132,6, 131,2, 128,8, 128,6, 128,1, 126,1, 113,7, 14,3.
МС (ESI) m/z, 280 (M-35)+.
Rf: 0,23 (гексан:этилацетат 4:1).
Пример 5: Соединение 15b
Раствор соединения 14b (1,8 г, 5,2 ммоль) в CH2Cl2 (50 мл) обрабатывали PDC (2,9 г, 7,8 ммоль) при 23°C в течение 48 ч. Реакционную смесь фильтровали через броунмиллерит, концентрировали и подвергали хроматографии (элюируя гексаном:этилацетатом 3:1) с получением соединения 15b в виде белого твердого вещества (1,5 г, 82%).
1H ЯМР (CDCl3, 300 МГц) δ 8,82 (д, J=4,9 Гц, 1H), 8,27 (с, 1H), 7,97 (д, J=9,3 Гц, 1H), 7,66 (д, J=4,9 Гц, 1H), 7,47 (дд, J=9,3, 2,9 Гц, 1Н), 7,13 (д, J=2,7 Гц, 1H), 3,93 (с, 3H), 2,34 (с, 3H).
13C ЯМР (CDCl3, 75 МГц) δ 193,0, 173,7, 159,6, 159,4, 158,9, 144,4, 144,2, 139,2, 131,3, 130,1, 127,3, 125,2, 113,7, 105,9, 55,9, 14,3.
МС (ESI) m/z, 368 (M+23)+.
Rf: 0,26 (гексан:этилацетат 3:1).
Пример 6: Соединение 16a
Раствор 4-йод-2-метилтиоформамида (соединение 13, 0,50 г, 2,0 ммоль) в безводном толуоле (12 мл) обрабатывали i-PrMgCl (1,0 мл, 2 M в тетрагидрофуране, 2 ммоль) при 0°C в течение 1 ч. Полученный арилмагний добавляли через канюлю к раствору соединения 15a (0,32 г, 1,0 ммоль) в безводном толуоле (30 мл) при 0°C, перемешивали в течение 25 мин, обрабатывали избытком ацетилхлорида (2,0 мл) и перемешивали в течение ночи при 23°C. Реакционную смесь распределяли между этилацетатом и насыщенным водным раствором бикарбоната натрия. Органический слой сушили над сульфатом натрия, фильтровали и упаривали. Остаток подвергали хроматографии (элюируя гексаном:этилацетатом от 4:1 до 1:1) с получением соединения 16a в виде желтого твердого вещества (150 мг, 15%).
1H ЯМР (CDCl3, 300 МГц) δ 8,53 (д, J=5,1 Гц, 2H), 8,32 (с, 1H), 8,01 (д, J=8,5 Гц, 1H), 7,81-7,77 (м, 2H), 7,58 (т, J=7,6 Гц, 1H), 7,35 (д, J=5,1 Гц, 2H), 2,36 (с, 6H), 2,30 (с, 3H).
Пример 7: Соединение 16b
Раствор 4-йод-2-метилтиопиримидина (соединение 13, 2,1 г, 8,3 ммоль, 2,0 эквив.) в тетрагидрофуране (50 мл) обрабатывали n-BuLi (3,3 мл, 2,5 M в гексанах, 8,3 ммоль) при -100°C и перемешивали при -100°C в течение 45 мин. Потом через канюлю при -78°C медленно добавляли раствор соединения 15b (1,4 г, 4,1 ммоль) в тетрагидрофуране (20 мл), поддерживая температуру -100°C. Реакционную смесь перемешивали при -100°C в течение 3 ч. Реакцию гасили добавлением насыщенного водного раствора хлорида аммония, нагревали до 23°C и распределяли между этилацетатом и насыщенным водным раствором хлорида аммония. Органический слой сушили над сульфатом натрия, фильтровали и упаривали. Неочищенный продукт подвергали хроматографии (элюируя гексаном:этилацетатом от 4:1 до 2:1) с получением соединения 16b в виде белого твердого вещества (1,48 г, 76%).
1H ЯМР (CDCl3, 300 МГц) δ 8,57 (д, J=5,1 Гц, 2H), 7,87 (д, J=9,3 Гц, 1H), 7,47 (с, 1Н), 7,43 (д, J=5,1 Гц, 2H), 7,36 (дд, J=9,3, 2,7 Гц, 1Н), 6,92 (д, J=2,7 Гц, 1Н), 6,34 (с, 1Н), 3,87 (с, 3H), 2,47 (с, 6H).
13C ЯМР (CDCl3, 75 МГц) δ 172,1, 169,4, 158,7, 158,2, 147,5, 143,1, 138,1, 134,4, 129,7, 127,4, 124,2, 115,3, 105,7, 80,0, 55,9, 14,5.
МС (ESI) m/z: 494 (M+23)+.
Rf: 0,06 (гексан:этилацетат 4:1).
Пример 8: Соединение 17a