Производные пиридина и лекарственное средство на их основе, обладающее селективной блокирующей активностью в отношении подвида nmda-рецепторов
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы IA или IB, где R1 означает водород, C1-С7алкил, -(CH2)n-ОН, -(CH2)n-N(R6)2, R2 означает C1-С7алкил, -(CH2)n-N(R6)2, -NR6C(O)C(O)O-(C1-C7)алкил, -NR6-(CH2)n-OH, -NR6C(O)-(C1-C7)алкил, -NH-бензил, R3 означает водород или амин, или R2 и R3 вместе с атомами углерода, к которым они присоединены, означают группу -N(R6)-CH2-O-CH2-, R4 означает водород или C1-C7алкил, R5 означает водород, R6 независимо друг от друга означают водород или C1-C7алкил, R' означает водород или C1-C7алкил, n равно 0, 1, 2 или 3. Также изобретение относится к лекарственному средству, обладающему селективной блокирующей активностью в отношении подвида NMDA-рецепторов, содержащему одно или более соединений формулы IA или IB или их фармацевтически приемлемую кислотно-аддитивную соль и инертный носитель. Технический результат - получение новых соединений, обладающих высоким сродством к рецептору NMDA, и которые могут быть использованы в составе лекарственного средства для лечения заболеваний, опосредованных этим рецептором. 3 н. и 10 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к применению соединений общей формулы
где
R1 и R2 независимо друг от друга означают водород, (низш.)алкил, -(CH2)n-ОН, -(CH2)n-N(R6)2, -NR6C(O)C(O)O-(низш.)алкил, -NR6-(СН2)n-ОН, -NR6С(О)-(низш.)алкил, -NH-бензил или NR6C(O)-(CH2)n-OH,
R6 независимо друг от друга означают водород или (низш.)алкил,
R' означает водород или (низш.)алкил,
R3 означает водород или амин,
R4 означает водород или (низш.)алкил,
R5 означает водород или галоген, или
R1 и R′ вместе с атомами углерода, к которым они присоединены, означают
группу -(СН2)4-, или
R2 и R3 вместе с атомами углерода, к которым они присоединены, означают
группу -N(R6)-CH2-O-CH2-, n равно 0, 1, 2 или 3,
и к применению их фармацевтически приемлемых кислотно-аддитивных солей для получения лекарственного средства, предназначенного для лечения заболеваний с терапевтическими показаниями для специфичных блокаторов подвида рецептора NMDA, которые включают острые формы нейродегенерации, вызванные инсультом и травмой мозга, и хронические формы нейродегенерации, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, боковой амиотрофический склероз (ALS), и нейродегенерации, ассоциированные с бактериальными или вирусными инфекциями, и, кроме того, с депрессией и хронической и острой болью.
Соединения формулы I и их соли обладают ценными терапевтическими свойствами. Соединения по настоящему изобретению являются селективными блокаторами подвида рецептора NMDA (N-метил-D-аспартата), которые выполняют основную функцию в модулировании нейронной активности и пластичности, что делает их главными компонентами в опосредовании процессов, лежащих в основе развития ЦНС, а также в обучении и формировании памяти.
При патологических состояниях острых или хронических формах нейродегенерации суперактивация рецепторов NMDA является ключевым событием для запуска гибели нейронных клеток. Рецепторы NMDA включают два субъединичных подсемейства, NR-1 (8 различных вариантов, образованных за счет сплайсинга) и NR-2 (A-D), кодируемых различными генами. Члены этих двух субъединичных подсемейств характеризуются различным распределением в различных отделах мозга. Гетеромерные комбинации членов семейства NR-1 с различными субъединицами NR-2 приводят к образованию рецепторов NMDA, обладающих различными фармакологическими свойствами. Возможные терапевтические показания для специфических блокаторов подвида рецептора NR-2B включают острые формы нейродегенерации, вызванные, например, инсультом или травмой мозга, и хронические формы нейродегенерации, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, боковой амиотрофический склероз (ALS), и нейродегенерации, ассоциированные с бактериальными или вирусными инфекциями, и, кроме того, с депрессией и хронической и острой болью.
Объектом настоящего изобретения является применение соединений формул IA и IB и их фармацевтически приемлемых кислотно-аддитивных солей для получения лекарственных средств, содержащих соединения формул IA и IB, получение соединений формулы IA или IB и их солей, лекарственные средства, содержащие соединение формулы IA или IB или их фармацевтически приемлемые кислотно-аддитивные соли, получение таких лекарственных средств и применение соединений формулы IA или IB или их фармацевтически приемлемых солей для лечения или профилактики заболеваний, прежде всего заболеваний и нарушений, указанных выше.
Общие термины, используемые в описании заявки, имеют следующие значения, независимо от того, применяются ли эти термины отдельно или в различных сочетаниях.
Термин "(низш.)алкил", используемый в тексте заявки, означает алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, бутил и т.п. Предпочтительные (низш.)алкильные группы содержат от 1 до 4 атомов углерода.
Термин "галоген" означает хлор, иод, фтор и бром.
Термин "фармацевтически приемлемые кислотно-аддитивные соли" означает соли неорганических и органических кислот, таких как хлористоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и т.п.
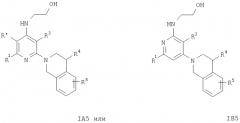
Предпочтительны соединения формулы IA
и их фармацевтически приемлемые кислотно-аддитивные соли, где R2 означает С1-C7алкил, -(CH2)n-ОН, -(CH2)n-N(R6)2, -NR6C(O)C(O)O-(C1-С7)алкил, -NR6 -(CH2)n-ОН, -NR6C(O)-(C1-C7)алкил, -NH-бензил или NR6C(O)-(CH2)n-ОН, R независимо друг от друга означают водород или С1-С7алкил, а
R1, R3, R4, R5 и R′ имеют значения, указанные в пункте 1.
Примерами предпочтительных соединений формулы IA являются соединения, в которых R2 означает аминогруппу, например следующие соединения:
2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламин,
рац.-2-(4-метил-3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламин,
2-(3,4-дигидро-1Н-изохинолин-2-ил)-5-метилпиридин-4-иламин,
2-(3,4-дигидро-1Н-изохинолин-2-ил)-6-метилпиридин-4-иламин,
2-(3,4-дигидро-1 Н-изохинолин-2-ил)-6-этилпиридин-4-иламин или
[4-амино-6-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-2-ил]метанол.
Кроме того, предпочтительны соединения формулы IA, в которых R2 означает -NH(CH2)2OH. Примеры таких соединений включают
2-[2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламино]этанол,
2-[2-(3,4-дигидро-1Н-изохинолин-2-ил)-6-метилпиридин-4-иламино]этанол или
2-[2-(3,4-дигидро-1Н-изохинолин-2-ил)-5-метилпиридин-4-иламино]этанол.
Предпочтительны также соединения формулы IA, в которых R2 означает -NH(низш.)алкил, например следующие соединения:
[2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]метиламин или [2-(3,4-дигидро-1Н-изохинолин-2-ил)-пиридин-4-иламино]диметиламин. Предпочтительны также соединения формулы IB
и их фармацевтически приемлемые кислотно-аддитивные соли, где R2 означает С1-C7алкил, -(CH2)n-OH, -(CH2)n-N(R6)2, -NR6C(O)C(O)O-C(C1-С7)алкил, -NR6 -(CH2)n-ОН-, -NR6C(O)- (С1-С7)алкил, -NH-бензил или
NR6C(O)-(CH2)n-OH, R6 независимо друг от друга означают водород или С1-С7алкил, а
R1, R3, R4, R5 и R′ имеют значения, указанные в пункте 1.
Кроме того, предпочтительны соединения формулы IB, в которых R2 означает аминогруппу, например следующие соединения:
4-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-2-иламин или
4-(3,4-дигидро-1Н-изохинолин-2-ил)-6-метилпиридин-2-иламин.
Кроме того, предпочтительны соединения формулы IB, в которых R2 означает -NHC(O)С(O)ОСН2СН3 или -NH(CH2)2OH, например следующие соединения:
этиловый эфир N-[4-(3,4-дигидро-1Н-изохинолин-2-ил)-6-метилпиридин-4-ил]оксаламовая кислоты или
2-[4-(3,4-дигидро-1Н-изохинолин-2-ил)-6-метилпиридин-2-иламино]этанол.
Указанные соединения формул IA и IB получают способом по изобретению, который включает
а) взаимодействие соединения формулы
с соединением формулы
с образованием соединения формулы
где R1-R5 и R′ имеют значения, указанные выше, a hal означает бром или хлор, или
б) взаимодействие соединения формулы
с соединением формулы
с образованием соединения формулы
где R3-R5 имеют значения, указанные выше, или в) взаимодействие соединения формулы
с ClC(O)С(O)ОСН2СН3
с образованием соединения формулы
где R1, R3 -R5 и R' имеют значения, указанные выше, или г) восстановление соединения формулы
восстанавливающим агентом, таким как AlLiH4/ТГФ с образованием соединения формулы
или с образованием соединения формулы
где R1, R3 -R5 и R′ имеют значения, указанные выше, или
д) взаимодействие соединения формулы
с ClC(O)ОСН2СН3, или СН3С(O)Cl, или ClC(O)-фенил, или HCOOH/CH2O соответственно с образованием соединения формулы
или с образованием соединения формулы
или с образованием соединения формулы
или с образованием соединения формулы
где R1, R3 -R5 и R′ имеют значения, указанные выше, или е) взаимодействие соединения формулы
с HCOOH/CH2O с образованием соединения формулы
где R1, R4, R5 и R′ имеют значения, указанные выше, и
при необходимости превращение полученного соединения формулы I в фармацевтически приемлемую соль.
Далее приводится более подробное описание получения соединений формул IA и IB.
По вариантам способа, указанным выше, по схемам 1-12, приведенным ниже, соединения формул IA и IB получают по известным методикам, например, как описано ниже.
Смесь соединения формулы IIA или IIB, например 2-бромпиридин-4-иламина или 4-бромпиридин-2-иламина, соответственно, и соединения формулы III, такого, как 1,2,3,4-тетрагидроизохинолин, перемешивают при 150°С в течение приблизительно 3 ч. Продукт экстрагируют органическим растворителем, экстракт сушат и концентрируют, при этом получают свободное основание соединения общей формулы IA или IB.
Соединения формулы IIA1 получают по следующей методике. К раствору соединения формулы IIA, например, 2-бром-6-этилпиридина (S.G.Davies и M.R.Shipton, J. Chem. Soc., Perkin Trans., 1, 3, 501 (1991)), в уксусной кислоте добавляют перуксусную кислоту, поддерживая температуру смеси <50°С. После добавления реагента смесь перемешивают при 50°С в течение 5 ч, а затем охлаждают до комнатной температуры. В смесь добавляют измельченный лед и раствор КОН до рН 12. После экстракции объединенную органическую фазу сушат и упаривают, при этом получают соответствующий оксид формулы IVA. Затем при охлаждении на ледяной бане добавляют по каплям HNO3, а затем Н2SO4, смесь перемешивают при приблизительно 90°С в течение 90 мин, а затем охлаждают до комнатной температуры. Затем в смесь добавляют измельченный лед и раствор NaOH до рН 12. После экстракции объединенную органическую фазу сушат и упаривают, при этом получают соединение формулы VA, которое непосредственно используют на следующей стадии. Раствор соединения формулы VA в уксусной кислоте обрабатывают порошкообразным железом, смесь медленно нагревают до 100°С и выдерживают при указанной температуре в течение 1 ч. Затем реакционную смесь охлаждают до комнатной температуры и фильтруют. Растворитель выпаривают, остаток кристаллизуют, при этом получают соединение формулы IIA1. Соответствующие соединения формулы IA получают, как описано выше.
Кроме того, соединения формулы IIA2 получают, как описано ниже. К раствору соединения формулы VA1, например 2-бром-6-метил-4-нитропиридина (A.Puszko, Pr. Nauk. Akad. Ekon. Im. Oskara Langego Wroclawiu, 278, 169 (1984)), в конц. H2SO4 добавляют CrO3, поддерживая температуру смеси <55°С. Через 4 ч смесь нагревают при 70°С в течение 30 мин, а затем охлаждают до комнатной температуры. В смесь добавляют ледяную воду, поддерживая температуру смеси <70°С, и выдерживают в течение ночи, при этом получают соединение формулы VA2. Полученное соединение растворяют в ТГФ, обрабатывают бораном/ТГФ и кипятят с обратным холодильником в течение 6 ч. Затем к смеси добавляют порошкообразное железо и уксусную кислоту и кипятят с обратным холодильником в течение еще 6 ч. Смесь фильтруют, растворитель выпаривают, остаток распределяют между двумя фазами, органическую фазу сушат и концентрируют, при этом получают соединение формулы IIA2. Соответствующие соединения формулы IA получают, как описано выше.
Соединение формулы IIA3 получают, как описано ниже. При эффективном охлаждении на ледяной бане соединение формулы VI, например 2-бром-5,6,7,8-тетрагидрохинолин-1-оксид (S.Zimmerman и др., J. Am. Chem. Soc., 113, 183 (1991)), обрабатывают конц. H2SO4, а затем конц. HNO3. Полученную смесь нагревают при приблизительно 90°С в течение 90 мин, охлаждают и выливают в измельченный лед, добавляют NaOH до рН 7, водную фазу экстрагируют, экстракт сушат и концентрируют, при этом получают соединение формулы VII. Смесь соединения формулы VII, например, 2-бром-4-нитро-5,6,7,8-тетрагидрохинолин-1-оксида, порошкообразного железа и уксусной кислоты нагревают при приблизительно 100°С в течение 1 ч. После охлаждения смесь фильтруют, упаривают, остаток распределяют между двумя фазами, органическую фазу сушат и концентрируют, при этом получают соединение формулы IIA3. Соответствующие соединения формулы IA1 получают, как описано выше.
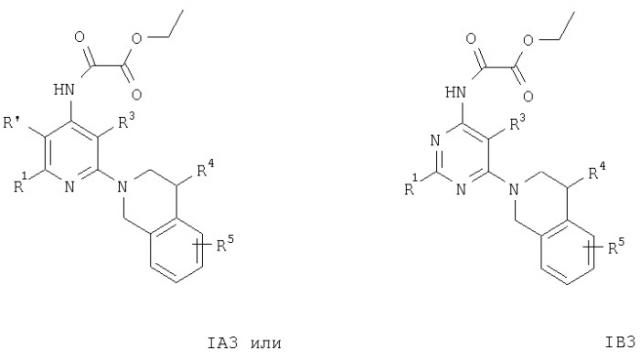
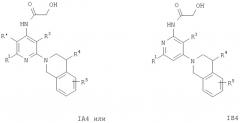
Кроме того, соединения формул IA3 или IB3 получают при взаимодействии соединения формулы IA2 или IB2 с этиловым эфиром хлороксоуксусной кислоты. Затем полученное соединение формулы IA3 или IB3 вводят в реакцию с литийалюминийгидридом. После обработки и очистки продукта хроматографией получают свободное основание соединения формулы IA4 и IA5 или IB4 и IB5. Соединения формулы IA9 или IB9 получают, как описано ниже. Раствор соединений формулы IA2 или IB2, например 2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламина, в муравьиной кислоте обрабатывают водным раствором формальдегида. Смесь кипятят с обратным холодильником в течение 1 ч, а затем упаривают летучие компоненты. Остаток распределяют между двумя фазами, органическую фазу отделяют, сушат и концентируют.
Соединения формул IA6, IB6, IA7, IB7, IA8 или IB8 получают из соединения формулы IA2 или IB2 при взаимодействии с этиловым эфиром хлормуравьиной кислоты, ацетилхлоридом или бензоилхлоридом соответственно. Указанные реакции проводят по обычным методикам.
Как показано на схемах 11 и 12, соединение формулы IA11 или IB11 или их аналоги получают, как описано ниже.
Раствор соединений формулы IA11 или IB11 или аналогичные соединения получают из раствора соединения формулы IA10 или IB10, например [2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]этиламина, в муравьиной кислоте. Указанный раствор обрабатывают водным раствором формальдегида, смесь кипятят с обратным холодильником в течение 1 ч, а затем упаривают летучие компоненты. Остаток распределяют между двумя фазами, органическую фазу отделяют, сушат и концентрируют, при этом получают соединение формулы IA11 или IB11.
Фармацевтически приемлемые соли получают по известными методам. Для фармацевтического применения наиболее пригодны кислотно-аддитивные соли соединений формулы I.
На схемах 1-12 показаны способы получения соединений формулы I из известных исходных соединений, из коммерческих препаратов или из соединений, которые получают известными способами.
Более подробно получение соединений формул IA и IB описано в примерах 1-35.
Схема 1
На схеме 1 заместители R1-R5 и R′ имеют значения, указанные выше.
Схема 2
На схеме 2 заместители R1-R5 и R′ имеют значения, указанные выше.
Схема 3
На схеме 3 заместители R1, R3 и R′ имеют значения, указанные выше.
Схема 4
На схеме 4 заместители R1 и R3 имеют значения, указанные выше.
Схема 5
На схеме 5 заместители R′ и R3 имеют значения, указанные выше.
Схема 6
На схеме 6 заместители R3-R5 имеют значения, указанные выше.
Схема 7
На схеме 7 заместители R1, R3-R5 и R′ имеют значения, указанные выше.
Схема 8
На схеме 8 заместители R1 и R3-R5 имеют значения, указанные выше.
Схема 9
На схеме 9 заместители R1 и R3-R5 имеют значения, указанные выше.
Схема 10
На схеме 10 заместители R1, R3-R5 и R′ имеют значения, указанные выше.
Схема 11
На схеме 11 заместители R1, R′, R4, R5 и R6 имеют значения, указанные выше.
Схема 12
На схеме 12 заместители R1, R4 и R5 имеют значения, указанные выше.
Как отмечалось выше, соединения формулы I и их фармацевтически приемлемые кислотно-аддитивные соли обладают ценными фармакодинамическим свойствами. Указанные соединения являются селективными блокаторами подвида 2В рецептора NMDA, который выполняет основную функцию в модулировании нейронной активности и пластичности, что делает их главными компонентами в опосредовании процессов, лежащих в основе развития ЦНС, а также в обучении и формировании памяти.
Соединения анализировали на наличие активности по следующее методике.
Методика анализа
Определение связывания 3H-Ro 25-6981 (Ro 25-6981 означает [R-(R*,S*)]-α-(4-гидроксифенил)-β-метил-4-(фенилметил)-1-пиперидинпропанол)
В эксперименте использовали самцов крыс альбиносов линии Fullinsd или f массой 150-200 г. Для получения мембранной фракции головной мозг (за исключением мозжечка и продолговатого мозга) гомогенизировали в гомогенизаторе Polytron (10000 об./мин, 30 сек) в 25 объемах охлаженного буферного раствора трис-HCl (50 мМ, рН 7,1), 10 мМ EDTA. Гомогенат центрифугировали (48000 g) при 4°С в течение 10 мин. Осадок ресуспендировали в гомогенизаторе Polytron в исходном объеме буферного раствора и инкубировали при 37°С в течение 10 мин. Затем центрифугировали, осадок гомогенизировали в исходном буферном растворе и хранили в замороженном состоянии при -80°С по меньшей мере в течение 16 ч, но не более 10 сут. При проведении анализа гомогенат размораживали при 37°С, центрифугировали и осадок трижды промывали холодным буферным раствором трис-HCl (5 мМ, рН 7,4). Затем осадок ресуспендировали в указаном буферном растворе и использовали в анализе при конечной концентрации белка 200 мг/мл.
Эксперименты по связыванию 3H-Ro 25-6981 проводили в буферном растворе трис-HCl (50 мМ, рН 7,4). Эксперименты по конкурентному связыванию проводили при 5 нМ концентрации H-Ro 25-6981, а неспецифическое связывание определяли при 10 мМ концентрации тетрагидроизохинолина. При этом неспецифическое связыванием обычно составляло 10% от общего количества связанного лиганда. Анализируемые соединения инкубировали с мембраной фракцией при 4°С в течение 2 ч, а затем смесь фильтровали через стекловолоконные фильтры Ватман GF/B (Unifilter-96, фирма Packard, Цюрих, Швейцария). Фильтры пятикратно промывали холодным буферным раствором, добавляли 40 мл сцинтилляционой жидкости (microscint 40, фирма Canberra Packard, Цюрих, Швейцария) и определяли радиоактивность на сцинтилляционном счетчике для сканирования микропланшетов (Packard Topcount).
Действие соединений измеряли при 8 концентрациях при по меньшей мере двух повторах. Усредненные нормализованные значения анализировали по программе с использованием нелинейной регрессии. В результате получали величины IC50 с верхней и нижней границей доверительного интервала 95%.
Величина IC50 (мкМ) предпочтительных соединений формулы I, измеренная, как описано выше, составляет <0,02 мкМ. Величины IC50 для некоторых предпочтительных соединений приводятся в таблице.
| Пример № | IC50 (мкМ) |
| 1 | 0,008 |
| 3 | 0,011 |
| 4 | 0,014 |
| 5 | 0,0053 |
| 6 | 0,011 |
| 9 | 0,006 |
| 10 | 0,011 |
| 30 | 0,004 |
| 31 | 0,02 |
| 32 | 0,011 |
| 33 | 0,02 |
| 35 | 0,004 |
Соединения формулы I и их соли, описанные в тексте заявки, можно включать в стандартные фармацевтические лекарственные формы, например, для перорального или парентерального введения, в смеси с обычными фармацевтическими адъювантами, например органическими или неорганическими инертными носителями, такими как вода, желатин, лактоза, крахмал, стеарат магния, тальк, растительные масла, камеди, полиалкиленгликоли и т.п. Фармацевтические препараты могут использоваться в твердой форме, например в форме таблеток, суппозиториев, капсул, или в жидкой форме, например, в виде растворов, суспензий или эмульсий. Фармацевтические адъюванты могут включать консерванты, стабилизаторы, смачивающие агеты, эмульгаторы, соли для изменения осмотического давления или в качестве буферных веществ. Фармацевтические препараты могут также включать другие терапевтически активные соединения.
Дозы могут изменяться в широком интервале и должны соответстввовать индивидуальным требованиям в каждом конкретном случае. При пероральном введении доза составляет от приблизительно 0,1 мг до приблизительно 1000 мг/сут соединения общей формулы I, хотя верхний предел можно превысить в соответствии с показаниями.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1
Гидрохлорид 2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламина, 1:1
Смесь 2-бромпиридин-4-иламина (0,50 г, 2,9 ммоля) и 1,2,3,4-тетрагидроизохинолина (1,1 г, 8,7 ммоля) перемешивали при 150°С в течение 3 ч. После экстракции (AcOEt/H2O) органическую фазу сушили (Na2SO4) и концентрировали, остаток очищали хроматографией (SiO2, элюент: СН2Cl2/СН3ОН/NH4OH, 140:10:1), при этом получали свободное основание указанного в заголовке соединения (0,39 г, 60%) в виде бесцветного масла. После взаимодействия с хлористым водородом получали кристаллы белого цвета (изопропанол/AcOEt). tпл.252°C (разл.). МС: m/е 226 (М+Н+).
Пример 2
Фумарат рац.-2-(4-метил-3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламина (1:1)
Указанное в заголовке соединение получали в виде кристаллов белого цвета по общему методу, описанному в примере 1, при взаимодействии 2-бромпиридин-4-иламина с рац.-4-метил-1,2,3,4-тетрагидроизохинолина (G. Grunewald и др., J. Med. Chem., 31, 433 (1988)) с последующей кристаллизацией (MeOH/Et2O) в виде фумарата. Tпл.178-179°С. МС: m/е 239 (М+).
Пример 3
Фумарат 2-(3,4-дигидро-1Н-изохинолин-2-ил)-5-метилпиридин-4-иламина
Указанное в заголовке соединение получали в виде кристаллов белого цвета по общему методу, описанному в примере 1, при взаимодействии 2-бром-5-метилпиридин-4-иламина (A.Puszko, Z.Talik, Pr.Nauk. Acad. Econ. im. Oskara Langego Wroclawiu, 167, 177 (1980)) с 1,2,3,4-тетрагидроизохинолином с последующей кристаллизацией (MeOH/Et2O) в виде фумарата. tпл.110°C (разл.). МС: m/е 240 (М+Н+).
Пример 4
Фумарат 2-(3,4-дигидро-1Н-изохинолин-2-ил)-6-метилпиридин-4-иламина
Указанное в заголовке соединение получали в виде кристаллов белого цвета по общему методу, описанному в примере 1, при взаимодействии 2-бром-6-метилпиридин-4-иламина (A.Puszko, Pr.Nauk. Acad. Econ. im. Oskara Langego Wroclawiu, 278, 169 (1984)) с 1,2,3,4-тетрагидроизохинолином с последующей кристаллизацией (MeOH/Et2O) в виде фумарата. tпл110°C (разл.). МС: m/е 239 (М+).
Пример 5 Фумарат 2-(3,4-дигидро-1Н-изохинолин-2-ил)-6-этилпиридин-4-иламина
а) 1-Оксид 2-бром-6-этилпиридина
К раствору 2-бром-6-этилпиридина (15,4 г, 82,8 ммоля) (S.G.Davies, M.R.Shipton, J.Chem. Soc., Perkin Trans. 1, 3, 501, (1991)) в уксусной кислоте (15 мл) добавляли перуксусную кислоту (26 мл, 39% раствор), поддерживая температуру смеси <50°С. После завершения добавления реагента смесь перемешивали при 50°С в течение 5 ч, затем охлаждали до КТ. В реакционную смесь добавляли измельченный лед (40 г) и 40% КОН до рН 12. Смесь экстрагировали CHCl3 (6×60 мл), объединенные органические слои сушили (Na2CO3) и упаривали, при этом получали 20,0 г (>100%) указанного в заголовке соединения в виде масла желтого цвета. МС: m/е 201 (М+).
б) 1-Оксид 2-бром-6-этил-4-нитропиридина
К 1-оксиду 2-бром-6-этилпиридина (пример 5а) (20,0 г, 99 ммолей) при охлаждении на ледяной бане по каплям добавляли HNO3 (100%, 25 мл), а затем H2SO4 (98%, 17 мл). Реакционную смесь перемешивали при 90°С в течение 90 мин и охлаждали до КТ. Затем в реакционную смесь добавляли измельченный лед (500 г) и 28% NaOH до рН 12. Смесь экстрагировали AcOEt (4х250 мл), объединенные органические слои сушили (Na2СО3) и упаривали, при этом получали 15,9 г (65%) твердого вещества желтого цвета, которое использовали на следующей стадии без очистки.
в) 2-Бром-6-этилпиридин-4-иламин
К раствору 1-оксида 2-бром-6-этил-4-нитропиридина (пример 56) (15,9 г, 69 ммолей) в уксусной кислоте (310 мл) добавляли порошкообразное железо (25,8 г, 462 ммоля), реакционную смесь медленно нагревали до 100°С и выдерживали при указанной температуре в течение 1 ч. Затем смесь охлаждали до КТ и фильтровали. Растворитель упаривали, остаток кристаллизовали (пентан), при этом получали указанное в заголовке соединение (88%) в виде твердого вещества бежевого цвета. tпл.75-77°C. МС: m/е 200 (М+).
г) Фумарат 2-(3,4-дигидро-1Н-изохинолин-2-ил)-6-этилпиридин-4-иламина,
Указанное в заголовке соединение получали в виде кристаллов белого цвета по общему методу, описанному в примере 1, при взаимодействии 2-бром-6-этилпиридин-4-иламина (пример 5в) с 1,2,3,4-тетрагидроизохинолином с последующей кристаллизацией (AcOEt) в виде фумарата. tпл.140-141°C. МС: m/е 254 (М+Н+).
Пример 6
[4-Амино-6-(3.4-дигидро-1Н-изохинолин-2-ил)пиридин-2-ил]метанол
а) 6-Бром-4-нитропиридин-2-карбоновая кислота
К раствору 2-бром-6-метил-4-нитропиридина (17,8 г, 82,0 ммоля) (А.Puszko, Pr.Nauk. Acad. Econ. im. Oskara Langego Wroclawiu, 278, 169 (1984)) в конц. H2SO4 (100 мл) добавляли CrO3 (32,8 г, 328 ммоля), поддерживая температуру смеси <55°С. Через 4 ч смесь нагревали при 70°С в течение 30 мин, после чего охлаждали до КТ. Затем, поддерживая температуру смеси <70°С, в реакционную смесь добавляли ледяную воду (500 мл) и выдерживали в течение ночи. Указанное в заголовке соединение кристаллизовали (Н2О), при этом получали твердое вещество бежевого цвета (76%). tпл.173-175°C. MC: m/e 246 (М+).
б) (4-Амино-6-бромпиридин-2-ил)метанол
К раствору 6-бром-4-нитропиридин-2-карбоновой кислоты (пример 6а) (6,60 г, 29,1 ммоля) в ТГФ (150 мл) добавляли боран/ТГФ (87 мл, 1 М раствор). Смесь кипятили с обратным холодильником в течение 6 ч, затем добавляли порошкообразное железо (16,3 г, 291 ммоль) и уксусную кислоту (150 мл). Реакционную смесь кипятили с обратным холодильником в течение 6 ч, фильтровали, упаривали растворитель и распределяли между двумя фазами (AcOEt/раствор NaHCO3). Органическую фазу сушили (Na2SO4) и концентрировали, остаток очищали хроматографией (SiO2, элюент: CH2Cl2/MeOH, 93:7), при этом получали 2 г (34%) (4-амино-6-бромпиридин-2-ил)метанола в виде твердого вещества белого цвета (AcOEt). tпл.144-145°С. MC: m/e 202 (М+).
в) [4-Амино-6-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-2-ил]метанол Указанное в заголовке соединение получали в виде кристаллов грязно-белого цвета по общему методу, описанному в примере 1, при взаимодействии (4-амино-6-бромпиридин-2-ил)метанола (пример 66) с 1,2,3,4-тетрагидроизохинолином. tпл.183-184°С (AcOEt). MC: m/e 255 (М+).
Пример 7
Гидрохлорид 2-(3,4-дигидро-1Н-изохинолин-2-ил)-5,6,7,8-тетрагидрохинолин-4-иламина (1:1)
а) 1-Оксид 2-бром-4-нитро-5,6,7,8-тетрагидрохинолина
1-Оксид 2-бром-5,6,7,8-тетрагидрохинолина (8,0 г, 35 ммолей) (S.Zimmermann и др., J. Am. Chem. Soc., 113, 183 (1991)) при интенсивном охлаждении на ледяной бане обрабатывали конц. H2SO4 (65 мл), а затем конц. HNO3 (10 мл). Полученную смесь нагревали при 90°С в течение 90 мин, охлаждали и выливали в измельченный лед (200 г). Затем добавляли NaOH (28% раствор) до рН 7 и экстрагировали AcOEt. Органическую фазу сушили (Na2SO4) и концентрировали, при этом получали 7,9 г (83%) указанного в заголовке соединения в виде масла желтого цвета. МС: m/е 272 (М).
б) 2-Бром-5,6,7,8-тетрагидрохинолин-4-иламин
Смесь 1-оксида 2-бром-5,6,7,8-тетрагидрохинолина (пример 7а) (7,9 г, 28,9 ммоля), порошкообразного железа (13,3 г, 238 ммолей) и уксусной кислоты (160 мл) нагревали при 100°С в течение 1 ч. Затем смесь охлаждали, фильтровали, упаривали и остаток распределяли между двумя фазами (AcOEt/раствор NaHCO3). Органическую фазу сушили (Na2SO4) и концентрировали, остаток очищали хроматографией (SiO2, элюент: СН2Cl2/МеОН, 98:2), при этом получали 2,4 г (37%) указанного в заголовке соединения в виде твердого вещества коричневого цвета. МС: m/е 226 (М+).
в) Гидрохлорид 2-(3,4-дигидро-1Н-изохинолин-2-ил)-5,6,7,8-тетрагидрохинолин-4-иламина (1:1)
Указанное в заголовке соединение получали в виде кристаллов грязно-белого цвета по общему методу, описанному в примере 1, при взаимодействии 2-бром-5,6,7,8-тетрагидрохинолин-4-иламина (пример 76) с 1,2,3,4-тетрагидроизохинолином с последующей кристаллизацией (MeOH/Et2O) в виде гидрохлорида. tпл.109-110°С. МС: т/е 279 (М+).
Пример 8
Этиловый эфир N-[2-(3,4-дигидро-1Н-изохинолин-2-ил)-6-метилпиридин-4-ил]оксаламовой кислоты
К охлаждаемому на ледяной бане раствору 2-(3,4-дигидро-1Н-изохинолин-2-ил)-6-метилпиридин-4-иламина (пример 4) (2,9 г, 12,1 ммоля) в пиридине (40 мл) по каплям добавляли раствор этилового эфира хлороксоуксусной кислоты (2,0 г, 14,6 ммоля) в ТГФ (25 мл). Смесь перемешивали при 75°С в течение 1 ч, упаривали и распределяли между двумя фазами (AcOEt/раствор NaHCO3). Органическую фазу сушили (Na2SO4) и концентрировали, продукт кристаллизовали (AcOEt), при этом получали 3,1 г (75%) указанного в заголовке соединения в виде твердого вещества светло-коричневого цвета. tпл.128-129°С. МС: m/е 340 (М+Н+).
Пример 9
Гидрохлорид 2-[2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламино]этанола (1:1)
а) Гидрохлорид N-[2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]оксаламовой кислоты (1:1)
Указанное в заголовке соединение получали в виде кристаллов белого цвета по общему методу, описанному в примере 8, при взаимодействии 2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламина (пример 1) с этиловым эфиром хлороксоуксусной кислоты с последующей кристаллизацией (EtOH/Et2O) в виде гидрохлорида. tпл.>187°C (разл.). МС: m/е 326 (М+Н+).
б) Гидрохлорид 2-[2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламино]этанола (1:1)
Раствор этилового эфира N-[2-(3,4-дигидро-1Н-изохинолин-2-ил)-пиридин-4-ил]оксаминовой кислоты (пример 9а) (1,3 г, 4,1 ммоля) в ТГФ (41 мл) охлаждали на ледяной бане и пятью порциями добавляли литийалюминийгидрид (0,31 г, 8,2 ммоля). Реакционную смесь кипятили с обратным холодильником в течение 2 ч, реакцию останавливали добавлением водного раствора сегнетовой соли и смесь разбавляли AcOEt (200 мл). Органическую фазу отделяли, сушили (Na2SO4) и концентрировали, остаток очищали хроматографией (SiO2, элюент: CH2Cl2/CH3OH/NH4OH, 140:10:1), при этом получали свободное основание указанного в заголовке соединения в виде бесцветного масла (0,79 г, 72%). Полученное масло обрабатывали хлористым водородом и растирали с гексаном, при этом получали указанное в заголовке соединение в виде гигроскопичной пены белого цвета. МС: m/е 270 (M+Н+).
Пример 10
Гидрохлорид 2-[2-(3,4-дигидро-1Н-изохинолин-2-ил)-6-метилпиридин-4-иламино]этанола (1:1)
Этиловый эфир 1N-[2-(3,4-дигидро-1Н-изохинолин-2-ил)-6-метилпиридин-4-ил]оксаламовой кислоты (пример 8) обрабатывали литийалюминийгидридом по общему методу, описанному в примере 9. После экстракции и хроматографии свободное основание указанного в заголовке соединения обрабатывали аликвотным количеством 0,1н. соляной кислоты, раствор фильтровали и лиофильно высушивали. МС: m/е 284 (М+Н+).
Пример 11
Фумарат 2-[2-(3,4-дигидро-1Н-изохинолин-2-ил)-5-метилпиридин-4-иламино]этанола (1:1)
а) Этиловый эфир N-[2-(3,4-дигидро-1Н-изохинолин-2-ил)-5-метилпиридин-4-ил]оксаламовой кислоты
Указанное в заголовке соединение получали в виде кристаллов белого цвета по общему методу, описанному в примере 8, при взаимодействии 2-(3,4-дигидро-1Н-изохинолин-2-ил)-5-метилпиридин-4-иламина (пример 3) с этиловым эфиром хлороксоуксусной кислоты (AcOEt). tпл.110-111°С. MC: m/e 340 (М+Н+).
б) Фумарат 2-[2-(3,4-дигидро-1Н-изохинолин-2-ил)-5-метилпиридин-4-иламино] этанола (1:1)
Этиловый эфир N-[2-(3,4-дигидро-1Н-изохинолин-2-ил)-5-метилпиридин-4-ил]оксаминовой кислоты (пример 11а) обрабатывали литийалюминийгидридом по общему методу, описанному в примере 9. После экстракции и хроматографии свободное основание указанного в заголовке соединения обрабатывали аликвотным количеством фумаровой кислоты и кристаллизовали (MeOH/Et2O), при этом получали соль белого цвета. tпл.232-233°С. MC: m/e 284 (М+Н+).
Пример 12
Фумарат [2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]метиламин, 1:1
а) Гидрохлорид этилового эфира [2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]карбаминовой кислоты (1:1)
Указанное в заголовке соединение получали в виде твердого вещества белого цвета по общему методу, описанному в примере 8, при взаимодействии 2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламина (пример 1) с этиловым эфиром хлормуравьиной кислоты с последующей кристаллизацией (MeOH/Et2O), в виде гидрохлорида. tпл.>213°C (разл.). MC: m/e 298 (М+Н+).
б) Фумарат 2-[2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]метиламина (1:1)
Этиловый эфир [2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]карбаминовой кислоты (пример 12а) обрабатывали литийалюминийгидридом по общему методу, описанному в примере 9. После экстракции и очистки хроматографией свободное основание указанного в заголовке соединения обрабатывали аликвотным количеством фумаровой кислоты, при этом получали кристаллы белого цвета (MeOH/Et2O). tпл.171-172°C. MC: m/e 239 (М+).
Пример 13
Фумарат [2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]диметиламина Раствор 2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламина (пример 1) (2,3 г, 10,0 ммолей) в муравьиной кислоте (16 мл) обрабатывали водным раствором формальдегида (8 мл 40% раствора). Смесь кипятили с обратным холодильником в течение 1 ч, а затем упаривали летучие компоненты. Остаток распределяли между двумя фазами (AcOEt/раствор NaHCO3), органическую фазу отделяли, сушили (Na2SO4) и концентрировали, продукт очищали хроматографией (SiO2, элюент: СН2Cl2/СН3ОН/NH4ОН, 300:10:1), при этом получали свободное основание указанного в заголовке соединения в виде бесцветного масла (1,44 г, 57%), которое кристаллизовали (MeOH/Et2O) в виде фумарата белого цвета. tпл.177-178°С. MC: m/e 254 (М+Н+).
Пример 14
Гидрохлорид 5-(3,4-дигидро-1Н-изохинолин-2-ил)-1-метил-1,4-дигидро-2Н-пиридо[4,3-d][1, 3]оксазина (1:1)
Свободное основание указанного в заголовке соединения получали в виде минорного (менее полярного) продукта (0,54 г, 19%) при синтезе [2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]диметиламина (пример 13). Продукт кристаллизовали (MeOH/Et2O) в виде гидрохлорида белого цвета. tпл.220-221°C. MC: m/e 282 (М+Н+).
Пример 15
Гидрохлорид N-[2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]ацетамида (1:1)
Указанное в заголовке соединение получали по общему методу, описанному в примере 8, при взаимодействии 2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-иламина (пример 1) с ацетилхлоридом с последующей кристаллизацией (MeOH/Et2O) в виде гидрохлорида белого цвета. tпл.229-230°С. MC: m/e 267 (М+).
Пример 16 Фумарат [2-(3,4-дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]этиламина
N-[2-(3,4-Дигидро-1Н-изохинолин-2-ил)пиридин-4-ил]ацетамид (пример 15) обрабатывали литийалюминийгидридом по общему методу, описанному в примере 9. После очистки хроматографией свободное основание указанного в заголовке соединения обрабат