Производное пиперидина, способ его получения и фармацевтическая композиция на его основе
Иллюстрации
Показать всеИзобретение относится к новому производному пиперидина формулы (I)
где R обозначает водород, n равно целому числу от 1 до 5. Указанные соединения обладают ингибирующей активностью в отношении ФДЭЧ и могут быть использованы в медицине для лечения воспалительных заболеваний, диабета, аллергических, аутоиммунных и других заболеваний. 5 н. и 5 з.п. ф-лы, 10 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к производному пиперидина Более конкретно, настоящее изобретение относится к
(1) производному пиперидина формулы (I)
(2) к способу его получения,
(3) к композиции, включающей его в качестве активного ингредиента,
(4) к соединению формулы (III)
которое используется в качестве промежуточного соединения для получения соединений формулы (I), и
(5) к способу его получения.
Циклический аденозин-3',5'-монофосфат (цАМФ) и циклический гуанозин-3',5'-монофосфат (цГМФ), как внутриклеточные молекулы сигнальной трансдукции (вторичные мессенджеры), подвергаются разложению группой гидролаз, обозначаемых в целом фосфодиэстеразами (ФДЭ), на неактивные 5'-АФМ и 5'-ГМФ соответственно.
Изозимы ФДЭ, которые инактивируют указанные молекулы, не представлены однородно in vivo, а распределяются in vivo на основе органоспецифичной локализации, демонстрируя, например, различный характер распределения по клеткам и по тканям.
К настоящему времени подтверждено наличие 11 семейств ФДЭ1-ФДЭ11 (см. Current Opinion in Cell Biology, 12, 174-179 (2000)).
Среди указанных ФДЭ ФДЭ4 присутствуют в различных клетках, таких как гладкомышечные клетки дыхательных путей, эпителиальные клетки, клетки, присутствующие при воспалении (макрофаги, нейтрофилы и эозинофилы) и Т-лимфоциты и т.п., и контролируют клеточную функцию путем регуляции уровня внутриклеточного цАМФ в указанных клетках. С другой стороны, другие ФДЭ, такие как ФДЭ5 и т.п., присутствуют, например, в тромбоцитах, в мышечных клетках сердца и гладкомышечных клетках сосудов и участвуют в регуляции системы кровообращения органов за счет регуляции уровня внутриклеточных цГМФ или цАМФ.
Так, известно, что ингибиторы ФДЭ4 обладают бронходилатирующей активностью, противовоспалительной активностью, ингибирующей активностью по высвобождению медиатора, иммуносупрессорной активностью и т.п., поскольку они вызывают накопление внутриклеточного цАМФ за счет ингибирования деградации цАМФ под действием ФДЭ4.
Соответственно, считается, что средство, которое специфически ингибирует ФДЭ4, не демонстрирует активности, свойственной процессу ингибирования другими видами ФДЭ, такими как ФДЭ5, на органы, участвующие в системе кровообращения, и используемыми для профилактики и/или лечения различных заболеваний, таких как воспалительные заболевания (например, астма, обструктивная болезнь легких, сепсис, саркоидоз, нефрит, гепатит, энтерит и т.п.), заболевания диабетической природы, аллергические заболевания (например, аллергический ринит, аллергический конъюнктивит, сезонный конъюнктивит, атопический дерматит и т.п.), аутоиммунные заболевания (например, язвенный колит, болезнь Крона, ревматизм, псориаз, рассеянный склероз, коллагеновая болезнь и т.п.), глазные болезни (например, аллергический конъюнктивит, сезонный конъюнктивит и т.п.), остеопороз, перелом кости, остеоартрит, ожирение, булимия, депрессия, болезнь Паркинсона, деменция, ишемическое реперфузионное повреждение, лейкемия и СПИД (Exp. Opin. Invest. Drugs, 8, 1301-1325 (1999)), шок, системное воспалительное заболевание (SIRS) и т.п.
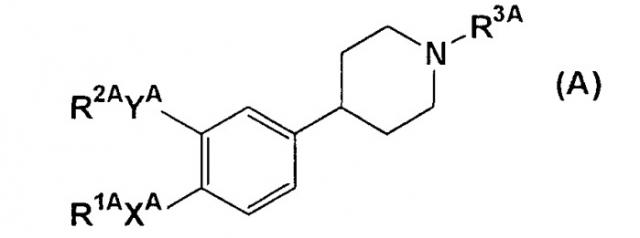
В качестве ингибиторов ФДЭ4, например, в описании JP Hei 8-509731 (т.е. WO94/25437) раскрывается соединение формулы (А)
(где R1A обозначает H или C1-6алкил; R2A обозначает С3-7алкил, С3-7циклоалкил и т.п.; R3A обозначает COR4A, COCOR4A и т.п.; R4A обозначает H, OR5A, NHOH и т.п.; R5A обозначает H, C1-6алкил и т.п.; XA обозначает O и т.п.; YA обозначает О и т.п.) или его фармацевтически приемлемая соль, которая обладает ингибирующей активностью в отношении ФДЭ4.
Кроме того, в описании WO 93/19747 раскрывается соединение формулы (B)
(где R1B обозначает -(CR4BR5B)rBR6B и т.п.; rB равен 1-6; R4B и R5B, каждый, независимо обозначает атом водорода или С1-2алкильную группу; R6B обозначает атом водорода, С3-6циклоалкильную группу и т.п.; XB обозначает YBR2B и т.п.; YB обозначает О и т.п.; R2B обозначает метил, этил и т.п.; X2B обозначает О и т.п.; X3B обозначает атом водорода и т.п.; sB равен 0-4; R3B обозначает атом водорода, CN и т.п.; X5B обозначает атом водорода и т.п.; ZB обозначает CR8BR8BC(O)OR14B, CR8BR8BC(Y'B)NR10BR14B и т.п.; R8B обозначает атом водорода и т.п.; R10B обозначает атом водорода, OR8B и т.п.; и R14B обозначает атом водорода и т.п.) или его фармацевтически приемлемая соль, которая обладает ингибирующей активностью в отношении ФДЭ4.
Также в описании WO 93/19749 раскрывается соединение формулы (С)
(где R1С обозначает -(CR4СR5С)rcR6С и т.п.; rC равен 1-6; R4С и R5С, каждый, независимо обозначает атом водорода или С1-2алкильную группу; R6С обозначает атом водорода, С3-6циклоалкильную группу и т.п.; XС обозначает YCR2C и т.п.; YC обозначает О и т.п.; R2C обозначает метил, этил и т.п.; X2C обозначает О и т.п.; X3C обозначает атом водорода и т.п.; X4С обозначает
и т.п.; R3C обозначает атом водорода, CN и т.п.; X5С обозначает атом водорода и т.п.; sC равен 0-4; ZС обозначает C(O)OR14С, C(Y'С)NR10СR14С и т.п.; R10с обозначает атом водорода, OR8С и т.п.; R8С обозначает атом водорода и т.п.; и R14С обозначает атом водорода и т.п.) или фармацевтически приемлемая соль, которая обладает ингибирующей активностью в отношении ФДЭ4.
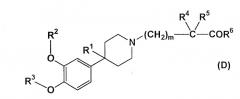
Заявитель ранее зарегистрировал заявку на патент, относящуюся к производному пиперидина (D)
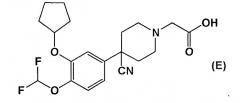
(где все символы имеют значения, такие же, как указанные в PCT/JP01/06861) и к его нетоксичной соли и ингибитору ФДЭ4, включающим его в качестве активного ингредиента (см. описание в WO 02/14280). Конкретно, пример 2(9) в заявке на международный патент раскрывает 2-(4-(3-циклопентилокси-4-дифторметоксифенил)-4-цианопиперидин-1-ил-уксусную кислоту формулы (E)
Описание изобретения
Задачей настоящего изобретения является создание соединения, обладающего ингибирующей активностью в отношении ФДЭ4. Указанная задача может быть достигнута производным пиперидина формулы (I).
Соединение формулы (I), в особенности моногидрат 2-(4-(3-циклопентилокси-4-дифторметоксифенил)-4-цианопиперидин-1-ил)уксусной кислоты (сокращенно обозначаемый далее как соединение 1), не было описано конкретно в указанной выше заявке на международный патент и представляет собой совершенно новое соединение.
Также авторы настоящего изобретения обнаружили, что соединение формулы (III) весьма полезно в качестве промежуточного соединения для получения производного пиперидина формулы (II), что составило суть настоящего изобретения.
Настоящее изобретение относится
(1) к моногидрату 2-(4-(3-циклопентилокси-4-дифторметоксифенил)-4-цианопиперидин-1-ил)уксусной кислоты формулы (I):
где R обозначает водород, атом щелочного металла, атом щелочноземельного металла или органический амин, n представляет собой целое число от 1 до 5 или соответствующую фракцию его, или не соответствующую фракцию до 5,
(2) к производному пиперидина по указанному выше пункту (1), где R обозначает водород,
(3) к производному пиперидина по указанному выше пункту (1), где n равно 1,
(4) к соединению по любому из указанных выше пунктов (1)-(3), которое представляет собой моногидрат 2-(4-(3-циклопентилокси-4-дифторметоксифенил)-4-цианопиперидин-1-ил)уксусной кислоты,
(5) к 4-(3-циклопентилокси-4-дифторметоксифенил)-4-цианопиперидину формулы (III) или его аддитивной соли кислоты:
(6) к способу получения 2-(4-(3-циклопентилокси-4-дифторметоксифенил)-4-цианопиперидин-1-ил)уксусной кислоты •nH2O, где n имеет значение, указанное выше в пункте (1), который включает проведение рекристаллизации в спиртовом растворителе не обязательно в смеси с водой и/или одним или более органическим(и) растворителем(ями),
(7) к ингибитору ФДЭ4, включающему соединение по любому из указанных выше пунктов (1)-(4) в качестве активного ингредиента,
(8) к композиции для предупреждения и/или лечения воспалительных заболеваний, диабета, аллергических заболеваний, аутоиммунных заболеваний, глазных болезней, остеопороза, перелома кости, остеоартрита, ожирения, булимии, депрессии, болезни Паркинсона, деменции, ишемического реперфузионного повреждения, лейкемии, СПИДа, шока, системной воспалительной болезни (SIRS), которая включает соединение по любому из указанных выше пунктов (1)-(4) в качестве активного ингредиента,
(9) к композиции для предупреждения и/или лечения по указанному выше пункту (8), где воспалительное заболевание включает астму, хроническую обструктивную болезнь легких, сепсис, саркоидоз, нефрит, гепатит или энтерит,
(10) к композиции для предупреждения и/или лечения по указанному выше пункту (8), где аллергическое заболевания представляет собой аллергический ринит или атопический дерматит,
(11) к композиции для предупреждения и/или лечения по указанному выше пункту (8), где аутоиммунное заболевание представляет собой язвенный колит, болезнь Крона, ревматизм, псориаз, рассеянный склероз или коллагеновую болезнь,
(12) к композиции для предупреждения и/или лечения по указанному выше пункту (8), где глазные болезни представляют аллергический конъюнктивит или сезонный конъюнктивит, и
(13) к способу получения соединения формулы (III) по указанному выше пункту (5).
В настоящем описании целое число 1-5, которое представляет собой значения n, включает 1, 2, 3, 4 и 5.
В настоящем описании соответствующая фракция от 1 до 5, которая обозначает n, представляет собой, например, 1/2, 1/3, 1/4, и т.п., и несоответствующая фракция представляет собой, например, 3/2, 10/2 и т.п.
В настоящем описании металлы, которые обозначает R, включают все фармацевтически приемлемые металлы, например щелочные металлы, щелочноземельные металлы и т.п. Щелочные металлы включают калий, натрий, литий и т.п., щелочноземельные металлы включают кальций, магний и т.п.
В настоящем описании органические амины, которые обозначает R, включают такие амины, которые образуют соль и являются фармацевтически приемлемыми, например триэтиламин, метиламин, диметиламин, циклопентиламин, бензиламин, фенетиламин, пиперидин, моноэтаноламин, диэтаноламин, трис(гидроксиметил)метиламин, лизин, аргинин, N-метил-D-глюкамин и т.п.
nH2O в формуле (I) представляет собой кристаллизационную воду и адгезионную воду. Кристаллизационная вода предпочтительно указывается как nH2O.
Соединение формулы (I) в контексте фармацевтического рассмотрения R представляет собой предпочтительно водород, и n равно предпочтительно 1.
Краткое описание чертежей
На фиг. 1 показана порошковая рентгенограмма моногидрата 2-(4-(3-циклопентилокси-4-дифторметоксифенил)-4-цианопиперидин-1-ил)уксусной кислоты (соединение 1).
На фиг. 2 показана порошковая рентгенограмма 2-(4-(3-циклопентилокси-4-дифторметоксифенил)-4-цианопиперидин-1-ил)уксусной кислоты (соединение сравнения).
На фиг. 3 показан ИК спектр соединения 1.
На фиг. 4 приведены данные по ИК спектру сравнительного соединения.
На фиг. 5 показан график, построенный на основе измерения ДСК соединения 1.
На фиг. 6 показан график, построенный на основе измерения ТГ соединения 1.
На фиг. 7 показан график, построенный на основе измерения ДСК сравнительного соединения.
На фиг. 8 показан график, построенный на основе измерения ТГ сравнительного соединения.
На фиг. 9 приведены данные структурного анализа монокристалла соединения 1.
На фиг. 10 приведены данные структурного анализа монокристалла соединения 1.
Способы получения соединения по настоящему изобретению
Соединения по настоящему изобретению формул (I) и (III) могут быть получены в соответствии с приведенными ниже способами, описанными в примерах.
Соединение по настоящему изобретению формулы (I) может быть получено посредством снятия защиты, защитных групп карбоксигруппы соединения формулы (II)
(где R1 обозначает защитную группу для карбоксигруппы).
Защитные группы для карбоксигруппы включают, например, метил, этил, трет-бутил, бензил и т.п.
Защитные группы для карбоксигруппы не ограничиваются указанными выше, и могут также использоваться другие, если они легко и селективно удаляются. Так, например, могут быть использованы группы, описанные в руководстве Грина (T.W.Greene, Protective Groups in Organic Synthesis 3rd edition, Wiley, New York, 1999).
Реакция удаления защитных групп с карбоксигруппы известна, например
(1) реакция удаления защитных групп в щелочных условиях,
(2) реакция удаления защитных групп в кислых условиях,
(3) реакция удаления защитных групп путем гидратации и т.п.
Ниже указанные методы описаны подробно.
(1) Реакция снятия защитной группы в щелочных условиях проводится, например, в органическом растворителе (например, в метаноле, тетрагидрофуране, диоксане, диметилформамиде и т.п.) с использованием гидроксида щелочного металла (например, гидроксида натрия, гидроксида калия, гидроксида лития и т.п.), гидроксида щелочноземельного металла (например, гидроксида бария, гидроксида кальция и т.п.) или карбоната (например, карбоната натрия, карбоната калия и т.п.), органического амина (например, триэтиламина, диизопропилэтиламина, пиперазина и т.п.), или соли четвертичного аммония (например, фторида тетрабутиламмония и т.п.), или его водного раствора, или его смеси, при температуре примерно от 0° до 40°С.
(2) Реакция снятия защитной группы в кислых условиях проводится, например, в органическом растворителе (например, в метиленхлориде, хлороформе, диоксане, этилацетате, анизоле и т.п.) с использованием органической кислоты (например, уксусной кислоты, трифторуксусной кислоты, метансульфоновой кислоты и т.п.), неорганической кислоты (например, хлористоводородной кислоты, серной кислоты, и т.п.) или их смеси (бромисто-водородной кислоты/уксусной кислоты и т.п.) при температуре примерно от 0 до 100°С.
(3) Реакция снятия защитной группы путем гидратации проводится, например, в растворителе (например, в эфирах (тетрагидрофуран, диоксан, диметоксиэтан, диэтиловый эфир и т.п.), спиртах (метанол, этанол и т.п.), бензолах (бензол, толуол и т.п.), кетонах (ацетон, метилэтилкетон и т.п.), нитрилах (ацетонитрил и т.п.), амидах (диметилформамид и т.п.), воде, этилацетате, уксусной кислоте, или смеси двух или более агентов, выбранных из числа указанных выше, в присутствии катализатора (палладий-на-угле, черный палладий, гидроксид палладия, оксид платины, никелевый катализатор Ренея и т.п.) в условиях нормального атмосферного давления или при повышенном давлении водорода или в присутствии формиата аммония при температуре от 0 до 200°С.
Как очевидно специалистам в данной области, соединения по настоящему изобретению могут быть легко получены с использованием указанных реакций.
Соединение формулы (I) может быть также получено при необязательном проведении реакции солеобразования, перекристаллизации или сушки после проведения реакции удаления защитной группы.
Солеобразование, перекристаллизация и сушка представляют собой известные реакции и могут быть проведены, например, в соответствии со способом, описанным в литературе (The fouth series of experimental chemistry No. 1, Basic operation No. 1 (edition by The Chemical Society of Japan)).
Растворители, которые используют при перекристаллизации, представляют собой, например, водные и/или спиртовые растворители, необязательно включающие один или более органических растворителей.
Спиртовые растворители включают такие растворители, которые представляют алканы, несущие гидроксигруппы в своей структуре, например метанол, этанол, пропанол, изопропанол, бутанол и т.п.
Органические растворители включают растворители, использующиеся при перекристаллизации, например эфирные растворители линейной структуры, эфирные растворители циклической структуры, амидные растворители, фосфорамидные растворители, серусодержащие растворители, нитрильные растворители, сложноэфирные растворители, кетоновые растворители, карбонатные растворители, растворители на основе карбоновых кислот, алкановые растворители линейной структуры, алкановые растворители циклической структуры, ароматические карбоциклические растворители, циклические азотсодержащие растворители.
Эфирные растворители линейной структуры включают растворители, которые содержат простую эфирную связь в своей структуре и имеют линейную структуру. Заместителем на углероде, который составляет эфирную связь, может быть цепь или кольцо, например 1,2-диметоксиэтан, циклопентилметиловый эфир, диэтиловый эфир, изопропиловый эфир и метил-трет-бутиловый эфир и т.п.
Эфирные растворители циклической структуры включают растворители, которые содержат эфирную связь в своей структуре, например тетрагидрофуран, 1,4-диоксан и т.п.
Амидные растворители включают растворители, которые содержат амидную связь в своей структуре, например N,N-диметилацетамид, N,N-диметилформамид и т.п.
Фосфорамидные растворители включают растворители, которые содержат фосфорамидную связь в своей структуре, например гексаметилфосфортриамид и т.п.
Серусодержащие растворители включают растворители, которые содержат атом серы в своей структуре, например диметилсульфоксид, тетраметиленсульфоксид и т.п.
Нитрильные растворители включают растворители, которые содержат нитрильный радикал в своей структуре, например ацетонитрил и т.п.
Сложноэфирные растворители включают растворители, которые содержат сложноэфирную связь в своей структуре, например этилацетат и т.п.
Кетоновые растворители включают растворители, которые содержат кетоновый радикал в своей структуре, например ацетон, метилкетон и т.п.
Карбонатные растворители включают растворители, которые содержат карбоксильный радикал в своей структуре, например уксусную кислоту.
Алкановые растворители линейной структуры включают растворители, структура которых представляет собой линейный алкан, например пентан, н-гексан, гептан и т.п.
Алкановые растворители циклической структуры включают растворители, структура которых представляет собой циклический алкан, например циклогексан и т.п.
Ароматические карбоциклические растворители включают растворители на основе ароматических карбоциклов, например бензол, толуол, ксилол и т.п.
Циклические азотсодержащие растворители включают растворители, которые содержат атом(ы) азота и имеют циклическую структуру, например пиридин, пиперидин, 1,3-диметил-2-имидазолидинон, 1-метил-2-пирролидон и т.п.
Операция сушки включает, например, естественную сушку, воздушную сушку, ускоренную сушку (с использованием сушильных агентов, сушки при пониженном давлении и т.п.)
Соединение формулы (II) может быть получено в соответствии с реакционными схемами 1 и 2, описанными далее в примерах.
Соединение формулы (III) является новым и может быть получено при проведении реакции удаления защитных групп с соединения формулы (IV)
(где R2 обозначает защитную группу для аминогруппы).
Защитные группы для аминогруппы включают, например, бензил, 4-метоксибензил, бензилоксикарбонил, трет-бутоксикарбонил, трифторацетил, 9-флуоренилметоксикарбонил и т.п.
Защитные группы для аминогруппы не ограничиваются указанными выше и могут быть использованы другие, если они легко и селективно удаляются. Например, могут быть использованы группы, описанные в руководстве Грина (T.W.Greene, Protective Groups in Organic Synthesis 3rd edition, Wiley, New York, 1999).
Реакции удаления защитных групп для аминогруппы известны и включают, например:
(1) реакцию удаления защитных групп в щелочных условиях,
(2) реакцию удаления защитных групп в кислых условиях,
(3) реакцию удаления защитных групп путем гидратации и т.п.
Указанные ниже методы описаны подробно.
(1) Реакция удаления защитных групп в щелочных условиях проводится, например, в органическом растворителе (в метаноле, этаноле, тетрагидрофуране, диоксане, диметилформамиде и т.п.) с использованием гидроксида щелочного металла (гидроксида натрия, гидроксида калия, гидроксида лития и т.п.), гидроксида щелочноземельного металла (гидроксида бария, гидроксида кальция и т.п.) или карбоната (карбоната натрия, карбоната калия и т.п.), органического амина (триэтиламина, диизопропилэтиламина, пиперазина, пиперидина, морфолина и т.п.), или соли четвертичного аммония (например, фторида тетрабутиламмония и т.п.), или их раствора, или их смеси при температуре от 0 до 40°С.
(2) Реакция удаления защитных групп в кислых условиях проводится, например, в органическом растворителе (в метиленхлориде, хлороформе, диоксане, этилацетате, анизоле и т.п.) или в его отсутствие с использованием органической кислоты (уксусной кислоты, трифторуксусной кислоты, метансульфоновой кислоты и т.п.), или неорганической кислоты (хлористоводородной кислоты, серной кислоты и т.п.), или их смеси (бромистоводородной кислоты/уксусной кислоты и т.п.) при температуре от 0 до 100°С.
(3) Реакцию удаления защитных групп путем гидратации проводят, например, в растворителе, в эфирах, таких как тетрагидрофуран, диоксан, диметоксиэтан, диэтиловый эфир и т.п., в спиртах (метанол, этанол и т.п.), в бензолах (бензол, толуол и т.п.), в кетонах (ацетон, метилэтилкетон и т п.), в нитрилах (ацетонитрил и т.п.), в амидах (диметилформамид и т.п.), воде, этилацетате, уксусной кислоте или в смеси двух или более растворителей, выбранных из указанных выше агентов, в присутствии катализатора (палладий-на-угле, черный палладий, гидроксид палладия, оксид платины, никелевый катализатор Ренея и т.п.) при нормальном давлении водорода или при повышенном давлении водорода или в присутствии формиата аммония при температуре от 0 до 200°С.
Как очевидно специалистам в данной области, соединения по настоящему изобретению могут быть легко получены при проведении указанных реакций удаления защитной группы.
Соединение формулы (IV) может быть также получено в соответствии с методом, описанным на приведенной ниже реакционной схеме 3 или в примерах.
На приведенных реакционных схемах R3 обозначает защитную группу фенола, X обозначает удаляемую группу (хлор, бром, йод, тозил, мезил и т.п.), и другие символы имеют указанные выше значения.
В каждой реакции по настоящему изобретению реакционные продукты могут быть очищены с использованием традиционных методик, например перегонкой при нормальном или повышенном давлении, высокоэффективной жидкостной хроматографией, тонкослойной хроматографией или колоночной хроматографией с использованием силикагеля или силиката магния. Очистка может быть проведена после каждой реакции или после проведения серии реакций.
Соль
Соединение по настоящему изобретению формулы (III) может быть превращено в кислотно-аддитивную соль традиционным способом.
Кислотно-аддитивные соли соединения формулы (III) включают, например, соли неорганической кислоты, такой как хлористоводородная, бромистоводородная, йодистоводородная, серная, фосфорная и азотная; и соли органической кислоты, такие как ацетат, лактат, тартрат, бензоат, цитрат, метансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат, изетионат, глюкуронат и глюконат.
Соединение по настоящему изобретению формулы (I), особенно его моногидрат (соединение I, описанное ниже), применимы для получения стабильной композиции, в особенности твердой композиции (например, таблеток, капсул и т.п.). Так, ангидрат (безводное) (сравнительное соединение, описанное ниже) может быть превращен в смесь ангидрата и моногидрата при поглощении водяных паров в ходе приготовления твердой композиции или при ее стоянии, тогда как соединение по настоящему изобретению не вызывает таких морфологических изменений; в этой связи соединение по настоящему изобретению является очень полезными.
Сравнительный тест
В ходе описанного ниже сравнительного исследования было подтверждено (с помощью порошковой рентгенограммы, данных по ИК (инфракрасному спектру), данных ДСК (дифференциальная сканирующая калориметрия), данных ТГ (термогравиметрии), результатов элементного анализа, результатов рентгено-структурного анализа монокристаллов), что два соединения являются совершенно разными; т.е. моногидрат 2-(4-(3-циклопентилокси-4-дифторметоксифенил)-4-цианопиперидин-1-ил)уксусной кислоты (соединение 1; указанное соединение получают по способу примера 2, приведенному далее), как представитель соединения по настоящему изобретению формулы (I), и 2-(4-(3-циклопентилокси-4-дифторметоксифенил)-4-цианопиперидин-1-ил)уксусная кислота (сокращенно обозначаемое как сравнительное соединение) в сравнительном примере 1, описанном ниже, в соответствии с примером 2(9) в заявке на международный патент No. PCT/JP00/06861 (т.е. WO02/14280), который приведен в указанной выше заявке на международный патент.
1) Данные порошковой рентгенограммы
Графики, описывающие порошковую рентгенограмму, приведены на фиг. 1 и 2, на которых показан Cu Kα характерный рентгеновский спектр соединения 1 и сравнительного соединения. Порошковая рентгенограмма, d-параметр и относительная интенсивность показаны в таблице.
Условия измерения
Прибор: Прибор для определения порошковой рентгенограммы Rigaku Corporation, RINT-1400
| Мишень | Cu |
| Фильтр | не используется |
| Напряжение | 40 кВ |
| Сила тока | 20 мА |
| Скорость сканирования | 2,0°/мин |
| Относительная интенсивность порошковой рентгенограммы | |||
| Соединение 1 (фиг.1) | Сравнительное соединение (фиг.2) | ||
| d-параметр(Е) | Относительная интенсивность | d-параметрЕ | Относительная интенсивность |
| 9,006,295,705,155,044,874,674,494,234,153,893,833,593,513,352,982,942,852,77 | 5619393081878214610023207543142112329 | 9,057,106,005,725,454,814,514,134,033,683,533,083,043,002,882,71 | 98 95764810019311621117967 |
Фиг. 1 и 2 (таблица) показывают, что оба соединения различаются как соединения, имеющие разные кристаллические структуры.
2) Данные ИК
На фиг.3 и 4 показаны данные ИК спектра соединения 1 и сравнительного соединения.
Условия измерения
Прибор Фотометр для определения дисперсии в инфракрасных лучах JASKO Corporation FT/IR-660Plus Infrared
Показатель растворения 4 см-1
Число сканирований 64
При сравнении фиг. 3 и 4 видно, что пики абсорбции от 1450 до 1200 см-1 и от 900 до 600 см-1 отличаются, поэтому можно сделать вывод, что указанные соединения явно являются разными.
3) Данные ДСК и ТГ
На фиг. 5, 6, 7 и 8 приведены графики, построенные на основе измерений ДСК и ТГ соединения 1 и сравнительного соединения.
Условия измерения
ДСК
| Приборы | дифференциальный сканирующий калориметр Seiko Instruments DSC6200 |
| Образец | примерно 4,8 мг |
| Ячейка для образца | открытая алюминиевая ячейка |
| Скорость пропускания газа аргона | 20 мл/мин |
| Скорость нагревания | 10°С/мин |
ТГ
| Приборы | термогравиметрический анализатор Shimadzu TGA-50 |
| Образец | примерно 4,8 мг |
| Ячейка для образца | открытая алюминиевая ячейка |
| Скорость пропускания газа аргона | 20 мл/мин |
| Скорость нагревания | 10°С/мин |
Из данных ДСК и ТГ видно, что анализируемые соединения являются разными.
В соединении 1 данные ДСК (фиг. 5) показывают широкий эндотермический пик между 75 и 120°С и эндотермический пик при 174°С. Данные ТГ (фиг. 6) указывают на снижение веса на 4,2% (что соответствует одной молекуле воды) в прежнем диапазоне и на отсутствие снижения веса до достижения температуры, когда прекращается указанная эндотермическая реакция.
И наоборот, в сравнительном соединении данные ДСК (фиг. 7) показывают единственный эндотермический пик при 174°С и отсутствие снижения веса до прекращения эндотермической реакции.
Поскольку данные порошковой рентгенограммы двух соединений (фиг. 1 и 2) различаются, следует полагать, что пик между 75°С и 120°С является эндотермическим, возникающим за счет выпаривания воды и кристаллического перехода и что эндотермический пик при 174°С является результатом плавления.
4) Результаты элементного анализа
Данные элементного анализа соединения 1 и сравнительного соединения показаны ниже. Условия измерения:
| Прибор | элементный анализатор Perkin Elmer PE 2400 серии II CHNS/O |
| Образец | 1,661 мг (соединение формулы (I) по настоящему изобретению)1,606 мг (сравнительное соединение) |
| Температура возгорания | 975°С |
| Температура восстановления | 500°С |
| Температура детекторного термостата | 82,5°С |
| Газ-носитель | газ гелий высокой чистоты, газ кислород высокой чистоты (99,999%) |
| Стандарт | ацетанилид |
Соединение 1 (C20H24F2N2O4 H2O)
Расчет (в %): С - 58,24; H - 6,35; N - 6,79
Найдено (в %): С - 58,09; H - 6,20; N - 6,73
Сравнительное соединение (С20H24F2N2O4)
Расчет (в %): С - 60,91; H - 6,13; N - 7,10
Найдено (в %): С - 60,90; H - 5,90; N - 7,09
На основании полученных данных было выявлено, что соединение 1 является моногидратом, а сравнительное соединение является ангидратом (безводным).
5) Результаты рентгеноструктурного анализа монокристалла
На фиг. 9 приведены данные по рентгеноструктурному анализу монокристалла соединения 1.
Условия измерения:
| Прибор: | структурный анализатор монокристалла Bruker SMART 6000 CCD |
| Температура измерения | 100К |
| Мишень | Мо (λ = 0,71073Е) |
| R = 0,1390 |
Данные по кристаллу имеют следующий вид:
Усилитель решетки: a = 11,9387(13)Е, b = 35,127(4)Е, c = 14,8284(16)Е, β = 141,418(3)°, V = 3878,1(7)Е3
Пространственная группа: P21/n
Из фиг. 9 и 10 видно, что соединение 1 является моногидратом.
Фармакологическая активность
Ингибирующая активность в отношении ФДЭ4 соединения по настоящему изобретению формулы (I) была подтверждена приведенными тестами.
Энзиматический тест in vitro
Экспериментальные методы
Клетки U937 (полученные из человеческих моноцитов) культивируют в среде PRMI 1640, содержащей 10% фетальной сыворотки теленка. Клетки U937 собирают и гомогенизируют в 50 мМ Tris-HCl буфере [pH 7,5, содержащей ПМСФ (1 мМ), лейпептин (1 мкг/мл) и пепстатин А (1 мкг/мл)]. После центрифугирования (15000 об/мин в течение 10 минут) отбирают супернатант и фильтруют его через фильтр 0,45 мкм. Образец наносят на колонку с MonoQ (производство Pharmacia, сильная анионообменная смола) и элюируют градиентом плотности от 0 до 0,8 М NaCl. Отбирают фракции, из которых исчезает активность ФДЭ в тесте с 10 мкМ ролипрама (селективный ингибитор ФДЭ4), и используют в качестве ферментного раствора для измерения ингибирующей активности ФДЭ4.
Ферментативную активность определяют следующим образом. 70 мкл разбавленного ферментного раствора (в фосфатном буфере (pH 7,4), содержащем 0,1 мг/кг бычьего сывороточного альбумина), 10 мкл раствора соединения 1 (10% ДМСО) и 10 мкл 3H-цАМФ (20000 имп/мин, 10 мкМ) [в имидазольном буфере (100 мМ, pH 7,5), содержащем MgSO4 (100 мМ) и бычий сывороточный альбумин (1 мг/мл)] смешивают и инкубируют при комнатной температуре в течение 30 минут. Реакцию останавливают обработкой реакционного раствора в течение 2,5 минут в микроволновой печи. После центрифугирования (2000 об/мин в течение 1 минуты) добавляют 10 мкл змеиного яда (1 мг/мл, производства Sigma, торговое наименование V7000) и инкубируют в течение 30 минут при комнатной температуре. На колонку с кремнеземом (100 мкл) наносят 50 мкл супернатанта, элюируют с использованием 80 мкл 0,005 N хлористоводородной кислоты и измеряют радиоактивность элюата.
Ингибирующую активность в отношении ФДЭ4 соединения по настоящему изобретению формулы (I) вычисляют с помощью следующего уравнения:
Уровень ингибирующей активности в отношении ФДЭ4 (%)
= (1-радиоактивность в присутствии соединения по настоящему изобретению формулы (I)/радиоактивность в отсутствие соединения по настоящему изобретению формулы (I)) Ч100
Величину ИК50 вычисляют как концентрацию соединения 1, дающую 50% ингибирование активности ФДЭ4.
В результате было показано, что величина ИК50 для соединения 1 составляет 42 нмоль/л.
Ингибирующий эффект продукции TNF-α
Гепаринизированный образец крови, взятый у здорового индивидуума, раскапывают по ячейкам 96-ячеечного планшета по 180 мкл/клетка. Раствор соединения 1 (конечная концентрация ДМСО: 0,1% или менее) распределяют по 10 мкл и планшет выдерживают при 37°С в течение 30 минут в инкубаторе в атмосфере 5% CO2. Реакцию инициируют добавлением 10 мкл раствора ЛПС. После 6 часов инкубации в атмосфере CO2 (5% CO2, увлажнение) планшет встряхивают и затем центрифугируют при 300 × g в течение 5 минут с получением 50 мкл супернатанта (плазма крови). Количество TNF-α в супернатанте измеряют с использованием набора для определения TNF-α методом ELISA (DIACLONE Cat. No. 850.090.096) в соответствии с прилагаемой к нему методикой. В результате было показано, что соединение 1 демонстрирует зависимую от дозы ингибирующую активность в отношении продукции TNF-α.
Токсичность
Токсичность соединения формулы (I) по настоящему изобретению очень низка, так что можно считать, что соединение достаточно безопасное для использования в качестве фармацевтического средства.
Применение в качестве фармацевтического препарата
Поскольку соединение по настоящему изобретению формулы (I) обладает ингибирующей активностью в отношении ФДЭ4, считается, что оно будет полезно для предупреждения и/или лечения различных заболеваний, таких как воспалительные заболевания (например, астма, хроническая обструктивная болезнь легких, сепсис, саркоидоз, нефрит, гепатит, энтерит и т.п.), диабет, аллергические заболевания (например, аллергический ринит, атопический дерматит и т.п.), аутоиммунные заболевания (например, язвенный колит, болезнь Крона, ревматизм, псориаз, рассеянный склероз, коллагеновые болезни и т.п.), глазные болезни (например, аллергический конъюнктивит, сезонный конъюнктивит и т.п.), остеопороз, перелом кости, остеоартрит, ожирение, булимия, депрессия, болезнь Паркинсона, деменция, ишемическое реперфузионное повреждение, лейкемия, СПИД, шок, системное воспалительное заболевание (SIRS) и т.п.
Соединение по настоящему изобретению формулы (I) в основном вводят системно или местно, перорально или парентерально, при использовании для достижения указанных выше целей.
Соединение по настоящему изобретению формулы (I) может вводиться в качестве сопутствующего средства в сочетании с другими препаратами:
1) дополняя и/или усиливая профилактический и/или лечебный эффект соединения,
2) улучшая кинетику и всасывание соединения и снижая вводимую дозу и/или
3) снижая побочный эффект соединения.
Сопутствующее средство для соединения по настоящему изобретению формулы (I) вместе с другими средствами может вводиться в виде объединенного препарата, в котором оба компонента объединены в единый препарат или в виде отдельных препаратов. В варианте введения в виде разных препаратов может использоваться режим и одновременного введения, и введения в разное время. В случае введения в разное время вначале может вводиться соединение формулы (I) и затем может вводиться другое соединение или, наоборот, вначале может вводиться другое соединение, а затем соединение формулы (I). Указанные способы введения могут быть одинаковыми или разными.