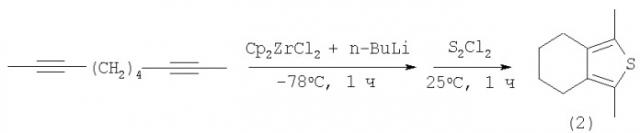Способ получения 2,3,4,5-тетраалкилтиофенов
Иллюстрации
Показать всеИзобретение относится к органической химии, в частности к способу получения 2,3,4,5-тетраалкилтиофенов, которые могут найти применение в пищевой промышленности, в качестве биологически активных соединений, красителей, присадок к маслам и гидравлическим жидкостям. Сущность способа заключается во взаимодействии дизамещенных ацетиленов с н-BuMgCl и полухлористой серой S2Cl2 в присутствии катализатора цирконацендихлорида в атмосфере аргона при комнатной температуре в диэтиловом эфире в течение 6-10 часов. Предложенный способ позволяет получить целевой продукт с выходом 40-54% по упрощенной технологии с использованием легкодоступного и нетоксичного сырья. 1 табл.
Реферат
Предлагаемое изобретение относится к органической химии, конкретно к усовершенствованному способу получения 2,3,4,5-тетраалкилтиофенов общей формулы (1):
где R=С2Н5, н-С3Н7, н-С4Н9
Замещенные тиофены могут найти применение в пищевой промышленности в качестве компонентов усилителей аромата пищи, биологически активных соединений, красителей, присадок к маслам и гидравлическим жидкостям.
Известен способ ([1], R.J.Fagan, W.A.Nugent, J.C.Calabrese. Metallacycle transfer from zirconium to main group elements: A versatile synthesis of heterocycles // JACS, V.116, 5, (1994), 1880-1890) синтеза тетразамещенных тиофенов (2) с выходом ˜55% взаимодействием α,ω-диацетиленов с последующей обработкой реакционной массы бис-циклопентадиенилцирконийдихлоридом и бутиллитием (n-BuLi) с полухлористой серой (S2Cl2) за 1 час по схеме:
Известным способом не могут быть получены 2,3,4,5-тетраалкилтиофены (1).
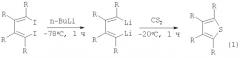
Известен способ ([2], J.Chen, Q.Song, Z.Xi. Novel reaction patterns of carbon disulfide with organolithium compounds via cleavage of C=S bonds or via cycloaddition reactions // Tetrahedron Lett., 43 (2002), 3533-3535) синтеза тетраалкилтиофенов взаимодействием 1,4-дилитио-1,3-диенов, полученных обработкой 1,2,3,4-тетраалкил-1,4-дииод-1,3-бутадиенов бутиллитием (n-BuLi) при температуре -78°С в течение 1 часа, с сероуглеродом при -20°С за 1 час с выходом 52-68% по схеме:
Известный способ синтеза 2,3,4,5-тетраалкилтиофенов (1) предполагает использование труднодоступных 1,4-дииодо-1,3-бутадиенов, крайне пирофорного n-BuLi и сероуглерода (CS2), представляющего из себя легковоспламеняющуюся, легколетучую и высокотоксичную жидкость, кроме того, в ходе реакции необходимо поддерживать низкую температуру -78°С.
Предлагается усовершенствованный способ синтеза 2,3,4,5-тетраалкилтиофенов (1).
Сущность способа заключается во взаимодействии дизамещенных ацетиленов формулы , где R=С2Н5, н-С3Н7, н-С4H9, с н-BuMgCl в присутствии катализатора цирконацендихлорида Cp2ZrCl2, взятыми в мольном соотношении :н-BuMgCl:Ср2ZrCl2=10:(22-26):(1.0-1.4), предпочтительно 10:24:1.2, с последующим добавлением при 0°С полухлористой серы (S2Cl2), взятой в количестве 0.5 мольных эквивалента к BuMgCl. Реакцию проводят в атмосфере аргона при комнатной температуре (˜20°С) и атмосферном давлении. Время реакции 6-10 часов, выход целевых продуктов 40-54%. В качестве растворителя необходимо использовать диэтиловый эфир, в других эфирных растворителях (ТГФ, диоксан) выход целевых продуктов (1) значительно снижается.
Реакция протекает по схеме:
Целевые продукты (1) образуются только лишь с участием дизамещенного ацетилена, н-BuMgCl, полухлористой серы (S2Cl2) и катализатора Cp2ZrCl2. В присутствии других катализаторов на основе комплексов переходных металлов (например, Zr(acac)4, Cp2TiCl2, Ра(асас)2, Ni(acac)2, Fe(асас)3) целевые продукты (1) не образуются.
Проведение реакции в присутствии катализатора Cp2ZrCl2 больше 14 мол.% по отношению к ацетилену не приводит к существенному увеличению выхода целевых продуктов (1). Использование в реакции катализатора Cp2ZrCl2 менее 10 мол.% снижает выход МОС (1), что связано со снижением каталитически активных центров в реакционной массе. Опыты проводили при комнатной температуре ˜20°С. При более высокой температуре (например, 50°С) увеличивается содержание продуктов уплотнения, при меньшей температуре (например, 0°С) снижается скорость реакции.
Изменение соотношения исходных реагентов в сторону увеличения содержания н-BuMgCl по отношению к ацетилену не приводит к значительному повышению выхода целевых продуктов (1). Снижение количества н-BuMgCl по отношению к ацетилену уменьшает выход МОС (1).
Существенные отличия предлагаемого способа:
1. В предлагаемом способе используются в качестве исходных соединений дизамещенный ацетилен, н-BuMgCl и S2Cl2 с участием катализатора Cp2ZrCl2. В известном способе тетраалкилтиофены (1) получают из 1,4-дииодобутадиенов, бутиллития и сероуглерода.
Предлагаемый способ обладает следующими преимуществами:
1. Способ позволяет получать с высокой селективностью 2,3,4,5-тетраалкилтиофены (1) без использования труднодоступных 1,4-дииодобутадиенов, крайне прирофорного н-BuLi и высокотоксичного сероуглерода CS2.
Способ поясняется следующими примерами:
ПРИМЕР 1. В стеклянный реактор объемом 50 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 1.2 ммоль Cp2ZrCl2, 10 ммоль окт-4-ина и при температуре ˜0°С 24 ммоль н-BuMgCl (2M раствор в Et2O). Перемешивают при комнатной температуре 3 часа. Далее реакционную массу охлаждают до 0°С и добавляют 12 ммоль полухлористой серы S2Cl2. Температуру доводят до комнатной и перемешивают еще 5 часов. Получают индивидуальный 2,3,4,5-тетрапропилтиофен (1) с выходом 49%. Спектральные характеристики 2,3,4,5-тетрапропилтиофена (1):
| Спектр ЯМР 13С (δ, м.д.): 13.54 (С14,17), 14.25 (С8,11), 21.90 (С13,16), 24.18 (С7,10), 29.33 (С6,9), 30.17 (С12,15), 135.25 (С2,5), 136.78 (С3,4). |
Другие примеры, подтверждающие способ, приведены в таблице 1.
| Таблица 1 | ||||
| №№ п/п | Мольное соотношение RC≡CR:н-BuMgCl:S2Cl2:Cp2ZrCl2, ммоль | Время реакции, час | Выход (1), % | |
| 1 | гекс-3-ин | 10:24:12:1.2 | 8 | 50 |
| 2 | ″ | 10:26:13:1.2 | 8 | 52 |
| 3 | ″ | 10:22:11:1.2 | 8 | 46 |
| 4 | ″ | 10:24:12:1.4 | 8 | 54 |
| 5 | ″ | 10:24:12:1.0 | 8 | 40 |
| 6 | ″ | 10:24:12:1.2 | 10 | 53 |
| 7 | ″ | 10:24:12:1.2 | 6 | 44 |
| 8 | окт-4-ин | 10:24:12:1.2 | 8 | 49 |
| 9 | дец-5-ин | 10:24:12:1.2 | 8 | 47 |
Все опыты проводили при комнатной температуре (˜20°С) в диэтиловом эфире.
Способ получения 2,3,4,5-тетраалкилтиофенов общей формулы (I)
где R=C2H5, н-С3Н7, н-С4Н9,
характеризующийся тем, что дизамещенный ацетилен общей формулы , где R=C2H5, н-С3Н7, Н-С4Н9, подвергают взаимодействию с н-BuMgCl в присутствии катализатора цирконацендихлорида Cp2ZrCl2 при мольном соотношении : н-BuMgC: Cp2ZrCl2=10:22-26:1.0-1.4 в атмосфере аргона при нормальном давлении в диэтиловом эфире в течение 2-4 ч при комнатной температуре с последующим добавлением в реакционную смесь при 0°С полухлористой серы S2 Cl2 в количестве 0,5 мольных эквивалентов по отношению к BuMgCl и последующим перемешиванием при комнатной температуре в течение 4-5 ч.