Амидное производное, фармацевтическая композиция и терапевтические средства на его основе
Иллюстрации
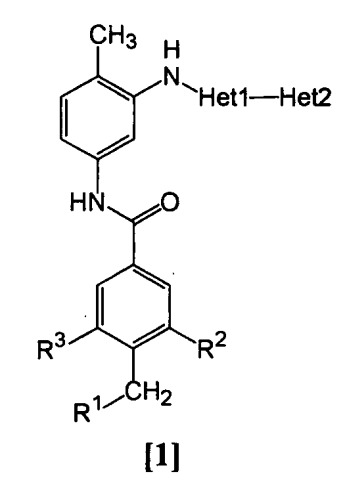
Показать всеИзобретение относится к амидному производному, представленному следующей формулой [1] в любом из следующих случаев (А) и (В), или его соли. (А) R1 представляет 5-7 членную насыщенную циклическую группу, имеющую 1-2 атома азота в качестве атома, образующего цикл (насыщенная циклическая аминогруппа может быть замещена 1-3 одинаковыми или разными заместителями, выбранными из группы, состоящей из С1-10алкила, C1-10алкоксикарбонила), моноС1-10алкиламино или диС1-10алкиламино; R2 представляет С1-10алкил, галоген, галогенС1-10алкил, С1-10алкокси, C1-10алкоксикарбонил, нитро, моноC1-10алкилкарбамоил, диС1-10алкилкарбамоил или циано; R3 представляет водород, галоген или C1-10алкокси; Het1 представляет любую из групп следующих формул [2]-[8]; Het2 представляет пиридил, пиримидинил, пиразинил, пиридазинил или 1,2-дигидропиридазинил (Het2 может быть замещенным 1-3 одинаковыми или разными заместителями, выбранными из галогена); кроме соединения, в котором R1 является (i) пирролидинилом, пиперидинилом, пиперазинилом или морфолинилом, каждый из которых может быть замещен 1-3 одинаковыми или разными заместителями, выбранными из группы, состоящей из алкила, алкоксикарбонила, галогена, галогеналкила, гидроксиалкила, амино, моноалкиламино, диалкиламино, карбамоила, моноалкилкарбамоила и диалкилкарбамоила, (ii) моноалкиламино или (iii) диалкиламино, Het1 является группой формулы [6], а Het2 является пиразинилом или пиридилом, который может быть замещенным алкилом; (В) R1 представляет 4-метилпиперазин-1-ил, 1-пирролидинил, пиперидино, 4-этилпиперазин-1-ил, 4-н-пропилпиперазин-1-ил, цис-3,5-диметилпиперазин-1-ил, морфолино, диметиламино или диэтиламино; R2 представляет метил, галоген, трифторметил, метокси, метоксикарбонил, нитро, диметилкарбамоил или циано; R3 представляет водород, бром или метокси; Het1 представляет группу формулы [6]; Het2 представляет 3-пиридил. Изобретение относится к фармацевтической композиции, обладающей ингибирующей активностью в отношении BCR-ABL тирозинкиназы, содержащей в качестве активного ингредиента амидное производное формулы I или его соль и фармацевтически приемлемый нетоксичный и инертный носитель. Изобретение также относится к ингибитору BCR-ABL тирозинкиназы, терапевтическим средствам для лечения хронической миелогенной лейкемии, острой лимфобластной лейкемии, острой миелогенной лейкемии, содержащим в качестве активного ингредиента амидное производное формулы I или его соль и, необязательно, фармацевтически приемлемый нетоксичный и инертный носитель. Технический результат - амидное производное, ингибирующее активность BCR-ABL тирозинкиназы. 6 н. и 2 з.п. ф-лы, 2 табл.
Реферат
Данное изобретение относится к амидному производному или его соли и фармацевтической композиции, содержащей амидное производное или его соль в качестве активного ингредиента.
Поскольку BCR-ABL тирозинкиназа (см., например, непатентный документ 1) вызывает аберрантный рост клеток, соединение, которое подавляет ее активность, пригодно для профилактики или лечения заболеваний, вызванных активностью BCR-ABL тирозинкиназы, например, хронической миелогенной лейкемии, острой лимфобластной лейкемии и острой миелогенной лейкемии (см., например, непатентный документ 2).
BCR является геном, который находится в человеческой двадцать второй хромосоме, а ABL является геном, который находится в человеческой девятой хромосоме, и хромосома Philadelphia образуется транслокацией человеческой двадцать второй и девятой хромосом. Известно, что генный продукт хромосомы, BCR-ABL, является протеином, обладающим тирозинкиназной активностью, и постоянно генерирует рост сигнала, который вызывает аберрантный рост клеток (см., например, непатентный документ 2).
Поэтому подавление активности BCR-ABL тирозинкиназы делает возможным подавление роста клеток, вызванного киназой, и соединение, которое подавляет данную активность, пригодно для использования в качестве терапевтического средства таких заболеваний, как хроническая миелогенная лейкемия, острая лимфобластная лейкемия и острая миелогенная лейкемия. Известен препарат Гливек® (Glyvek®) (см., например, патентный документ 1) в качестве лекарственного средства, обладающего аналогичным действием, однако другие лекарственные средства, имеющие такой же механизм действия, никогда не поступали на рынок, и, таким образом, было необходимо разработать лучшие лекарственные средства.
Известно, что у пациентов, у которых достигнута ремиссия в результате применения Гливека® при BCR-ABL-положительной острой лимфобластной лейкемии, рецидивы часто регистрируют в дополнение к примерам бластного криза хронической миелогенной лейкемии (см., например, непатентный документ 3). В результате изучения лейкемических клеток пациентов, страдающих от рецидива заболевания, определено появление такого варианта, как Е255К (см., например, непатентные документы с 4 по 7). Также при применении Гливека® у пациентов с BCR-ABL-положительной острой лимфобластной лейкемией зарегистрировано появление устойчивых клеток, которые в основном представляют вариант Е255К (см., например, непатентный документ 8). С увеличением использования Гливека® число резистентных пациентов дополнительно увеличивается, и, таким образом, необходимо разрабатывать терапию.
Патентный документ 1:
Japanese Unexamined Patent No. 6-87834
Патентный документ 2:
Pamphlet of International Publication WO 02/22597
Непатентный документ 1:
Shtivelman E., et al.: Nature, 1985, 315, 550-554
Непатентный документ 2:
Daley G. Q., et al.: Science, 1990, 247, 824-830
Непатентный документ 3:
Druker B. J., et al.: N. Engi. J. Med., 2001, 344, 1038-1042
Непатентный документ 4:
Weisberg E., et al.: Drug Resist Updat, 2001, 4, 22-28
Непатентный документ 5:
Gorre M. E., et al.: Science, 2001, 293, 876-880
Непатентный документ 6:
Blagosklonny M. V.: Leukemia, 2002, 16, 570-572
Непатентный документ 7:
Hochhaus A., et al.: Leukemia, 2002, 16, 2190-2196
Непатентный документ 8:
Hofmann W.-K., et al.: blood, 2002, 99, 1860-1862
Непатентный документ 9:
Deninger W. N., et al.: blood, 2000, 96, 3343-3356
Непатентный документ 10:
J.Org.Chem., 1996, 61, 1133-1135
Непатентный документ 11:
J.Org.Chem., 2000, 65, 1144-1157
Непатентный документ 12:
Recl.Trav.Chim.Pays-Bas., 1950, 69, 673-699
Непатентный документ 13:
J.Med.Chem., 2000, 43, 1508-1518
Непатентный документ 14:
J.Med.Chem., 1975, 18, 1077-1088
Непатентный документ 15:
Bioorg.Med.Chem.Lett., 2001, 11, 2235-2239
Непатентный документ 16:
J.Heterocyclic Chem., 2000, 37, 1457-1462
Непатентный документ 17:
J.Med.Chem., 2000, 43(8), 1508-1518
Непатентный документ 18:
Khim.Geterotsikl.Soedim., 1981, (7), 958-962
Непатентный документ 19:
J.Heterocyclic Chem., 1990, 27, 579-582
Непатентный документ 20:
Arzneim.-Forsch./Drug Res., 1989, 39(2), 1196-1201
Непатентный документ 21:
J.Org.Chem., 1996, 61, 7240-7241
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Задачей данного изобретения является создание амидного производного, обладающего превосходной подавляющей BCR-ABL тирозинкиназу активностью, или его соли.
Были проведены интенсивные исследования в отношении разных соединений, и было обнаружено, что поставленная задача достигается с помощью амидного производного в соответствии с данным изобретением, и, таким образом, было выполнено данное изобретение.
Данное изобретение относится к амидному производному общей формулы [1] в любом из следующих случаев [А] и [В] или его соли (здесь далее называемым «соединением данного изобретения»).
(А)
R1 представляет насыщенную циклическую аминогруппу (насыщенная циклическая аминогруппа может быть замещена 1-3 одинаковыми или разными заместителями, выбранными из группы, состоящей из алкила, алкоксикарбонила, галогена, галогеналкила, гидроксиалкила, амино, моноалкиламино, диалкиламино, карбамоила, моноалкилкарбамоила и диалкилкарбамоила), моноалкиламино или диалкиламино,
R2 представляет алкил, галоген, галогеналкил, гидроксиалкил, алкокси, алкоксиалкил, алкоксикарбонил, ацил, амино, моноалкиламино, диалкиламино, нитро, карбамоил, моноалкилкарбамоил, диалкилкарбамоил или циано,
R3 представляет водород, галоген или алкокси,
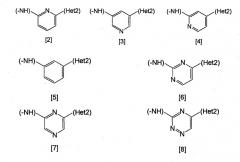
Неt1 представляет любую из групп следующих формул с [2] по [8]:
Неt2 представляет пиридил, пиримидинил, пиразинил, пиридазинил или 1,2-дигидропиридазинил (Неt2 может быть замещенным 1-3 одинаковыми или разными заместителями, выбранными из группы, состоящей из алкила, галогена и амино).
Кроме соединения, в котором R1 является (i) пирролидинилом, пиперидинилом, пиперазинилом или морфолинилом, каждый из которых может быть замещен 1-3 одинаковыми или разными заместителями, выбранными из группы, состоящей из алкила, алкоксикарбонила, галогена, галогеналкила, гидроксиалкила, амино, моноалкиламино, диалкиламино, карбамоила, моноалкилкарбамоила и диалкилкарбамоила, (ii) моноалкиламино или (iii) диалкиламино, Неt1 является группой формулы [6], а Неt2 является пиразинилом или пиридилом, который может быть замещенным алкилом;
(В)
R1 представляет 4-метилпиперазин-1-ил, 1-пирролидинил, пиперидино, 4-этилпиперазин-1-ил, 4-н-пропилпиперазин-1-ил, цис-3,5-диметилпиперазин-1-ил, морфолино, диметиламино или диэтиламино;
R2 представляет метил, галоген, трифторметил, метокси, метоксикарбонил, нитро, диметилкарбамоил или циано;
R3 представляет водород, бром или метокси;
Неt1 представляет группу формулы [6];
Неt2 представляет 3-пиридил.
Данное изобретение относится также к фармацевтической композиции, содержащей представленное выше амидное производное или его соль в качестве активного ингредиента, и более конкретно, к ингибитору BCR-ABL тирозинкиназы, содержащему вышеуказанное амидное производное или его соль в качестве активного ингредиента. Специфическое терапевтическое средство для лечения болезней включает терапевтическое средство для лечения хронической миелогенной лейкемии, терапевтическое средство для лечения острой лимфобластной лейкемии и терапевтическое средство для лечения острой миелогенной лейкемии.
Примеры предпочтительных амидных производных и их солей включают следующие амидные производные или их соли.
Амидное производное общей формулы [1], где R1 является насыщенной циклической аминогруппой (насыщенная циклическая аминогруппа может быть замещенной 1-3 одинаковыми или разными заместителями, выбранными из группы, состоящей из алкила и алкоксикарбонила), моноалкиламино или диалкиламино,
R2 представляет алкил, галоген, галогеналкил, алкокси, алкоксикарбонил, нитро, диалкилкарбамоил или циано,
R3 представляет водород, галоген или алкокси,
Неt1 является любой из групп формул [2]-[8], и
Неt2 представляет пиридил, пиримидинил, пиразинил, пиридазинил или 1,2-дигидропиридазинил (Неt2 может быть замещенным 1-3 одинаковыми или разными атомами галогена), или их соли.
Примеры особенно предпочтительных среди представленных выше амидных производных включают следующие амидные производные (1)-(40) или их соли:
(1) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(2) 3-йод-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(3) 3-хлор-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(4) 3-фтор-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(5) 4-(4-метилпиперазин-1-илметил)-3-трифторметил-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(6) 4-(4-метилпиперазин-1-илметил)-3-трифторметил-N-{4-метил-3-[4-(5-пиримидинил)пиримидин-2-иламино]фенил}бензамид,
(7) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(2-пиразинил)пиримидин-2-иламино]фенил}бензамид,
(8) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{3-[4-(6-хлорпиридин-3-ил)пиримидин-2-иламино]-4-метилфенил}бензамид,
(9) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{3-[4-(5-бромпиридин-3-ил)пиримидин-2-иламино]-4-метилфенил}бензамид,
(10) 4-(4-метилпиперазин-1-илметил)-3-трифторметил-N-{3-[4-(5-бромпиридин-3-ил)пиримидин-2-иламино]-4-метилфенил}бензамид,
(11) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{3-[4-(1,2-дигидропиридазин-4-ил)пиримидин-2-иламино]-4-метилфенил}бензамид,
(12) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридазинил)пиримидин-2-иламино]фенил}бензамид,
(13) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(5-пиримидинил)пиримидин-2-иламино]фенил}бензамид,
(14) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиридин-2-иламино]фенил}бензамид,
(15) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(5-пиримидинил)пиридин-2-иламино]фенил}бензамид,
(16) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[2-(3-пиридил)пиридин-6-иламино]фенил}бензамид,
(17) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[3-(3-пиридил)пиридин-5-иламино]фенил}бензамид,
(18) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[3-(3-пиридил)фениламино]фенил}бензамид,
(19) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[2-(3-пиридил)пиразин-6-иламино]фенил}бензамид,
(20) 3-бром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[5-(3-пиридил)-1,2,4-триазин-3-иламино]фенил}бензамид,
(21) 3-метил-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(22) 4-(4-метилпиперазин-1-илметил)-3-нитро-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(23) 3-метокси-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(24) 3,5-дибром-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(25) 3,5-диметокси-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(26) 3-(N,N-диметилкарбамоил)-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(27) 3-бром-4-(4-этилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(28) 3-бром-4-[4-(н-пропил)пиперазин-1-илметил]-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(29) 3-бром-4-(N,N-диметиламинометил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(30) 3-бром-4-(N,N-диэтиламинометил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(31) 3-бром-4-(1-пирролидинилметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(32) 3-бром-4-(пиперидинометил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(33) 3-бром-4-(морфолинометил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(34) 3-бром-4-(цис-3,5-диметилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(35) 3-бром-4-(4-метилгексагидро-1Н-1,4-диазепин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид,
(36) 3-бром-4-(1-пиперазинилметил)-N-{4-метил-3-[4-(5-пиримидинил)пиримидин-2-иламино]фенил}бензамид,
(37) 4-[4-(трет-бутоксикарбонил)пиперазин-1-илметил]-3-трифторметил-N-{4-метил-3-[4-(5-пиримидинил)пиримидин-2-иламино]фенил}бензамид,
(38) 4-(1-пиперазинилметил)-3-трифторметил-N-{4-метил-3-[4-(5-пиримидинил)пиримидин-2-иламино]фенил}бензамид,
(39) 3-метоксикарбонил-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид и
(40) 3-циано-4-(4-метилпиперазин-1-илметил)-N-{4-метил-3-[4-(3-пиридил)пиримидин-2-иламино]фенил}бензамид.
Соединение данного изобретения обладает подавляющей BCR-ABL тирозинкиназу активностью и пригодно в качестве терапевтического средства при таких заболеваниях, как хроническая миелогенная лейкемия, острая лимфобластная лейкемия и острая миелогенная лейкемия (см., например, непатентный документ 9).
Соединение вышеприведенной формулы [1] в случае (В) описывалось в уровне техники (см., например, патентный документ 1 или 2), но специально не раскрыто в публикации. Соединение вышеприведенной формулы [1] в случае (А) также не описано.
Данное изобретение далее будет подробно описано.
Примеры «насыщенной циклической аминогруппы» включают 4-8-членную насыщенную циклическую группу, которая представляет насыщенную циклическую группу, имеющую, по меньшей мере, один атом азота в качестве атома, образующего цикл, а также может иметь от 1 до 3 одинаковых или разных членов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы. Когда атом, образующий кольцо циклического амина, является атомом азота или атомом серы, атом азота или атом серы может образовывать оксид. Примерами являются пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил и гексагидро-1Н-1,4-диазепинил. Эти заместители могут иметь присоединение по своему любому положению. Конкретно это означает, что «пирролидинил» включает все из 1-пирролидинила, 2-пирролидинила и 3-пирролидинила.
«Алкил» включает линейные или разветвленные алкильные группы, имеющие от 1 до 10 атомов углерода, например метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторичный бутил, трет-бутил, н-пентил, изопентил, н-гексил, изогексил, н-гептил, изогептил, н-октил, н-нонил и н-децил. Линейные алкильные группы, имеющие от 1 до 3 атомов углерода, являются особенно предпочтительными.
Алкильная часть «галогеналкила», алкоксикарбонила», «гидроксиалкила», «моноалкиламино», «диалкиламино», «моноалкилкарбамоила», «диалкилкарбамоила», «алкокси», алкоксиалкила» и «гидроксиалкила» включает вышеназванный алкил.
«Галоген» включает, например, фтор, хлор, бром и йод.
«Галогеналкил» включает моногалогеналкил, дигалогеналкил и тригалогеналкил, и галогеновая составляющая «галогеналкила» включает представленный выше галоген. «Галогеналкил» включает, например, трифторметил и 2,2,2-трифторэтил.
«Ацил» включает ацильные группы, имеющие от 1 до 11 атомов углерода, например формил, ацетил, пропионил, бутирил, изобутирил, бензоил, 1-нафтоил и 2-нафтоил.
«Пиридил» включает, например, 2-пиридил, 3-пиридил и 4-пиридил.
«Пиримидинил» включает, например, 2-пиримидинил, 4-пиримидинил и 5-пиримидинил.
«Пиразинил» включает, например, 2-пиразинил.
«Пиридазинил» включает, например, 3-пиридазинил и 4-пиридазинил.
«1,2-дигидропиридазинил» включает, например, 1,2-дигидропиридазин-3-ил и 1,2-дигидропиридазин-4-ил.
Соединение данного изобретения может быть получено из известного соединения или промежуточного соединения, которое может быть с легкостью получено, например, следующим способом. При получении соединения согласно данному изобретению обычно, если исходное вещество содержит реакционноспособные заместители, которые не должны участвовать в данной реакции, его используют уже защищенным соответствующими защитными группами по существу известными методами, когда исходные вещества имеют заместители, которые не предназначены для реакции. После реакции защитные группы могут быть удалены известными методами.
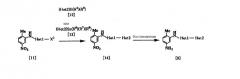
Процесс 1
где R1, R2, R3, Неt1 и Неt2 определены выше.
Эта реакция является реакцией конденсации соединения [9] и соединения [10] и поэтому проводится по существу известными методами, используемыми для реакции конденсации. Соединение [1] может быть получено путем взаимодействия карбоновой кислоты в качестве соединения [10] или ее реакционноспособного производного с амином в качестве соединения [9]. Примеры реакционноспособного производного соединения [10] включают те соединения, которые обычно используют при реакции конденсации с образованием амида, например галогенангидрида кислоты (например, хлорангидрида кислоты, бромангидрида кислоты и т.д.), смешанного ангидрида кислоты, имидазолида и активного амида. При использовании карбоновой кислоты [10] используют конденсирующий агент (например, 1,1'-оксалилдиимидазол, 1-этил-3-(3-диметиламинопропил)карбодиимид, дициклогексилкарбодиимид, диэтилцианофосфонат, дифенилфосфорилазид, 2-хлор-1-метилпиридиния йодид и т.д.) и реакцию проводят при температуре от -20 до 100°С в присутствии или в отсутствие основания (например, органического основания, такого как триэтиламин, N,N-диизопропил-N-этиламин, N,N-диметиланилин, пиридин, 4-диметиламинопиридин, 1,8-диазабицикло[5.4.0]ундец-7-ен и т.д.). Растворитель конкретно не ограничивается, поскольку он не участвует в реакции, и его примеры включают простые эфиры, такие как тетрагидрофуран и диэтиловый эфир; амиды, такие как N,N-диметилформамид и N,N-диметилацетамид; нитрилы, такие как ацетонитрил и пропионитрил; углеводороды, такие как бензол и толуол; галогенированные углеводороды, такие как хлороформ и дихлорметан; и смеси этих растворителей. В этом случае могут быть также добавлены добавки (например, 1-гидроксибензотриазол, N-гидроксисукцинимид и т.д.). Время реакции меняется в зависимости от видов исходных веществ и конденсирующего агента и температуры реакции, но предпочтительно составляет от 30 минут до 24 часов. Количество соединения [10] и конденсирующего агента предпочтительно составляет от 1 до 3 моль на моль соединения [9]. При использовании галогенангидрида кислоты в качестве реакционноспособного производного соединения [10] реакцию проводят при температуре от -20 до 100°С, используя пиридиновый растворитель, такой как пиридин или 4-метилпиридин, или основание и растворитель, описанные выше. А также в качестве добавки может использоваться 4-диметиламинопиридин. Время реакции меняется в зависимости от вида галогенангидрида кислоты и температуры реакции, но предпочтительно составляет от 30 минут до 24 часов.
Соединение [9] в качестве исходного вещества, где Неt1 является группой формулы [6], может быть получено способом, который описан в патентном документе 1.
Соединение [9] в качестве исходного соединения, где Неt1 является группой формулы [4], [5] или [7], может быть получено следующим образом:
где Неt1 и Неt2, имеют значения, представленные выше, R4 и R5 представляют алкил или гидрокси, R6, R7 и R8 представляют алкил, и Х1 представляет галоген.
Стадия 1
Эта реакция представляет собой реакцию перекрестного соединения с использованием соединения [11] и борорганического соединения [12] или оловоорганического соединения [13] и может быть проведена по существу известными методами. Например, эту реакцию проводят при 20-200°С в подходящем растворителе в присутствии палладиевого катализатора. В качестве палладиевого катализатора обычно используют тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий и дихлорбис(три-о-толилфосфин)палладий. Растворитель, используемый в реакции, конкретно не ограничивается, поскольку он не участвует в реакции, и примерами его являются простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и 1,2-диметоксиэтан; спирты, такие как метанол и этанол; амиды, такие как N,N-диметилформамид и N,N-диметилацетамид; углеводороды, такие как бензол, толуол и ксилол; органические амины, такие как пиридин и триэтиламин; и смеси этих растворителей. При использовании соединения [12] существенным является добавление основания (например, гидроксида натрия, карбоната калия, трехзамещенного фосфата калия и т.д.). Время реакции меняется в зависимости от вида исходного вещества и температуры реакции, но предпочтительно составляет от 1 до 48 часов.
Стадия 2
Эта реакция является реакцией восстановления ароматической нитрогруппы соединения [14] до аминогруппы и поэтому проводится по существу известными методами, используемыми при реакции восстановления. Данный метод включает, например, метод обработки цинком или оловом в кислых условиях. В соответствии с методом каталитического восстановления, например, гидрирование можно проводить, используя платину, никель Ренея, платину-на-угле (Pt-С), палладий-на-угле (Pd-С) или рутениевый комплекс в качестве катализатора. Кроме того, примерами являются метод с использованием сульфида, такого как дитионит натрия, и способ восстановления формиатом аммония или гидразином в присутствии металлического катализатора.
Соединение [11] в качестве исходного соединения, где Неt1 является группой формулы [4], можно получить путем взаимодействия 2,4-дихлорпиридина (полученного, например, методом, описанным в непатентном документе 12) с 2-метил-5-нитроанилином, используя метод J. P. Wolfe et al. c использованием палладиевого катализатора (см. непатентные документы 10 и 11). Когда Неt1 является группой формулы [5], например, данное соединение может быть получено посредством взаимодействия 1-бром-3-иодбензола с 2-метил-5-нитроанилином. Когда Неt1 является группой формулы [7], например, данное соединение может быть получено посредством взаимодействия 2,6-дихлорпиразина с 2-метил-5-нитроанилином.
Растворитель, используемый в реакции, специально не ограничивается, поскольку он не участвует в реакции, и примерами его являются простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и 1,2-диметоксиэтан; углеводороды, такие как бензол, толуол и ксилол; и смеси из этих растворителей. Реакцию проводят при температуре от 70 до 100°С в присутствии основания. Примеры палладиевого катализатора включают трис(дибензилиденацетон)дипалладий (0), ацетат палладия(II) и три(о-толилфосфин)палладий(0). Количество палладия предпочтительно составляет от 0,5 до 4 мол.% от галогенированного арила. В качестве лиганда палладиевого катализатора, например, можно использовать 1,3-бис(дифенилфосфино)пропан, 1,1'-бис(дифенилфосфино)ферроцен и (±)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил [(±)-БИНАФ; BINAP]. Примеры основания включают трет-бутоксид натрия, трет-бутоксид калия, карбонат цезия, карбонат калия и карбонат натрия. Время реакции меняется в зависимости от исходного вещества и температуры реакции, но предпочтительно составляет от 1 до 36 часов.
Соединение [11], где Неt1 является группой [4], может быть также получено путем взаимодействия 2,4-дихлорпиридина с 2-метил-5-нитроанилином при 20-200°С в подходящем растворителе в присутствии или в отсутствие основания. Примеры основания включают пиридин, триэтиламин, N,N-диизопропил-N-этиламин, карбонат калия, гидрокарбонат натрия и гидроксид калия. Растворитель конкретно не ограничивается, поскольку он не участвует в реакции, и его примеры включают простые эфиры, такие как тетрагидрофуран, дибутиловый эфир и 1,4-диоксан; амиды, такие как N,N-диметилформамид и N,N-диметилацетамид; углеводороды, такие как бензол и толуол; спирты, такие как этиленгликоль и 2-метоксиэтанол; галогенированные углеводороды, такие как хлороформ и дихлорметан; диметилсульфоксид и смеси этих растворителей. Время реакции меняется в зависимости от исходного вещества и температуры реакции, но предпочтительно составляет от 1 до 24 часов.
Соединение [14а] в качестве исходного соединения [соединение [14], где Неt1 является группой формулы [4]), может быть также получено следующим образом:
где R4, R5, R6, R7, R8, Неt2 и Х1 имеют значения, представленные выше, и Х2 представляет галоген.
Стадия 1
Эта реакция является реакцией перекрестного соединения с использованием соединения [15] и борорганического соединения [12] или оловоорганического соединения [13] и может быть проведена таким же образом, который описан выше.
Стадия 2
Соединение [17] получают галогенированием соединения [16]. Поэтому данную реакцию проводят по существу известными методами. Данную реакцию проводят с использованием оксихлорида фосфора, оксибромида фосфора, пентахлорида фосфора или пентабромида фосфора в растворителе или без него. Растворитель, используемый в реакции, специально не ограничивается, поскольку он не участвует в реакции, и примерами его являются простые эфиры, такие как тетрагидрофуран, дибутиловый эфир и 1,4-диоксан; амиды, такие как N,N-диметилформамид и N,N-диметилацетамид; галогенированные углеводороды, такие как хлороформ и дихлорметан; и смеси этих растворителей. Реакцию обычно проводят при температуре от комнатной до 130°С, и время реакции предпочтительно составляет от 20 минут до 24 часов.
Стадия 3
Соединение [14а] может быть получено путем взаимодействия соединения [17] с соединением [18] с использованием вышеуказанного метода при использовании палладиевого катализатора (см., например, непатентные документы 10 и 11).
Соединение [9а] [соединение [9], где Неt1 является группой формулы [4]), может быть получено путем взаимодействия соединения [17] с соединением [19] с использованием вышеприведенного метода при использовании палладиевого катализатора [см., например, непатентные документы 10 и 11) с получением соединения [20] и удаления защиты у соединения [20].
где Неt2 и Х2 имеют значения, представленные выше, и R9 представляет защитную группу.
Стадия 1
Исходное соединение [19] может быть получено путем защиты 2,4-диаминотолуола с помощью подходящей защитной группы с использованием по существу известных методов. Примеры защитной группы включают ацильные производные, такие как бензоил, ацетил и формил; и производные уретанового типа, такие как бензилоксикарбонил, трет-бутоксикарбонил и 2,2,2-трихлорэтоксикарбонил. Соединение [20] можно получить путем взаимодействия соединения [17] с соединением [19], используя палладиевый катализатор.
Стадия 2
При реакции удаления защиты у соединения [20] защитную группу ацильного типа удаляют путем гидролиза, используя кислоту или щелочь, или удаляют с помощью аммиачной воды или гидразина. Примеры кислоты, используемой при гидролизе, включают неорганические кислоты, такие как соляная кислота и серная кислота, и примеры основания включают неорганические основания, такие как гидроксид натрия и гидроксид калия. Примеры растворителя, используемого в реакции, включают спирты, такие как метанол и этанол; простые эфиры, такие как тетрагидрофуран и 1,4-диоксан; воду и смеси этих растворителей. Температура реакции находится в интервале от 0 до 100°С, и время реакции обычно составляет от нескольких минут до 24 часов. Когда защитная группа является производным уретанового типа, ее можно удалить гидрированием с использованием палладиевого катализатора или удалить обработкой соляной кислотой, трифторуксусной кислотой, триметилсилилйодидом или трифторидом бора, также в зависимости от вида защитной группы.
Исходное соединение [9], где Неt1 является группой формулы [8], можно получить методом, описанным в сравнительном примере 18, представленным ниже.
Соединение [10] в качестве исходного соединения может быть получено следующим образом:
где R1, R2 и R3 имеют значения, представленные выше, R10 представляет алкил, и Х3 представляет удаляемую группу, такую как Cl, Br, I, OTs или OMs.
Стадия 1
Соединение [23] может быть получено конденсацией соединения [21] (которое можно получить, например, методом, описанным в непатентном документе 13) с помощью амина [22] (где удаляемая группа Х3 представляет такую удаляемую группу, как галоген, мезилат или тозилат). Эта реакция представляет собой реакцию нуклеофильного замещения алкилгалогенида и аминов и проводится по существу известными методами. Эту реакцию проводят в подходящем растворителе, используя избыток амина или в присутствии основания. Примеры предпочтительного основания включают пиридин, триэтиламин, N,N-диизопропил-N-этиламин, карбонат калия и гидрокарбонат натрия. Растворитель специально не ограничивается, поскольку он не участвует в реакции, и его примеры включают простые эфиры, такие как тетрагидрофуран и диэтиловый эфир; амиды, такие как N,N-диметилформамид и N,N-диметилацетамид; нитрилы, такие как ацетонитрил и пропионитрил; углеводороды, такие как бензол и толуол; спирты, такие как метанол и этанол; воду и смеси этих растворителей. Температура реакции обычно находится в интервале от 0°С до 100°С. Время реакции меняется в зависимости от исходного вещества и температуры реакции, но предпочтительно составляет от 30 минут до 24 часов.
Стадия 2
Соединение [10] можно получить гидролизом соединения [23]. Реакцию обычно проводят в подходящем растворителе в присутствии кислоты или основания. Примеры кислоты, используемой при гидролизе, включают неорганические кислоты, такие как соляная кислота и серная кислота, и примеры основания включают неорганические основания, такие как гидроксид натрия и гидроксид калия. Примеры растворителя, используемого в реакции, включают спирты, такие как метанол и этанол; простые эфиры, такие как тетрагидрофуран и 1,4-диоксан; воду и смеси этих растворителей. Температура реакции находится обычно в интервале от 0 до 100°С, и время реакции составляет обычно от 30 минут до 24 часов.
Процесс 2
где R1, R2, R3, Неt1 и Неt2 имеют определения, представленные выше, Х4 представляет Cl, Br, I или SR11, и R11 представляет алкил.
Соединение [1] можно получить взаимодействием соединения [24] с соединением [25]. Реакцию проводят при температуре от 20 до 200°С в подходящем растворителе в присутствии или в отсутствие основания. Примеры основания включают пиридин, триэтиламин, N,N-диизопропил-N-этиламин, карбонат калия, гидрокарбонат натрия и гидроксид калия. Растворитель конкретно не ограничивается, поскольку он не участвует в реакции, и его примеры включают простые эфиры, такие как тетрагидрофуран, диэтиловый эфир и 1,4-диоксан; амиды, такие как N,N-диметилформамид и N,N-диметилацетамид; углеводороды, такие как бензол и толуол; спирты, такие как этиленгликоль и 2-метоксиэтанол; галогенированные углеводороды, такие как хлороформ и дихлорметан; диметилсульфоксид и смеси этих растворителей. Время реакции меняется в зависимости от исходного вещества и температуры реакции, но предпочтительно составляет от 1 до 24 часов.
Соединение [24] в качестве исходного вещества может быть получено конденсацией 2,4-диаминотолуола с соединением [10] в соответствии с модифицированным процессом 1.
Соединение [25] в качестве исходного вещества можно получить путем использования 2,6-дибромпиридина, когда Неt1 является группой формулы [2], 3,5-дибромпиридина, когда Неt1 является группой формулы [3], или 2,4-дихлорпиримидина, когда Неt1 является группой формулы [6] в соответствии с процессом 4, описанным ниже. Когда Неt1 является группой формулы [4], соединение [25] может быть также получено методом, описанным в приведенном выше процессе 1.
Процесс 3
где R1, R2, R3 и Неt2 имеют значения, представленные выше.
Соединение [1b] (соединение [1], где Неt1 является группой формулы [6]) может быть получено взаимодействием соединения [26] или его кислотно-аддитивной соли с соединением [27]. Данную реакцию проводят при температуре от 20 до 200°С в подходящем растворителе. Растворитель специально не ограничивается, поскольку он не участвует в реакции, и его примеры включают спирты, такие как метанол, этанол, 2-пропанол и 2-метоксиэтанол. Количество соединения [27] составляет от 1 до 2 моль и предпочтительно от 1 до 1,2 моль на моль соединения [26]. Время реакции меняется в зависимости от исходного вещества и температуры реакции, но предпочтительно составляет от 30 минут до 30 часов. При использовании кислотно-аддитивной соли соединения [26] реакция может быть проведена добавлением подходящего основания (например, карбоната калия, гидрокарбоната натрия, гидроксида натрия, гидроксида калия и т.д.).
Соединение [26] в качестве исходного соединения может быть получено в виде свободной соли или кислотно-аддитивной соли путем взаимодействия соединения [24] с цианамидом по методу, описанному в документе (см., например, непатентный документ 14).
Соединение [27] в качестве исходного вещества может быть получено, например, в соответствии с модифицированным методом, описанным в патентном документе 1.
Процесс 4
где R1, R2, R3, R4, R5, R6, R7, R8, Неt1 и Неt2 имеют значения, представленные выше, Х5 представляет галоген.
Эта реакция является реакцией перекрестного соединения с использованием соединения [28] и борорганического соединения [12] или оловоорганического соединения [13] и может быть проведена по существу известными методами. Например, эту реакцию проводят при температуре от 20 до 200°С в подходящем растворителе в присутствии палладиевого катализатора. В качестве палладиевого катализатора используют тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий и дихлорбис(три-о-толилфосфин)палладий. Растворитель, используемый в реакции, специально не ограничивают, поскольку он не участвует в реакции, и его примеры включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и 1,2-диметоксиэтан; спирты, такие как метанол и этанол; амиды, такие как N,N-диметилформамид и N,N-диметилацетамид; углеводороды, такие как бензол, толуол и ксилол; органические амины, такие как пиридин и триэтиламин; и смеси этих растворителей. При использовании соединения [12] существенно добавление основания (например, гидроксида натрия, карбоната калия, трехзамещенного фосфата калия и т.д.). Время реакции меняется в зависимости от исходного вещества и температуры реакции, но предпочтительно составляет от 1 до 48 часов.
Соединение [28] в качестве исходного соединения может быть получено путем взаимодействия соединения [24] с 4-гидрокси-2-(метилтио)пиридином, когда Неt1 является группой формулы [4], или взаимодействием соединения [24] с 4-гидрокси-2-(метилтио)пиримидином и обработки продукта реакции оксихлоридом фосфора (см., например, непатентный документ 15), когда Неt1 является группой формулы [6], или взаимодействием по методу, описанному в документе (см., например, непатентный документ 16) с использованием соединения [24] и 2,4-дихлорпиримидина, когда Неt1 является группой формулы [6].
Соединение данного изобретения можно использовать в качестве лекарственного средства в виде свободного основания, однако его можно использовать также в виде фармацевтически приемлемой соли, полученной по существу известными методами. Эти соли включают соли минеральных кислот, таких как соляная кислота, бромистоводородная кислота, серная кислота и фосфорная кислота, и соли органических кислот, таких как уксусная кислота, лимонная кислота, виннокаменная кислота, малеиновая кислота, янтарная кислота, фумаровая кислота, п-толуолсульфоновая кислота, бензолсульфоновая кислота и метансульфоновая кислота.
Гидрохлорид амидного производного по данному изобретению, например, может быть получен растворением амидного производного в спиртовом растворе, этилацетатном растворе или эфирном растворе хлористого водорода.
Как показано в примерах испытания, описанных далее, соединение данного изобретения обладает высокой ингибирующей активностью в отношении BCR-ABL тирозинкиназы по сравнению с пиримидиновым производным, описанным в патентном документе 1. Поэтому лекарственное средство данного изобретения пригодно в качестве профилактического или терапевтического средства для лечения заболеваний, связанных с активностью BCR-ABL тирозинкиназы, например хронической миелогенной лейкемии, острой лимфобластной лейкемии и острой миелогенной лейкемии.
Когда соединение данного изобретения применяют в качестве лекарственного средства, его можно применять для лечени