Способ выявления мутаций в гене gjb2, сопровождающихся развитием несиндромальной аутосомно-рецессивной глухоты
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к медицинской генетике и оториноларингологии. Способ включает выделение ДНК из лимфоцитов периферической крови методом фенольно-хлороформной экстракции и амплификацию одновременно трех участков гена GJB2 в смеси трех пар последовательностей олигонуклеотидов: (35delG) (F) 5' cttttccagagcaaaccgccc 3', (R) 5' tgctggtggagtgtttgttcac 3'; (167delT) (F) 5' atgagcaggccgactttgtctg 3' (R) 5' gtgggagatggggaagtagtga 3'; (235delC) (F) 5' acgatcactacttccccatctc 3', (R) 5' actaggagcgctggcgtggac 3', фланкирующих области с возможным содержанием мутаций 35delG, 167delT, 235delC. При наличии аллелей 89 пн и 88 пн, 83 пн и 82 пн, 79 пн и 78 пн диагностируют гетерозиготное носительство мутаций 35delG, 167delT и 235delC; аллелей 88 пн, 82 пн, 78 пн - гомозиготное носительство мутаций 35delG, 167delT и 235delC. Использование изобретения позволяет получить точный объективный клинический диагноз наследственной аутосомно-рецессивной потери слуха. 1 табл., 1 ил.
Реферат
Изобретение относится к медицине, а именно к медицинской генетике и оториноларингологии, может быть использовано для диагностики врожденной наследственной глухоты у человека.
Врожденная глухота - одно из частых заболеваний человека, регистрируемое с частотой 1:1000 новорожденных детей. К сожалению, существует множество причин ослабления слуха и возникновения глухоты. Потеря слуха является одновременно медицинской и социальной проблемой. Наибольшее значение имеет врожденная глухота как тяжелое и инвалидизирующее заболевание. В вопросах этиологии и патогенеза заболевания остается много неясных аспектов, но считается, что примерно половина всех случаев врожденной глухоты имеет наследственное происхождение. Несмотря на острую социальную значимость проблемы, до сих пор не разработаны способы ранней диагностики и система профилактических мероприятий.
Наследственная глухота относится к тем заболеваниям, в которых анамнестические и клинические данные представляют довольно скудный материал для постановки правильного диагноза с определением этиологии заболевания. Вместе с тем, своевременная и точная диагностика этого наследственного дефекта позволит наиболее качественно и в самые ранние сроки начинать реабилитационные мероприятия для обеспечения полноценной социальной адаптации лиц с наследственными дефектами слуха.
Преимущества предлагаемой разработки перед существующими аналогами заключаются в оптимальности разрабатываемых подходов ДНК-диагностики заболеваний, основанных на выявлении существующего своеобразия генофонда народов Волго-Уральского региона.
Согласно литературным данным, наиболее частая форма наследственной потери слуха - несиндромальная аутосомно-рецессивная глухота (DFNB1) - относится к сенсоневральным нарушениям слуха, при которых страдает процесс звуковосприятия. Наиболее частой причиной возникновения заболевания являются мутации в генах семейства белков-коннексинов: GJB2 (gap junction β2) и GJB6 (gap junction β6), локализованных в 13 хромосоме в области 13q11-q13 (Guilford P., 1994), кодирующих коннексин 26 (Сх26) и коннексин 30 (Сх30) - трансмембранные белки, участвующие в перемещении калия между клетками (Simon A. et al., 1998). Наиболее частой мутацией в гене GJB2 является делеция гуанина в 35-м положении (35delG) в единственном экзоне, которая ответственна приблизительно за 20% всех наследственных нарушений слуха у человека (Zelante et al., 1997; Denoyelle et al., 1997). Наряду с 35delG, достаточно частыми мутациями гена GJB2 являются делеция тимина в 167 положении (167delT), особенно распространенная среди больных еврейского происхождения (Rabionet et al., 2000), и делеция цитозина в 235-м положении (235delC), часто встречающаяся в популяциях Азии (Wilcox et al., 2000; Loffler et al., 2001; Abe et al., 2001).
Известен способ детекции мутаций 35delG, 167delT и 235delC гена GJB2 посредством гетеродуплексного анализа (Kelley P.M., Harris D.J., Comer B.C. et al. Novel mutations in the connexin 26 gene (GJB2) that cause autosomal recessive (DFNB1) hearing loss // American Journal of Human Genetics. - 1998. V.62. P.792-799). Однако гетеродуплексный анализ - достаточно дорогостоящий и сложный метод, который, к тому же, не выявляет однонуклеотидные замены, находящиеся в гомозиготном состоянии, поскольку в таких образцах затруднено образование гетеродуплексов - показателей наличия мутации в образце.
SSCP - анализ (анализ конформационного полиморфизма одноцепочечной ДНК), широко применяемый для детекции однонуклеотидных делеций, был предложен в 1989 году (Orita M., Iwahana Н., Kanazawa H., Sekya Т. Detection of polymorphism of human DNA by gel electrophoresis as single cell conformation polymorphism // Protocols Natl. Acad. Sci. - 1989. - V.86. - P.2766-2770). Существенными недостатками этого метода являются его трудоемкость и необходимость дорогостоящего оборудования и реактивов, а также длительность около 5 суток.
Прототипом изобретения является способ, описанный в работе Baris I. с соавторами (Baris I., Koksal V. et al. Myltiplex deletion of common mutations in the connexin-26 gene, Genetic Testing, 2003, v.7, №1, pp.63-65). Способ включает выделение ДНК из лимфоцитов периферической крови; проведение мультиплексной полимеразной цепной реакции, амплификацию фрагементов ДНК, содержащих мутации 35delG, 167delT и 235delC гена GJB2 и позволяет выявлять гетерозиготное носительство мутаций гена GJB2. Основными недостатками ближайшего аналога являются его трудоемкость и необходимость в использовании дорогостоящего оборудования и реактивов.
Техническим результатом изобретения является упрощение способа и повышение точности определения мутаций 35delG, 167delT и 235delC гена GJB2.
Указанный технический результат достигается тем, что в способе, включающем выделение ДНК из лимфоцитов периферической крови методом фенольно-хлороформной экстракции, проведение мультиплексной полимеразной цепной реакции, амплификацию фрагментов ДНК, содержащих мутации 35delG, 167delT и 235delC гена GJB2, амплифицируют одновременно три участка гена GJB2 в смеси трех пар последовательностей олигонуклеотидов: (35delG) (F) 5'cttttccagagcaaaccgccc 3', (R) 5' tgctggtggagtgtttgttcac 3' (167delT) (F) 5' atgagcaggccgactttgtctg 3', (R) 5' gtgggagatggggaagtagtga 3' (235delC) (F) 5' acgatcactacttccccatctc 3', (R) 5' actaggagcgctggcgtggac 3', фланкирующих области с возможным содержанием мутаций 35delG, 167delT, 235delC, и при наличии аллелей 89 пн и 88 пн, 83 пн и 82 пн, 79 пн и 78 пн диагностируют гетерозиготное носительство мутаций 35delG, 167delT и 235delC; аллелей 88 пн, 82 пн, 78 пн - гомозиготное носительство мутаций 35delG, 167delT и 23 5delC.
Способ осуществляется следующим образом. ДНК выделяют из лимфоцитов периферической крови. В качестве консерванта используют раствор следующего состава: 0,48% лимонной кислоты, 1,32% цитрата натрия, 1,47% глюкозы. При заборе крови к 1 мл консерванта добавляют 4 мл венозной крови и хорошо перемешивают. Для получения ДНК необходимой степени чистоты и достаточного молекулярного веса используется метод выделения ДНК из крови фенольно-хлороформной экстракцией, описанный Метью (Mathew С.С. The isolation of high molecular weight eucariotic DNA. // Methods in Molecular Biology / Ed. Walker J.M.Y.L.: Human Press. 1984. - V.2. - P.31-34).
1. Кровь в пробирке с консервантом тщательно перемешивается и переливается в центрифужный стакан объемом 50 мл, туда же добавляем 30 мл охлажденного лизирующего буфера, содержащего 320 мМ сахарозы, 1% раствор тритона Х-100, 5 мМ MgCl2, 10 мМ трис HCl (рН 7,6).
2. Смесь центрифугируется 20 мин при 4000 об/мин.
3. Надосадочную жидкость сливают, к получившемуся осадку приливают 0,4 мл 10% SDS и протеиназу К (концентрация 10 мг/мл). Смесь для лизиса оставляют на 16 часов в термостате при температуре 37°С.
Экстракцию ДНК осуществляют в следующем порядке:
4. К лизату добавляют 0,5 мл фенола, насыщенного 1 М трисHCl до рН 7,8.
5. Смесь встряхивают на шейкере и центрифугируют 10 мин при 6000 об/мин.
6. Отбирают водную фазу, содержащую ДНК и неденатурированные белки.
7. Отобранную фазу обрабатывают смесью фенол-хлороформа (1:1), а затем хлороформом.
8. Препараты осаждают двумя объемами охлажденного этанола 96%.
9. Образовавшийся осадок ДНК растворяют в 1,5 мл деионизированной Н2О; раствор хранят при -20°С.
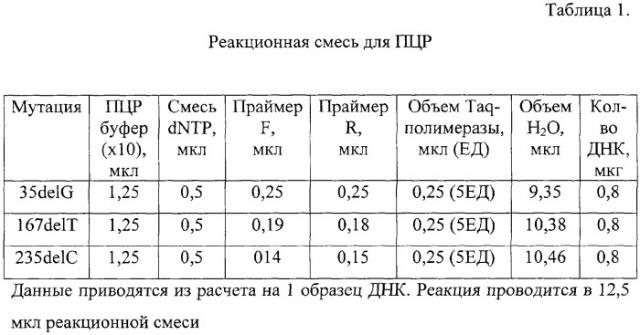
В дальнейшем полученную ДНК используют в качестве матрицы для полимеразной цепной реакции (ПЦР) для амплификации нужного фрагмента кодирующего региона гена GJB2. Специфические последовательности олигонуклеотидных праймеров для детекции мутаций 167delT, 235delC гена GJB2 и их оптимальные концентрации в реакционной смеси подобраны с помощью пакета биологических программ DNASTAR (Primer select 5.05 1993-2002). Олигонуклеотиды, фланкирующие область с возможным содержанием мутации 35delG, представлены в работе Kelley P.M. (Kelley P.M., Harris D.J., Comer B.C. et al. Novel mutations in the connexin 26 gene (GJB2) that cause autosomal recessive (DFNB1) hearing loss // American Journal of Human Genetics. - 1998. V.62. P.792-799). Состав реакционной смеси для ПНР указан в таблице 1. Используются следующие последовательности олигонуклеотидов: (35delG) (F) 5'cttttccagagcaaaccgccc 3', (R) 5' tgctggtggagtgtttgttcac 3' (167delT) (F) 5' atgagcaggccgactttgtctg 3' (R) 5' gtgggagatggggaagtagtga 3' (235delC) (F) 5' acgatcactacttccccatctc 3' (R) 5' actaggagcgctggcgtggac 3'.
Состав реакционной смеси: 0,8 мкг геномной ДНК, соответствующее количество каждого олигонуклеотида (Таблица 1), 125 мкМ каждого дезоксинуклеозидтрифосфата (Promega, USA) помещают в 12,5 мкл однократного буфера для ПЦР следующего состава: 67 mM Tris-HCl, pH 8,8, 6,7 мМ MgCl2, 16,6 мМ (NH4)2SO4, 0,01% Tween-20. К полученной смеси прибавляют 5 единиц термофильной ДНК-полимеразы, 20-30 мкл стерильного минерального масла. Режим амплификации: предварительная денатурация 4 минуты при 94°С, затем 30 циклов со следующими параметрами - 94°С - 45 секунд, 65°С - 45 секунд, 72°С - 1 минута. После 30-го цикла проводят инкубацию при 72°С в течение 7 минут. Полученные ПЦР-продукты подвергают электрофорезу в вертикальном 9% полиакриламидном геле. Перед нанесением на вертикальный электрофорез пробы смешивают в соотношении 1:5 с краской, содержащей 0,25% бромфенолового синего, 0,25% ксиленцианола, 15% фикола. Электрофорез проводят при постоянном напряжении 10 В/см2. Детекцию результатов проводят путем окрашивания полиакриламидного геля бромистым этидием в течение 10 минут с последующей визуализацией в ультрафиолетовом свете на трансиллюминаторе. Время исследования составляет 2 дня. Идентификацию генотипов проводят по критерию присутствия или отсутствия аллелей 89 пн, 83 пн и 79 пн (норма), аллели 88 пн (мутация 35delG), 82 пн (мутация 167delT), 78 пн (мутация 235delC). При наличии аллелей 89 пн и 88 пн, 83 пн и 82 пн, 79 пн и 78 пн диагностируют гетерозиготное носительство мутаций 35delG, 167delT и 235delC; аллелей 88 пн, 82 пн, 78 пн - гомозиготное носительство мутаций 35delG, 167delT и 235delC.
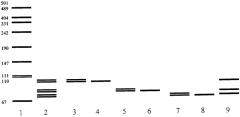
На чертеже представлено электрофоретическое разделение продуктов амплификации: 1) молекулярный маркер λpUC19/Pstl 2) гетерозиготное носительство мутаций 35delG, 167delT и 235delC (аллели 89 пн и 88 пн, 83 пн и 82 пн, 79 пн и 78 пн); 3) гетерозиготное носительство мутации 35delG (аллели 88 пн и 89 пн); 4) гомозиготное носительство мутации 35delG (аллели 88 пн); 5) гетерозиготное носительство мутации 167delT (аллели 82 пн и 83 пн); 6) гомозиготное носительство мутации 167delT (аллели 82 пн); 7) гетерозиготное носительство мутации 235delC (аллели 78 пн и 79 пн); 8) гомозиготное носительство мутации 235delC (аллели 78 пн); 9) гомозиготное носительство мутаций 35delG, 167delT и 235delC (88 пн, 82 пн и 78 пн).
В качестве конкретных примеров обследовано в целом 94 больных с наследственными формами потери слуха, состоящих на учете в Республиканском сурдологическом центре Республиканской детской клинической больницы г.Уфы, членов их семей, а также здоровых доноров, проживающих в Волго-Уральском регионе.
Диагноз глухоты или тугоухости устанавливался на основе данных тональной пороговой аудиометрии (аудиометр «GSI-61», Grason Stadler Instruments, USA), акустической импедансометрии (импедансометр «Zodiac 901», Дания) и регистрации отоакустической эмиссии (система «ILO 92», Otodynamics Ltd., Великобритания). Наследственный характер глухоты в семьях устанавливали на основании генеалогических данных и ретроспективного анализа анамнеза больных с целью исключения возможного влияния факторов внешней среды во время пренатального и постнатального развития: учитывали отсутствие инфекций, травм слухового аппарата, применения ототоксических антибиотиков.
Молекулярно-генетический анализ частоты мутаций 35delG, 167delT и 235delC гена GJB2 проводился у больных, страдающих сенсоневральной тугоухостью третьей и четвертой степени и глухотой предположительно наследственной этиологии.
Из 94 неродственных пробандов мутация 35delG выявлена у 50 больных, что составляет 53%. В гомозиготном состоянии мутация del35G обнаружена у 36 (38%) больных, в гетерозиготном - у 15 (15%). Таким образом, из 188 проанализированных хромосом 86 (45,7%) содержали данную мутацию. На основании этого анализа больным с мутацией 35delG гена GJB2 в гомозиготном состоянии поставлен диагноз - несиндромальная аутосомно-рецессивная потеря слуха. Мутация 167delT гена GJB2 на хромосомах больных наследственными формами потери слуха встречается с частотой 0,027 (2,7%), а мутация 235delC - с частотой 0,01 (1%). Таким образом, среди больных с несиндромальной потерей слуха наиболее частой причиной является мутационное повреждение гена GJB2, а наиболее частыми мутациями являются 35delG, 167delT и 235delC. Полученные высокие значения частоты мутаций 35delG и 167delT среди больных наследственной несиндромальной глухотой в Башкортостане подтверждают важность определения этих делеций в гене GJB2 при медико-генетическом консультировании пациентов с высоким риском рождения глухого ребенка.
Пример 1. Больной М.А., 1986 год рождения, город Нефтекамск, Республика Башкортостан. Диагноз нейросенсорной двухсторонней глухоты установлен в 1987 году. В настоящее время пациент использует слуховой аппарат. Со стороны родителей и ближайших родственников - наследственность не отягощена. Нарушений слуха у родных пациента не выявлено. При молекулярно-генетическом тестировании у больного и его родителей было взято по 8 мл венозной крови с последующим выделением ДНК и амплификацией трех участков 1 экзона гена GJB2 в реакционной смеси, содержащей 0,8 мкг геномной ДНК, соответствующее количество каждого олигонуклеотида (Таблица 1), 125 мкМ каждого дезоксинуклеозидтрифосфата в 12,5 мкл однократного буфера для ПЦР. Затем провели электрофорез амплифицированных ПЦР-продуктов при постоянном напряжении 250-300 В. После окончания электрофореза гель окрасили раствором бромистого этидия в течение 10 минут и проанализировали при ультрафиолетовом освещении. Исследование ДНК больного и его родителей выявило гетерозиготное носительство мутации 35delG у отца (аллели 88 пн и 89 пн) и гетерозиготное носительство мутации 167delT у матери (аллели 82 пн и 83 пн). У пациента были выявлены обе мутации 35delG и 167delT (аллели 88 пн и 89 пн, аллели 82 пн и 83 пн), которые в компаунд-гетерозиготном состоянии явились причиной глухоты. Время исследования составило 2 дня.
Пример 2. Пациентка В.В., 1980 год рождения, город Туймазы, Республика Башкортостан. Слух нормальный, беременность 8 недель. Со стороны мужа наследственность отягощена по врожденной глухоте. Также выявлены нарушения слуха у сына сестры пациентки. Больной был проведен амниоцентез и взята ворсина хориона. Также у супругов взяли по 8 мл венозной крови с последующим выделением ДНК и амплификацией трех участков 1 экзона гена GJB2 в реакционной смеси, содержащей 0,8 мкг геномной ДНК, соответствующее количество каждого олигонуклеотида (Таблица 1), 125 мкМ каждого дезоксинуклеозидтрифосфата в 12,5 мкл однократного буфера для ПНР. Затем провели электрофорез амплифицированных ПЦР-продуктов при постоянном напряжении 250-300 В. После окончания электрофореза гель окрасили раствором бромистого этидия в течение 10 минут и проанализировали при ультрафиолетовом освещении. При исследовании ДНК ворсины хориона была обнаружена мутация 35delG гена GJB2 в гомозиготном состоянии (аллели 88 пн), что свидетельствовало о симметричной нейросенсорной глухоте у плода. Оба супруга являлись гетерозиготными носителями данной мутации (у супругов обнаруживались аллели 88 пн и 89 пн).
Таким образом, нами проведено молекулярно-генетическое изучение распространенности трех наиболее часто встречающихся мутаций гена GJB2 у 94 больных несиндромальной наследственной глухотой, проживающих на территории республики Башкортостан. Полученные данные позволяют оценивать вероятность появления врожденной глухоты у детей из семей с отягощенной наследственностью. Установление с помощью молекулярно-генетических методов необратимого наследственного повреждения слуха с самого рождения позволяет правильно проводить реабилитацию ребенка с повреждениями процесса звуковосприятия и снижать экономические затраты на проведение дорогостоящих диагностических процедур.
Способ выявления мутаций в гене GJB2, сопровождающихся развитием несиндромальной аутосомно-рецессивной глухоты, включающий выделение ДНК из лимфоцитов периферической крови методом фенольно-хлороформной экстракции, проведение мультиплексной полимеразной цепной реакции амплификации фрагментов ДНК, содержащих мутации 35delG, 167delT и 235delC гена GJB2, отличающийся тем, что амплифицируют одновременно 3 участка гена GJB2 в смеси трех пар последовательностей олигонуклеотидов: (35delG) (F) 5' cttttccagagcaaaccgccc 3', (R) 5' tgctggtggagtgtttgttcac 3'; (167delT) (F) 5' atgagcaggccgactttgtctg 3', (R) 5' gtgggagatggggaagtagtga 3'; (235delC) (F) 5' acgatcactacttccccatctc 3', (R) 5' actaggagcgctggcgtggac 3', фланкирующих области с возможным содержанием мутаций 35delG, 167delT, 235delC, и при наличии аллелей 89 пн и 88 пн, 83 пн и 82 пн, 79 пн и 78 пн диагностируют гетерозиготное носительство мутаций 35delG, 167delT и 235delC; аллелей 88 пн, 82 пн, 78 пн - гомозиготное носительство мутаций 35delG, 167delT и 235delC.