Соединения, способ их получения и фармацевтическая композиция на их основе
Иллюстрации
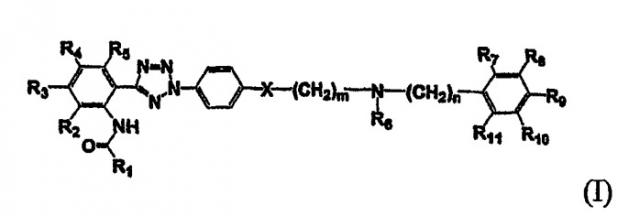
Показать всеОписываются новые соединения общей формулы (I)
где R1 - хинолинил, возможно замещенный С1-5 алкокси, изохинолинил, хиноксалинил, пиридинил, пиразинил, бензил, возможно замещенный галогеном, нафталинил, тиофенил, фуранил, циннолил, фенилвинил, хинолилвинил или 4-оксо-4Н-хроменил, возможно замещенный галогеном, С1-5 алкилом или С1-5 алкокси;
R2, R5, R8 и R11 - водород;
R3 и R4 - галоген, C1-5 алкокси;
R6 и R7 - Н или C1-5 алкил или вместе образуют радикал -СН2-СН2-;
R9 и R10 - C1-5 алкокси;
m и n - независимо целое число от 0 до 4.
Х означает CH2 или S, их фармацевтически приемлемые соли, способ их получения и фармацевтическая композиция на их основе. Данные соединения являются ингибиторами р-гликопротеина, усиливают биодоступность противоракового агента и могут найти применение в медицине. 3 н. и 4 з.п. ф-лы, 3 табл.
Реферат
Область техники
Настоящее изобретение относится к эффективному ингибитору р-гликопротеина и к его фармацевтически приемлемой соли, способу получения указанного ингибитора и фармацевтической композиции, содержащей данный ингибитор в качестве активного ингредиента.
Уровень техники
Известно, что многие противораковые агенты, например винкаалкалоиды, антрациклин, эпиподофилотоксин, паклитаксел и доцетаксел, оказывают эффективное действие при введении больному, обладающему резистентностью ко многим лекарственным средствам (MDR), возникающей у больного за счет повышенной экспрессии р-гликопротеина. р-Гликопротеин ингибирует внутриклеточное накопление введенного противоракового агента, способствуя выведению его из клетки (D.W.Shen, et al., Science (1986), 232, 643-645; и Schinkel, et al., Cell (1994), 77, 491-502). Таким образом, многочисленные попытки были предприняты для повышения биодоступности вышеупомянутых агентов посредством объединения их с ингибитором р-гликопротеина.
Поскольку традиционные ингибиторы р-гликопротеина, такие как верапамил и циклоспорин А, вызывают серьезные неблагоприятные эффекты, например, снижение кровяного давления и подавление иммунитета, был разработан ряд новых ингибиторов п-гликопротеина, таких как пиперидин-2-карбоксилат, акридин, пиперазин-2,5-дион, антраниловая кислота и производные метандибензосуберана. Однако исследователями было сообщено, что подобные, вновь открытые ингибиторы п-гликопротеина проявляют токсичность и другие неблагоприятные свойства (смотри международные публикации РСТ № WO 94/07858; WO 92/12132; WO 96/20180 и 98/17648, и WO 98/22112).
Таким образом, авторы настоящего изобретения предприняли попытку разработать ингибитор п-гликопротеина, лишенный вышеуказанных проблем, и обнаружили новое соединение, которое в значительной степени повышает биодоступность противораковых агентов, подавляя активность п-гликопротеина.
Сущность изобретения
Таким образом, целью настоящего изобретения является предоставление соединения, которое может быть использовано в качестве эффективного ингибитора п-гликопротеина для увеличения биодоступности противоракового агента с минимальными неблагоприятными эффектами.
Другой целью настоящего изобретения является предоставление способа получения такого соединения.
Еще другой целью настоящего изобретения является предоставление фармацевтической композиции, содержащей такое соединение.
Подробное описание изобретения
В соответствии с одним аспектом настоящего изобретения, изобретение обеспечивает соединение формулы (I) и его фармацевтически приемлемую соль:
где R1 означает арил, гетероарил, акриларил, акрилгетероарил, гетероциклоалкенил или карбоцикло, который, необязательно, замещен одним или более заместителями, выбранными из С1-5 алкила, гидрокси, С1-5 алкокси, галогена, трифторметила, нитро- и амино;
R2, R3, R4, R5, R6, R7, R8, R9, R10 и R11 каждый независимо означает водород, гидрокси, галоген, нитро, С1-5 алкил или алкокси, причем R6 и R11, необязательно, объединены друг с другом с образованием 4-8-членного кольца;
m и n каждый независимо является целым числом, колеблющимся от 0 до 4, и
Х является СН2, О или S.
В отличие от традиционных ингибиторов п-гликопротеина, например, циклоспорина А, цинхонина и верапамила, соединение формулы (I) само по себе не обладает фармакологической активностью, и, следовательно, не вызывает побочных эффектов, в то же время оно повышает биодоступность противораковых агентов путем ингибирования активности п-гликопротеина.
У соединения формулы (I) согласно настоящему изобретению, предпочтительным радикалом R1 является незамещенный или замещенный фенил, пиридин, пиразин, хинолин, изохинолин, хиназолин, хиноксалин, пиразол, имидазол, триазол, оксазол, тиазол, оксадиазол, тиадиазол, бензотиазол, бензоксазол, хромон, хинолон, циннамил или хинолинакрил.
Характерные примеры соединения формулы (I) включают
хинолин-3-карбоновой кислоты
[2-(2-4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
хинолин-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
изохинолин-3-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
хинолин-8-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
изохинолин-1-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
хинолин-4-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
4-метоксихинолин-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
хиноксалин-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
пиридин-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]никотинамид;
N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]изоникотинамид;
пиразин-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]бензамид;
нафталин-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]-2-фторбензамид;
N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]-3-фторбензамид;
N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]-4-фторбензамид;
N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]-3,4-дифторбензамид;
тиофен-3-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
фуран-3-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
4-оксо-4Н-хромен-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
6-метил-4-оксо-4Н-хромен-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
5-гидрокси-4-оксо-4Н-хромен-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
5-метокси-4-оксо-4Н-хромен-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
6-фтор-4-оксо-4Н-хромен-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
6-бром-4-оксо-4Н-хромен-2-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
цинолин-4-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
4-оксо-4Н-хромен-3-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
хинолин-3-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-дифторфенил]амид;
хинолин-3-карбоновой кислоты
[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этилсульфанил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амид;
хинолин-3-карбоновой кислоты
2-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-илэтил)-2Н-тетразол-5-ил]-4,5-диметоксифениламид;
N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]-3-фенилакриламид;
N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]-3-хинолин-3-илакриламид; и
4-оксо-4Н-хромен-2-карбоновой кислоты
(2-{2-[4-(2-{[2-(3,4-диметоксифенил)этил]метиламино}этил)фенил]-2Н-тетразол-5-ил}-4,5-диметоксифенил)амид.
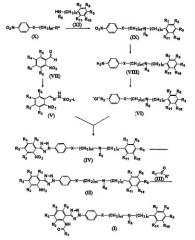
Соединение формулы (I) может быть получено по следующей реакционной схеме А:
Реакционная схема А
где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, m, n и X имеют такие же значения, как определены в формуле (I);
R' и R" каждый в зависимости друг от друга означает OH, Cl или Br, и
L означает бензил или толил.
На реакционной схеме А, соединение формулы (I) может быть получено (i) циклизацией соединения формулы (V) c соединением формулы (VI) в присутствии основания с получением соединения формулы (IV); (ii) гидрированием соединения формулы (IV) в присутствии катализатора с получением соединения формулы (II), и (iii) ацилированием соединения формулы (II), полученного на стадии (ii), соединением формулы (III) в присутствии основания или конденсирующего реагента.
Основание, используемое на стадии (i), может быть выбрано из группы, состоящей из пиридина, триэтиламина и диизопропилэтиламина. Реакцию на стадии (i) можно проводить в таком растворителе, как метанол, этанол, хлороформ, дихлорметан, тетрагидрофуран, этиловый эфир, гексан и толуол, и соединение формулы (VI) может быть использовано в количестве в интервале от 1 до 2 эквивалентов, исходя из 1 эквивалента соединения формулы (V).
Реакцию на стадии (ii) можно проводить в таком растворителе, как метанол, этанол, хлороформ, дихлорметан, тетрагидрофуран, этиловый эфир, гексан и толуол, при температуре в интервале от 0 до 50°С и катализатор для стадии (ii) может быть выбран из группы, состоящей из палладиевого, платинового и цинкового катализаторов.
Для реакции на стадии (iii) соединение формулы (III) может быть использовано в количестве, в интервале от 1 до 1,5 эквивалентов относительно 1 эквивалента соединения формулы (II). Основание для стадии (iii) может быть использовано в количестве в интервале от 1 до 2 эквивалентов на 1 эквивалент соединения формулы (II), в то время как конденсирующий реагент может присутствовать в количестве в интервале от 1 до 5 эквивалентов, предпочтительно от 1 до 2 эквивалентов на 1 эквивалент соединения формулы (II). Основание для стадии (iii) включает триэтиламин, дипропилэтиламин и пиридин, и конденсирующий реагент для стадии (iii) выбирают из группы, состоящей из 1-(3-диметиламинопропил)-3-этилкарбодиимида, N,N'-дициклогексилкарбодиимида, N,N'-диизопропилкарбодиимида и 1-циклогексил-3-(2-(морфолинэтил)карбодиимид)метил-п-толуолсульфоната, предпочтительно 1-(3-диметиламинопропил)-3-этилкарбодиимида. В случае использования конденсирующего реагента на стадии (iii), 4-(диметиламино)пиридин может быть добавлен в качестве катализатора в количестве в интервале от 0,05 до 0,3 эквивалента, исходя из 1 эквивалента соединения формулы (II). Ацилирование соединения формулы (II) может быть выполнено в растворителе, выбранном из группы, состоящей из дихлорметана, хлороформа, N,N-диметилформамида, тетрагидрофурана и 1,4-диоксана, предпочтительно дихлорметана и хлороформа, при температуре в интервале от -20°С до температуры кипения используемого растворителя, предпочтительно от 10 до 40°С.
На реакционной схеме А показано, что соединение формулы (V) может быть получено взаимодействием соединения формулы (VII) с толуолсульфонилхлоридом или бензолсульфонилхлоридом способом, описанным в Bulletin of the Chemical Society of Japan Vol. 49(7), 1920-1923 (1976). В данной реакции толуолсульфонилхлорид или бензолсульфонилхлорид может быть использован в количестве в интервале от 0,5 до 5 эквивалентов, предпочтительно от 1 до 2 эквивалентов, на 1 эквивалент соединения формулы (VII), и реакцию можно проводить в растворителе, выбранном из группы, состоящей из хлороформа, тетрагидрофурана, этанола, метанола и воды, при температуре в интервале от -10 до 20°С, предпочтительно от 0 до 5°С.
Кроме того, соединение формулы (VI) может быть получено взаимодействием соединения формулы (Х) с соединением формулы (XI) в присутствии основания, например, пиридина, триэтиламина или диизопропилэтиламина, с получением соединения формулы (IX), гидрированием соединения формулы (IX) в присутствии катализатора с образованием соединения формулы (VIII), и взаимодействием соединения формулы (VIII) с нитритом натрия и HCl (смотри публикацию в Bulletin of the Chemical Society of Japan Vol. 49(7), 1920-1923 (1976)).
В данном синтезе реакцию между соединением формулы (Х) и соединением формулы (XI) можно проводить в растворителе, выбранном из группы, состоящей из метанола, этанола, хлороформа, дихлорметана, тетрагидрофурана, этилового эфира, гексана и толуола, при температуре в интервале от 0 до 50°С.
Катализатор, подходящий для данного синтеза, представляет собой металлический катализатор, такой как палладиевый, платиновый или цинковый катализатор, и гидрирование соединения формулы (IX) можно проводить в растворителе, таком как метанол, этанол, хлороформ, дихлорметан, тетрагидрофуран, этиловый эфир, гексан или толуол, при температуре в интервале от 0 до 50°С.
Количество нитрита натрия, используемого в данном синтезе, может составлять от 1 до 5 эквивалентов, предпочтительно от 1 до 3 эквивалентов, на 1 эквивалент соединения формулы (VIII), в то время как кислота HCl может быть использована в количестве в интервале от 0,5 до 1 эквивалента, исходя из 1 эквивалента соединения формулы (VIII). Реакция превращения соединения формулы (VIII) в соединение формулы (VI) может быть проведена в растворителе, таком как этанол, метанол или вода, при температуре в интервале от -10 до 20°С предпочтительно от 0 до 5°С.
Кроме того, настоящее изобретение в его объеме охватывает фармацевтически приемлемую соль ингибитора п-гликопротеина формулы (I), образованную с неорганической или органической кислотой. Предпочтительная неорганическая или органическая кислота может быть выбрана из группы, состоящей из хлористоводородной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты, азотной кислоты, уксусной кислоты, гликолевой кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаминовой кислоты, фумаровой кислоты, яблочной кислоты, миндальной кислоты, винной кислоты, лимонной кислоты, аскорбиновой кислоты, пальмитиновой кислоты, малеиновой кислоты, гидроксималеиновой кислоты, бензойной кислоты, гидроксибензойной кислоты, фенилуксусной кислоты, коричной кислоты, салициловой кислоты, метансульфокислоты, бензолсульфокислоты и толуолсульфокислоты.
Ингибитор п-гликопротеина согласно настоящему изобретению может быть введен в комбинации с противораковым агентом, который трудно всасывается в пищеварительном тракте вследствие ингибирующего действия п-гликопротеина. Таким образом, в следующем аспекте, настоящее изобретение предоставляет композицию, содержащую ингибитор п-гликопротеина формулы (I) или его фармацевтически приемлемую соль вместе с противораковым агентом, которая способствует:
(а) улучшению или повышению эффективности противоракового агента;
(b) повышению или восстановлению чувствительности опухоли к противораковому агенту, или
(с) снижению или уничтожению MDR резистентности опухоли к действию противоракового агента, независимо от того, является ли MDR приобретенной, индуцированной или врожденной.
Предпочтительные примеры противоракового агента включают таксан (например, паклитаксел или доцетаксел), винкаалкалоид (например, винкристин, винбластин и винорельбин), антрациклин (например, дауномицин, даунорубицин, доксорубицин и акларубицин), камптотецин (например, топотекан и иринотекан), подофиллотоксин (например, этопозид и VP16), митоксантрон, актиномицин, колхицин, грамицидин D и амсакрин.
В другом аспекте, настоящее изобретение предоставляет фармацевтическую композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль в качестве активного ингредиента вместе с фармацевтически приемлемыми носителями, наполнителями или другими добавками, для лечения млекопитающего, страдающего от рака:
(а) с целью улучшения или повышения эффективности противоракового агента;
(b) с целью повышения или восстановления чувствительности опухоли к действию противоракового агента, или
(с) с целью снижения или уничтожения MDR резистентности опухоли к действию противоракового агента, независимо от того, является ли MDR приобретенной, индуцированной или врожденной.
Фармацевтическая композиция согласно настоящему изобретению может быть приготовлена для перорального введения или парентерального введения, такого как внутримышечное, внутривенное или трансдермальное введение.
Для перорального введения фармацевтическая композиция согласно настоящему изобретению может быть приготовлена в виде таблетки, покрытой оболочкой таблетки, порошка, твердой или мягкой желатиновой капсулы, раствора, эмульсии, микроэмульсионной или водной дисперсии, обычным способом вместе, по крайней мере, с одним фармацевтически приемлемым носителем, таким как связывающие реагенты (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон и гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза и вторичный кислый фосфат кальция); смазывающие реагенты (например, стеарат магния, тальк и двуокись кремния); дезинтегрирующие реагенты (например, лаурилсульфат натрия и натриевая соль крахмалгликолевой кислоты). Такие таблетки могут быть покрыты оболочками способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут быть приготовлены в виде, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта, предназначенного для смешивания с водой или другим подходящим носителем до использования. Такие жидкие препараты могут быть приготовлены обычными способами вместе, по крайней мере, с одной фармацевтически приемлемой добавкой, такой как суспендирующий реагент (например, сироп сорбита, производное целлюлозы и гидрогенизованный пищевой жир); эмульгирующий реагент (например, лецитин и гуммиарабик); неводный носитель (например, миндальное масло, сложный эфир масла, этиловый спирт и фракционированное растительное масло) и консервант (например, метил- или пропил-п-гидроксибензоат и сорбиновая кислота). Указанные препараты также могут содержать, по крайней мере, одну буферную соль или, по крайней мере, один ароматизатор, краситель или подсластитель, что потребуется.
Фармацевтическая композиция согласно настоящему изобретению может быть приготовлена для парентерального введения посредством болюсного вливания или непрерывной инфузии. Препараты для инъекции могут быть представлены в виде стандартной лекарственной формы, например, в виде ампул или в виде контейнеров со множеством доз, с добавленным консервантом. Фармацевтические композиции могут быть представлены в виде суспензий, растворов или эмульсий в масляных, водных или спиртовых носителях, и могут содержать поверхностно-активные вещества, суспендирующие реагенты или эмульгаторы, которые могут быть выбраны из воды, солевого раствора, раствора глюкозы, сахароподобного раствора, спирта, гликоля, простого эфира (например, полиэтиленгликоля 400), масла, жирной кислоты, сложного эфира жирной кислоты и глицерида.
Фармацевтическая композиция согласно настоящему изобретению может быть введена отдельно, до или после введения противоракового агента, или в комбинации с противораковым агентом.
Предполагаемая суточная доза соединения согласно настоящему изобретению для введения человеку (приблизительно 70 кг веса тела) составляет приблизительно от 0,1 мг/кг до 100 мг/кг, более предпочтительно приблизительно от 1 мг/кг до 20 мг/кг. Следует признать, что суточная доза должна быть определена, исходя из существующих факторов, включая состояние, которое подвергается лечению, тяжесть симптомов у больного, способ введения или физиологическую форму противоракового агента, и поэтому, предложенная выше дозировка не должна рассматриваться, как ограничивающая объем изобретения каким бы то ни было образом.
Следующие примеры предназначены проиллюстрировать настоящее изобретение, не ограничивая его объема.
Пример 1: Синтез хинолин-3-карбоновой кислоты [2-(2-4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Стадия 1: Получение 4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фениламина
2-(4-Нитрофенил)этанбромид в количестве 2,30 г и 2,29 г гидрохлорида 6,7-диметокси-1,2,3,4-тетрагидроизохинолина растворяли в 150 мл N,N'-диметилформамида, затем добавляли 4,15 г карбоната калия и 1,80 г йодида натрия, и смесь оставляли для проведения реакции при 100°С в течение 12 часов. После смешивания со 150 мл воды, реакционную смесь экстрагировали три раза 200 мл порциями этилацетата, и объединенные органические слои промывали насыщенным раствором NaCl и сушили над сульфатом магния. Из полученного раствора удаляли растворитель при пониженном давлении, и остаток перекристаллизовывали, используя этилацетат, с получением 2,40 г нитропроизводного. Нитропроизводное добавляли к смеси 150 мл тетрагидрофурана и 150 мл метанола, затем добавляли 0,24 г Pd/C и восстановление проводили в атмосфере водорода в течение 18 часов. Полученный раствор фильтровали и концентрировали при пониженном давлении с получением остатка, который привел к 2,03 г указанного в заголовке соединения (выход 65%).
1Н ЯМР (CDCl3)δ: 6,97 (д, 2Н), 6,57 (д, 2Н), 6,53(с, 1Н), 6,47 (с, 1Н), 3,77 (с, 6Н), 3,57 (с, 2Н), 3,50 (с, 2Н), 2,71 (м, 8Н)
Стадия 2: Получение 4,5-диметокси-2-нитро-п-толуолсульфонилгидразона
п-Толуолсульфонилгидразид в количестве 6,90 г растворяли в 40 мл этанола, и добавляли 7,90 г альдегида 6-нитровератровой кислоты, растворенного в малом количестве этанола. Смесь перемешивали при 80°С течение 30 мин, охлаждали до комнатной температуры и смешивали со 100 мл воды. Образовавшееся твердое вещество фильтровали, промывали 100 мл этанола и сушили при пониженном давлении с получением 12,0 г указанного в заголовке соединения (выход 85%).
1Н ЯМР (CDCl3)δ: 8,47 (с, 1Н), 8,00 (с, 1Н), 7,87 (д, 2Н), 7,61 (с, 1Н), 7,41 (с, 1Н), 7,32 (д, 2Н), 3,99 (д, 6Н), 2,42 (с, 3Н)
Стадия 3: Получение 2-(2-4-[5-(4,5-диметокси-2-нитрофенил)тетразол-2-ил]фенилэтил)-6,7-диметокси-1,2,3,4-тетрагидроизохинолина
Полученное на стадии 1 соединение в количестве 7,4 г добавляли к 40 мл 50% этанола и охлаждали до 5°С. Затем добавляли 6,32 мл 35% HCl и раствор, полученный растворением 1,8 г нитрата натрия в 10 мл воды, и смесь охлаждали до -15°С. Полученное на стадии 2 соединение в количестве 9 г растворяли в 140 мл пиридина и медленно добавляли к вышеуказанной смеси. Образовавшийся раствор перемешивали в течение 14 часов и промывали посредством 1 н. HCl. Органический слой отделяли, сушили над сульфатом магния, фильтровали и подвергали дистилляции при пониженном давлении. Остаток очищали колоночной хроматографией с получением 9,0 г указанного в заголовке соединения (выход 70%).
1Н ЯМР (CDCl3)δ: 8,08 (д, 2Н), 7,66 (с, 1Н), 7,45 (д, 2Н), 7,32 (с, 1Н), 6,59 (д, 2Н), 4,03 (с, 6Н), 3,85 (с, 6Н), 3,68 (с, 2Н), 3,01 (м, 2Н), 2,84 (м, 6Н)
Стадия 4: Получение 2-(2-4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил-2Н-тетразол-5-ил)-4,5-диметоксифениламина
Полученное на стадии 3 соединение в количестве 0,25 г смешивали с 3 мл этанола, 3 мл дихлорметана и 0,07 г Pd/C и оставляли в атмосфере водорода в течение 12 часов. Реакционную смесь фильтровали через слой целлита, слой промывали этанолом, и фильтрат и промывной раствор объединяли и подвергали дистилляции при пониженном давлении с получением 0,2 г указанного в заголовке соединения (выход 85%).
1Н ЯМР (CDCl3)δ: 8,21 (д, 2Н), 7,81 (с, 1Н), 7,58 (д, 2Н), 6,71 (д, 2Н), 6,48 (с, 1Н), 4,74 (ушир.с, 2Н), 4,02 (д, 6Н), 3,96 (д, 6Н), 3,79 (м, 2Н), 3,51 (м, 8Н)
Стадия 5: Получение хинолин-3-карбонилхлорида
3-Хинолинкарбоновую кислоту в количестве 10 г смешивали с 8,5 мл тионилхлорида и 150 мл толуола и оставляли для осуществления реакции при 100°С в течение 12 часов. Реакционную смесь конденсировали при пониженном давлении с получением остатка, который привел к 10 г указанного в заголовке соединения (выход 90%).
1Н ЯМР (CDCl3)δ: 9,64 (с, 1Н), 9,36 (с, 1Н), 8,85 (д, 1Н), 8,17 (м, 2Н), 7,92 (т, 1Н)
Стадия 6: Получение хинолин-3-карбоновой кислоты [2-(2-4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Полученное на стадии 4 соединение в количестве 0,2 добавляли к 5 мл дихлорметана, к этому добавляли 0,07 г полученного на стадии 5 соединения и 0,1 мл триэтиламина, и смесь оставляли при комнатной температуре в течение 12 часов. После промывания посредством 50 мл дистиллированной воды, органический слой сушили над сульфатом магния, фильтровали и подвергали дистилляции при пониженном давлении. Остаток подвергали колоночной хроматографии с получением 0,18 г указанного в заголовке соединения (выход 69%).
1Н ЯМР (CDCl3)δ: 11,86 (с, 1Н), 9,69 (с, 1Н), 8,95 (с, 1Н), 8,75 (с, 1Н), 8,23 (д, 1Н), 8,12 (д, 1Н), 7,99 (д, 1Н), 7,86 (т, 2Н), 7,66 (м, 1Н), 7,46 (д, 2Н), 6,59 (д, 2Н), 4,06 (д, 6Н), 3,85 (с, 6Н), 3,69 (с, 2Н), 3,04 (м, 2Н), 2,83 (м, 6Н)
Пример 2: Синтез хинолин-2-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Полученное на стадии 4 примера 1 соединение в количестве 0,15 г и 0,05 г 2-хинолинкарбоновой кислоты добавляли к 5 мл дихлорметана, к этому добавляли 0,1 г гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида и 0,005 г 4-(диметиламино)пиридина, и смесь оставляли при комнатной температуре в течение 12 часов. После промывания 50 мл дистиллированной воды органический слой отделяли и сушили над сульфатом магния, фильтровали и подвергали дистилляции при пониженном давлении. Остаток подвергали колоночной хроматографии с получением 0,14 г указанного в заголовке соединения (выход 73%).
1Н ЯМР (CDCl3)δ: 12,60 (с, 1Н), 8,71 (с, 1Н), 8,40 (д, 2Н), 8,20 (д, 2Н), 8,13 (д, 1Н), 7,90 (с, 2Н), 7,65 (м, 2Н), 7,37 (д, 2Н), 6,58 (д, 2Н), 4,05 (д, 6Н), 3,85 (с, 6Н), 3,67 (с, 2Н), 3,01 (т, 2Н), 2,83 (м, 6Н)
Пример 3: Синтез изохинолин-3-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что гидрат 3-изохинолинкарбоновой кислоты использовали вместо 2-хинолинкарбоновой кислоты с получением 0,12 г указанного в заголовке соединения (выход 62%).
1Н ЯМР (CDCl3)δ: 12,67 (с, 1Н), 9,29 (с, 1Н), 8,83 (с, 1Н), 8,73 (с, 1Н), 8,41 (д, 2Н), 8,01 (д, 2Н), 7,93 (с, 1Н), 7,77 (м, 2Н), 7,53 (д, 2Н), 6,62 (с, 1Н), 6,57 (с, 1Н), 4,04 (д, 6Н), 3,85 (с, 6Н), 3,72 (с, 2Н), 3,07 (т, 2Н), 2,86 (м, 6Н)
Пример 4: Синтез хинолин-8-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что 8-хинолинкарбоновую кислоту использовали вместо 2-хинолинкарбоновой кислоты с получением 0,13 г указанного в заголовке соединения (выход 67%).
1Н ЯМР (CDCl3)δ: 13,69 (с, 1Н), 8,87 (д, 1Н), 8,77 (кв, 1Н), 8,37 (с, 1Н), 8,24 (д, 1Н), 8,06 (д, 1Н), 8,00 (д, 2Н), 7,38 (м, 1Н), 7,23 (с, 1Н), 6,58 (д, 2Н), 4,03 (д, 6Н), 3,85 (с, 6Н), 3,65 (с, 2Н), 2,95(м, 2Н), 2,81(м, 6Н)
Пример 5: Синтез изохинолин-1-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что 1-изохинолинкарбоновую кислоту использовали вместо 2-хинолинкарбоновой кислоты с получением 0,12 г указанного в заголовке соединения (выход 62%).
1Н ЯМР (CDCl3)δ: 12,76 (с, 1Н), 9,76 (д, 1Н), 8,91 (с, 1Н), 8,73 (д, 1Н), 8,37 (д, 2Н), 8,05 (с, 1Н), 8,00 (м, 1Н), 7,93 (д, 1Н), 7,86 (м, 2Н), 7,47 (д, 2Н), 6,70 (д, 2Н), 4,17 (д, 6Н), 3,96 (с, 6Н), 3,80 (с, 2Н), 3,15 (т, 2Н), 2,94 (м, 6Н)
Пример 6: Синтез хинолин-4-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что 4-хинолинкарбоновую кислоту использовали вместо 2-хинолинкарбоновой кислоты с получением 0,11 г указанного в заголовке соединения (выход 57%).
1Н ЯМР (CDCl3)δ: 11,38 (с, 1Н), 9,09 (д, 1Н), 8,74 (с, 1Н), 8,52 (д, 1Н), 8,23 (д, 1Н), 7,89 (с, 1Н), 7,79 (м, 4Н), 7,64 (т, 1Н), 7,36 (д, 2Н), 6,62 (с, 1Н), 6,65 (с, 1Н), 4,08 (с, 3Н), 4,01 (с, 3Н), 3,85 (с, 6Н), 3,67 (с, 2Н), 2,98 (т, 2Н), 2,82 (м, 6Н)
Пример 7: Синтез 4-метоксихинолин-2-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что 0,06 г 4-метокси-2-хинолинкарбоновой кислоты использовали вместо 0,05 г 2-хинолинкарбоновой кислоты с получением 0,15 г указанного в заголовке соединения (выход 76%).
1Н ЯМР (CDCl3)δ: 12,58 (с, 1Н), 8,70 (с, 1Н), 8,22 (м, 3Н), 8,04 (д, 1Н), 7,90 (с, 1Н), 7,80 (с, 1Н), 7,66 (т, 1Н), 7,56 (т, 1Н), 7,36 (д, 2Н), 6,58 (д, 2Н), 4,16 (с, 3Н), 4,04 (д, 6Н), 3,85 (с, 6Н), 3,00 (т, 2Н), 2,84 (м, 6Н)
Пример 8: Синтез хиноксалин-2-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что 2-хиноксалинкарбоновую кислоту использовали вместо 2-хинолинкарбоновой кислоты с получением 0,14 г указанного в заголовке соединения (выход 73%).
1Н ЯМР (CDCl3)δ: 12,45 (с, 1Н), 9,75 (с, 1Н), 8,65 (с, 1Н), 8,14 (м, 4Н), 7,79 (м, 3Н), 7,37 (д, 2Н), 6,54 (д, 2Н), 4,00 (д, 2Н), 3,81 (с, 6Н), 3,64 (с, 2Н), 2,98 (т, 2Н), 2,79 (м, 6Н)
Пример 9: Синтез пиридин-2-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что 0,04 г пиколиновой кислоты использовали вместо 0,05 г 2-хинолинкарбоновой кислоты с получением 0,13 г указанного в заголовке соединения (выход 73%).
1Н ЯМР (CDCl3)δ: 12,55 (с, 1Н), 8,77 (с, 1Н), 8,73 (д, 1Н), 8,35 (м, 3Н), 7,94 (т, 2Н), 7,50 (м, 3Н), 6,58 (д, 2Н), 4,03 (д, 6Н), 3,85 (д, 6Н), 3,69 (с, 2Н), 3,05 (т, 2Н), 2,84 (м, 6Н)
Пример 10: Синтез N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]никотинамида
Процедуру, описанную в примере 2, повторяли за исключением того, что 0,04 г никотиновой кислоты использовали вместо 0,05 г 2-хинолинкарбоновой кислоты с получением 0,12 г указанного в заголовке соединения (выход 67%).
1Н ЯМР (CDCl3)δ: 11,77 (с, 1Н), 9,54 (с, 1Н), 8,92 (д, 1Н), 8,78 (с, 1Н), 8,55 (д, 1Н), 8,20 (д, 2Н), 7,93 (с, 1Н), 7,60 (м, 3Н), 6,69 (д, 2Н), 4,14 (д, 6Н), 3,96 (д, 6Н), 3,79 (с, 2Н), 3,14 (т, 2Н), 2,95 (м, 6Н)
Пример 11: Синтез N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]изоникотинамида
Процедуру, описанную в примере 2, повторяли за исключением того, что 0,04 г изоникотиновой кислоты использовали вместо 0,05 г 2-хинолинкарбоновой кислоты с получением 0,12 г указанного в заголовке соединения (выход 67%).
1Н ЯМР (CDCl3)δ: 11,73 (с, 1Н), 8,86 (м, 2Н), 8,67 (с, 1Н), 8,10 (д, 2Н), 8,00 (д, 2Н), 7,83 (с, 1Н), 7,49 (д, 2Н), 6,58 (д, 2Н), 4,00 (д, 6Н), 3,85 (с, 6Н), 3,68 (с, 6Н), 3,03 (т, 2Н), 2,85 (м, 6Н)
Пример 12: Синтез пиразин-2-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что 0,04 г 2-пиразинкарбоновой кислоты использовали вместо 0,05 г 2-хинолинкарбоновой кислоты с получением 0,14 г указанного в заголовке соединения (выход 78%).
1Н ЯМР (CDCl3)δ: 12,47 (с, 1Н), 9,56 (д, 1Н), 8,83 (д, 1Н), 8,73 (с, 1Н), 8,70 (м, 1Н), 8,30 (д, 2Н), 7,93 (с, 1Н), 7,52 (д, 2Н), 6,59 (д, 2Н), 4,05 (д, 6Н), 3,86 (д, 6Н), 3,70 (2Н), 3,06 (т, 2Н), 2,85 (м,6Н)
Пример 13: Синтез N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]бензамида
Процедуру, описанную в примере 2, повторяли за исключением того, что бензойную кислоту использовали вместо 2-хинолинкарбоновой кислоты с получением 0,15 г указанного в заголовке соединения (выход 84%).
1Н ЯМР (CDCl3)δ: 11,39 (с, 1Н), 8,68 (с, 1Н), 8,15 (д, 2Н), 8,08 (д, 2Н), 7,78 (с, 1Н), 7,53 (м, 3Н), 7,42 (д, 2Н), 6,59 (с, 1Н), 6,52 (с, 1Н), 3,98 (д, 6Н), 3,82 (с, 6Н), 3,66 (с, 2Н), 2,98 (т, 2Н), 2,83 (м, 6Н)
Пример 14: Синтез нафталин-2-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что 0,06 г 2-нафтойной кислоты использовали вместо 0,05 г 2-хинолинкарбоновой кислоты с получением 0,15 г указанного в заголовке соединения (выход 77%).
1Н ЯМР (CDCl3)δ: 11,65 (с, 1Н), 8,79 (с, 1Н), 8,69 (с, 1Н), 8,23 (д, 1Н), 8,11 (д, 2Н), 7,97 (м, 3Н), 7,60 (м, 2Н), 7,44 (м, 3Н), 6,62 (с, 1Н), 6,56 (с, 1Н), 4,08 (с, 3Н), 4,03 (с, 3Н), 3,86 (с, 6Н), 3,69 (с, 2Н), 3,03 (т, 2Н), 2,85 (м, 6Н)
Пример 15: Синтез N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]-2-фторбензамида
Процедуру, описанную в примере 2, повторяли за исключением того, что 2-фторбензойную кислоту использовали вместо 2-хинолинкарбоновой кислоты с получением 0,12 г указанного в заголовке соединения (выход 66%).
1Н ЯМР (CDCl3)δ: 11,23 (с, 1Н), 8,58 (с, 1Н), 8,08 (м, 3Н), 7,84 (с, 1Н), 7,52 (м, 1Н), 7,44 (д, 2Н), 7,32 (т, 1Н), 7,23 (м, 1Н), 6,62 (с, 1Н), 6,55 (с, 1Н), 4,03 (д, 6Н), 3,85 (с, 6Н), 3,67 (с, 2Н), 3,01 (т, 2Н), 2,85 (м, 6Н)
Пример 16: Синтез N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]-3-фторбензамида
Процедуру, описанную в примере 2, повторяли за исключением того, что 3-фторбензойную кислоту использовали вместо 2-хинолинкарбоновой кислоты с получением 0,02 г указанного в заголовке соединения (выход 11%).
1Н ЯМР (CDCl3)δ: 11,57 (с, 1Н), 8,76 (с, 1Н), 8,17 (д, 2Н), 8,03 (д, 1Н), 7,94 (д, 2Н), 7,58 (м, 3Н), 7,37 (м, 1Н), 6,69 (с, 1Н), 6,62 (с, 1Н), 4,15 (д, 6Н), 3,92 (с, 6Н), 3,75 (с, 2Н), 3,10 (т, 2Н), 2,91 (м, 6Н)
Пример 17: Синтез N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]-4-фторбензамида
Процедуру, описанную в примере 2, повторяли за исключением того, что 4-фторбензойную кислоту использовали вместо 2-хинолинкарбоновой кислоты с получением 0,13 г указанного в заголовке соединения (выход 70%).
1Н ЯМР (CDCl3)δ: 11,41 (с, 1Н), 8,60 (с, 1Н), 8,12 (м, 2Н), 8,06 (д, 2Н), 7,76 (с, 1Н), 7,48 (д, 2Н), 7,19 (т, 2Н), 6,59 (с, 1Н), 6,51 (с, 1Н), 3,98 (д, 6Н), 3,82 (с, 6Н), 3,68 (с, 2Н), 3,03 (т, 2Н), 2,84 (м, 6Н)
Пример 18: Синтез N-[2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]-3,4-дифторбензамида
Процедуру, описанную в примере 2, повторяли за исключением того, что 0,06 г 3,4-дифторбензойной кислоты использовали вместо 0,05 г 2-хинолинкарбоновой кислоты с получением 0,12 г указанного в заголовке соединения (выход 63%).
1Н ЯМР (CDCl3)δ: 11,53 (с, 1Н), 8,65 (с, 1Н), 8,10 (д, 2Н), 7,98 (м, 1Н), 7,90 (м, 1Н), 7,84 (с, 1Н), 7,49 (д, 2Н), 7,35 (д, 1Н), 6,62 (с, 1Н), 6,55 (с, 1Н), 4,03 (д, 6Н), 3,85 (с, 6Н), 3,68 (с, 2Н), 3,04 (т, 2Н), 2,85 (м, 6Н)
Пример 19: Синтез тиофен-3-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что 3-тиофенкарбоновую кислоту использовали вместо 2-хинолинкарбоновой кислоты с получением 0,10 г указанного в заголовке соединения (выход 55%).
1Н ЯМР (CDCl3)δ: 11,43 (с, 1Н), 8,63 (с, 1Н), 8,21 (д, 1Н), 8,08 (д, 2Н), 7,76 (с, 1Н), 7,74 (с, 1Н), 7,48 (д, 2Н), 7,38 (м, 1Н), 6,61 (с, 1Н), 6,54 (с, 1Н), 3,99 (д, 6Н), 3,83 (с, 6Н), 3,67 (с, 2Н), 3,02 (т, 2Н), 2,83 (м, 6Н)
Пример 20: Синтез фуран-3-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что 0,04 г 3-фуранкарбоновой кислоты использовали вместо 0,05 г 2-хинолинкарбоновой кислоты с получением 0,11 г указанного в заголовке соединения (выход 62%).
1Н ЯМР (CDCl3)δ: 11,32 (с, 1Н), 8,64 (с, 1Н), 8,22 (с, 1Н), 8,11 (д, 2Н), 7,78 (с, 1Н), 7,51 (м, 3Н), 7,03 (д, 1Н), 6,62 (с, 1Н), 6,55 (с, 1Н), 4,01 (д, 6Н), 3,85 (с, 6Н), 3,68 (с, 2Н), 3,04 (т, 2Н), 2,85 (м, 6Н)
Пример 21: Синтез 4-оксо-4Н-хромен-2-карбоновой кислоты [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}-2Н-тетразол-5-ил)-4,5-диметоксифенил]амида
Процедуру, описанную в примере 2, повторяли за исключением того, что 0,07 г хромон-2-карбоновой кислоты использовали вместо 0,05 г 2-хинолинкарбоновой кислоты с получением 0,16 г указанного в заголовке соединения (выход 80%).
1Н ЯМР (CDCl3)δ: 12,63 (с, 1Н), 8,76 (с, 1Н), 8,37 (д, 1Н), 8,27 (