Водорастворимая лекарственная композиция и способ ее получения
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам и касается водорастворимой лекарственной композиции с повышенной фармакологической активностью, состоящей из малорастворимых в воде лекарственных субстанций в виде водорастворимых межмолекулярных комплексов с арабиногалактаном в соотношении от 1:5 до 1:20 по весу соответственно. Также раскрыт способ получения водорастворимой лекарственной композиции, включающий смешение арабиногалактана с порошкообразной лекарственной субстанцией. Композиции по изобретению обладают повышенной растворимостью, что позволяет повысить активность лекарственных средств, уменьшить их дозы и снизить побочные эффекты. 2 н. и 2 з.п. ф-лы, 10 ил., 6 табл.
Реферат
Изобретение относится к медицине и промышленности производства лекарственных препаратов, в частности к способу получения водорастворимых форм малорастворимых лекарственных субстанций, имеющему цели повышения базовой фармакологической активности, снижения дозы и создания высокоэффективных лекарственных средств с минимальным побочным действием.
Среди известных способов получения водорастворимых форм лекарственных препаратов выделяются способы, основанные на образовании комплексов с водорастворимыми природными олиго- и полисахаридами, например декстранами, инулином, мальтодекстрином и циклодекстрином. Так, в патенте [1] описано получение комплексов антибиотиков с водорастворимыми природными полисахаридами -декстранами, инулином и мальтодекстрином. Способ получения включает в себя смешение растворов антибиотиков и полисахаридов и последующую сушку с выделением сухого аддукта. Биологические испытания показали повышенную антимикробную активность продуктов сочетания использованных антибиотиков и полисахаридов. По мнению авторов, патента как в твердом виде, так и растворах имеет место образование комплексов антибиотиков с полисахаридами, связанных нековалентными и неионными связями. Однако какие-либо физико-химические данные, обосновывающие свои заключения, авторы не приводят.
Широкое распространение получили способы повышения растворимости в воде малорастворимых лекарственных субстанций, основанные на образовании межмолекулярных комплексов с циклодекстринами, чаще всего с β-циклодекстрином. Молекулы циклодекстринов имеют тороидальную форму, причем ее внутренняя полость гидрофобна. Водорастворимые межмолекулярные комплексы липофильных органических соединений образуются в растворе за счет интеркаляции их молекул в эту полость. Известны комплексы β-циклодекстрина с нестероидными противовоспалительными средствами (парацетамол, ибупрофен, кетопрофен, флуфенамовая и мефенамовая кислоты и др.), стероидами, простагландинами и простациклинами, барбитуратами, сульфонамидами, сердечными гликозидами и другими препаратами [2].
Аналогом нашего изобретения является патент [3]. В нем описано получение и использование водорастворимых комплексов включения малорастворимых липофильных лекарственных веществ - половых гормонов с производными циклодекстрина. Комплексы получают в растворе с последующим высушиванием до твердого сухого материала. В патенте приведены примеры повышения растворимости ряда биологически активных субстанций за счет комплексообразования с циклодекстринами.
Еще одним аналогом нашего изобретения является исследование [4], посвященное изучению комплексов включения ацетаминофена (парацетамола) и альфа- и бета- циклодестринов, а также микрокристаллической целлюлозы, получаемых путем обработки смесей компонентов в керамической шаровой мельнице. Авторы отмечают падение степени кристалличности веществ по мере увеличения длительности обработки, что связывают с образованием межмолекулярных комплексов. Однако в этих же условиях комплексы включения не образуются с индометацином, диазепамом, гидрокортизоном и т.д. из-за геометрических затруднений их интеркаляции в гидрофобную полость циклодекстринов [5]. Кроме того, в работах [4, 5] отсутствуют данные по биологической активности получаемых комплексов.
Наиболее близким аналогом, выбранным в качестве прототипа нашего изобретения, является патент [6]. В нем также использовано образование комплексов биологически активного соединения инсектицида пиперонилбутоксида с циклодекстрином для улучшения растворимости в воде. В патенте отмечается, что повышенная растворимость улучшает проникновение через биологические мембраны вследствие увеличения действующей концентрации пиперонилбутоксида в растворе. Вследствие этого требуемое биологическое действие ускоряется и усиливается и может достигаться при меньшем количестве биологически активного вещества. Также приводятся данные биологических испытаний - летальность насекомых - подтверждающие достижение требуемого биологического эффекта при меньших дозировках инсектицида, используемого в виде комплексов с циклодекстрином. Комплексы пиперонилбутоксида с циклодекстринами также получают путем смешения растворов компонент и последующего удаления растворителей.
Недостатками указанных способов повышения растворимости и фармакологической эффективности за счет образования водорастворимых комплексов являются:
- недостаточная информация о увеличении фармакологической эффективности;
- необходимость использования поли- и олигосахаридов (в частности, циклодекстринов), требующих организации специального биосинтетического производства и обладающих к тому же относительно высокой токсичностью;
- недостаточно высокая водорастворимость описанных комплексов циклодекстринов и полисахаридов с лекарственными веществами;
- ограничение круга лекарственных веществ, способных образовывать комплексы, геометрическими параметрами молекул циклодекстринов;
- несовершенные жидкофазные методы получения комплексов, заключающиеся в предварительном растворении или плавлении компонент и последующем выделении образовавшихся комплексов, недостатком которых является частичное разложение веществ, трудности подбора растворителей, растворяющих одновременно все компоненты, значительная продолжительность процесса, необходимость использования дорогостоящего технологического оборудования и зачастую утилизации отходов использованных растворителей.
Задачей настоящего изобретения является повышение фармакологической активности малорастворимых в воде лекарственных субстанций путем использования их в виде водорастворимых комплексов с арабиногалактаном, а также разработка способа получения таких комплексов, обладающих следующими преимуществами:
- использование доступного и дешевого комплексообразователя, способного связывать лекарственные препараты в комплексы, обладающие уровнем растворимости в воде, обеспечивающим улучшение фармакологических свойств лекарственных препаратов;
- повышение активности лекарственных веществ;
- уменьшение дозы лекарственного вещества, необходимого для достижения базового фармакологического действия;
- уменьшение побочных эффектов лекарственных препаратов;
- обеспечение возможности получения комплексов не зависимо от растворимости исходных веществ, а также их химической стабильности в растворах и расплавах;
- сокращение числа технологических операций при получении водорастворимых композиций за счет упрощения технологической аппаратуры;
- повышение производительности;
- снижение себестоимости лекарственных средств.
Конечным техническим результатом является создание лекарственных средств с улучшенными токсико-фармакологическими характеристиками и пониженной себестоимостью.
В основу настоящего изобретения положено обнаруженное нами явление повышения растворимости малорастворимых лекарственных субстанций за счет образования их водорастворимых комплексов с природным растительным полисахаридом арабиногалактаном и способ их получения в твердой фазе путем механической обработки их порошкообразных смесей интенсивными механическими воздействиями.
Поставленная задача решается использованием для комплексообразования лекарственных препаратов полисахарида арабиногалактана. Арабиногалактан является полисахаридным метаболитом эндемиков сибирской лесной флоры лиственницы сибирской (Larix sibirica) и лиственницы Гмелина (Larix Gmelinii) и легко выделяется из древесины указанных деревьев. Содержание арабиногалактана составляет до 15% от веса сухой древесины. Необходимо подчеркнуть, что оба вида лиственницы являются главными составляющими лесных массивов Восточной Сибири. Выделение и очистка арабиногалактана производится по простой технологии. Для выделения арабиногалактана могут быть использованы отходы лесосеки, лесопиления, целлюлозно-бумажной промышленности. Таким образом, арабиногалактан по своей доступности не имеет конкурентов среди природных и биосинтетических полисахаридов [7-10].
Химически арабиногалактан представляет собой полисахарид гребенчатого строения с м.м. 9-18 кД. Главная цепь состоит из звеньев галактозы, боковые цепи - из звеньев арабинозы и галактозы. Эта особенность строения, по нашему мнению, может способствовать образованию прочных межмолекулярных комплексов лекарственных препаратов, молекулы которых вероятнее всего связываются межмолекулярными водородными связями в пространстве, образованном боковыми цепями. Учитывая конформационную подвижность макромолекул арабиногалактана, это пространство может варьироваться, способствуя образованию межмолекулярных комплексов с широким кругом веществ. Кроме того, возможно образование комплексов различного стехиометрического состава, когда одна молекула арабиногалактана может связываться с несколькими молекулами других органических соединений - лекарственных веществ, позволяя изменять соотношения этих компонентов в широких пределах. В этом состоят преимущества арабиногалактана как комплексообразователя, по сравнению с обычно используемыми для этих целей циклодекстринами. Предусматривается использование комплексов, преимущественно содержащих 5-20% весовых субстанций лекарственных препаратов и 80-95% весовых очищенного арабиногалактана.
Поставленная задача решается также заявляемым способом получения водорастворимой лекарственной композиции, включающим смешение комплексообразователя с исходной порошкообразной лекарственной субстанцией, при этом в качестве комплексообразователя используют арабиногалактан, смесь малорастворимой в воде лекарственной субстанции с арабиногалактаном подвергают механической обработке.
Предпочтительно механическую обработку проводят путем ударно-истирающих воздействий.
Предпочтительно малорастворимую в воде лекарственную субстанцию и арабиногалактан берут соотношении от 1:5 до 1:20 по весу соответственно.
Предпочтительно смесь малорастворимой в воде лекарственной субстанции и арабиногалактана подвергают обработке путем ударно-истирающих механических воздействий до исчезновения кристаллической фазы лекарственной субстанции.
В нашем изобретении для получения комплексов использован механохимический подхода, заключающийся в обработке смеси твердых компонентов интенсивными механическими воздействиями - давлением и сдвиговыми деформациями, реализуемыми в экструдерах, а также преимущественно в различного типа мельницах, осуществляющих ударно-истирающие воздействия на вещества [11].
Смесь малорастворимых лекарственных веществ и арабиногалактана, взятых преимущественно в соотношениях от 1:5 до 1:20 по весу, подвергается механической обработке предпочтительно в шаровых мельницах, в частности планетарных. Однако для механической обработки также возможно использование аппаратов, реализующих длительное (не импульсное) воздействие высокого давления и сдвиговой деформации, - экструдеров. В процессе механической обработки происходит диспергирование молекул лекарственных веществ из «начального» кристаллического состояния в избыток твердой матрицы арабиногалактана, тем самым образуя твердый раствор, представляющий собой разупорядоченную твердую фазу, в которой молекулы лекарственного вещества (ЛВ) и арабиногалактана испытывают нековалентные неионные взаимодействия - аналогичные вышеуказанным взаимодействиям при комплексообразовании в растворе. Во время растворения этой твердой дисперсии, высвобождение лекарственного вещества происходит в виде его комплексов.
Процессы растворения и комплексообразования малорастворимых ЛВ могут быть описаны схемами 1 и 2
равновесие по схеме 2 описывается уравнением 3:
где ЛВтв - твердая кристаллическая фаза лекарственного вещества, находящаяся в равновесии с раствором; ЛВрр - лекарственное вещество, находящееся в растворе в свободном виде; АГрр - арабиногалактан в растворе в свободном виде; (ЛВ·АГ)рр - комплекс арабиногалактана и лекарственного вещества в растворе; Кк - константа нестойкости образования межмолекулярного комплекса.
Величина [ЛВрр] соответствует равновесному (термодинамическому) значению растворимости в отсутствие комплексующего агента. При комплексообразовании общая концентрация ЛВ в растворе будет равна сумме концентраций свободного ЛВ и ЛВ, находящегося в составе комплексов. Таким образом, увеличение концентрации ЛВ в растворе Слв в присутствии комплексообразователя будет:
При этом ЛВ в растворе и в составе комплексов находятся в динамическом равновесии по схеме 2. Применительно к фармакологическому эффекту, можно предположить, что при метаболизме ЛВ или связывании его специфическими рецепторами концентрация его не связанных молекул будет восполняться путем диссоциации комплексов. Фактически, в растворе будет существовать «депо» ЛВ, обеспечивающее повышенный фармакологический эффект. Применительно к оральному пути введения, комплексообразование обеспечивает более эффективное высвобождение малорастворимых ЛВ из твердых лекарственных форм, кроме того, в этом случае возможна абсорбция в кровоток непосредственно комплекса ЛВ с арабиногалактаном, что может служить дополнительными факторами повышения эффективности ЛВ. Таким образом, достигаются заявленные преимущества состава композиций - повышается биодоступность ЛВ, для достижения одного и того же фармакологического эффекта требуется меньшая доза, что влечет за собой снижение нежелательных побочных эффектов.
Достигаемая суммарная концентрация ЛВ в растворе определяется в этом случае уравнением 4 и значительно превышает равновесную (с его кристаллической фазой) растворимость ЛВ. Скорость высвобождения ЛВ определяется скоростью растворения матрицы арабиногалактана и, учитывая его высокую растворимость, значительно превышает скорость растворения ЛВ из его кристаллической фазы. Процесс молекулярного диспергирования при механической обработке контролируется рентгенофазовым и термическим анализами - по уменьшению интенсивности и исчезновению соответствующих рефлексов или эндотермических пиков плавления кристаллической фазы ЛВ. Полученные заявляемым способом твердые дисперсии (порошки) могут подвергаться дальнейшим «сухим» технологическим операциям производства лекарственных средств - смешению с вспомогательными веществами, гранулированию, таблетированию и т.д. Таким образом, достигаются заявленные преимущества способа получения - приготовление происходит в одну технологическую стадию механической обработки на мельницах или экструдерах, отсутствуют ограничения по совместной растворимости компонентов, не требуется участия жидких фаз, исключается энергоемкий и длительный процесс сушки материала, отсутствуют отходы растворителей.
В исследованных нами системах достигаемая суммарная концентрация ЛВ в водном растворе в присутствии комплексообразователя значительно превышает равновесную (с его кристаллической фазой) растворимость ЛВ. При этом не происходит заметных, в пределах точности анализов ВЭЖХ, химических превращений ЛВ. Наибольшая прочность межмолекулярных комплексов и их водорастворимость (величина Слв и Кк) достигается при заявленном механохимическом пути их получения (см. таблица 1). Этот факт является неожиданным техническим результатом, не следующим из ранее опубликованных работ. Кроме того, обнаруженный факт значительного повышения растворимости ЛВ при механохимическом получении комплексов (в 2-9 раз) присущ именно полисахариду арабиногалактану и согласно литературным данным неизвестен или отсутствует для других комплексообразователей, в частности для бета-циклодекстрина.
В качестве аппаратов для механической обработки могут использоваться экструдеры, в которых механическое действие носит протяженный во времени характер, а также преимущественно шаровые валковые, планетарные, вибрационные, виброцентробежные и т.д. мельницы, обладающие ударно-истирающим воздействием. Возможно использование мелющих тел, отличных от шаров, например стрежней. Процесс масштабируется от шаровых лабораторных мельниц с загрузкой в несколько грамм до проточных виброцентробежных мельниц с производительностью до 100 кг/ч и более [12]. Отсутствуют специальные требования к контролю влажности помещений, так как вещества обрабатываются в герметичном внутреннем объеме мельниц. Во всех случаях процесс проводится фактически в одну стадию, не требует дорогостоящего оборудования и прост в реализации. Конкретные параметры технологических процессов зависят от физико-химических и физико-механических свойств используемых компонентов.
Эффективность способа демонстрируется образованием водорастворимых комплексов арабиногалактана с малорастворимыми в воде субстанциями транквилизаторов бенздиазепинового ряда сибазоном и мезапамом, нейролептиком азалептином и нестероидным противовоспалительным средством индометацином. Арабиногалактаны представляют собой не циклическую линейно-разветвленную цепь глюкозидных остатков и вышеописанная модель образования межмолекулярных комплексов включения с циклодекстринами для них не применима. До наших исследований было известно использование арабиногалактана для конъюгации [8] с различными лекарственными веществами путем их химического взаимодействия с образованием ковалентных или ионных связей. В литературе отсутствовали данные об исследованиях, было известно использование арабиногалактана для конъюгации [8] с различными лекарственными веществами путем их химического взаимодействия с образованием ковалентных или ионных связей. В литературе отсутствовали данные о возможном комплексообразовании арабиногалактанов и липофильных малорастворимых органических соединений - лекарственных субстанций - за счет слабых нековалентных неионных взаимодействий. Таким образом, обнаруженное нами явление повышения растворимости малорастворимых ЛВ за счет комплексообразования с арабиногалактаном также отвечает критерию новизны.
| Таблица 1 | ||
| Весовые соотношения ЛВ/арабиногалактан | Увеличение растворимости лекарственных веществ в воде, раз | |
| Без м/а* | Смесь м/а в планетарной мельнице** | |
| Сибазон 1/10 | 1,2 | 2,4 |
| Азалептин 1/10 | 4,4 | 20,5 |
| Мезапам 1/10 | 4,9 | 19,1 |
| Индометацин 1/10 | 1,1 | 9,9 |
| * - межмолекуляные комплексы, образовавшиеся в растворе; | ||
| ** - межмолекулярные комплексы, полученные механохимическим путем. |
В наших экспериментах во всех случаях достигалась величина Слв>>1, что подтверждало высокую активность арабиногалактана как комплексообразователя. Слв определялась методом ВЭЖХ и возрастала с уменьшением массовой доли ЛВ в композициях в соответствии с уравнением 4. Увеличение содержания ЛВ в композиции свыше 20 вес.% не позволяло получать однородную твердую молекулярную дисперсию ЛВ в арабиногалактане и снижало скорость его высвобождения. С другой стороны, уменьшение содержания ЛВ ниже 5 вес.% затрудняет контроль содержания его кристаллической фазы в механически обработанных смесях из-за ограничений чувствительности методов рентгеноструктурного и термического анализов. Однако указанные интервалы весовых соотношений являются преимущественными, но не необходимыми. В принципе, эффект увеличения растворимости малорастворимого ЛВ будет достигаться как при увеличении, так и при уменьшении его относительного содержания за пределы вышеуказанных соотношений. Аналогично, преимущественным критерием является исчезновение кристаллической фазы лекарственной субстанции за счет диспергирования ее молекул в матрице арабиногалактана, что способствует ее ускоренному высвобождению в раствор. Неполное диспергирование (остаток кристаллической фазы) может привести только к уменьшению скорости растворения, однако и в этом случае будет также достигаться целевой эффект увеличения его растворимости.
Фармакологические испытания полученных комплексов на лабораторных животных - мышах - показали, что для получения одинакового по сравнению с исходным ЛВ специфического фармакологического действия (седативный, противовоспалительный эффект и т.д.) требовалась в несколько раз меньшая доза ЛВ.
Таким образом, перевод малорастворимых лекарственных субстанций в водорастворимую форму путем образования комплексов с арабиногалактаном, получаемым из древесины лиственниц сибирской и Гмелина, и разработка механохимического твердофазного способа их получения обеспечивают получение следующих заявленных преимуществ:
- снижение (не менее 10-кратное) терапевтической дозы при сохранении базовой фармакологической активности;
- снижение побочных эффектов, например ульцерогенности у нестероидных противовоспалительных средств;
- повышение прочности комплексообразования и растворимости лекарственных веществ;
- упрощение технологии производства и снижение себестоимости лекарственных препаратов.
Настоящее изобретение иллюстрируется следующими примерами
Пример 1. Получение комплексов индометацина и арабиногалактана.
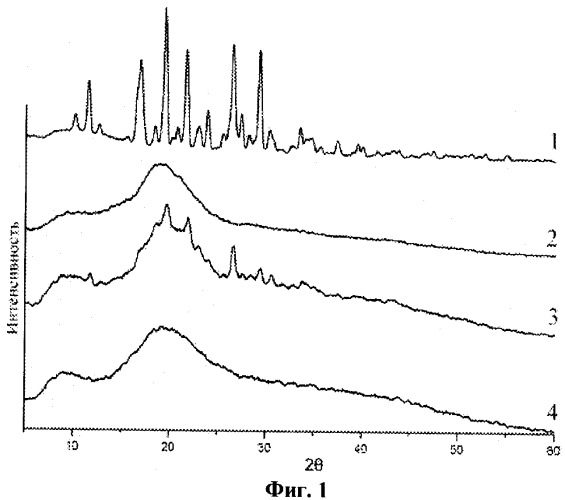
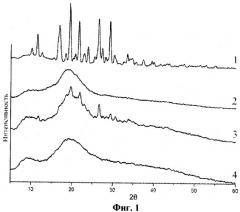
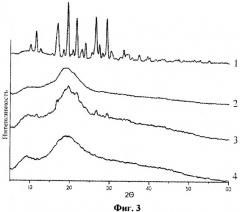
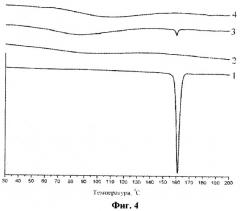
0,25 г индометацина (1-(парахлорбензоил)-5-метокси-2-метилиндол-3-уксусная кислота) и 2,5 г арабиногалактана (весовое соотношение 1:10) обрабатываются в планетарной центробежной мельнице АГО-2 в течение 10 минут при ускорении мелющих тел 60 g. Порошок выгружается и анализируется. На фиг.1 приведены рентгенограммы исходных индометацина (1), арабиногалактана (2), а также смеси индометацина и арабиногалактана 1:10 до (3) и после (4) механической обработки в мельнице АГО-2. На фиг.2 приведены термограммы ДСК исходных индометацина (1), арабиногалактана (2), а также смеси индометацина и арабиногалактана 1:10 до (3) и после (4) механической обработки в мельнице АГО-2. В необработанной смеси наблюдаются характерные для кристаллической фазы индометацина рефлексы рентгенограмм и фазовый переход плавления, исчезающие после механической обработки. Из этих данных следует, что в механически обработанной смеси исчезают характерные следы кристаллической фазы индометацина - происходит его молекулярное диспергирование в избыток твердой фазы арабиногалактана. Аналогичные изменения происходят в смеси 0,125 г индометацина с 2,5 г арабиногалактана (весовое соотношение 1:20), см. фиг.3 (рентгенограммы исходных индометацина (1), арабиногалактана (2), а также смеси индометацина и арабиногалактана 1:20 до (3) и после (4) механической обработки в мельнице АГО-2) и фиг.4 (термограммы ДСК исходных индометацина (1), арабиногалактана (2), а также смеси индометацина и арабиногалактана 1:20 до (3) и после (4) механической обработки в мельнице АГО-2). Увеличение содержания ЛВ в насыщенном растворе Слв, определенное с помощью ВЭЖХ, составляет 9,75 и 17,0 для первого и второго составов дисперсий.
Пример 2. Исследование противовоспалительного действия комплексов индометацина и арабиногалактана в весовых соотношениях 1:10 и 1:20 на модели каррагенинового воспаления.
Противовоспалительную активность комплексов (1:10 и 1:20) исследовали на белых беспородных мышах массой 20-25 г на модели каррагенинового воспаления (1,5% раствор вводили апоневроз по 0,05 мл), в сравнении с эталонным препаратом - индометацином. Чистый индометацин, а также оба его комплекса вводили внутрижелудочно через час после воспроизведения воспаления в общей дозе 75 мг/кг. При этом доза индометацина составляла 75 мг/кг, 7,5 мг/кг и 3,75 мг/кг для эталонного индометацина и его комплексов с арабиногалактаном 1:10 и 1:20 соответственно. Результаты исследований представлены в таблице 2.
| Таблица 2Сравнительная противовоспалительная активность эталонного индометацина и его комплексов с арабиногалактаном в соотношениях 1:10 и 1:20. | ||||
| Контроль, каррагенин | Индометацин 75 мг + каррагенин | Индометацин 10 мг + каррагенин | Комплекс 1:10, индометацина 7,5 мг/кг + каррагенин | Комплекс 1:20, индометацина 3,75 мг/кг + каррагенин |
| Индекс отека (%) | ||||
| 61,0±5,7 | 33,1±2,9* | 53,1±1,4* | 35,5±3,1* | 33,2±4,3* |
| * - значение Р<0.05, что свидетельствует о достоверном отличии от показателей контрольной группы. |
Установлено, что при снижении дозы индометацина в 10 и 20 раз относительно его эталонной дозы противовоспалительная активность индометацина сохраняется высокой.
Эксперименты по выявлению одного из побочных эффектов нестероидных противовоспалительных средств - степени деструктивных поражений слизистой желудка (ульцерогенности) для комплексов, содержащих индометацин, были проведены на крысах линии Вистар массой 200-220 г в сравнении с индометацином.
Все агенты и эталон сравнения вводили животным однократно натощак внутрижелудочно и через 18 часов умерщвляли под эфирным наркозом, извлекали желудки и подсчитывали количество деструктивных поражений слизистой желудка.
Оба комплекса вводили в дозе 75 мг/кг, где доза индометацина составляла 7,5 и 3,75 мг; эталонный индометацин в терапевтических дозах 25 и 75 мг/кг. Было показано, что снижение дозы индометацина в комплексах позволило уменьшить по сравнению с эталоном количество деструктивных поражений слизистой желудка в 2 раза, но сохранить в малых дозах высокую базовую противовоспалительную активность индометацина.
Пример 3. Получение комплексов сибазона и арабиногалактана.
0,25 г сибазона (7-хлор-2,3-дигидро-1-метил-5-фенил-1Н-1,4-бензодиазепин-2-он) и 2,5 г арабиногалактана (весовое соотношение 1:10) обрабатываются в планетарной центробежной мельнице АГО-2 в течение 10 минут при ускорении мелющих тел 60 g. Порошок выгружается и анализируется. На фиг.5 приведены рентгенограммы исходных сибазона (1), арабиногалактана (2), а также смеси сибазона и арабиногалактана 1:10 до (3) и после (4) механической обработки в мельнице АГО-2. На фиг.6 представлены термограммы ДСК исходных сибазона (1), арабиногалактана (2), а также смеси сибазона и арабиногалактана 1:10 до (3) и после (4) механической обработки в мельнице АГО-2. В необработанной смеси наблюдаются характерные для кристаллической фазы сибазона рефлексы рентгенограмм и фазовый переход плавления, исчезающие после механической обработки. Из этих данных следует, что в механически обработанной смеси исчезают характерные следы кристаллической фазы сибазона - происходит его молекулярное диспергирование в избыток твердой фазы арабиногалактана. Аналогичные изменения происходят в смеси 0,125 г сибазона с 2,5 г арабиногалактана (весовое соотношение 1:20). Увеличение содержания ЛВ в насыщенном растворе Слв, определенное с помощью ВЭЖХ, составляет 2,4 и 3,0 для первого и второго составов дисперсий.
Пример 4. Изучение анксиолитического действия комплекса арабиногалактан:сибазон в весовом соотношении 1:10 в тесте «открытое поле».
Комплекс 1:10 в дозах 25 и 2,5 мг/кг, эталон сравнения сибазон - в дозе 2,5 мг/кг вводили однократно внутрижелудочно за час до тестирования животных. Дозы сибазона в используемом комплексе 1:10 составляли 2,5 и 0,25 мг/кг. Эффект оценивался по изменению количества различных видов движений и общего эмоционального состояния животных на приборе фирмы TruScan (США). Результаты представлены в таблице 3.
| Таблица 3Показатели двигательной активности мышей после введения эталонных препаратов и комплекса арабиногалактана с сибазоном 1:10. | ||||
| Группа | Контроль | Сибазон 2,5 мг/кг | Комплекс 1:10; 25 мг/кг (доза сибазона 2,5 мг/кг) | Комплекс 1:10; 2,5 мг/кг (доза сибазона 0,25 мг/кг) |
| А | 13,0±1,0 | 10,3±0,7 | 7,3±1,1** | 11,2±1,1 |
| Б | 102,1±1,4 | 107,0±2,1 | 111,3±1,1** | 105,9±1,7 |
| В | 17,8±1,4 | 13,0±2,1 | 8,7±1,1** | 11,0±0,5 |
| Г | 311,9±26,6 | 385,5±38,1* | 366,2±21,5* | 256,0±11,3 |
| Д | 2,6±0,2 | 3,2±0,3* | 3,0±0,2* | 2,1±0,1 |
| Е | 3,9±0,4 | 7,0±1,2* | 6,7±1,3 | 5,3±1,0 |
| Ж | 5,0±0,4 | 8,0±1,1* | 8,8±1,3* | 7,1±1,4 |
| З | 2,4±0,4 | 0,0±0,0 | 0,0±0,0 | 0,5±0,01* |
| *Р<0,05; **Р<0,005 достоверность по сравнению с контрольной группой;А - общая двигательная активность(кол-во актов); Б - двигательная активность (с);В - неподвижный момент (иммобильность, с); Г - дистанция движения (см);Д - скорость движения (см/с); Е - количество исследованных отверстий;Ж - время исследовательских реакций (с); З - количество вертикальных вставаний. |
Установлено, что комплексообразование с арабиногалактаном способствует: во-первых, усилению анксиолитического (транквилизирующего) эффекта сибазона, проявляющегося в уменьшении количества актов двигательной активности и времени иммобильности; во-вторых, снижению в 10 раз его дозы с сохранением базовой (транквилизирующей) активности сибазона.
Пример 5. Получение комплексов мезапама и арабиногалактана.
0,25 г мезапама (7-хлор-2,3-дигидро-1-метил-5-фенил-1Н-1,4-бензодиазепин) и 2,5 г арабиногалактана (весовое соотношение 1:10) обрабатываются в планетарной центробежной мельнице АГО-2 в течение 10 минут при ускорении мелющих тел 60 g. Порошок выгружается и анализируется. Рентгенограммы исходных мезапама (1), арабиногалактана (2), а также смеси мезапама и арабиногалактана 1:10 до (3) и после (4) механической обработки в мельнице АГО-2 представлены на фиг.7. На фиг.8 представлены термограммы ДСК исходных мезапама (1), арабиногалактана (2), а также смеси мезапама и арабиногалактана 1:10 до (3) и после (4) механической обработки в мельнице АГО-2. В необработанной смеси наблюдаются характерные для кристаллической фазы мезапама рефлексы рентгенограмм, исчезающие после механической обработки. Из этих данных следует, что в механически обработанной смеси исчезают характерные следы кристаллической фазы мезапама - происходит его молекулярное диспергирование в избыток твердой фазы арабиногалактана. Аналогичные изменения происходят в смеси 0,125 г мезапама с 2,5 г арабиногалактана (весовое соотношение 1:20). Увеличение содержания ЛВ в насыщенном растворе Слв, определенное с помощью ВЭЖХ, составляет 19,0 и 47,0 для первого и второго составов дисперсий.
Пример 6. Изучение анксиолитического действия комплексов арабиногалактан:мезапам в весовых соотношениях 1:10 и 1:20 в тесте «открытое поле».
Комплексы 1:10 и 1:20 в дозе 10 мг/кг, эталон сравнения мезапам - в дозах 1 и 10 мг/кг вводили однократно внутрижелудочно за час до тестирования животных. Количество мезапама в комплексах 1:10 и 1:20 составляло 1,0 и 0,5 мг/кг.
Эффект оценивался по изменению количества различных видов движений и общего эмоционального состояния животных на приборе фирмы TruScan (США). Результаты представлены в таблицах 4 и 5.
| Таблица 4Показатели двигательной активности мышей после введения эталонных препаратов и комплексов мезапама с арабиногалактаном в весовых соотношениях 1:10 и 1:20. | |||||
| Группа | Контроль | Мезапам 10 мг/кг | Мезапам 1 мг/кг | Комплекс 1:10, 10 мг/кг (доза мезапама 1 мг/кг) | Комплекс 1:20, 10 мг/кг (доза мезапама 0,5 мг/кг) |
| А | 13,5±0,7 | 10,3±0,7* | 9,9±0,6 | 13,1±1,2 | 11,6±1,3 |
| Б | 100,8±1,3 | 106,5±0,9* | 106,6±0,9 | 103±1,9 | 104,4±2,5 |
| В | 17,1±1,7 | 13,5±1,5* | 13,4±1,3 | 16,3±1,9 | 15,6±2,5 |
| Г | 293,5±21,9 | 472,5±21,3** | 355,4±25,2 | 390,4±23,9 | 307,9±12,7 |
| Д | 2,4±0,2 | 4,2±0,2** | 2,9±0,2 | 3,2±0,2* | 2,5±0,1 |
| Е | 3,1±0,7 | 3,9±0,4 | 3,9±0,6 | 8,0±1,0** | 8,5±1,0* |
| Ж | 3,6±0,9 | 4,6±0,5 | 4,0±0,5 | 9,1±1,1** | 10,5±1,4* |
| З | 1,5±0,1 | 1,1±0,3 | 1,1±0,3 | 3,1±1,1 | 1,4±0,5 |
| *Р<0,05; ** Р<0,005 достоверность по сравнению с контрольной группой;А - общая двигательная активность(кол-во актов); Б - двигательная активность (с);В - неподвижный момент (иммобильность, с); Г - дистанция движения (см);Д - скорость движения (см/с); Е - количество исследованных отверстий;Ж - время исследовательских реакций (с); З - количество вертикальных вставаний. |
| Таблица 5 | |||||
| Группа | А | Б | В | Г | Д |
| Контроль | 184,3±18,7 | 86,5±5,7 | 72,9±12,0 | 33,50±5,7 | 8,9±1,1 |
| Мезапам 10 мг/кг | 234,1±32,1 | 81,13±4,6 | 91,1±13,5 | 38,9±4,6 | 11,00±1,0 |
| Комплекс 1:10, 10 мг/кг (кол-во мезапама 1 мг/кг) | 154,5±21,8 | 75,8±4,5 | 100,1±10,4 | 44,3±4,5 | 10,5±0,8 |
| Комплекс 1:20, 10 мг/кг (кол-во мезапама 0,5 мг/кг) | 127,8±11,6* | 72,4±4,6 | 92,0±13,5 | 47,6±4,6 | 9,8±0,96 |
| А - пройденное расстояние по периметру открытого поля (см);Б - время движения по периметру (с); В - пройденное расстояние по центру открытого поля (см);Г - время нахождения в центре открытого поля (с); Д - количество актов посещения центра. |
Установлено, что комплексообразование дневного транквилизатора мезапама с арабиногалактаном способствует снижению степени тревожности животных в два раза по сравнению с самим мезапамом, заключающемуся в восстановлении до исходного уровня показателей двигательной активности, увеличении количества исследованных отверстий и вертикальных стоек, времени исследовательских реакций и пройденного расстояния по центру открытого поля. Высокая противотревожная активность комплекса проявляется при снижении дозы мезапама в комплексе в 10 и 20 раз по сравнению с его терапевтической дозой.
Пример 7. Получение комплексов азалептина и арабиногалактана.
0,25 г азалептина (8-хлор-11-(4-метил-1-пиперазинил)-5Н-дибензо[b,е][1,4]-диазепин) и 2,5 г арабиногалактана (весовое соотношение 1:10) обрабатываются в планетарной центробежной мельнице АГО-2 в течение 10 минут при ускорении мелющих тел 60 g. Порошок выгружается и анализируется. Рентгенограммы исходных азалептина (1), арабиногалактана (2), а также смеси азалептина и арабиногалактана 1:10 до (3) и после (4) механической обработки в мельнице АГО-2 представлены на фиг.9. На фиг.10 представлены термограммы ДСК исходных азалептина (1), арабиногалактана (2), а также смеси азалептина и арабиногалактана 1:10 до (3) и после (4) механической обработки в мельнице АГО-2. В необработанной смеси наблюдаются характерные для кристаллической фазы азалептина рефлексы рентгенограмм и фазовый переход плавления, исчезающие после механической обработки. Из этих данных следует, что в механически обработанной смеси исчезают характерные следы кристаллической фазы азалептина - происходит его молекулярное диспергирование в избыток твердой фазы арабиногалактана. Аналогичные изменения происходят в смеси 0,125 г азалептина с 2,5 г арабиногалактана (весовое соотношение 1:20). Увеличение содержания ЛВ в насыщенном растворе Слв, определенное с помощью ВЭЖХ, составляет 21,0 и 39,0 для первого и второго составов дисперсий.
Пример 8. Изучение нейролептической активности комплексов азалептина и арабиногалактана в весовых соотношениях 1:10 и 1:20 в тесте «открытое поле».
Комплексы 1:10 и 1:20 в дозе 250 мг/кг, эталон сравнения азалептин - в дозе 25 мг/кг вводили однократно внутрижелудочно за час до тестирования животных. Количество введенного азалептина в комплексах 1:10 и 1:20 составляло 25,0 и 12,5 мг/кг соответственно.
Эффект оценивался по изменению количества различных видов движений и общего эмоционального состояния животных на приборе фирмы TruScan (США). Результаты представлены в таблице 6.
| Таблица 6Показатели двигательной активности мышей после введения комплексов арабиногалактан:азалептин=10:1 и 20:1 | ||||
| Группа | Контроль | Азалептин 25 мг/кг | Комплекс 1:10, 250 мг/кг (доза азалептина 25 мг/кг) | Комплекс 1:20, 250 мг/кг (доза азалептина 12,5 мг/кг) |
| А | 14,3±0,7 | 16,0±1,2 | 19,5±1,4 | 17,0±1,9 |
| Б | 97,5±3,3 | 91,7±3,9 | 80,8±3,1*** | 88,7±6,0 |
| В | 22,5±3,3 | 28,3± |