Производные замещенного дигидропираноиндол-3,4-диона как ингибиторы ингибитора-1 активатора плазминогена (pai-1)
Иллюстрации
Показать всеИзобретение относится к замещенным дигидропираноиндол-3,4-диона формулы I и формулы II:
и
где Х означает Н; R1 означает Н, фенил, бензил, причем циклы упомянутых фенила и бензила могут быть факультативно замещены 1-3 заместителями, выбранными независимо друг от друга из группы, в которую входят галоген, C1-С6-алкил, C1-С6-перфторалкил, -O-C1-С6-перфторалкил, C1-С6-алкоксигруппа; где R2 означает Н, -ОН; R3 означает H, фенил, бензил, бензилоксигруппу, причем циклы этих групп могут быть факультативно замещены 1-3 заместителями, выбранными независимо друг от друга из группы, в которую входят фенил, галоген, C1-С6-алкил, C1-С6-перфторалкил, -O-C1-С6-перфторалкил, C1-С6-алкоксигруппа, фармацевтически приемлемые соли этих соединений. Соединения проявляют активность ингибирования ингибитора активатора плазминогена (PAI-1), что позволяет использовать их для изготовления лекарственного средства для лечения патологических состояний, возникающих вследствие фибринолитических расстройств. 17 н. и 6 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к производным замещенного дигидропираноиндол-3,4-диона, полезным в качестве ингибиторов ингибитора-1 активатора плазминогена (PAI-1), и к фармацевтическим композициям, содержащим такие соединения, для лечения болезненных состояний, являющихся следствиями фибринолитических расстройств, например, глубокого венозного тромбоза и ишемической болезни сердца, а также фиброза легких.
Предпосылки создания изобретения
Ингибитор-1 активатора плазминогена (PAI-1) является основным регуляторным компонентом плазминоген-плазминной системы. PAI-1 является главным физиологическим ингибитором как активатора плазминогена тканевого типа (tPA), так и активатора плазминогена типа урокиназы (uPA). Повышенные уровни PAI-1 в плазме связаны с тромботическими явлениями; это показано в экспериментах на животных (Кришнамурти - Krishnamurti, Blood, 69, 798 (1987); Рейли - Reilly, Arteriosclerosis and Thrombosis, 11, 1276 (1991); Кармелье - Carmeliet, Journal of Clinical Investigation, 92, 2756 (1993)), а также в клинических исследованиях (Роша - Rocha, Fibrinolysis, 8, 294, 1994; Азнар - Aznar, Haemostasis 24, 243 (1994)). Нейтрализация действия PAI-1 антителами приводит к усилению эндогенного тромболиза и реперфузии (Бимонд - Biemond, Circulation, 91, 1175 (1995); Леви - Levi, Circulation 85, 305, (1992)). Повышенные уровни PAI-1 играют роль также при некоторых женских болезнях, например, при синдроме поликистоза яичников (Нордт - Nordt, Journal of clinical Endocrinology and Metabolism, 85, 4, 1563 (2000)) и остеопорозе, индуцированном дефицитом эстрогенов (Дачи - Daci, Journal of Bone and Mineral Research, 15, 8, 1510 (2000)). Соответственно, агенты, ингибирующие PAI-1, могут оказаться полезными при лечении болезненных состояний, возникающих вследствие фибринолитических расстройств, например, глубокого венозного тромбоза, ишемической болезни сердца, фиброза легких, болезни Альцгеймера, синдрома поликистоза яичников и т.п.
В WO 99/43654 и WO 99/43651 в качестве ингибиторов фосфолипаз, полезных при профилактике воспалительных состояний, предложены производные индола следующей формулы:
В патенте США №4851406 раскрыты кардиотонические соединения следующей формулы:
где А - пятичленный или шестичленный гетероцикл; Х - связь, алкилен или винилен; R1-Н, алкил, алкенил, циклоалкил, циклоалкенил, карбоксил, цианогруппа, алкилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил или арил; R2 - Н, алкил, тригалогенметил, гидроксил, циклоалкил, цианогруппа, карбоксил, циклоалкенил, карбоксил, цианогруппа, алкилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил или арил; и R3 - атом водорода.
В WO 96/32379 описаны соединения - ингибиторы PDE следующей формулы:
где R1 - Н, галоген, нитрогруппа, карбоксил, защищенный карбоксил, низший алкенил или ацил; R2 - Н, галоген, карбоксил, низший алкенил или ацил; R3 - низший алкенил или низший алкенил, оба факультативно замещенные; и R4 - карбоксил, защищенный карбоксил или ацил.
WO 9928297 относится к замещенным индолам нижеприведенной формулы, действующим как ингибиторы тромбина и антагонисты рецепторов фибриногена:
где Ra - галоген, карбоксил, R3R4N-СО-, R3R4SO2- или R4R5N-; Rb и Rd - либо алкилы, либо группы R2-A, где R2 - факультативно замещенный фенил и А - алкилен или замещенный алкилен; и Rc - водород или алкил.
В патенте ЕР 0655439 описаны 5,6-конденсированные бициклические соединения, в том числе индолы, бензофураны и бензотиофены, соответствующие нижеприведенной формуле, в качестве ингибиторов агрегирования эритроцитов.
Краткое описание изобретения
Настоящее изобретение относится к соединениям формулы I и формулы II:
где X - водород, щелочной металл или основная аминогруппа;
R1 - C1-C8-алкил, предпочтительно С1-С6-алкил, С3-С6-циклоалкил, -СН2-С3-С6-циклоалкил, пиридинил, -СН2-пиридинил, фенил или бензил, причем циклы упомянутых циклоалкила, пиридинила, фенила и бензила могут быть факультативно замещены 1-3 заместителями, выбранными независимо друг от друга из группы, в которую входят галоген, C1-С6-алкил, С1-С6-перфторалкил, -О-С1-С6-перфторалкил, C1-C6-алкоксигруппа, -ОН, -NH2 и -NO2;
R2 - водород, галоген, С1-С6-алкил, C1-С3-перфторалкил, C1-C6-алкоксигруппа, С3-С6-циклоалкил, -СН2-С3-С6-циклоалкил, гидроксил, -NH2 или -NO2;
R3 - водород, галоген, C1-С6-алкил, C1-С3-перфторалкил, C1-C6, С3-С6-циклоалкил, -СН2-С3-С6-циклоалкил, гидроксил, -NH2, -NO2, фенил, бензил, бензилоксигруппа, пиридинил или -СН2-пиридинил, причем циклы этих групп могут быть факультативно замещены 1-3 заместителями, выбранными независимо друг от друга из группы, в которую входят фенил, галоген, C1-С6-алкил, C1-С6-перфторалкил, -O-C1-С6-перфторалкил, C1-С6-алкоксигруппа, -ОН, -NH2 и -NO2; или фармацевтически приемлемые соли либо сложные эфиры этих соединений.
Подробное описание изобретения
Предпочтительными вариантами соединений по настоящему изобретению являются соединения формулы (III) и формулы (IV):
или
где R1, R2 и R3 соответствуют вышеприведенным определениям, или фармацевтически приемлемые соли либо сложные эфиры этих соединений.
Более предпочтительными вариантами соединений по настоящему изобретению являются соединения формулы (V) и формулы (VI):
или
где R1 - C1-C8-алкил, предпочтительно C1-C6-алкил, С3-С6-циклоалкил, -СН2-С3-С6-циклоалкил или бензил, причем циклы упомянутых циклоалкила и бензила могут быть факультативно замещены 1-3 заместителями, выбранными независимо друг от друга из группы, в которую входят галоген, C1-C6-алкил, С1-С6-перфторалкил, -O-C1-C6-перфторалкил, C1-С6-алкоксигруппа, -ОН, -NH2 и -NO2;
R2 - водород, галоген, C1-С6-алкил, C1-С3-перфторалкил, предпочтительно -CF3, C1-С6-алкоксигруппа, С3-С6-циклоалкил, -СН2-С3-С6-циклоалкил, гидроксил, -NH2 или -NO2;
R4, R5 и R6 - независимо друг от друга водород, фенил, галоген, C1-С3-алкил, C1-С3-перфторалкил, предпочтительно -CF3, -O-C1-С3-перфторалкил, C1-С3-алкоксигруппа, -ОН, -NH2 или -NO2; или фармацевтически приемлемые соли либо сложные эфиры этих соединений.
К щелочным металлам, пригодным для применения по настоящему изобретению, относятся: натрий, калий, литий, кальций, магний и т.п. К пригодным основным аминогруппам относятся: аммиак, первичные амины, вторичные амины, третичные амины, пиридин, ароматические амины, бензиламины и т.п. Термин "алкил" охватывает как неразветвленные, так и разветвленные углеродные цепи. Предпочтительным C1-С3-перфторалкильным заместителем является -CF3, а предпочтительным -O-C1-С3-перфторалкильным заместителем является -OCF3.
Далее настоящее изобретение включает способ ингибирования ингибитора активатора плазминогена типа 1 (PAI-1) в организме млекопитающего, включающий введение в организм млекопитающего, нуждающегося в таком вмешательстве, терапевтически эффективного количества соединения формулы (I) и формулы (II):
где X - щелочной металл или основная аминогруппа, соответствующие вышеприведенным определениям;
R1 - C1-C8-алкил, предпочтительно C1-С6-алкил, С3-С6-циклоалкил, -СН2-С3-С6-циклоалкил, пиридинил, -СН2-пиридинил, фенил или бензил, причем циклы упомянутых циклоалкила, пиридинила, фенила и бензила могут быть факультативно замещены 1-3 заместителями, выбранными независимо друг от друга из группы, в которую входят галоген, C1-С3-алкил, С1-С3-перфторалкил, -О-С1-С3-перфторалкил, C1-С3-алкоксигруппа, -ОН, -NH2 и -NO2;
R2 - водород, галоген, C1-С6-алкил, С1-С3-перфторалкил, C1-C6-алкоксигруппа, С3-С6-циклоалкил, -СН2-С3-С6-циклоалкил, гидроксил, -NH2 или -NO2;
R3 - водород, галоген, C1-С6-алкил, C1-С3-перфторалкил, C1-C6, С3-С6-циклоалкил, -СН2-С3-С6-циклоалкил, гидроксил, -NH2, -NO2, фенил, бензил, бензилоксигруппа, пиридинил или -СН2-пиридинил, причем циклы этих групп могут быть факультативно замещены 1-3 заместителями, выбранными независимо друг от друга из группы, в которую входят галоген, С1-С3-алкил, С1-С3-перфторалкил, -O-C1-С3-перфторалкил, C1-С3-алкоксигруппа, -ОН, -NH2 и -NO2; или фармацевтически приемлемые соли либо сложные эфиры этих соединений.
Неограничительными примерами предпочтительных солевых форм соединений по настоящему изобретению являются натриевые и калиевые соли. К другим пригодным солевым формам этих соединений относятся соли с фармацевтически приемлемыми неорганическими и органическими основаниями, известными в отрасли. К неорганическим основаниям, применяемым для получения солевых форм, относятся гидроксиды, карбонаты и бикарбонаты терапевтически приемлемых щелочных металлов, например, натрия, калия, магния, кальция и т.п. К приемлемым органическим основаниям относятся амины, например, бензиламин, моно-, ди- и триалкиламины, предпочтительно содержащие алкильные группы, включающие от 1 атома до 6 атомов углерода, более предпочтительно от 1 атома до 3 атомов углерода, например, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, моно-, ди- и триэтаноламин. Пригодны также алкилендиамины, содержащие до 6 атомов углерода, например, гексаметилендиамин; циклические насыщенные или ненасыщенные основания, содержащие до 6 атомов углерода, в том числе пирролидин, пиперидин, морфолин, пиперазин и их N-алкил- и N-гидроксиалкил-производные, например, N-метилморфолин и N-(2-гидроксиэтил)-пиперидин, или пиридин. Могут быть получены также четвертичные соли, например, тетраалкильные формы, тетраметильные формы, алкил-алканольные формы, например, метилтриэтанольные или триметилмоноэтанольные формы, и циклические аммониевые солевые формы, например, соли N-метилпиридиния, N-метил-N-(2-гидроксиэтил)-морфолиния, N,N-диметил-морфолиния, N-метил-N-(2-гидроксиэтил-морфолиния) или N,N-диметилпиперидиния. Эти солевые формы можно получать, применяя кислотные формы соединений формулы I и известные в отрасли способы.
Сложноэфирные формы соединений по настоящему изобретению включают сложные эфиры, содержащие неразветвленные алкилы с 1-6 атомами углерода или разветвленные алкилы с 3-6 атомами углерода, в том числе метиловые, этиловые, пропиловые, бутиловые, 2-метилпропиловые и 1,1-диметилэтиловые сложные эфиры. К другим сложным эфирам, пригодным для целей настоящего изобретения, относятся сложные эфиры формулы , где R7 выбран из групп, имеющих формулы:
или
где R8, R9, R10, R11 выбраны независимо друг от друга из группы, в которую входят водород, алкил с 1-10 атомами углерода, арил с 6-12 атомами углерода, арилалкил с 6-12 атомами углерода; гетероарил и алкилгетероарил, где гетероарильный цикл связан с остальной частью молекулы алкильной цепью из 1-6 атомов углерода.
Неограничительными примерами сложноэфирных форм соединений по настоящему изобретению являются C1-С6-алкиловые сложные эфиры, разветвленные С3-С6-алкиловые сложные эфиры, бензиловые сложные эфиры и т.п.
Термин "арил" в настоящем описании относится к ненасыщенной ароматической карбоциклической группе, состоящей из 6-14 атомов углерода и содержащей один цикл (например, фенил) или несколько конденсированных циклов (например, нафтил или антрил). К предпочтительным арилам относятся фенил, нафтил и т.п. Термин "гетероарил" в настоящем описании относится к ароматической гетероциклической системе (моноциклической или бициклической), где гетероарильные группы являются пяти- или шестичленными циклами, содержащими от 1 гетероатома до 4 гетероатомов, выбранных из группы, которую составляют S, N и О. Такие гетероарилы могут содержать один цикл, например, пиридил, пирролил или фурил, либо несколько конденсированных циклов, как, например, индолил, индолизинил, бензофуранил или бензотиенил. К предпочтительным гетероарилам относятся пиридил, пирролил и фурил.
В случае отсутствия соответствующих ограничений в определениях арилов или гетероарилов, упомянутых в настоящем описании, эти группы могут быть факультативно замещены заместителями в количестве от 1 до 5, выбранными из группы, в которую входят ацилоксигруппа, гидроксил, ацил, алкил, содержащий от 1 атома до 6 атомов углерода, алкоксигруппа, содержащая от 1 атома до 6 атомов углерода, алкенил, содержащий от 2 атомов до 6 атомов углерода, алкинил, содержащий от 2 атомов до 6 атомов углерода, замещенный алкил, замещенная алкоксигруппа, замещенный алкенил, замещенный алкинил, аминогруппа, аминогруппа, замещенная одним или двумя алкилами, содержащими от 1 атома до 6 атомов углерода, аминоацил, ациламиногруппа, азидогруппа, цианогруппа, галоген, нитрогруппа, тиоалкоксигруппа, содержащая от 1 атома до 6 атомов углерода, замещенная тиоалкоксигруппа, содержащая от 1 атома до 6 атомов углерода, и тригалогенметил. К заместителям при вышеупомянутых алкилах, алкенилах, алкинилах, тиоалкокси- и алкоксигруппах относятся галогены, CN, ОН и аминогруппы. Предпочтительными заместителями при упомянутых арилах являются алкил, содержащий от 1 атома до 6 атомов углерода, алкоксигруппа, содержащая от 1 атома до 6 атомов углерода, галоген, цианогруппа, нитрогруппа, тригалогенметил и тиоалкоксигруппа.
Соединения по настоящему изобретению являются ингибиторами ингибитора серинпротеазы PAI-1, и поэтому полезны при лечении, подавлении, предотвращении или профилактике процессов, включающих продуцирование и/или действие PAI-1, в организмах млекопитающих, предпочтительно человека. Таким образом, соединения по настоящему изобретению полезны при лечении или профилактике инсулинонезависимого сахарного диабета и предотвращении тромботических явлений, связанных с ишемической болезнью сердца и заболеванием сосудов мозга. Эти соединения могут быть полезными также для подавления болезненных процессов, в том числе тромботических и протромботических состояний, неограничительный перечень которых включает образование атеросклеротических бляшек, тромбоз вен и артерий, ишемию миокарда, фибрилляцию предсердий, глубокий тромбоз вен, синдромы коагуляции, фиброз легких, церебральный тромбоз, тромбоэмболические осложнения при хирургических операциях (например, при замене сустава) и окклюзию периферических артерий. Эти соединения полезны также при лечении приступов, связанных с фибрилляцией предсердий или возникающих вследствие такой фибрилляции.
Соединения по настоящему изобретению могут оказаться полезными также при лечении заболеваний, связанных с накоплением внеклеточной матрицы, неограничительный перечень которых включает фиброз почек, хроническое обструктивное легочное заболевание, синдром поликистоза яичников, рестеноз, заболевание почечных сосудов и отторжение трансплантированных органов.
Соединения по настоящему изобретению могут оказаться полезными также при лечении злокачественных новообразований и заболеваний, связанных с неоангиогенезом (например, диабетической ретинопатии).
Соединения по настоящему изобретению можно применять также в связи с процессами или процедурами, включающими поддержание проходимости кровеносных сосудов (в том числе с хирургическими операциями на сосудах, восстановлением проходимости путем трансплантации и расширения сосудов), с имплантацией и трансплантацией органов, тканей и клеток, или после таких процессов или процедур.
Соединения по настоящему изобретению могут быть применены также при лечении болезни Альцгеймера. Этот способ можно охарактеризовать также как ингибирование активатора плазминогена под действием PAI-1 в организме млекопитающего, в частности, человека, страдающего болезнью Альцгеймера или подверженного ей. Этот способ можно охарактеризовать также как способ повышения или нормализации концентрации плазмина в организме млекопитающего, в частности, человека, страдающего болезнью Альцгеймера или подверженного ей.
Соединения по настоящему изобретению полезны при обработке крови или продуктов крови, применяемых при диализе, при хранении крови в жидком состоянии, особенно при агрегировании эритроцитов ex vivo. Соединения по настоящему изобретению можно также добавлять к плазме крови человека в процессе анализа химии крови в клинических лабораториях с целью определения ее фибринолитической способности.
Соединения по настоящему изобретению можно применять также в сочетании с протромболитическими, фибринолитическими и антикоагуляционными агентами.
Соединения по настоящему изобретению можно применять также при лечении раковых опухолей, неограничительный перечень которых включает рак молочной железы и яичников, а также в качестве проявляющих агентов для идентификации метастатических раковых опухолей.
Соединения по настоящему изобретению могут оказаться полезными также при лечении миелофиброза с миелоидной метаплазией путем регулирования гиперплазии клеток стромы и увеличения количества протеинов внеклеточной матрицы.
Соединения по настоящему изобретению можно применять также в сочетании с ингибиторами протеаз в схеме высокоактивной антиретровирусной терапии (HAART) для лечения заболеваний, возникающих вследствие фибринолитической недостаточности и в результате склонности к гиперкоагуляции у инфицированных ВИЧ-1 пациентов, получающих такую терапию.
Соединения по настоящему изобретению можно применять для лечения диабетической невропатии и при диализе почек, связанном с нефропатией.
Соединения по настоящему изобретению можно применять для лечения рака, сепсиса, ожирения, резистентности к инсулину, пролиферативных заболеваний, например, псориаза, повышенной коагуляции, гомеостаза, заболеваний сосудов мозга, заболевания микрососудов, гипертензии, деменыии, остеопороза, артрита, астмы, сердечной недостаточности, аритмии, стенокардии, в качестве агента замещения гормонов, для лечения, профилактики или обращения развития атеросклероза, болезни Альцгеймера, остеопении, для снижения уровня маркеров воспаления, для снижения уровня С-реактивного белка, для профилактики или лечения воспаления сосудов в легкой форме, инсульта, ишемической болезни сердца, для первичной и вторичной профилактики инфаркта миокарда, устойчивой и неустойчивой стенокардии, для первичной профилактики сердечно-сосудистых явлений, для вторичной профилактики сердечно-сосудистых явлений, заболевания периферических сосудов, заболевания периферических артерий, острых сосудистых синдромов, для снижения риска необходимости процедуры восстановления сосудов миокарда, микромышечных заболеваний, например, нефропатии, невропатии, ретинопатии, нефротического синдрома, диабета типа 1 и типа 2 и родственных заболеваний, гипергликемии, гиперинсулинемии, злокачественных повреждений, предзлокачественных повреждений, желудочно-кишечных злокачественных заболеваний, липосарком и эпителиальных опухолей, пролиферативных заболеваний, например, псориаза, повышенной коагуляции, гомеостаза и/или повышенной функции эндотелия и всех форм заболеваний сосудов головного мозга.
Соединения по настоящему изобретению можно применять также для местного нанесения при лечении ран с целью предотвращения образования рубцов.
Способы лечения, подавления, предотвращения или профилактики каждого из перечисленных в настоящем описании заболеваний или состояний у млекопитающих являются частью настоящего изобретения. Каждый способ включает введение в организм млекопитающего, нуждающегося в таком вмешательстве, фармацевтически или терапевтически эффективного количества соединения по настоящему изобретению или фармацевтически приемлемой солевой или сложноэфирной формы такого соединения.
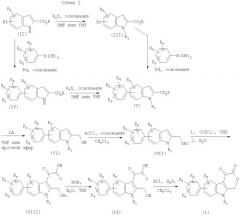
Соединения по настоящему изобретению можно получить, используя способ, показанный на Схеме I, или модификацию этого способа, с применением легкодоступных исходных материалов, реагентов и обычных методик синтеза. Возможно также варьирование этих стадий процесса, которые сами по себе известны и находятся в пределах знаний и опыта химика-специалиста в области медицинской химии. В нижеследующих схемах реакций R1, R2, R4, R5 и R6 выбраны из групп, соответствующих вышеприведенным определениям.
Как видно из Схемы I, броминдол-2-карбоксилаты (II) вводят в реакцию с галогеналкилами или галогеналкиларилами с использованием основания, например, гидрида натрия, в среде диметилформамида (ДМФ) или тетрагидрофурана (ТГФ), и получают N-замещенные броминдолкарбоксилаты (III). Эти N-замещенные броминдолкарбоксилаты (III) затем подвергают перекрестному сочетанию с различными замещенными арилгалогенидами в присутствии палладиевых катализаторов и получают N-замещенные арилиндолкарбоксилаты (V). Согласно альтернативному варианту путем проведения реакции броминдол-2-карбоксилатов (II) с различными замещенными арилборными кислотами в условиях перекрестного сочетания в присутствии палладиевых катализаторов получают арилиндолкарбоксилаты (IV). Алкилированием соединений (IV) галогеналкилами или галогеналкиларилами в основной среде, как описано выше, получают N-замещенные арилиндолкарбоксилаты (V). Восстановление соединений V в соответствующие спирты (VI) выполняют, обрабатывая соединения V алюмогидридом лития в диэтиловом эфире или ТГФ. Проведя реакцию спирта (VI) с ацетилхлоридом в присутствии основания, например, триэтиламина или N,N-диизопропилэтиламина, в инертном растворителе, например, в дихлорметане, получают ацетат VII. Путем проведения реакции соединения VII с оксалилхлоридом в ТГФ или дихлорметане с последующим гашением водой получают кетокислоту VIII. Обработкой ацетата (VIII) водным раствором основания, например, КОН или NaOH, в среде растворителя, например, ТГФ, получают соль карбоновой кислоты (IX). Лактонизацию соединений (IX) в соответствующие производные пираноиндола (I) выполняют путем обработки соединения IX водным раствором кислоты, например, хлористоводородной, в органическом растворителе, например, в дихлорметане.
Настоящее изобретение предлагает также фармацевтические композиции, содержащие фармацевтически или терапевтически эффективное количество соединения по настоящему изобретению либо фармацевтически приемлемой солевой или сложноэфирной формы такого соединения, в чистом виде или в сочетании с одним или несколькими фармацевтически приемлемыми носителями или наполнителями (т.е. с фармацевтически приемлемыми материалами, не обладающими фармакологическим действием). Имеется в виду, что в настоящем описании выражение "фармацевтически или терапевтически эффективное количество соединения" означает количество рассматриваемого соединения, достаточное для ингибирования ингибитора серинпротеазы PAI-1 в организме млекопитающего, нуждающегося в таком ингибировании, в достаточной степени для обеспечения желаемого улучшения рассматриваемого состояния, или для обеспечения ингибирования ингибитора серинпротеазы PAI-1 с целью предотвращения, подавления или ограничения возникновения физиологической основы рассматриваемого заболевания или состояния.
Точные дозы соединений, подлежащие применению, зависят от нескольких факторов, в том числе от особенностей пациента (как в ветеринарии, так и в медицине), природы и тяжести состояния, подлежащего лечению, способа введения лекарственного средства в организм и конкретного применяемого активного вещества. Упомянутые соединения можно вводить в организм больного любым известным способом, в частности, энтеральным, предпочтительно пероральным в форме таблеток или капсул. Для применения в качестве лекарственного средства упомянутые соединения могут быть в свободном виде или в форме фармацевтически приемлемой соли; в частности, это относится к применению для профилактики или лечения атеросклероза или его осложнений (стенокардии, инфаркта миокарда, аритмий, сердечной недостаточности, почечной недостаточности, инсульта, окклюзии периферических артерий и аналогичных патологических состояний). Эти меры замедляют развитие болезненного состояния и содействуют организму в обращении направления процесса под воздействием природных факторов.
Для приготовления фармацевтических композиций можно использовать любой пригодный для данного случая носитель, известный в отрасли. Носитель в таких композициях может быть твердым веществом, жидкостью или смесью твердого вещества с жидкостью. К твердым композициям относятся порошки, таблетки и капсулы. Твердый носитель может представлять собой одно или несколько веществ, которые могут также действовать как ароматизатор, смазывающий агент, солюбилизатор, суспензатор, связующее или дезинтегратор таблеток. В порошках носителем является тонкоизмельченное твердое вещество, находящееся в смеси с тонкоизмельченным активным ингредиентом. В таблетках активный ингредиент смешан в соответствующем соотношении с носителем, обладающим необходимыми связующими свойствами, и смесь спрессована в компактные единицы желаемой формы и величины. К пригодным носителям относятся карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлоза, гидроксиметилцеллюлоза, натриевая карбоксиметилцеллюлоза, низкоплавкий воск, масло какао и т.п. В сочетании с соединениями по настоящему изобретению могут быть использованы также капсулирующие материалы, и термин "композиция" охватывает активный ингредиент в сочетании с капсулирующим материалом в виде лекарственной формы, содержащей или не содержащей другие носители. Для введения в организм противоатеросклеротических лекарственных средств по настоящему изобретению могут использоваться также крахмальные облатки.
К стерильным жидким композициям относятся растворы, суспензии, эмульсии, сиропы и эликсиры. Соединения по настоящему изобретению могут быть растворены или суспендированы в фармацевтически приемлемом носителе, например, в стерильной воде, стерильном органическом растворителе или в их смеси. Предпочтительными жидкими носителями являются носители, пригодные для парентеральных инъекций. Если соединения обладают достаточной растворимостью, они могут быть растворены непосредственно в нормальном физиологическом растворе с применением или без применения соответствующих органических растворителей, например, пропиленгликоля или полиэтиленгликоля. При желании могут быть приготовлены дисперсии тонкоизмельченных соединений в водном растворе крахмала или натриевой карбоксиметилцеллюлозы либо в соответствующем масле, например, в арахисовом масле. Жидкие фармацевтические композиции, которыми являются стерильные растворы или суспензии, можно применять путем внутримышечных, внутрибрюшинных или подкожных инъекций. Во многих случаях жидкие формы композиций могут быть использованы вместо предпочтительного перорального способа введения твердого препарата.
Предпочтительно приготовлять единичные дозированные формы соединений для стандартных схем применения. Таким способом композиции можно легко подразделять на меньшие дозы в соответствии с рекомендациями врача. Единичные дозы могут быть приготовлены, например, в форме фасованных порошков, флаконов или ампул, а предпочтительно в форме капсул или таблеток. Активное соединение может присутствовать в этих единичных дозированных формах в количествах от приблизительно 1 г до приблизительно 15 г или более, рассчитанных на однократное или многократное употребление в течение суток, в соответствии с конкретной потребностью пациента. Суточная доза активного соединения варьирует в зависимости от способа введения в организм, массы тела, возраста и пола пациента, тяжести болезненного состояния и реакции на лечение, контролируемой по анализу крови и скорости выздоровления пациента. Начиная лечение с минимальной суточной дозы приблизительно 1 г, можно использовать данные уровня PAI-1 в крови и облегчения симптомов заболевания для определения необходимости применения большей дозы. Исходя из данных, представленных ниже, расчетная суточная доза как в ветеринарии, так и в медицине составляет от приблизительно 25 мг до приблизительно 200 мг на кг массы тела в сутки, более обычные дозы составляют от приблизительно 50 мг до приблизительно 100 мг на кг массы тела в сутки.
Способность соединений по настоящему изобретению ингибировать ингибитор-1 активатора плазминогена была установлена следующими экспериментальными процедурами:
Первичный скрининг на ингибирование PAI-1
Испытуемые соединения растворяли в диметилсульфоксиде (ДМСО) в конечной концентрации 10 мМ, после чего разбавляли 100Х в буферном физиологическом растворе. Испытание на ингибирование начинали путем прибавления испытуемого соединения (конечная концентрация 1-100 мкМ, максимальная концентрация ДМСО 0,2%) к буферному раствору рН 6,6, содержащему рекомбинантный ингибитор-1 активатора плазминогена человека в концентрации 140 нМ (Molecular Innovations, Royal Oak, Ml). После инкубирования в течение 1 ч при комнатной температуре добавляли рекомбинантный тканевый активатор плазминогена (tPA) человека в концентрации 70 нМ, и смесь испытуемого соединения, PAI-1 и tPA инкубировали дополнительно в течение 30 мин. После вторичного инкубирования добавляли хромогенный субстрат для tPA - Spectrozyme-tPA (American Diagnostica, Greenwich, CT) и измеряли поглощение на длине волны 405 нм в начальный момент времени (момент 0) и через 60 мин. Относительная степень ингибирования PAI-1 характеризовалась остаточной активностью tPA в присутствии испытуемого соединения и PAI-1. Контрольные пробы включали полное ингибирование tPA под действием PAI-1 при используемом молярном соотношении (2:1) и отсутствие какого-либо влияния испытуемого соединения на сам по себе tPA.
Испытание для определения IC50 для ингибирования PAI-1
Это испытание основано на взаимодействии между tPA и активным PAI-1 в отсутствие диссоциации под влиянием SDS. Испытательные планшеты вначале покрывали tPA человека (10 мкг/мл). Испытуемые соединения растворяли в ДМСО в концентрации 10 мМ, затем разбавляли физиологическим буферным раствором (рН 7,5) до конечной концентрации 1-50 мкМ. Испытуемые соединения инкубировали с PAI-1 человека в течение 15 мин при комнатной температуре. Покрытый tPA планшет промывали раствором 0,05% Твин-20 и 0,1% бычьего сывороточного альбумина (BSA), а затем блокировали 3% раствором BSA. Затем на планшет, покрытый tPA, помещали аликвотное количество раствора испытуемого соединения/PAI-1, инкубировали при комнатной температуре в течение 1 ч и промывали. Количество активного PAI-1, связанного на планшете, определяли путем добавления аликвотного количества разбавления 1:1000 моноклонального антитела 33В8 против PAI-1 человека (Molecular Innovations, Royal Oak, Ml) и инкубирования планшета при комнатной температуре в течение 1 ч. Планшет вновь промывали и добавляли раствор конъюгата козьей щелочной фосфатазы против мышиного IgG в разбавлении 1:50000 в козьей сыворотке крови. Инкубировали планшет в течение 30 мин при комнатной температуре, промывали и добавляли раствор субстрата щелочной фосфатазы. Инкубировали планшет в течение 45 мин при комнатной температуре и определяли развитие окрашивания путем измерения оптической плотности на длине волны 405 нм (OD405nm). Количественное определение активного PAI-1, связанного с tPA, при различных концентрациях испытуемого соединения использовали для определения IC50. Результаты анализировали с применением аппроксимации логарифмическим уравнением. Чувствительность испытания, определенная по калибровочной кривой, охватывающей диапазон 0-100 нг/мл, составляла 5 нг/мл PAI-1 человека.
Соединения по настоящему изобретению ингибировали ингибитор-1 активатора плазминогена с эффективностью, охарактеризованной в Таблице 1.
| Таблица I | ||
| Пример | IC50, мкМ | Процент ингибирования в концентрации 25 мкМ |
| 1 | 2,3 | |
| 2 | - | 34 |
| 3 | - | 22 |
| 4 | 29,5 | - |
| 5 | 26,6 | - |
| 6 | 34,8 | - |
| 7 | - | 6 |
| 8 | 4,83 | - |
| 9 | - | 40 |
| 10 | - | 59 |
| 11 | - | 30 |
| 12 | - | 40 |
| 13 | - | 36 |
Пример 1
9-(4-метилбензил)-6-[4-(трифторметокси)фенил]-1,9-дигидропирано[3,4-b]-индол-3,4-дион
Стадия 1
Этил-5-бром-1-(4-метилбензил)-1H-индол-2-карбоксилат
NaH (60%, 3,88 г, 96,98 ммоль) прибавляли частями при перемешивании к раствору этил-5-бром-1Н-индол-2-карбоксилата (20,0 г, 74,6 ммоль) в ДМФ (140 мл) при 0°С в атмосфере азота в течение 10 мин. Затем смесь нагревали до комнатной температуры. После перемешивания реакционной смеси при комнатной температуре в течение 1 ч прибавляли 4-метилбензилбромид (14,2 г, 74,6 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Гасили реакционную смесь водным раствором хлорида аммония и разбавляли водой. Водную смесь экстрагировали этилацетатом. Органический экстракт промывали водой и рассолом и сушили над безводным сульфатом магния. Эту смесь концентрировали и получали полутвердое вещество, содержащее 0,8 моль-эквивалента ДМФ. Масс-спектр (ESI, [M+H]+) m/z 372. 1H ЯМР (400 МГц, DMSO-d6) δ 7,93 (d, 1H, J=7,94 Гц), 7,55 (d, 1H, J=9,01 Гц), 7,40 (dd, 1H, J=8,85 Гц и 1,98 Гц), 7,32 (s, 1H), 7,04 (d, 2H, J=7,96 Гц), 6,90 (d, 2H, J=7,94 Гц), 5,79 (s, 2H), 4,28 (q, 2H), 2,20 (s, 3Н) и 1,28 млн-1 (t, 3Н).
Стадия 2
Этил-1-(4-метилбензил)-5-[4-(трифторметокси)фенил]-1Н-индол-2-карбоксилат
Смесь этил-5-бром-1-(4-метилбензил)-1Н-индол-2-карбоксилата (5,8 г, 15,54 ммоль), 4-(трифторметокси)фенилборной кислоты (8,2 г, 38,85 ммоль), карбоната калия (5,4 г, 38,85 ммоль), комплекса [1'1'-бис(дифенилфосфино)-ферроцен]дихлорпалладия (II) с дихлорметаном (1:1) (4,41 г, 5,44 ммоль) в смеси диоксана с водой (10:1, 154 мл) перемешивали при 70°С в течение 2 дней. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический экстракт промывали водой и рассолом, после чего концентрировали, получая масло. Этот остаток кристаллизовали из диэтилового эфира и получали указанное в заголовке соединение в виде слегка окрашенного твердого вещества, т.пл. 77-78°С. Масс-спектр (ESI, [М+Н]+) m/z 454. 1H ЯМР (400 МГц, DMSO-d6) δ 8,00 (s, 1H), 7,78 (d, 2H, J=8,70 Гц), 7,67 (d, 1H, J=8,85 Гц), 7,61 (dd, 1H, J=8,70 и 1,68 Гц), 7,44 (s, 1H), 7,42-7,41 (m, 3Н), 7,06 (d, 2H, J=7,94 Гц), 6,94 (d, 2H, J=8,09 Гц), 5,83 (s, 2H), 4,29 (q, 2H), 2,21 (s, 3Н) и 1,30 млн-1 (t, 3Н).
Элементный анализ для С26Н22F3NO3:
Рассчитано: С, 68,87; Н, 4,89; N, 3,09.
Найдено: С, 69,00; Н, 4,66; N, 3,06.
Стадия 3
{1-(4-метилбензил)-5-[4-(трифторметокси)фенил]-1Н-индол-2-ил}метанол
Алюмогидрид лития (0,244 г, 6,1 ммоль) прибавляли частями при перемешивании к раствору этил-1-(4-метилбензил)-5-[4-(трифторметокси)-фенил]-1Н-индол-2-карбоксилата (2,0 г, 4,4 ммоль) в диэтиловом эфире (17 мл) при 0°С в атмосфере азота в течение 5 мин. Затем смесь нагревали до комнатной температуры. После перемешивания реакционной смеси при комнатной температуре в течение 5 ч, смесь осторожно гасили водой и фильтровали. Фильтрат экс