Применение эпотилонов в лечении заболеваний головного мозга, ассоциированных с пролиферативными процессами
Иллюстрации
Показать всеПредложено применение группы соединений эпотилона, которые имеют коэффициент среднего распределения между плазмой и мозгом 0,3-1,5 в анализе на мышах с помощью внутривенной болюсной инъекции, для получения лекарственного средства для терапии заболеваний первичных и вторичных опухолей головного мозга. Показана эффективность эпотилонов в отношении ксенотрансплантированной и внутричерепной глиомы человека. Соединения отличает не только высокая противоопухолевая активность в отношении опухоли головного мозга, но и хорошее проникновение в ткани мозга (площади под фармакокинетическими кривыми для плазмы крови и для головного мозга в среднем были одинаковыми). 4 н. и 6 з.п. ф-лы, 7 ил., 2 табл.
Реферат
Область техники изобретения
Настоящее изобретение относится к применению эпотилонов в лечении заболеваний головного мозга (далее мозга), ассоциированных с пролиферативными процессами, особенно первичных или вторичных опухолей мозга, множественного склероза и болезни Альцгеймера.
Предпосылки создания изобретения
Возможности медикаментозного лечения заболеваний головного мозга сильно ограничены существованием, так называемого, гематоэнцефалического барьера (ГЭБ). В то время, как ГЭБ служит в качестве защитного механизма для предотвращения поступления экзогенных веществ в ткань мозга, он также, к сожалению, препятствует поступлению препаратов, введенных обычным способом (перорально, парентерально и т.д.) (A.Maelicke, Nachr. Chem. Tech. Lab. 1989, 37, 32-34).
Важным классом заболеваний мозга, которые трудно лечить лекарственными средствами по упомянутой выше причине, являются заболевания, ассоциированные с пролиферативными процессами, такими, как опухоли мозга, множественный склероз или болезнь Альцгеймера. Различные исследования в отношении этих заболеваний, особенно злокачественных опухолей, обеспечили некоторые представления об эффективности препарата, объектом которого является мозг (W.Shapiro, J. Shapiro, Semin. Oncol. 1986, 13, 56-69; M. Donelli и др. Cancer Chemother. Pharmacol. 1992, 30, 251-260). В качестве эмпирического правила, чем более высоких концентраций в мозге достигает препарат, тем ниже его молекулярная масса и выше его липофильность (С.Unger и др., Klin. Wochenschr. 1985, 63, 565-571). Тем не менее в последние годы найдено, что по крайней мере для некоторых соединений (M.Fromm, Int. J. Clin. Pharmacol. Ther. 2000, 38, 69-74) существуют внутри ГЭБ механизмы активного вытеснения, так что поглощение препарата тканью мозга не может быть просто рассчитано на основании физических или химических данных, а должно быть определено экспериментально.
Были созданы некоторые экспериментальные методики, чтобы преодолеть ограничения поглощения препарата мозговой тканью, вызванные существованием ГЭБ; например, прямое внутриоболочечное применение препарата, использование жирорастворимых носителей или разрушение ГЭБ применением высоких доз маннита или других соединений (Е.Galanis и др., Curr. Opin. Neurol. 2000, 13, 619-625; H.Lahrmann и др., J. Neurol. Psychiatr. 2001, 2, 16-20). Однако эти методики связаны со значительными недостатками и/или нежелательными побочными эффектами. Большинство из них может рассматриваться на экспериментальном этапе, т.е. они не могут рассматриваться в качестве стандартной терапии.
В результате предшествующей работы можно констатировать, что большинство цитостатических агентов (которые являются наиболее важным классом препаратов для терапии заболеваний, ассоциированных с пролиферативными процессами) при системном применении не достигает в мозговой жидкости той же концентрации, что и в плазме крови. Например, недавно было найдено, что максимальные концентрации в мозговой жидкости, составляющие 20-30% от концентраций в плазме, могут быть достигнуты при применении нитрозомочевин, которые считаются самым лучшим типом циостатических агентов, проникающих через ГЭБ (Therapiekonzepte Oncologie; S. Seeberger, J.Schütter (Ред.), 3 издание, изд-во Springer, Berlin, 1998). Нитрозомочевины и комбинация нитрозомочевин с прокарбазином и винкристрином (терапия PCV) считаются стандартными химиотерапевтическими агентами для лечения злокачественной опухоли мозга (Н.Lahrmann и др., J. Neurol. Neurochir. Psychiatr. 2001, 2, 16-20; E.Galanis и др., Curr. Opin. Neurol. 2000, 13, 619-625).
Цитостатические агенты могут различаться в соответствии с механизмом их фармакологической активности. Наиболее важными классами цитостатических соединений являются антиметаболиты (например, фторурацил, цитарабин, меркаптопурин), антимитотические агенты (например, колхицин, паклитаксел, подофиллотоксин, алкалоиды винка), алкилирующие агенты (например, цисплатин, нитрозомочевины, азотистые иприты), антибиотики (например, блеомицин) и агенты, в отношении которых не известен механизм их терапевтической эффективности (например, аспарагиназа). Хотя и было найдено, что алкилирующие агенты полезны для противоопухолевой терапии, их фармакологический механизм сам имеет сильный канцерогенный потенциал.
В особенности эти эффекты проявляются у нитрозопроизводных (нитрозомочевин и нитрозоаминов), которые обсуждались выше как эффективные препараты для терапии мозга: 57 из 60 нитрозомочевин (95%), исследованных на канцерогенность, были активны (CD Römpp Chemie Lexikon - версия 1,0, Stuttgart/new York: Georg Thieme Verlag, 1995). Таким образом, было бы желательно для эффективной терапии заболеваний мозга, ассоциированных с пролиферативными процессами, обеспечить соединения, которые имеют такие же или лучшие свойства прохождения через ГЭБ, как нитрозомочевины, но без их канцерогенного потенциала.
В группе антимитотических агентов паклитаксел (таксол®) является самым известным ее членом и одним из самых реализуемых противоопухолевых средств в настоящее время. К сожалению, паклитаксел имеет исключительно низкую способность проникать через гематоэнцефалический барьер (М.Glantz и др., J. Natl. Cancer Inst. 1995, 87, 1077-1081) и поэтому не считается полезным для терапии заболеваний мозга посредством обычных путей введения. Было найдено, что другие антимитотические агенты, которые блокируют митотическое веретено пролиферирующей клетки путем связывания с белком веретена тубулином и тем самым вызывают апоптоз, являются более мощными противоопухолевыми агентами (К.-Н. Altman, Curr. Opin. Chem. Biol. 2001, 5, 424-431), в отношении которых сообщено меньше побочных канцерогенных эффектов, чем в случае алкилирующих агентов, обсужденных выше. К этой группе препаратов принадлежат также эпотилоны.
Природные продукты эпотилон А и В, а также некоторые их синтетические производные недавно вызвали интерес в связи с терапией рака, и было сделано много работ по их синтезу (К.Nicolaou и др., Angew. Chem. 1998, 110, 2120-2153) и синтезу модифицированных структур.
Заявки WO 99/07692, WO 99/02514 и WO 99/67252 раскрывают производные эпотилона, их синтез и фармацевтическое применение.
Заявка WO 00/66589 раскрывает синтез и фармацевтическое применение производных эпотилона, имеющих алкенильный, алкинилный заместитель или заместитель, содержащий простой циклический эфир в положении 6 макроциклического кольца.
Заявка WO 00/49021 раскрывает производные эпотилона, содержащие галоидный заместитель в положении 16, и их синтез.
Заявка WO 00/71521 раскрывает способ синтеза олефиновых эпотилонов.
Заявка WO 98/25929 имеет дело с получением библиотек аналогов эпотилона.
В заявке WO 99/43320 упоминается в самом общем виде применение эпотилонов для лечения рака. В раскрытии основное внимание уделяется созданию условий применения для конкретного соединения - эпотилона В при лечении широкого набора вариантов злокачественных опухолей. В этом документе нет упоминания о трудностях лечения заболеваний мозга, ассоциированных с пролиферативными процессами, как обсуждено выше, или каких-либо специфических преимуществах применения эпотилонов с этой целью.
В настоящее время неожиданно было найдено, что некоторые эпотилоны обнаруживают особенно хорошую способность проникать через ГЭБ по сравнению с другими цитостатическими агентами (антимитотическими агентами и другими), и поэтому являются особенно полезными при получении лекарственных средств для терапии заболеваний мозга, ассоциированных с пролиферативными процессами. Благодаря их фармакологическому механизму действия, данные соединения могут также применяться в терапии заболеваний, помимо рака, которые ассоциированы с пролиферативной активностью.
Краткое изложение изобретения
Соответственно настоящее изобретение относится к применению эпотилонов в лечении заболеваний мозга, ассоциированных с пролиферативными процессами, или при получении лекарственного средства для лечения заболеваний мозга, ассоциированных с пролиферативными процессами. Оно относится также к способам терапии заболеваний мозга, ассоциированных с пролиферативными процессами, путем перорального, ректального, местного или парентерального, предпочтительно ингаляционного, внутривенного или внутрибрюшинного, наиболее предпочтительно внутривенного применения эпотилона.
Для целей настоящего изобретения эпотилон определяют как циклическую молекулу с 16-членным циклом и различными заместителями и фармацевтической активностью в качестве цитостатического агента, который связывается с тубулином (Asnes и др., Anal. Biochem. 1979, 98, 64-73; Job и др., Cellular Pharmacol. 1993, I (Suppl. I), S7-S10; Lichtner и др., PNAS, 2001, 98, 11743-11748). Более того, предпочтительные эпотилоны для применения по настоящему изобретению обнаруживают коэффициент среднего распределения между плазмой и мозгом 0,3-1,5, измеренный в анализе на мышиной модели с использованием болюсной инъекции, как описано в контексте.
Другой предпочтительной подгруппой является та, где молекула эпотилона представляет собой молекулу лактона или лактама.
Предпочтительной подгруппой является та, где эпотилон обнаруживает коэффициент среднего распределения между плазмой и мозгом 0,6-1,2 в анализе на мышиной модели с использованием внутривенной болюсной инъекции.
Предпочтительную подгруппу составляет применение для терапии заболевания мозга, выбранного из группы, состоящей из первичной опухоли мозга, вторичной опухоли мозга, болезни Альцгеймера и множественного склероза.
Предпочтительные эпотилоны для применения по настоящему изобретению означают соединения общей формулы:
где R1a, R1b означают каждый независимо водород, (С1-С10)алкил, арил, аралкил или вместе образуют группу -(CH2)m, где m означает 2-5;
R2a, R2b означают каждый независимо водород, (С1-С10)алкил, арил, аралкил или вместе образуют группу -(СН2)n; где n означает 2-5, или (С2-С10)алкенил, или (С2-С10)алкинил;
R3 означает водород, (С1-С10)алкил, арил, аралкил;
R4a, R4b означают каждый независимо водород, (С1-С10)алкил, арил, аралкил или вместе образуют группу -(СН2)р, где р означает 2-5;
R5 означает водород, (С1-С10)алкил, арил, аралкил, СООН, СООалкил, СН2ОН, СН2Оалкил, СН2Оацил, CN, CH2NH2, СН2N(алкил, ацил)1,2 или СН2Hal;
R6, R7 означают каждый водород или образуют вместе дополнительную связь, или вместе образуют эпоксигруппу;
G означает кислород или СН2;
D-E означает группу Н2С-СН2, НС=СН, С≡С, СН(ОН)-СН(ОН), СН(ОН)СН2, СН2-СН(ОН), СН2-O, O-СН2, ;
W означает группу C(=X)R8 или означает би- или трициклический ароматический или гетероароматический радикал;
Х означает кислород или две группы OR20, или (С2-С10)алкилендиоксигруппу (которая может быть линейной или разветвленной), или H/OR9, или группу CR10R11;
R8 означает водород, (С1-С10)алкил, арил, аралкил, галоид, CN;
R9 означает водород или защитную группу PGX;
R10, R11 означают каждый независимо водород, (С1-С20)алкил, арил, аралкил или образуют вместе с метиленовым углеродом 5-7-членное карбоциклическое кольцо;
Z означает кислород или H/OR12;
R12 означает водород или защитную группу PGZ;
A-Y означает группу O-С(=O), О-СН2, CH2=C(=O), NR21-C(=O), NR21-SO2;
R20 означает (С1-С20)алкильную группу;
R21 означает водород или (С1-С10)алкил;
PGX, PGZ означают (С1-С20)алкил, (С4-С7)циклоалкил, который может содержать атом кислорода в кольце, арил, аралкил, (C1-C20)ацил, ароил, (С1-С20)алкилсульфонил, арилсульфонил, три(С1-С20)алкилсилил, ди(С1-С20)алкиларилсилил, (С1-С20)алкилдиарилсилил или три(аралкил)силил;
в виде одного стереоизомера или смеси различных стереоизомеров и/или в виде их фармацевтически приемлемой соли.
Данные соединения успешно применяются в терапии или при получении лекарственного средства для лечения заболевания мозга, ассоциированного с пролиферативными процессами.
В дополнительном варианте воплощения настоящее изобретение относится к способу лечения заболевания мозга, ассоциированного с пролиферативными процессами, включающему введение нуждающемуся в этом пациенту терапевтически эффективного количества эпотилона, как определено выше.
Предпочтительные варианты воплощения изобретения
Термин “заболевание мозга, ассоциированное с пролиферативными процессами”, как он упоминается в контексте настоящего изобретения, означает, но без ограничения, первичные опухоли мозга, такие, как астроцитомы, олигодендроглиомы, пинеаломы, медуллобластомы, неврилеммомы, менингеомы и эпендимомы, вторичные опухоли мозга, множественный склероз и болезнь Альцгеймера, из которых все представляют предпочтительные заболевания мозга, ассоциированные с пролиферативными процессами, подлежащие терапии по настоящему изобретению.
Особенно предпочтительными заболеваниями мозга, ассоциированными с пролиферативными процессами, подлежащими терапии путем введения эпотилона по настоящему изобретению, являются первичные и вторичные опухоли мозга.
Термин “терапевтически эффективное количество”, как он использован в контексте, относится к такому количеству соединения по изобретению, которое при введении нуждающемуся в этом пациенту является достаточным, чтобы осуществить терапию, как определено ниже, заболеваний мозга, ассоциированных с пролиферативными процессами. Количество, которое составляет “терапевтически эффективное количество”, будет меняться в зависимости от соединения, заболевания и его тяжести, возраста пациента, подвергаемого терапии, но может быть определено, как положено, одним из обычных специалистов в области, имеющей отношение к его собственным знаниям и данному раскрытию.
Термин “обработка” или “лечение”, как он использован в контексте, относится к лечению заболевания мозга у пациента, болезнь которого ассоциирована с пролиферативными процессами, и включает:
(i) предотвращение рецидива заболевания у пациента, особенно, когда такой пациент нуждается в дальнейшем медикаментозном лечении после перенесенного хирургического или медикаментозного лечения;
(ii) подавление заболевания, т.е. остановка его развития; или
(iii) ослабление заболевания, т.е. возможность вызвать регрессию заболевания.
Термин “алкил”, как он использован в контексте, относится к линейным или разветвленным алкильным группам, например метильной, этильной, пропильной, изопропильной, н-бутильной, трет-бутильной, н-пентильной, неопентильной, гептильной или децильной. Алкильные группы могут быть перфторированными или замещенными 1-5 заместителями, выбранными из группы, состоящей из галоида, гидрокси, (С1-С4)алкокси или (С6-С12)арила (который может быть замещен 1-3 атомами галоида).
Термин “арил”, как он использован в контексте, относится к ароматической карбоциклической или гетероциклической части, содержащей 5-14 кольцевых атомов, например фенил, нафтил, фурил, тиенил, пиридил, пиразолил, пиримидинил, оксазолил, пиридазинил, пиразинил, хинолил или тиазолил. Арильные группы могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из галоида, гидрокси, алкокси, -СООН, -СООалкила, -NH2, -NO2, -N3, -CN, (С1-С20)алкила, (С1-С20)ацила или (С1-С20)ацилокси. Гетероатомы могут быть окислены, если это не вызывает потерю ароматического характера заместителя, например пиридиновая часть может быть окислена, давая пиридин-N-оксид.
Термин “аралкил”, как он использован в контексте, относится к группе, которая может содержать до 14 атомов в арильном кольце (предпочтительно 5-10) и 1-8 атомов углерода в алкильной цепи (предпочтительно 1-4), например бензил, фенилэтил, нафтилметил, нафтилэтил, фурилметил, тиенилэтил или пиридилпропил. Кольца могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из галоида, гидрокси, алкокси, -СООН, -СООалкила, -NH2, -NO2, -N3, -CN, (С1-С20)алкила, (С1-С20)ацила или (С1-С20)ацилокси.
Защитные группы PG могут быть алкил- и/или арилзамещенными силилсодержащими частями, (С1-С20)алкилом, (С1-С20)циклоалкилом, который может содержать в кольце атом кислорода, арилом, аралкилом, (С1-С20)ацилом, алкил- или арилсульфонилом. Группы, которые можно легко удалить из молекулы, являются предпочтительными, например метоксиметильная, метоксиэтильная, этоксиэтильная, тетрагидропиранильная, тетрагидрофуранильная, триметилсилильная, триэтилсилильная, трет-бутилдиметилсилильная, трибензилсилильная, триизопропилсилильная, бензильная, n-нитробензильная, n-метоксибензильная, а также алкилсульфонильная или арилсульфонильная. Предпочтительными ацильными группами являются формильная, ацетильная, пропионильная, пивалоильная, бутирильная или бензоильная, которые все могут быть замещены одной или несколькими аминогруппами и/или гидроксигруппами.
Предпочтительной группой являются соединения общей формулы, которая приведена выше,
где A-Y означает O-С(=O);
D-E означает Н2С-СН2;
G означает СН2;
Z означает кислород;
R1a, R1b означают оба (С1-С10)алкил или образуют вместе группу -(СН2)p, где р означает 2-3;
R2a, R2b означают каждый независимо водород, (С1-С10)алкил, (С2-С10)алкенил или (С2-С10)алкинил;
R3 означает водород;
R4a, R4b означают каждый независимо водород или (С1-С10)алкил;
R5 означает (С1-С10)алкил.
Другой предпочтительной группой являются соединения общей формулы, которая приведена выше,
где R2a, R2b означают каждый независимо водород, (С2-С10)алкенил или (С2-С10)алкинил;
R6, R7 образуют эпоксигруппу или вместе образуют дополнительную связь;
W означает 2-метилбензотиазол-5-ильный радикал или 2-метилбензоксазол-5-ильный радикал, или хинолин-7-ильный радикал.
Из этой группы предпочтительную подгруппу составляют соединения, выбранные из следующих производных:
(4S,7R,8S,9S,13Е/Z2,16S(Е)-4,8-дигидрокси-16-(2-метилбензоксазол-5-ил)-1-окса-5,5,9,13-гетраметил-7-(проп-2-ен-1-ил)пиклогексадец-13-ен-2,6-диона;
(1S/R,3S(Е),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил)-2-(2-метилбензоксазол-5-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Е)-4,8-дигидрокси-16-(2-метилбензотиазол-5-ил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-диона;
(1S/R,3S(E),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил)-2-(2-метилбензотиазол-5-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Е))-4,8-дигидрокси-16-(2-метилбензотиазол-5-ил)-1-окса-9,13-диметил-5,5-(1,3-триметилен)-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-диона;
(1S/R,3S(E),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил)-2-(2-метилбензотиазол-5-ил)-12,16-диметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Е))-4,8-дигидрокси-16-(2-метилбензотиазол-5-ил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ин-1-ил)циклогексадец-13-ен-2,6-диона;
(1S/R,3S(E),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(проп-2-ин-1-ил)-3-(1-метил)-2-(2-метилбензотиазол-5-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Е))-4,8-дигидрокси-16-(хинолин-2-ил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-диона;
(1S/R,3S(Е),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил)-2-(хинолин-2-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/Z,16S(Е))-4,8-дигидрокси-16-(2-метилбензотиазол-5-ил)-1-аза-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-диона; и
(1S/R,3S(E),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил)-2-(2-метилбензотиазол-5-ил)-8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-диона.
Другая предпочтительная группа соединений имеет общую формулу, как приведенная выше,
где R2a, R2b означают каждый независимо водород или (С1-С10)алкил;
R6, R7 образуют эпоксигруппу или образуют дополнительную связь;
W означает группу C(=X)R8;
Х означает группу CR10R11;
R8 означает водород, галоид, (С1-С10)алкил;
R10, R11 означают водород/2-метилтиазол-4-ил или водород/2-пиридил.
В этой группе предпочтительную подгруппу составляют соединения, выбранные из следующих производных:
(4S,7R,8S,9S,13Е/Z,16S(Е))-4,8-дигидрокси-16-(1-метил-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5,9,13-тетраметил-7-этилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Е),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-этил-3-(1-метил-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/Z,16S(Е))-4,8-дигидрокси-16-(1-метил-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5-(1,3-триметилен)-9,13-диметил-7-этилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Е),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-этил-3-(1-метил-2-(2-метил-4-тиазолил)этенил)-8,8-(1,3-триметилен)-12,16-диметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Е))-4,8-дигидрокси-16-(1-метил-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5,9,13-тетраметил-7-пропилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(E),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-пропил-3-(1-метил-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/2,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Z),7S,10R,11S,12S,16R/Z)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/Z,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5,9,13-тетраметил-7-этилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Z),7S,10R,11S,12S,16R/S)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8,12,15-тетраметил-10-этил-4,17-диоксабицикло [14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/Z,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5-(1,3-триметилен)-7,9,13-триметилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Z),7S,10R,11S,12S,16R/S)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8-(1,3-триметилен)-10,12,16-триметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/Z,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5-(1,3-триметилен)-9,13-диметил-7-этилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Z),7S,10R,11S,12S,16R/S)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8-(1,3-триметилен)-12,16-диметил-10-этил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/Z,16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил-1-окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Z),7S,10R,11S,12S,16R/S)-7,11-дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5,9,13-тетраметил-7-этилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Z),7S,10R,11S,12S,16R/S)-7,11-дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-10-этил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/Z,16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5,9,13-тетраметил-7-пропилциклогексадец-13-ен-2,6-диона;
(1S/R,S(Z),7S,10R,11S,12S,16R/S)-7,11-дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-10-пропил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Е))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-пропилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Е),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-1-пропил-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/Z,16S(Е))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5-(1,3-триметилен)-9,13-диметил-7-этилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Е),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-этил-3-(1-метил-2-(2-пиридил)этенил)-8,8-(1,3-триметилен)-12,16-диметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Е))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5-(1,3-триметилен)-7,9,13-триметилциклогексадец-13-ен-2,6-диона;
(18/R,3S(Е),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-3-(1-метил-2-(2-пиридил)этенил)-8,8-(1,3-триметилен)-10,12,16-триметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Е))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-пропилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(E),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-пропил-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0] гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5-(1,3-триметилен)-7,9,13-триметилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Z),7S,10R,11S,12S,16R/S)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8-(1,3-триметилен)-10,12,16-триметил-4,17-диоксабицикло[14.1,0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5,9,13-тетраметил-7-этилциклогексадец-13-ен-2,6-диона;
(1S/R,3S(Z),7S,10R,11S,12S,16R/S)-7,11-дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-10-этил-4,17-диоксабицикло [14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5,9,13-тетраметил-7-этилциклогексадец-13-ен-2,6-диона; и
(18/R,3S(Z),7S,10R,11S,12S,16R/S)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-10-этил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона.
Другую предпочтительную группу составляют соединения общей формулы, как приведенная выше,
где R2a, R2b означают каждый независимо водород, (С2-С10)алкенил или (С2-С10)алкинил;
R6, R7 образуют эпоксигруппу или вместе образуют дополнительную связь;
W означает группу C(=X)R8;
Х означает группу CR10R11;
R8 означает водород, галоид, (С1-С10)алкил;
R10, R11 означают водород/2-метилтиазол-4-ил или водород/2-пиридил.
В этой группе предпочтительную подгруппу составляют соединения, выбранные из следующих производных:
(4S,7R,8S,9S,13E/Z,16S(E))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ин-1-ил)циклогексадец-13-ен-2,6-диона;
(1S/R,3S(E),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(проп-2-ин-1-ил)-3-(2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13E/Z,16S(Е))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-диона;
(1S/R,3S(E),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1,0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/Z,16S(Е))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(бут-3-ин-1-ил)циклогексадец-13-ен-2,6-диона;
(1S/R,3S(Е),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(бут-3-ин-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(1S/R,3S(E),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(бут-3-ен-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(1S/R,3S(Е),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(бут-3-ен-1-ил)-3-(2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/Z,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метилтиазол-4-ил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ин-1-ил)циклогексадец-13-ен-2,6-диона;
(1S/R,3S(Z),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(проп-2-ин-1-ил)-3-(1-фтор-2-(2-метилтиазол-4-ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона;
(4S,7R,8S,9S,13Е/Z,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метилтиазол-4-ил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-диона; и
(1S/R,3S(Z),7S,10R,11R,12S,16R/S)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-фтор-2-(2-метилтиазол-4-ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона.
Синтез соединений, перечисленных выше, описан в заявках WO 99/07692, WO 99/49021 и WO 00/66589, которые включены в контекст путем цитирования.
Для применения по изобретению соединения могут быть превращены в лекарственные формы способами, известными специалистам в данной области. Композиции для перорального, ректального, парентерального или местного применения могут быть приготовлены в форме таблеток, капсул, гранул, суппозиториев, имплантатов, стерильных инъекционных водных или масляных растворов, суспензий или эмульсий, аэрозолей, мазей, кремов или гелей, препаратов с замедленным высвобождением или имплантатов с замедленным высвобождением. Соединения могут быть также введены с помощью имплантируемых дозирующих систем.
Следовательно, фармацевтически активные соединения могут быть смешаны с вспомогательными веществами, известными в данной области, такими, как гуммиарабик, тальк, крахмал, маннит, метилцеллюлоза, лактоза, поверхностно-активные вещества, такие, как твины® или мирдж®, стеарат магния, водные или неводные носители, парафиновые производные, смачивающие агенты, диспергирующие агенты, эмульгаторы, консерванты и ароматизаторы.
Соединения могут применяться в форме их клатратов с α-, β- или γ-циклодекстрином или замещенным α-, β- или γ-циклодекстрином, или в форме липосомальной композиции, в особенности липосомальной композиции, включающей липид, модифицированнный полиэтиленгликолем (PEG).
Изобретение относится также к фармацевтическим композициям, содержащим одно или несколько перечисленных выше фармацевтически активных соединений, и их применению для лечения и в способах по настоящему изобретению. Предпочтительно одна стандартная доза этих композиций содержит примерно 0,01-100 мг фармацевтически активного соединения или соединений. Доза для человека для применения по изобретению составляет примерно 0,01-100 мг/день; предпочтительная доза составляет примерно 0,02-70 мг/день; более предпочтительная доза составляет примерно 0,04-40 мг/день.
Краткое описание чертежей
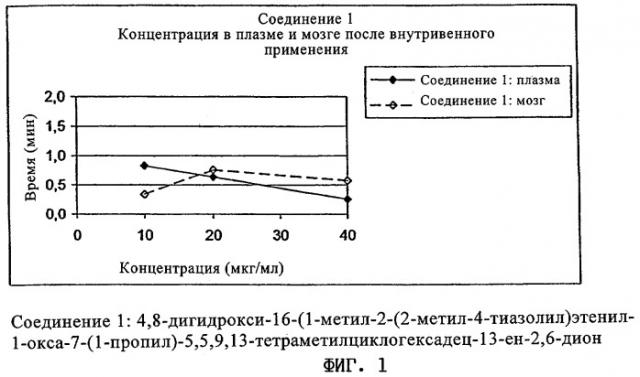
Фиг.1 демонстрирует концентрации 4,8-дигидрокси-16-(1-метил-2-(2-метил-4-тиазолил)этенил-1-окса-7-(1-пропил)-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-диона (соединения 1) в плазме и мозге после внутривенного применения, контролированного в течение периода 40 мин, определенные на животной модели примера 1.
Фиг.2 демонстрирует концентрации 3Н-меченого дигидрокси-3-(1-метил-2-(2-метил-4-тиазолил)этенил)-10-пропил-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона (соединения 2) в плазме и мозге после внутривенного применения, контролированного в течение периода 40 мин, определенные на животной модели примера 1.
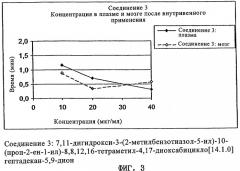
Фиг.3 демонстрирует концентрации 3Н-меченого 7,11-дигидрокси-3-(2-метилбензотиазол-5-ил)-10-(проп-2-ен-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона (соединения 3) в плазме и мозге после внутривенного применения, контролированного в течение периода 40 мин, определенные на животной модели примера 1.
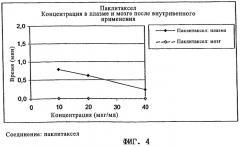
Фиг.4 демонстрирует концентрации 3Н-меченого паклитаксела в плазме и мозге после внутривенного применения, контролированного в течение периода 40 мин, определенные на животной модели примера 1.
Фиг.5 демонстрирует соотношение концентраций мозг-плазма после внутривенного применения эпотилонов фиг.1-3 и паклитаксела в качестве сравнения, контролированного в течение периода 40 мин, полученное из данных, приведенных на фиг.1-4.
Фиг.6 демонстрирует оценку подавления роста опухоли при подкожном введении 7,11-дигидрокси-3-(2-метилбензотиазол-5-ил)-10-(проп-2-ен-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона, основанную на объеме опухоли в ходе исследования из примера 2. Изменения объема опухоли в корреляции со временем показаны для контрольной группы А (υ) и для групп обработки В (ν) и С (σ).
Фиг.7 демонстрирует оценку массы тела животного при обработке с 7,11-дигидрокси-3-(2-метилбензотиазол-5-ил)-10-(проп-2-ен-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дионом в ходе исследования из примера 2. Изменения массы тела в корреляции со временем показаны для контрольной группы А (υ) и для групп обработки В (ν) и С (σ).
Пример 1 (анализ с помощью болюсной инъекции мышам)
(Анализ in vivo для оценки уровней эпотилонов в крови и мозге)
Мышей-самцов линии SCID (20-25 г, без жидких выделений) обрабатывали одной дозой меченых тритием эпотилонов и паклитаксела (5 мг/кг; 7,4 МБк/мг; 30% гидроксипропил-β-циклодекстрин (HPβCD)/NaCl, внутривенная болюсная инъекция). Распределение радиоактивности между кровью и мозгом измеряли с помощью жидкостного сцинтилляционного счетчика (LSC) и ВЭЖХ радиоактивного потока в трех временных точках (10, 20 и 40 мин) после инъекции.
Следующие соединения исследовали в этом анализе:
паклитаксел;
соединение 1: 4,8-дигидрокси-16-(1-метил-2-(2-метил-4-тиазолил)этенил)-1-окса-7-(1-пропил)-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион;
соединение 2: дигидрокси-3-(1-метил-2-(2-метил-4-тиазолил)этенил)-10-пропил-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1,0]гептадекан-5,9-дион; и
соединение 3: 7,11-дигидрокси-3-(2-метилбензотиазол-5-ил)-10-(проп-2-ен-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион.
Результаты
Все эпотилоны были обнаружены в мозге через 40 мин после внутривенного введения в концентрациях, которые превышали концентрации в плазме. Для соединений 1 и 2 более высокое соотношение концентраций мозг-плазма наблюдали уже после 20 мин. Для соединения 3 на 10 и 20 минутах наблюдали большие изменения показателей между животными внутри одной группы. Через 40 мин после применения паклитаксел определяли в мозге также в значительных количествах.
При сравнении отдельных (0-40 мин) площадей под кривой (AUC) для уровней в плазме/мозге во времени было найдено соотношение AUC-мозг/AUC-плазма, равное приблизительно 1 (соединение 1: 1,0; соединение 2: 1,2; соединение 3: 0,8), что указывало на свободный доступ в мозг.
Паклитаксел был ниже предела количественного определения во всех образцах мозга, но в сопоставимых концентрациях в плазме, приводящих к соотношению AUC-мозг/AUC-плазма, равному нулю.
Концентрации, измеренные для данных соединений, и рассчитанные соотношения их AUC суммированы в таблице 1.
Заключение
В противоположность паклитакселу, эпотилоны, по-видимому, в значительной мере проникают через гематоэнцефалический барьер. Остаются дольше в мозге по сравнению с плазмой.
| Таблица 1 | ||||||
| Соединение (3Н-меченое) | Время (мин) | Концентрация в плазме, среднее знач. (мкг/мл) | AUC (0-40 мин) плазмы (мкг·/мл) | Концентрация в мозге, среднее значение (мкг/г) | AUC (0-40 мин) мозга(мкг·мин/мл) | Соотношение AUC мозг/плазма |
| Соединение 1 | 10 | 0,8 | 20 | 0,3 | 21 | 1,0 |
| 20 | 0,6 | 0,8 | ||||
| 40 | 0,3 | 0,6 | ||||
| Соединение 2 | 10 | 1,6 | 31 | 1,1 | 35 | 1,2 |
| 20 | 0,7 | 1,1 | ||||
| 40 | 0,3 | 0,8 | ||||
| Соединение 3 | 10 | 1,2 | 25 | 0,9 | 20 | 0,8 |
| 20 | 0,7 | 0,3 | ||||
| 40 | 0,3 | 0,6 | ||||
| Паклитаксел | 10 | 0,8 | 19 | <LOQ | 0 | 0,0 |
| 20 | 0,6 | <LOQ | ||||
| 40 | 0,2 | <LOQ | ||||
| LOQ: предел количественного определения |
Пример 2 (активность in vivo)
Анализ in vivo для оценки эффективности эпотилонов в отношении ксенотрансплантированной и интрацеребральной человеческой глиомы.
Для этого эксперимента использовали самок мышей линии NMRI (20-28 г), полученных скрещиванием бестимусных особей (nu/nu). Клетки человеческой глиомы U373 имплантировали подкожно (1×107 /мышь), а также интрацеребрально (2×105 /мышь) в день 0. Обработку начинали в день 7, когда подкожные опухоли по размеру были приблизительно 0,05 см3. Обработку продолжали до тех пор, пока в день 32 в необработанной контрольной группе размеры опухолей не достигали приблизительно 0,6 см3. После окончания эксперимента определяли размер опухолей мозга (таблица 2).
В этом анализе исследовали следующее соединение:
соединение 3: 7,11-дигидрокси-3-(2-метилбензотиазол-5-ил)-10-(проп-2-ен-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион.
Результаты
Значительное терапевтическое воздействие на подкожные (фиг.6), а также на интрацеребральные мозговые опухоли U373 наблюдали в случае соединения 3 для обоих использованных режимах по сравнению с быстрым ростом в необработанных контрольных группах (таблица 2: группа В по сравнению с группой А и группа С по сравнению с группой А). Лишь умеренную потерю массы тела (незначимую) наблюдали в обработанных группах В и С (фиг.7).
Заключение
На основании данного исследования можно заключить, что эпотилоны, например соединение 3, демонстрировали высокую противоопухолевую